绣线菊碱C、D关键BCD三环中间体的不对称合成
孟银娟, 徐 亮
(四川大学 华西药学院,四川 成都 610041)
·快递论文·
绣线菊碱C、D关键BCD三环中间体的不对称合成
孟银娟, 徐 亮*
(四川大学 华西药学院,四川 成都 610041)
从易于制备的非手性烯丙醇化合物出发,以经典的的Sharpless不对称环氧化为关键反应构建烯丙仲醇手性中心,共经10步线性步骤以28.6%的总收率首次实现了绣线菊碱C、D全合成路线中BCD三环中间体(-)-4的不对称合成,该合成路线中涉及3个新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)表征。
烯丙仲醇; 绣线菊碱; Sharpless不对称环氧化; 二萜生物碱; 不对称合成
绣线菊碱C和D(spiramine C、D)是昆明植物所郝小江研究员从蔷薇科绣线菊植物(SpiraeajaponicaL.f)中分离出的代表性阿替生型二萜生物碱[1-2],具有显著的抗炎、抗血小板聚集、神经保护作用以及潜在的抗肿瘤活性[3-4]。最近,我们研究组从消旋的烯丙醇前体2-(4-羟基己-5-烯-1-基)-6-甲氧基苯酚(3)出发,经非对映选择性的氧化去芳香化/分子内Diels-Alder反应立体选择性地构建了消旋的三环中间体4,再经多步反应完成了绣线菊碱C、D消旋体的首次全合成(Scheme 1)[5-6]。然而该类光学活性天然分子的不对称全合成却未见报道。
本研究以易于制备的(E)-6-((叔丁基二甲基硅烷基)氧基)己-2-烯-1-醇(5)为起始原料,以Sharpless不对称环氧化为关键反应构建具有R构型的手性烯丙仲醇——(R)-6-[(叔丁基二甲基硅基)氧基]己-1-烯-3-醇(9),继而首次合成手性前体化合物(R)-(3)和光学活性的三环中间
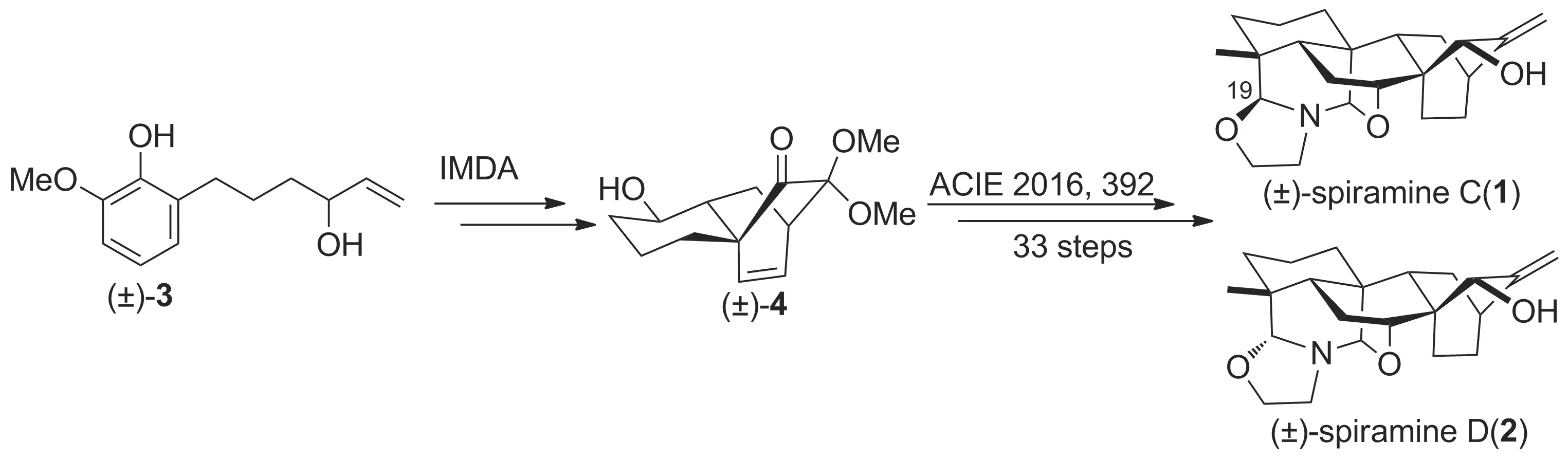
Scheme 1
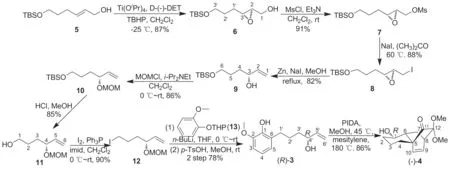
Scheme 2
体(-)-4(Scheme 2),为绣线菊碱C和D的不对称全合成奠定基础。该合成路线中涉及新化合物{(2R,3R)-3-[3-(叔丁基二甲基甲硅烷氧基)丙基]环氧乙烷-2-基}甲磺酸甲酯(7), 9和(R)-6-碘代-3-(甲氧甲醚基)己-1-烯(12),其结构经1H NMR,13C NMR和HR-MS(ESI)表征。
1 实验部分
1.1 仪器与试剂
Perkin Polarimeter 341型旋光测定仪;Varian UnityNOVA-400/5型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker BioTOFQ型高分辨质谱仪;Nicolet 200 SXV型红外光谱仪。
5按文献[7]方法合成;其余所用试剂均为分析纯,其中二氯甲烷、四氢呋喃及甲醇等溶剂均经无水处理。
1.2 合成
(1) {(2R,3R)-3- [3-(叔丁基甲基甲硅烷氧基)丙基]环氧乙烷-2-基}甲醇(6)的合成[7]

(2) 7的合成
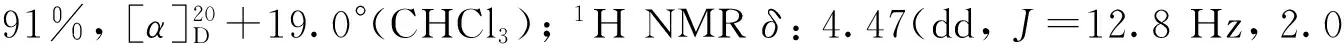
(3) 叔丁基{3-[(2R,3S)-3-(碘甲基)环氧乙烷-2-基]丙氧基}二甲基硅烷(8)的合成[7]

(4) 9的合成

(5) 叔丁基{[(R)-4-(4-甲氧甲醚基)己-5-烯-1-基]氧基}二甲基硅烷(10)的合成[8]
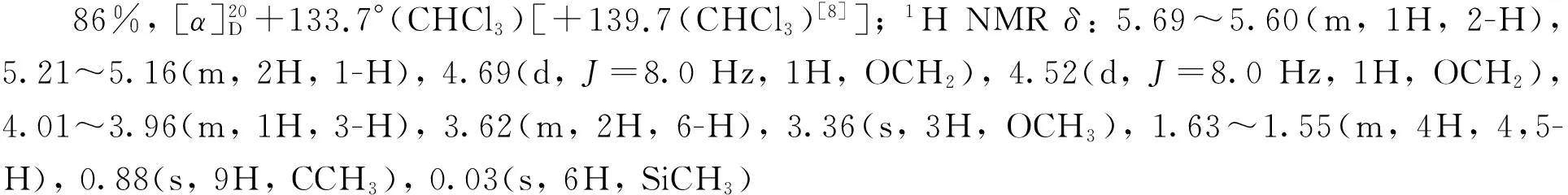
(6) (R)-4-(甲氧甲醚基)己-5-烯-1-醇(11)[8]的合成

(7) 12的合成

(8) (R)-(3)[5]的合成
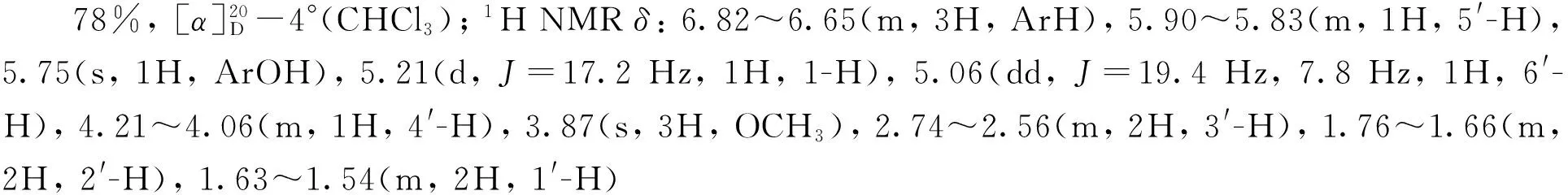
(9) (-)-4[6]的合成
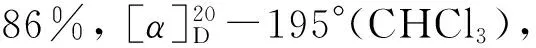
本研究以易于制备的5为起始原料,首先以(-)-酒石酸二乙酯和Ti(OPri)4为催化剂,在TBHP的作用下发生经典的烯烃Sharpless不对称环氧化反应[9-10],以87%的收率制得对映纯的环氧化合物6。接着尝试对化合物6中的羟基直接进行在碘/三苯基膦/咪唑条件下的碘代反应[11],结果发现反应收率较低,反应容易得到环氧结构降解的副产物。因而我们采用两步策略进行该碘代反应,首先将6中的伯羟基经甲烷磺酰化高收率转化成磺酸酯化合物7,随后7与碘化钠在丙酮中加热回流,顺利地以两步80%的收率制得了碘代环氧化合物8。8与活化锌粉和碘化钠在甲醇中回流[12-13],以82%收率得到R构型的烯丙仲醇化合物9。接下来将9中的仲羟基经甲氧甲基(MOM)保护得到化合物10。10在2 mol·L-1盐酸中选择性地脱除TBS硅醚保护基,以85%收率制得伯醇11。化合物11在经典的碘/三苯基膦条件下发生羟基碘代,顺利制得到手性碘代侧链前体12。接下来该前体在正丁基锂作用下,与THP保护的邻甲氧基苯酚13发生区域选择性偶联反应[5],所得偶联产物不经分离,用对甲苯磺酸一步同时脱除甲氧甲基和硅醚保护基,以两步78%的收率制得Diels-Alder反应关键前体(R)-3。(R)-3再在本研究组已经报道的氧化去芳香化/分子内DA反应条件下[6]以86%的高收率得到具有光学活性的三环中间体(-)-4。 (-)-4在石油醚-乙酸乙酯溶剂中一次重结晶即可得到ee值大于99%的对映纯化合物。
本研究以易于制备的(E)-6-((叔丁基二甲基硅烷基)氧基)己-2-烯-1-醇为起始物,以经典的的Sharpless不对称环氧化为关键反应,经9步反应,以29%收率顺利实现了克级规模的光学纯D-A关环反应前体(R)-3的合成,并进一步在前期发展的环合条件下顺利制得与天然产物绣线菊碱C、D绝对构型一致的BCD三环前体(-)-4,为绣线菊碱C、D的不对称全合成奠定了重要基础。
[1] Hao X J, Node M, Taga T,etal. The structures of four new diterpene alkaloids,spiramines A,B,C,and D[J].Chem Pharm Bull,1987,35:1670-1672.
[2] Node M, Hao X J, Zhou J,etal. Spiromines A,B,C,and D new diterpene alkaloids from spiraea japonica var. acuminata franch[J].Heterocycles,1990,30:635-643.
[3] Hao X J, Shen Y M, Li L,etal. The chemistry and biochemistry of Spiraea japonica complex[J].Curr Med Chem,2003,10:2253-2263.
[4] 郝小江. 粉花绣线菊复合群的化学与生物学[J].化学进展,2009,21(1):84-99.
[5] Cheng H, Xu L, Chen D L,etal. Construction of functionalized B/C/D ring system of C19-diterpenoid alkaloidsviaintramolecular Diels-Alder reaction followed by Wagner-Meerwein rearrangement[J].Tetrahedron,2012,68:1171-1176.
[6] Cheng H, Zeng F H, Yang X. Collective total syntheses of atisane-type diterpenes and atisine-type diterpenoid alkaloids:(±)-Spiramilactone B,(±)-Spiraminol,(±)-Dihydroajaconine,and (±)-Spiramines C and D[J].Angew Chem Int Ed,2016,55:392-396.
[7] Wadavrao S B, Ghogare R S Narsaiah A V. Total synthesis of the nonenolide xyolide using a regioselective nucleophilic epoxide opening approach[J].Synthesis,2015,47:2129-2137.
[8] Krishna P R, Kumar P V A, Mallula V S,etal. A stereoselective approach for the total synthesis of [2(S)-phenyl-propionyl]-2-piperidinone-3-(R)-yl-ester and its diastereomer[J].Tetrahedron,2013,69:2319-2326.
[9] Sharpless K B, Katsuki T. The first practical method for asymmetric epoxidation[J].J Am Chem Soc,1980,102:5974-5976.
[10] Gao Y, Klunder J M, Hanson R M,etal. Catalytic asymmetric epoxidation and kinetic resolution:Modified procedures including in situ derivatization[J].J Am Chem Soc,1987,109:5765-5780.
[11] Shelke A M, Suryavanshi G. An efficient organocatalytic route for asymmetric total synthesis of Stagonolide F[J].Tetrahedron L,2015,56:6207-6209.
[12] George S, Suryavanshi G, Sudalai A. A short enantioselective synthesis of guggultetrol,a naturally occurring lipid[J].Tetrahedron:Asymmetry,2010,21:558-561.
[13] Shelke A M, Rawat V, Suryavanshi G,etal. Asymmetric synthesis of (+)-stagonolide C and (+)-aspinolide Aviaorganocatalysis[J].Tetrahedron:Asymmetry,2012,23:1534-1541.
Asymmetric Synthesis of The Key BCD Tricyclic Precursor of Spiramine C and D
MENG Yin-juan, XU Liang*
(West China College of Pharmacy, Sichuan University, Chengdu 610041, China)
Starting from the known and easily available allylic alcohol compound, a 10-step asymmetric synthetic route for preparation of BCD tricyclic precursor of spiramine C/D, (-)-4, was successfully developed in a total yield of 28.6%, which features a highly effective Sharpless asymmetric epoxidation to built the key chiral center of secondary allylic alcohol as the key step. Three new compounds were involved in the synthetic route. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI).
allylic alcohol; spiramine; Sharpless asymmetric epoxidation; diterpenoid alkaloid; asymmetric synthesis
2017-02-11;
2017-06-06
国家自然科学基金资助项目(21272163, 21472129)
孟银娟(1990-),女,汉族,陕西咸阳人,硕士研究生,主要从事天然产物合成的研究。 E-mail: 1034043132@qq.com
徐亮,教授, Tel. 028 85503046, E-mail: liangxu@scu.edu.cn
O621.3; O629.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.17023

