穿心莲内酯诱导胃癌细胞周期抑制和内源性凋亡
刘奇章, 龚兴国
(浙江大学 生命科学学院 生物化学研究所, 浙江 杭州 310058)
穿心莲内酯诱导胃癌细胞周期抑制和内源性凋亡
刘奇章, 龚兴国*
(浙江大学 生命科学学院 生物化学研究所, 浙江 杭州 310058)
研究了穿心莲内酯诱导胃癌细胞SGC-7901生长抑制、周期阻滞与细胞凋亡的作用机制.用梯度浓度的穿心莲内酯作用于SGC-7901细胞,以MTT法检测药物对细胞的生长抑制情况;以流式细胞技术检测SGC-7901的周期分布状况、胞内的ROS水平以及线粒体膜电位的变化;以Annexin V-FITC/PI双染法检测细胞凋亡的水平;以Western blot检测不同加药浓度处理后的细胞内相关蛋白水平的变化.可知穿心莲内酯对SGC-7901细胞具有时间依赖和浓度依赖的抑制效果,48 h的IC50约为24 μg· mL-1;并且能够有效抑制G2/M期的周期进展,随后诱发内源性凋亡途径;与此同时,细胞内的ROS水平上升,线粒体膜电位下降;再加入NADPH之后,细胞内的GSH水平有所回升,周期阻滞得到缓解.细胞内的p53、p-CDC2、cleaved caspase-3/9、Bax等上调;bcl-2等水平下调.穿心莲内酯是通过上调胞内ROS水平并使线粒体膜电位崩溃而诱发G2/M期的周期阻滞与内源性凋亡,最终抑制SGC-7901细胞的生长.
穿心莲内酯;胃癌;凋亡诱导;周期阻滞
穿心莲内酯是从天然植物穿心莲中萃取的二萜类内酯活性化合物,分子量为350 D,已有研究表明穿心莲内酯具有抗菌消炎、抗病毒、抗肿瘤、调节免疫、治疗心血管疾病[1]等功能,而穿心莲内酯的抗肿瘤功能更是近年来的研究热点.据文献[2]报道,穿心莲内酯具有抑制多种肿瘤细胞生长的作用,其机制包括凋亡诱导、周期阻滞、抑制Na+-K+-ATPase & PKC等活性以及激活泛素蛋白酶体介导的蛋白降解途径等.
线粒体膜电位ΔΨm(MMP)是维持线粒体结构与功能稳定的根本,线粒体在氧化呼吸过程中,将产生的能量以电化学势能储存在线粒体内膜,内膜两侧质子及其他离子浓度的不对称分布而形成的线粒体膜电势差就是线粒体膜电位;因此,膜电位的稳定直接关系到ATP的合成.此外,线粒体中ROS水平的上升会导致线粒体膜电位的下降.
已有研究表明,穿心莲内酯可以上调多种细胞内ROS水平,而ROS水平的上升会导致细胞凋亡和周期阻滞[6].因此,穿心莲内酯可以作为一种肿瘤细胞杀伤药物,通过上调细胞内的ROS水平抑制肿瘤生长.
本文通过MTT实验检测穿心莲内酯对SGC-7901细胞的处理,初步了解穿心莲内酯对胃癌细胞的生长抑制作用;借助流式细胞技术检测穿心莲内酯对SGC-7901细胞周期分布、细胞凋亡的影响,同时检测细胞内ROS水平与膜电位的变化,并利用Western blot分析穿心莲内酯对细胞凋亡及周期相关蛋白表达水平的影响,以阐述穿心莲内酯杀死胃癌细胞的机制.
1 材料与方法
1.1 材料、试剂与仪器
SGC-7901为本实验室保存;穿心莲内酯(购于上海晶纯生化科技股份有限公司(阿拉丁))溶于DMSO(sigma),溴化噻唑蓝四氮唑(MTT);新生牛血清与RPMI1640培养基(含双抗,Gibico原装干粉配制,0.1 μm无菌滤膜过滤,无支原体) 购于杭州四季青生物工程公司;胰蛋白酶(含0.5 mM EDTA,Gibico原装干粉配制)和PBS(Gibico原装干粉配制)均购于杭州吉诺生物技术公司;Annexin V-FITC&PI凋亡检测试剂盒购于南京凯基生物科技有限公司;P53、cdc2、Caspase3/9抗体购于碧云天生物技术公司;BAX、Bcl抗体、N-乙酰半胱氨酸(NAC)、NADPH购于上海生工生物技术有限公司;
Multiskan MK3酶标仪购于赛默飞世尔(上海)仪器有限公司;低速离心机购于安徽中科中佳科学仪器有限公司,流式细胞仪购于Beckman Coulter公司.
1.2 方 法
1.2.1 细胞培养
细胞培养使用含10%胎牛血清、100 U· mL-1青霉素与100 U· mL-1链霉素的RPMI1640培养液.将培养液置于饱和湿度下含5%二氧化碳的细胞培养箱中37 ℃培养.每日更换新鲜培养基,当细胞长满到80%左右,传代.
1.2.2 细胞活力检测
采用MTT检测穿心莲内酯对肿瘤细胞SGC-7901生长抑制的效果;按照2.5×105cells·mL-1的浓度接种到96孔板中,培养12 h.每孔中分别加入不同浓度的穿心莲内酯(0,8,16,32,64 μg· mL-1),每个药物浓度设置5个重复,培养24,48,72 h,弃去培养基,加入120 μL MTT溶液(5 mg· mL-1),37 ℃避光孵充4 h,吸去溶液,每孔加入150 μL DMSO以溶解甲臜.震荡2 min,490 nm检测吸光度值,并根据吸光度值计算肿瘤细胞的存活率(细胞存活率=实验吸光度值/对照吸光度值×100%).
所有实验数据都是在重复3次以上之后得到的结果.
1.2.3 细胞凋亡与周期检测
Annexin V-FITC&PI细胞凋亡检测:Annexin V是一种Ca2+依赖性磷脂结合蛋白,不能透过细胞膜,与磷酯酰丝氨酸(PS)有很高的亲和性,凋亡早期PS外翻,因此用荧光素FITC标记Annexin V后,可以用来检测早凋;碘化丙啶(propidium iodide, PI)是一种核酸染料,正常细胞的细胞膜完整,具有选择通过性,染料无法穿透细胞膜从而无法染色.但是,由于坏死细胞或晚期凋亡细胞核膜的不完整性, PI可以与核酸结合呈现红光,同时Annexin V也会进入细胞内与PS结合呈现绿色,以此作为一种坏死细胞或晚期凋亡的检测手段.AV&PI双染区别细胞的依据是:正常细胞没有荧光;早凋细胞呈绿色荧光,晚期凋亡细胞呈绿色和红色.人胃癌细胞SGC-7901种植于6孔板中37 ℃ 5%CO2孵育至80%,加入含有不同浓度药物(0,16,24,32 μg· mL-1)的培养基,培养48 h.离心(1 200 r·min-1,5 min),采用不含EDTA的胰酶消化,再离心收集细胞,PBS洗涤2次,根据凯基Annexin V-FITC&PI细胞凋亡检测盒说明书加入结合缓冲液,Annexin V-FITC和PI染液,混匀,室温避光反应10 min,过200目筛,流式细胞仪下检测.
PI周期检测:细胞周期分为G0/G1,S,G2,M;G0/G1的DNA为二倍体,G2为四倍体,因此当外界因素使得细胞处于其中某个阶段时,可以通过检测DNA的分布状态确定细胞的周期捕获(cycle arrest);PI能选择性地嵌入核酸DNA和RNA双链螺旋的碱基之间与之结合,其结合的量与DNA含量成正比例,可以借助流式细胞仪进行分析.SGC-7901细胞种植于6孔板孵育培养至80%,加入无血清培养基同步24 h以上,加入含不同浓度药物的培养基,培养48 h.胰酶消化收集细胞,离心,PBS清洗2次,70%酒精重悬固定12 h以上;离心,周期检测试剂缓冲液重悬,加入适量PI染液,混匀,流式细胞仪检测荧光强度.
1.2.4 Hoechst 33258染色
非嵌入型荧光染料Hoechst 33258是一种可穿透细胞膜的蓝色荧光染料,可以在活细胞的DNA的AT富集区域与双链DNA结合,从而使核着色,而且这类染料可以与活细胞或者固定的细胞结合.
取适量对数生长期的SGC-7901细胞铺入有爬片的24孔板培养皿中,待细胞长至约80%时,加入含有不同浓度药物的1640培养基,37 ℃培育48 h;弃去上清,PBS清洗1遍,加入预先融化的Hoechst 33258染液,每孔加入500 μL染液,37 ℃孵育30 min,弃上清,PBS清洗2~3遍,挑出爬片倒扣在载玻片上,周围滴入50%甘油,以防止水分挥发变干.拿至荧光倒置显微镜处观察拍照,正常细胞的细胞核会出现淡染的现象,细胞发生凋亡时,会看到凋亡细胞的细胞核呈深染,或呈碎块状致密浓染.
1.2.5 ROS检测
DCFH-DA正常情况下是不发光的,但是可以自由穿过细胞膜,进入细胞内后可被细胞内的酯酶分解成DCFH,后者不能透过细胞膜,从而使探针很容易固定在细胞内,当胞内的活性氧上升时,DCFH与ROS反应生成具有荧光的DCF,借助流式细胞技术检测DCF荧光的强度,从而检测ROS在细胞内的水平.
取对数生长期的细胞,适量铺入6孔板培养皿内,37 ℃ 5% CO2培养至80%左右,加入含有不同浓度药物的培养基,48 h后,弃上清,胰酶消化1 200 r·min-1离心10 min收集细胞,PBS清洗1遍,37 ℃避光条件下,将细胞与1 mL含有10 μM DCFH-DA的无血清培养基孵育30 min,PBS清洗2遍,流式细胞仪下检测荧光强度.
1.2.6 线粒体膜电位检测
细胞在凋亡过程中通常会伴随线粒体膜电位的崩溃,这一事件的发生已经被广泛认为是凋亡早期发生的标志.检测线粒体膜电位的方法有很多种,JC-1是其中一种;JC-1在低浓度时以单体形式存在,浓度过高时则以二聚体的形式存在,前者发绿色荧光,后者则发出红色荧光;并且JC-1进入正常细胞的线粒体后由于浓度升高,会发出红色荧光,细胞受到外界的不良因素刺激或者人为干扰,导致线粒体的膜电位崩塌,进而JC-1外泄,因此浓度降低,分成单体发出绿光,可以此为检测线粒体膜电位的依据.
取对数期SGC-7901细胞,种植于6孔板中,待细胞长至80%左右,加入含有不同浓度的药物与阳性的1640培养基,培养48 h,保留培养基,胰酶消化1 min,终止,收集细胞,1 200 r·min-1离心10 min,弃上清,2 mL PBS重悬清洗1遍,1 200 r·min-1离心7 min,弃上清;预先配制好JC-1工作液,取适量JC-1(200X),按照每50 μL JC-1(200X)加入8 mL超纯水的比例稀释JC-1.充分溶解并混匀,然后再加入2 mL JC-1染色缓冲液(5X),混匀后即为JC-1染色工作液.每孔加入1 mL工作液,混匀,37 ℃孵育20 min;孵育结束后,1 200 r·min-1离心7 min去上清液,PBS清洗1~2遍,再用适量JC-1染色缓冲液(1X)重悬后,即可进行流式细胞仪检测.
1.2.7 Z-VAD-FMK,3-MA和 NADPH补偿实验
Z-VAD-FMK是凋亡相关蛋白酶caspase特异性抑制剂,而3-MA是自噬抑制剂,用含血清培养基预处理待加药细胞1 h,作用浓度分别为20 μmol·L-1和5 mmol·L-1.药物处理,然后检测细胞活力.
NAC是一种ROS消除剂,而NADPH是细胞内的还原当量,与细胞内的物质代谢和ROS的清除有着直接的关系.分别使用浓度为10 μmol·L-1的NAC与20 μmol·L-1的NADPH预处理细胞,药物处理过后进行MTT实验和流式细胞检测.
2 结 果
2.1 穿心莲内酯(AD)对胃癌细胞SGC-7901的生长抑制作用
MTT实验得出AD处理细胞24,48和72 h后细胞50%生长抑制浓度(IC50)分别为96.1, 24.3 和20.7 μg· mL-1,可见AD对SGC-7901细胞的生长抑制作用具有时间依赖性,48 h之后作用效果加强(见图1(a)和(b)).(*p<0.05,**p<0.01, ***p<0.0001,n=5,Tukey检验)
为了观察穿心莲内酯对正常胃细胞是否具有生长抑制作用,做了2个胃上皮细胞的MTT实验,结果表明:穿心莲内酯对正常胃上皮细胞的生长没有影响(见图1(c)和(d)).
随后,采用了2种抑制剂(Z-VAD-FMK是凋亡相关蛋白酶caspase的特异性抑制剂,而3-MA是自噬抑制剂,用含血清培养基预处理待加药细胞1 h)来初步判定穿心莲内酯对SGC-7901细胞生长抑制的作用机制.实验结果如图1(e)和(f)所示:凋亡抑制剂的预处理能够有效恢复穿心莲内酯造成的细胞生长抑制作用,但是自噬抑制剂却没有这一作用.
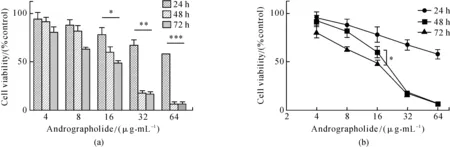
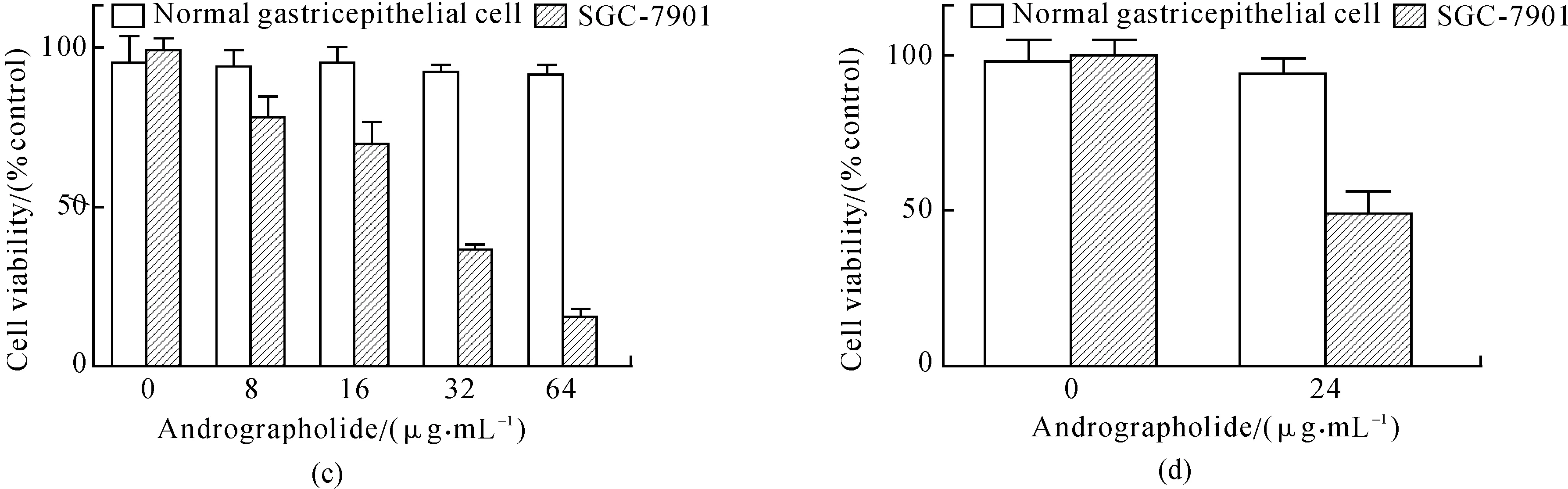
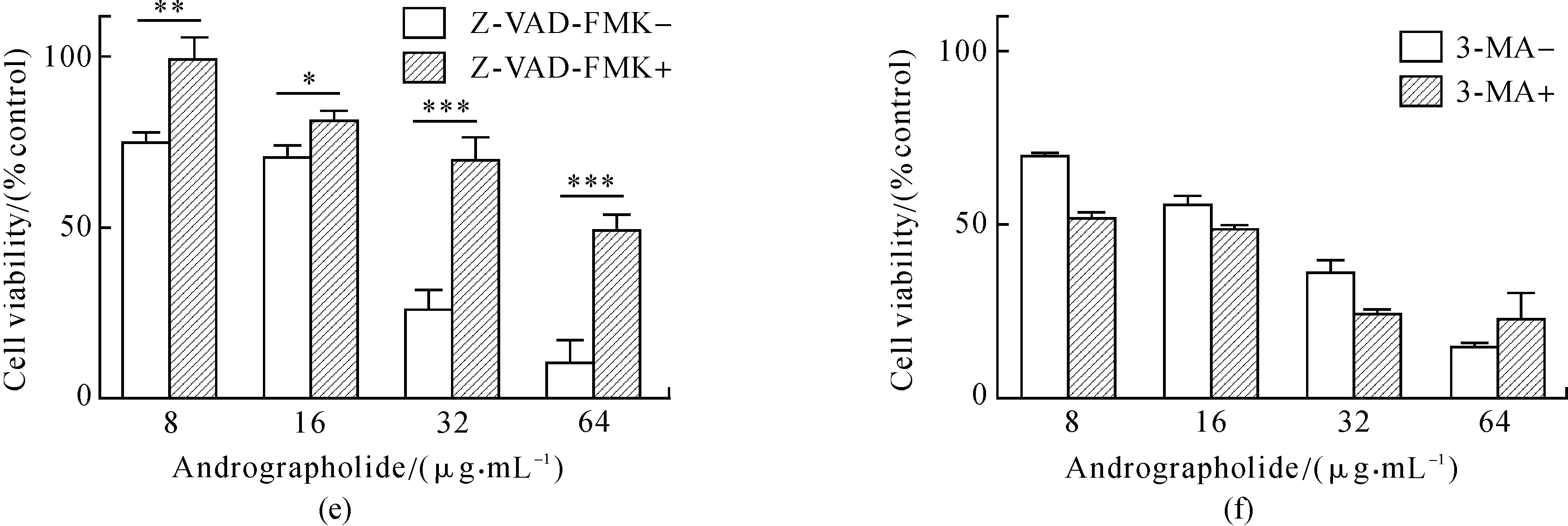
图1 细胞活力实验Fig.1 MTT assays(a)图中24和48 h、24和72 h的细胞活力对比具有显著差异性,可以看出药物作用48 h后具有明显的生长抑制效果;(b)图是(a)图同一实验数据的折线图:可见在处理48和72 h 2个时间梯度中,药物浓度大于16 μg· mL-1之后的作用效果不具有显著性差异,所以实验开始时选取3个时间梯度(24,48,72 h), 最终选择48 h作为后续实验的处理时间,在确定48 h的IC50后,将后续实验浓度调整为0,16,24,32 μg· mL-1;(c)、(d)图是药物对正常胃上皮细胞的2个MTT实验,目的在于验证药物对正常细胞没有生长抑制作用;正常细胞在各个药物浓度下都没有表现出生长抑制的效果;图中开始铺板时的正常细胞与肿瘤细胞数目相同,最终肿瘤细胞在0 μg· mL-1的吸光度比正常细胞高的原因可能是肿瘤细胞的分裂生长速度要比正常细胞快;(e)和(f)图分别是凋亡抑制实验和自噬抑制实验的MTT结果,其中凋亡抑制剂Z-VAD-FMK的浓度为10 μmol·L-1,自噬抑制剂3-MA浓度为50 μmol·L-1.
2.2 穿心莲内酯作用下SGC-7901细胞的ROS水平
随着药物浓度的增加,SGC-7901细胞内的ROS水平逐渐升高;并且在用NAC与NADPH预处理的实验组中ROS水平明显降低(见图2(a)和(b)).
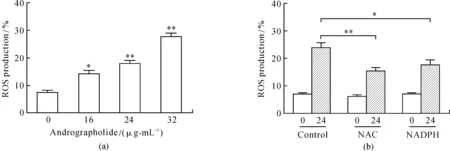
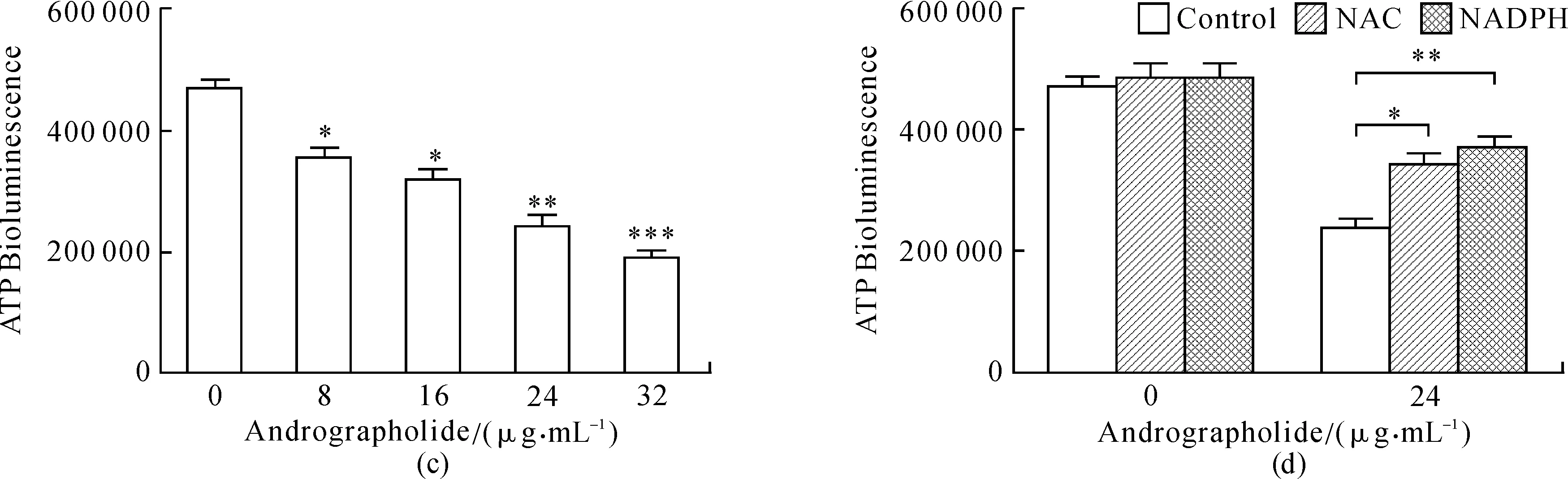
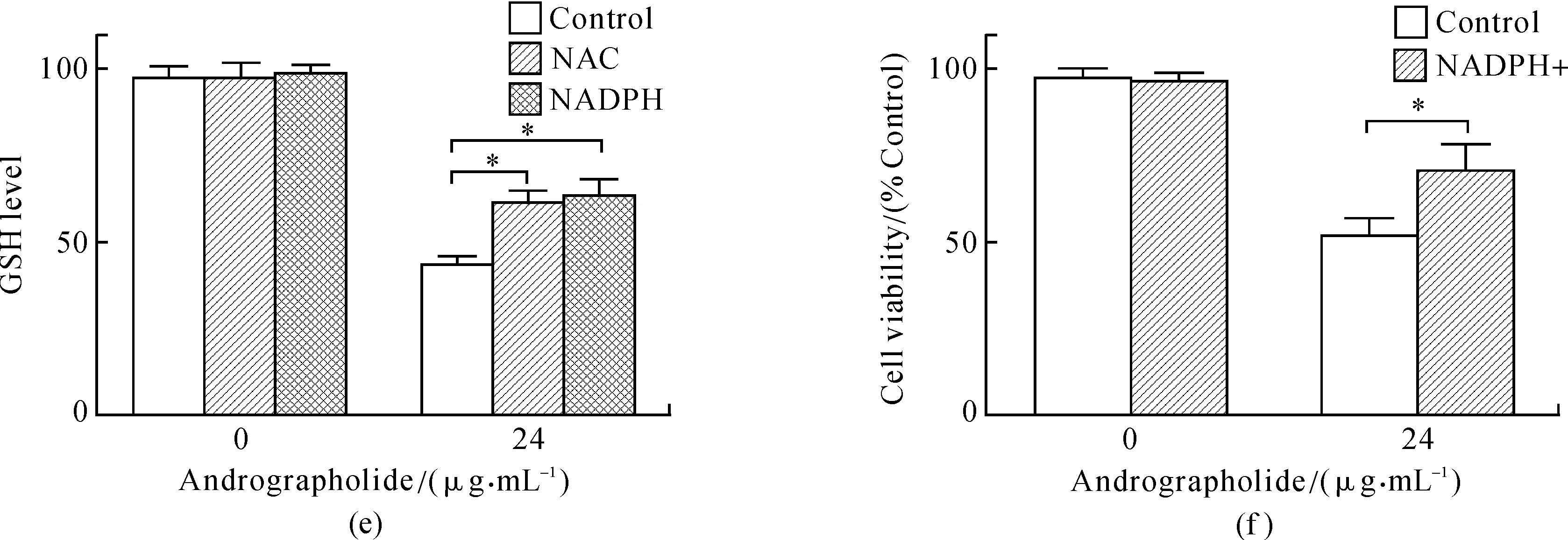
图2 细胞内活性氧、三磷酸腺苷和谷胱甘肽的浓度检测Fig.2 Level detection of ROS, ATP and GSH(a)和(b)图分别是药物处理后细胞内活性氧(ROS)水平的变化,阳性对照组是200 μmol·L-1 H2O2 处理的SGC7901细胞,其中NAC与NADPH的浓度分别为10 μmol·L-1与20 μmol·L-1;(c)和(d)图为不同药物浓度处理后细胞内ATP水平的变化,以及用NAC和NDAPH预处理后在IC50药物浓度下细胞内ATP水平的补偿实验;(e)图是IC50药物浓度处理后细胞内谷胱甘肽的水平变化和补偿实验;(f)图为NADPH对细胞活力阴性对照实验和在IC50药物浓度下NADPH的补偿实验.
2.3 穿心莲内酯导致细胞内ATP和GSH水平降低
穿心莲内酯影响线粒体膜电位,而线粒体膜电位对氧化呼吸链的正常运行至关重要.线粒体中进行氧化呼吸,产生能量货币ATP,膜电位的变化必然影响ATP的产生.同样,本实验也检测到穿心莲内酯处理SGC-7901后的细胞内ATP和GSH含量的降低,并且可以被NAC和NADPH的预处理恢复(见图2(d)和(e)).
2.4 穿心莲内酯对线粒体膜电位的影响
线粒体膜电位(mitochondrial membrane potential,MMP)崩溃是细胞早凋的标志之一.流式细胞仪检测发现,不同浓度穿心莲内酯(0,16,24,32 μg· mL-1)处理后的线粒体膜电位变化随加药浓度的增加而更明显(见图3(a)).
2.5 穿心莲内酯对G2/M期的周期阻滞与线粒体凋亡途径的诱导
随着穿心莲内酯浓度(0,16,24,32 μg· mL-1)的升高,SGC-7901细胞在G2/M期的周期阻滞(见图3(c))逐渐增强:(7.4±0.87)%,(14.3±1.37)%,(29.7±1.6)%,(40.1±3.35)%.
采用不同浓度穿心莲内酯(0,16,24,32 μg· mL-1)对SGC-7901处理48 h后,用 Annexin V-FITC & PI双染试剂处理细胞,于流式细胞仪下分选,结果表明凋亡率随着药物浓度的提高而上升(见图3(b)).
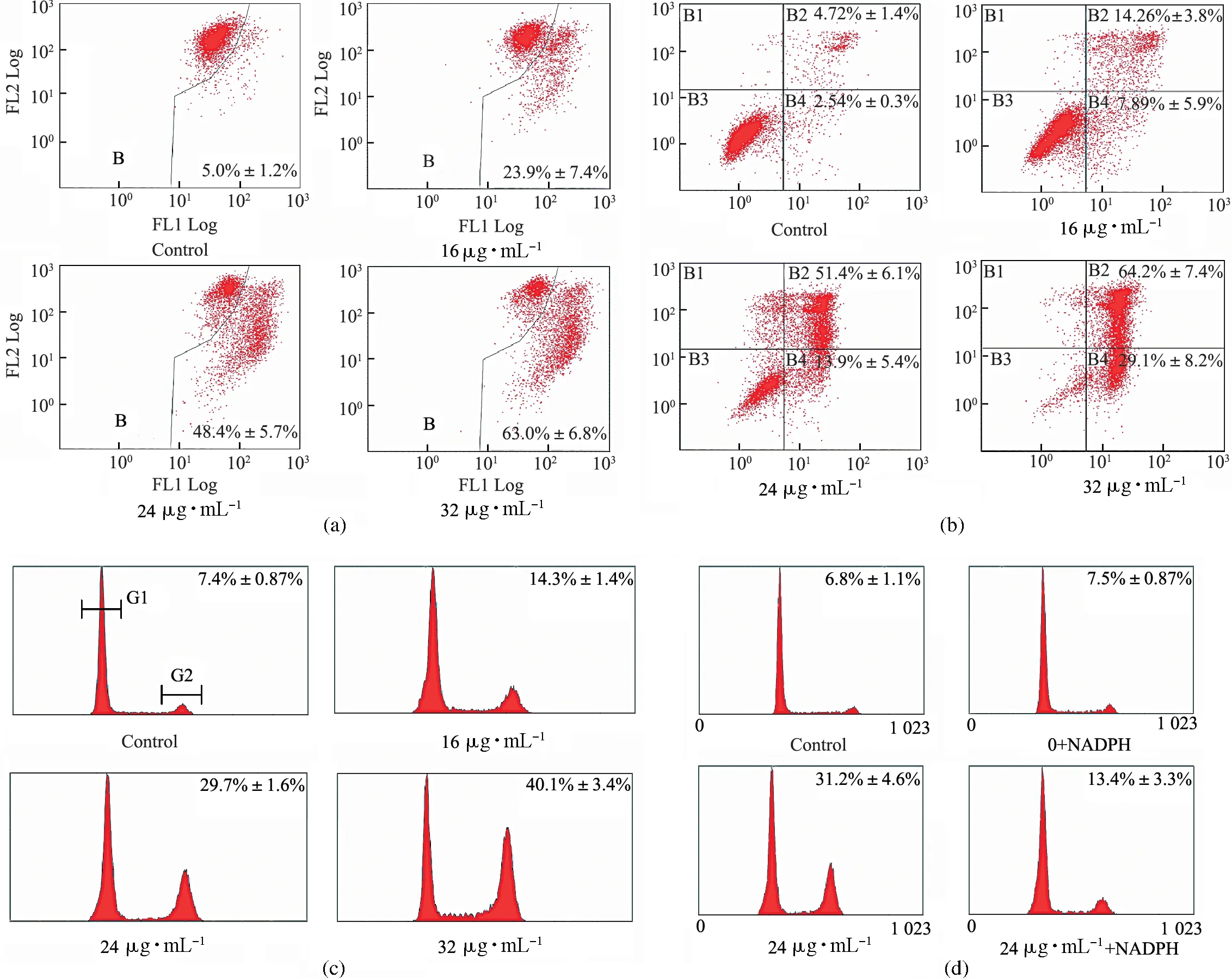
图3 穿心莲内酯诱导SGC-7901细胞凋亡和周期抑制的流式图Fig.3 Apoptosis and cycle arrest of SGC-7901 induced by andrographolide(a)图为药物处理过后线粒体膜电位的变化,其中FL2通道为膜电位正常的细胞,FL1通道为膜电位崩溃的细胞;(b)为凋亡流式图,其中B4象限为早凋细胞,B2象限为晚凋或者坏死的细胞;(c)为周期阻滞的流式检测,其中数字表示G2期细胞的百分比;(d)为20 μmol·L-1 NADPH预处理后的周期恢复流式图;以上数字都是平均值±标准方差(mean±SD).
2.6 Hoechst 33258染色
Hoechst 332258是针对细胞核进行染色的染料,从一个侧面可以反映细胞凋亡的数量.本实验在不同浓度的穿心莲内酯(0,16,24,32 μg·mL-1)处理胃癌细胞SGC7901后,用Hoechst 33258进行染色,结果发现随着浓度的升高,深染细胞增多(见图4).说明穿心莲内酯诱导了细胞凋亡,并且随着药物浓度的升高,凋亡率上升.
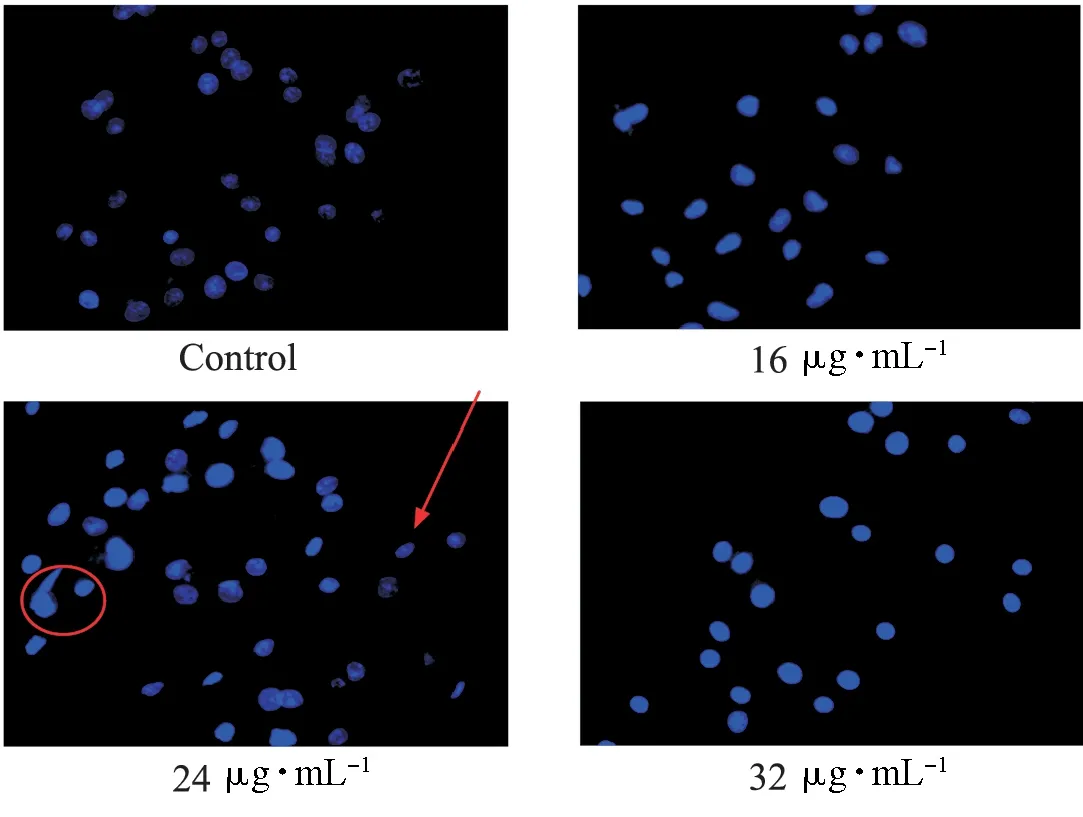
图4 Hoechst 33258染色Fig.4 Hoechst 33258 staining图4为形态学染色,进一步佐证药物诱导了凋亡的发生,其中红色圆圈处的深染为凋亡细胞,箭头所指的淡染为正常细胞;可见随着浓度的增加,深染的细胞数量越来越多,从而也说明凋亡率随着浓度的增加而增加,与图3(b)的流式结果一致.
2.7 NADPH的预处理对穿心莲内酯的周期阻滞具有补偿作用
在流式细胞仪上检测到周期捕获和凋亡现象后,随后检测了这2个生理过程中几个相关蛋白的水平(见图5(a)、(b)).XIAP是凋亡抑制蛋白,在凋亡发生时表达水平会降低,从而有利于凋亡的发生;cleaved-Caspase 3/9是活化形态的半胱氨酸蛋白酶,是凋亡的标志蛋白;而Bcl-2和BAX是Bcl家族成员,前者能够抑制凋亡发生,后者具有抑制作用.细胞色素C则是半胱氨酸酶发生级联反应的起始因子.p53蛋白是一种抑癌基因,作为转录因子会转录激活14-3-3,p21,GADD45 等蛋白的表达,从而抑制周期蛋白 cdc2 与 CyclinB1 的活性,使之转运出核并抑制二者的结合,从而抑制 G2/M 期的进展.Chk2是一种激酶,可以磷酸化cdc25,导致其失活,而后者可以激活cdc2,促进G2/M 期的跨越.然而,在用NADPH预处理SGC-7901细胞后,再用药物处理细胞,与正常加药组细胞相比,其周期阻滞得到恢复,但并不完全(NADPH对24 μg· mL-1加药组的周期抑制从31%下降到13%,见图2(f)和3(d)),同时周期、凋亡相关蛋白水平都有所恢复(见图5(a)和(b)).
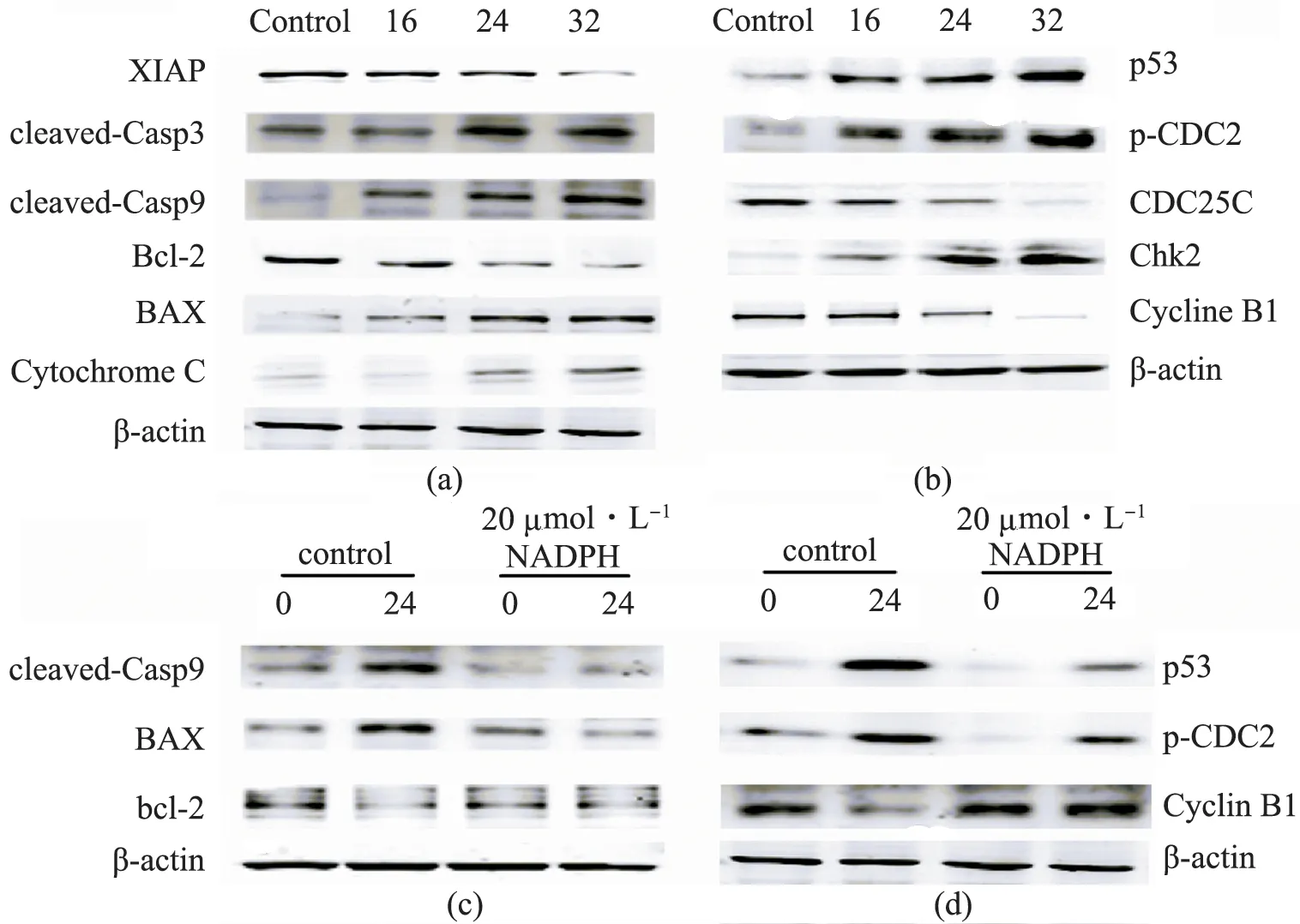
图5 凋亡和周期相关蛋白水平变化以及NADPH的补偿效应Fig.5 The changes of relevant proteins in apoptosis and G2/M phase and compensation of NADPH(a)(b)分别是凋亡相关蛋白和周期相关蛋白水平的变化,其中与凋亡相关的XIAP水平降低,活化的Caspase3/9水平上升,同时bcl-2下调,BAX上调,胞质中的细胞色素C浓度上升;在周期相关蛋白中p53、Chk2和磷酸化的CDC2水平下调,CDC25C和Cyclin B1表达水平下降,这些都进一步验证药物诱导了内源性凋亡和G2/M期阻滞的发生;(c)(d)分别为20 μmol·L-1 NADPH预处理后,在IC50药物浓度下,凋亡和周期相关蛋白水平的变化,可见相关蛋白水平得到了恢复.
3 讨 论
细胞周期的阻滞受到多种因素的调控,其中ROS介导的周期调控值得深入研究.穿心莲内酯作为一种中药提取物,具有多种生理功能,流式检测发现其提高了SGC-7901细胞内的活性氧水平,引起细胞膜电位的崩溃从而阻滞细胞周期.在实验过程中,通过补偿实验证明穿心莲内酯降低NADPH及GSH的水平,使得细胞处于高度氧化状态,因为有实验指出NADPH与细胞内ROS水平密切相关[7],并且GSSG的还原也需要NADPH的参与;ROS水平的提高激活了ROS介导的信号途径,最终与细胞周期相关的蛋白水平发生改变.本文并无直接证据证明穿心莲内酯通过何种途径促使一连串的细胞内信号的改变,但间接地说明了穿心莲内酯具有此种功能.
另外,很多药物作用都是浓度依赖和时间依赖的,穿心莲内酯也不例外.做了24,48,72 h时间梯度,最终将实验时间定在48 h,因此时药效好而且细胞死亡率不是太高,对后续实验的进行较为有利.
周期阻滞是抑制细胞生长的方式之一,之前已有研究指出穿心莲内酯能够引起细胞周期的阻滞,并且主要通过使周期抑制蛋白P27过表达来实现,不过P27对周期的抑制主要是将周期抑制在G0~G1期[8],而本研究的结果是将细胞周期阻滞在G2/M期,这说明穿心莲内酯对胃癌细胞SGC-7901的周期阻滞不是通过P27抑制信号通路实现的.实验中发现,调控该节点(checkpoint)的关键蛋白cdc25c,cdc2和CyclineB1都下调了,同时p53,Chk2上调了,表明药物是通过DNA-PK/p53/cdc2和ATM/ATR/Chk2/cdc25途径诱导G2/M期的抑制,并最终导致内源性细胞凋亡.实验仅证明了穿心莲内酯能提高SGC-7901细胞内ROS水平,并未有直接研究剖析高水平的ROS如何影响周期相关蛋白表达水平的.不过也有实验证明细胞内ROS可以直接作用于周期蛋白P21,激活P21的表达并导致G1期细胞周期阻滞[9].然后,进入细胞质中的ROS接下来进入细胞核对DNA造成损伤,进一步激发了内源途径凋亡[10],最终导致细胞死亡.
实验发现穿心莲内酯能够提升胃癌细胞SGC-7901内的ROS水平,并将胃癌细胞SGC-7901的周期阻滞在G2/M期,另外MTT实验也说明了穿心莲内酯能抑制胃癌细胞生长并对胃癌细胞有一定的杀伤力,这些开创性研究成果为利用穿心莲内酯治疗胃癌提供了深厚的理论基础.
4 结 论
穿心莲内酯能够抑制胃癌细胞SGC-7901的生长,其作用机制是将细胞抑制在G2/M期,并且诱导内源性细胞凋亡,最终导致细胞死亡.此外在过程中,还检测到细胞内的线粒体膜电位崩塌,ROS水平上升,ATP和GSH水平下降,这些现象均说明线粒体在穿心莲内酯导致的细胞周期抑制和程序性死亡中起重要作用.通过NADPH的补偿可以弥补部分周期抑制,进一步说明药物诱导的周期抑制与细胞内的ROS水平有关.
[1] LIM J C, CHAN T K, NG D S, et al. Andrographolide and its analogues: Versatile bioactive molecules for combating inflammation and cancer[ J ]. Clin Exp Pharmacol Physiol,2012,39(3):300-310.
[2] YAN J, CHEN Y, HE C, et al. Andrographolide induces cell cycle arrest and apoptosis in human rheumatoid arthritis fibroblast-like synoviocytes[ J ]. Cell Biol Toxicol,2012,28(1):47-56.
[3] SKULACHEV V P. Why are mitochondria involved in apoptosis? Permeability transition pores and apoptosis as selective mechanisms to eliminate superoxide-producing mitochondria and cell[ J ]. FEBS Lett,1996,397(1):7-10.
[4] SLIMEN I B, NAJAR T, GHRAM A, et al. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage[ J ]. Int J Hyperthermia,2014,30(7):513-523.
[5] SKULACHEV V P. Role of uncoupled and non-coupled oxidations in maintenance of safely low levels of oxygen and its one-electron reductants[ J ]. Q Rev Biophys,1996,29(2):169-202.
[6] LU H, ZHANG X Y, WANG Y Q, et al. Andrographolide sodium bisulfate-induced apoptosis and autophagy in human proximal tubular endothelial cells is a ROS-mediated pathway[ J ]. Environ Toxicol Pharmacol,2014,37(2):718-728.
[7] TEDESCHI P M, LIN H, GOUNDER M, et al. Suppression of cytosolic NADPH pool by thionicotinamide increases oxidative stress and synergizes with chemotherapy[J]. Mol Pharmacol,2015,88(4):720-727.
[8] CHEUNG M T, RAMALINGAM R, LAU K K, et al. Cell type-dependent effects of andrographolide on human cancer cell lines[J]. Life Sci,2012,91(15/16):751-760.
[9] YANG J, WU L J, TASHINO S, et al. Protein tyrosine kinase pathway-derived ROS/NO productions contribute to G2/M cell cycle arrest in evodiamine-treated human cervix carcinoma HeLa cells[ J ]. Free Radic Res,2010,44(4):792-802.
[10] PANT K, GUPTA P, DAMANIA P, et al. Mineral pitch induces apoptosis and inhibits proliferation via modulating reactive oxygen species in hepatic cancer cells[ J ]. BMC Complement Altern Med,2016,16(1):148-158.
Andrographolide induces cycle arrest at G2/M phase and intrinsic apoptosis in gastric carcinoma cells.
LIU Qizhang, GONG Xingguo
(InstituteofBiochemistry,CollegeoflifeSciences,ZhejiangUniversity,Hangzhou310058,China)
Andrographolide is one of the extractions fromAndrographispaniculata, which is a traditional herb early reported its anti-tumor efficacy, and is proved it’s the active ingredient which could suppress multiple carcinoma. It is proclaimed that many kinds of mechanisms concentrated on autophagy or apoptosis, and correlative signal pathway. To verify whether andrographolide would prevent amplification of gastric cancer cells, and to investigate the mechanism of andrographolide’s effect on cell growth, cycle arrest and induction of apoptosisinvitro, we designed the experiment: SGC7901 was treated with different doses(0, 16, 24 and 32 μg·mL-1) of andrographolide for 24, 48 and 72 h; Cell viability was measured by MTT assays to determine the efficacious time of performance. Then, investigations of cell cycle, ROS level and mitochondria membrane potential were proceeded and detected by flow cytometry. Cell apoptosis was monitored by flow cytometry using Annexin V-FITC/PI staining. Expression level of p53, p-CDC2, bcl-2, Bax were tested by western blot. Finally, we found that andrographolide effectively inhibited SGC-7901 cell growth and the IC50was 24 μg· mL-1in 48 h. Meanwhile, the medicine showed the ability of cell cycle arrest at G2/M phase and apoptosis above 60% when treated with 24 μg· mL-1andrographolide for 48 h. Western blot indicated that cell cycle and apoptosis relevant proteins, such as p53, p-CDC2 and Bax were up-regulated and bcl-2 was down-regulated. In the end, we conclude that andrographolide inhibits SGC-7901 cell proliferation through G2/M phase arrest and inducing intrinsic apoptosis pathway.
andrographolide; gastric carcinoma; induction of apoptosis; cycle arrest

2016-11-10.
刘奇章(1990-),ORCID: http://orcid.org/0000-0002-4043-1783,男,硕士,主要从事生物化学与分子生物学研究,E-mail: 18268139991@163.com.
*通信作者,ORCID: http://orcid.org/0000-0003-1206-5154,E-mail: gongxg@zju.edu.cn.
10.3785/j.issn.1008-9497.2017.04.011
Q 50
A
1008-9497(2017)04-456-08
Journal of Zhejiang University(Science Edition), 2017,44(4):456-463

