不同胎龄小鼠脑组织中神经干细胞所占比例的研究
张凤兰,杨璐军,朱红梅,张南炀,沙学芳,朱柯颖,肖志成,5*
(1.昆明医科大学分子临床医学研究院,云南省干细胞和再生医学重点实验室,昆明 650500; 2.深圳市宝安区人民医院,深圳 518101; 3.南方医科大学珠江医院神经外科,广东神经外科研究所,广东省脑功能修复与再生重点实验室,广州 510282;4.昆明医科大学基础医学院,昆明 650500; 5.澳大利亚莫纳什大学免疫与干细胞研究中心,墨尔本VIC3010)
不同胎龄小鼠脑组织中神经干细胞所占比例的研究
张凤兰1,杨璐军2,3,朱红梅1,张南炀1,沙学芳4,朱柯颖4,肖志成1,5*
(1.昆明医科大学分子临床医学研究院,云南省干细胞和再生医学重点实验室,昆明 650500; 2.深圳市宝安区人民医院,深圳 518101; 3.南方医科大学珠江医院神经外科,广东神经外科研究所,广东省脑功能修复与再生重点实验室,广州 510282;4.昆明医科大学基础医学院,昆明 650500; 5.澳大利亚莫纳什大学免疫与干细胞研究中心,墨尔本VIC3010)
目的 详细了解并比较不同胎龄小鼠全脑和大脑皮层组织中神经干细胞(neural stem cells,NSCs)所占比例,为后期优化分离培养NSCs提供直接量化数据。方法 分离不同胎龄小鼠全脑(胎龄12.5、14、16和18 d)和大脑皮层(胎龄14、16 和18 d)组织,消化成单细胞悬液,贴壁培养3 ~ 4 h,细胞免疫荧光标记NSCs特异性标记物Nestin,统计分析各组中NSCs所占比例。另外,通过实时荧光定量PCR技术检测Nestin mRNA在不同胎龄(12.5、14、16和18 d)小鼠大脑皮层中的表达水平。结果 细胞免疫荧光结果显示,分离培养的不同胎龄小鼠全脑和大脑皮层组织中均有Nestin阳性细胞。在分离培养的小鼠全脑组织中胎龄12.5 d组NSCs所占比例最高,为53.42% ± 1.57%;胎龄18 d组NSCs所占比例最低,为25.96% ± 1.31%,而胎龄14 d组和16 d组位于二者之间。在分离培养的不同胎龄小鼠大脑皮层组织中,胎龄14 d组NSCs所占比例最高,为33.65% ± 0.29%;胎龄18 d组比例最低,为25.29% ± 0.28%,胎龄16 d组位于二者之间(26.82% ± 0.30%)。实时荧光定量PCR结果显示,当把胎龄12.5 d组的小鼠大脑皮层组织中Nestin mRNA表达水平设定为1,胎龄14 d组的小鼠大脑皮层组织中Nestin mRNA的相对表达量为0.83± 0.04,胎龄16 d组为0.77± 0.05,胎龄18 d组为0.44± 0.05。因此,随着小鼠胎龄增加,小鼠大脑皮层中的Nestin mRNA的表达水平逐渐下降。结论 在小鼠大脑发育过程中,随着胎龄增加,分离培养的小鼠全脑和大脑皮层组织中神经干细胞比例逐渐降低。
小鼠;不同胎龄;神经干细胞;全脑;大脑皮层
神经干细胞(neural stem cells,NSCs)是中枢神经系统中一类能够自我更新,增殖并分化成神经元、星形胶质细胞和少突胶质细胞的细胞[1,2]。1992,Reynolds 和Weiss在成体小鼠纹状体中首次分离培养出NSCs[3]。自此以后,NSCs的基础研究和临床应用成为国内外新热点[4,5]。近年来,小鼠NSCs体外分离培养技术已被广泛报道,但是所用小鼠胎龄有所不同[6]。本实验旨在统计分析分离培养的不同胎龄小鼠全脑和大脑皮层细胞中NSCs所占比例及差异,为后期优化培养高纯度NSCs提供直接量化数据和前期研究基础。
1 材料和方法
1.1 实验动物
SPF级C57BL/6小鼠,购自北京维通利华实验动物技术有限公司,许可证号【SCXK(京)2011-0011】,后在昆明医科大学清洁级实验动物房繁殖饲养【SYXK(滇)2005-0004】。
1.2 主要试剂
Nestin抗体(Millipore公司),山羊抗小鼠荧光二抗(Abcam公司),DMEM/F12细胞培养基(Gibco公司),碱性成纤维生长因子(bFGF,Peprotech公司),表皮生长因子(EGF,Peprotech公司),B27(Gibco公司),0.05% EDTA-胰蛋白酶(Gibco公司),多聚甲醛(索莱宝公司),BSA(索莱宝公司),DAPI(罗氏公司),Trizol(Sigma公司),DNaseI(宝生物公司),PrimerScript RT reagent Kit(宝生物公司),Faststart Universal SYBR Green Master(ROX)(罗氏公司)
1.3 实验方法
1.3.1 小鼠大脑组织细胞的分离培养
将20~ 26 g左右健康成年C57BL/6雌性小鼠与雄性小鼠于傍晚合笼,次日观察雌性小鼠有无阴道栓,若有则表示交配成功,记为胎龄0.5 d(embryonic 0.5 d,E0.5)。标记多只孕鼠,分别在胎龄12.5 d(E12.5)、14 d(E14)、16 d(E16)和18 d(E18)时使用。将孕鼠麻醉,在无菌条件下每组至少分离3 ~ 4只雌雄不限的胎鼠全脑和大脑皮层,加入适量0.05% EDTA-胰蛋白酶在37℃水浴中消化脑组织,然后轻柔吹散成单个细胞,800 rpm离心10 min,弃上清,加入含2% B27,20 ng/mL的EGF和bFGF的DMEM/F12生长培养基调整细胞密度,按照 5 × 105cells/mL接种至已包被细胞外基质的24孔细胞培养板中培养3 ~ 4 h。然后加入4%多聚甲醛固定30 min,用于后期细胞免疫荧光实验。
1.3.2 细胞免疫荧光染色
将固定的细胞用PBS洗3遍,孔内加入0.3% Triton X-100打孔10 min,然后加入10% BSA室温封闭1 h。再次用PBS洗3遍,加入Nestin一抗(1∶50)4℃孵育过夜,次日用PBS清洗后加入相应的二抗(1∶1000)室温孵育1 h(此后需避光),最后加入DAPI细胞核染色5 min。荧光显微镜下观察,然后每个样品随机采集至少5张细胞分布较均匀的图片,计数Nestin阳性细胞和DAPI阳性细胞并计算二者比例。
1.3.3 RNA抽提及real-time PCR
每组至少分离3只12.5 d(E12.5)、14 d(E14)、16 d(E16)和18 d(E18)胎龄的雌雄不限的胎鼠大脑皮层,加入适量Trizol研磨至组织完全溶解,按照说明书操作步骤抽提总RNA,加入DNaseI去除基因组DNA。然后按照Primer Script RT reagent Kit(Perfect Real-time)说明书逆转获取cDNA。应用ABI7300型荧光定量PCR仪,使用Faststart Universal SYBR Green Master(ROX)进行扩增。Nestin上游引物序列为5′-AAAGTTCCAGCTGG CTGTGG-3′,下游引物序列为5′-TGGGGTCAGG AAAGCCAAGA-3′,Gapdh上游引物序列为5′-TGACGTGCCGCCTGGAGAAA-3′,下游引物序列为5′-AGTGTAGCCCAAGATGCCCTTCAG-3′。实验结果采用2-ΔΔCT法进行相对定量分析。
1.4 统计学方法
2 结果
2.1 不同胎龄小鼠全脑NSCs的比例及差异
通过观察4组细胞免疫荧光图发现,不同胎龄小鼠全脑组织细胞经消化分离后,未见细胞团块几乎全为单细胞,且未发现碎裂细胞残片。细胞贴壁培养3 ~ 4 h后,能较好贴壁。DAPI阳性细胞呈蓝色,在细胞核中均匀分布。Nestin阳性细胞呈绿色,在细胞质中均匀分布。且胎龄12.5 d组Nestin阳性细胞比例较胎龄14、16 d和18 d组高(图1)。

图1 不同胎龄小鼠全脑组织中的NSCs (细胞免疫荧光染色)Fig.1 NSCs in the whole brain of mice at different embryonic days (Imunofluorescence staining)

注:***P< 0.001。图2 不同胎龄小鼠全脑组织NSCs的比例Note. ***P< 0.001 showing a significant difference at different embryonic days.Fig.2 Proportion of NSCs in the whole brain of mice at different embryonic days
细胞免疫荧光统计分析显示,胎龄12.5 d组分离培养的全脑细胞中NSCs所占比例最高,为53.42% ± 1.57%,并与其他三组差异有显著性(P< 0.001)。胎龄18 d组所占比例最低,为25.96% ± 1.31%,胎龄14 d和16 d 组位于二者之间。另外,胎龄14 d组NSCs比例(33.77% ± 1.12%)与胎龄18 d组之间差异有显著性(P<0.05,未标注)(图2)。2.2 不同胎龄小鼠大脑皮层NSCs的比例及差异
观察3组不同胎龄小鼠大脑皮层细胞的免疫荧光图,发现无细胞团块,无碎裂细胞残片(与图1类似),且胎龄14 d组Nestin阳性细胞比例较胎龄16 d和18 d组高(图3)。
细胞免疫荧光统计分析显示,胎龄14 d组小鼠大脑皮层细胞中NSCs所占比例最高,为33.65% ± 0.29%;胎龄18 d组所占比例最低,为25.29% ± 0.28%。胎龄14 d组与16 d组(P< 0.01)和18 d组(P< 0.001)之间差异有显著性,但胎龄16 d组与18 d组之间差异无显著性(图4)。
2.3 不同胎龄小鼠大脑皮层中Nestin mRNA的表达水平
Real-time PCR检测胎龄12.5、14、16 d和18 d时小鼠大脑皮层中Nestin mRNA的表达水平结果显示,当把胎龄12.5 d组小鼠大脑皮层的Nestin mRNA表达水平设定为1时,胎龄14 d组的相对表达量为0.83±0.04,16 d组为0.77± 0.05,18 d组为0.44± 0.05。其中,胎龄18 d组小鼠大脑皮层中的Nestin mRNA表达水平最低,与另外三组差异有显著性(P< 0.01或0.001)。另外,胎龄12.5 d组与胎龄16 d组之间差异有显著性(P<0.05,未标注)(图5)。由此可知,随着小鼠胎龄增加,小鼠大脑皮层中Nestin mRNA的表达水平逐渐下降。

图3 不同胎龄小鼠大脑皮层的NSCs(细胞免疫荧光染色)Fig.3 NSCs in cerebral cortex of mice at different embryonic days (Immunofluorescence staining)
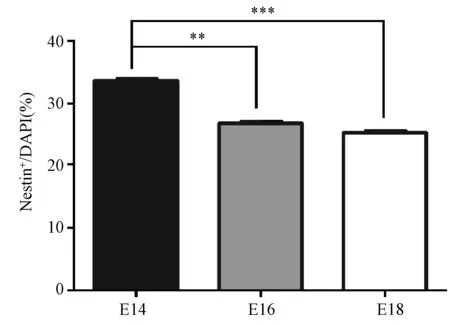
注:**P< 0.01;***P< 0.001。图4 不同胎龄小鼠大脑皮层NSCs的比例Note. **P< 0.01; ***P< 0.001.Fig.4 Proportions of NSCs in the cerebral cortex of mice at different embryonic days

注:**P< 0.01;***P< 0.001。图5 不同胎龄小鼠大脑皮层中Nestin mRNA 的表达水平Note. **P< 0.01; ***P< 0.001.Fig.5 Expression of Nestin mRNA in the cerebral cortex of mice at different embryonic days
3 讨论
NSCs的发现是神经科学领域的重要进展, 彻底改变了人们以往认为中枢神经不能再生的传统理念,为神经系统的研究与应用开辟了广阔的前景[7,8]。但是,目前NSCs的来源及数量不足仍是临床应用和基础研究中普遍存在的问题[1,9]。因此,优化NSCs的体外培养对于研究其潜在价值具有重要意义。
目前,在小鼠的脑源性NSCs研究中,已经建立以胎鼠、新生鼠和成体鼠作为主要供体来源的NSCs培养方法[10,11]。但就胎鼠而言,各科研机构取材时间有所不同,主要集中于胎龄12 d至胎鼠出生前[12,13]。虽然取自不同胎龄小鼠脑组织的神经干细胞都能自我更新,增殖并可以诱导分化,但是如何提高NSCs占分离培养总细胞的比例,减少杂细胞在NSCs培养中造成的负面影响是NSCs培养实验中非常重要的前期工作[14]。因此,充分了解并比较来自不同胎龄小鼠脑组织中NSCs的比例及其差异是十分必要的。
Nestin是一种中间纤维丝,属于细胞骨架蛋白[15,16]。它在早期胚胎发育的神经外胚层细胞中强烈表达,随着神经细胞的迁移和分化表达逐渐减弱,并在神经细胞的分化完成后表达停止[17]。该蛋白是目前广泛使用的NSCs特异性标记物[1,15],由神经组织分离培养的细胞,通过细胞免疫荧光染色认为Nestin阳性标记细胞即为NSCs。
本实验细胞免疫荧光结果表明在小鼠全脑组织分离培养的细胞中,胎龄12.5 d组NSCs占总细胞的比例明显高于其他三组,并约为胎龄18 d组比例的两倍。胎龄14 d组与18 d组之间也有显著性差异。在小鼠大脑皮层分离培养的细胞中,胎龄14 d 组NSCs占总细胞的比例明显高于胎龄16 d组和胎龄18 d组。另外,由于胎龄12.5 d时小鼠的大脑发育处于初期,大脑体积较小,大脑皮层较薄,消化后所得细胞量较少且细胞死亡率较高,对实验结果造成较大误差,故本实验未将其结果纳入分析。Real-time PCR实验检测小鼠大脑皮层发育过程中Nestin mRNA的表达水平变化,结果显示胎龄18 d组小鼠的大脑皮层中Nestin mRNA表达水平显著低于胎龄较小的其他三组。因此,随着小鼠胎龄增加,小鼠大脑皮层中的Nestin mRNA表达量逐渐降低,此结果与细胞免疫荧光结果基本一致。
刘晓梅等[18]通过对胎龄8.5 d至13.5 d的Nestin-GFP转基因小鼠胚胎进行冰冻切片,观察发现Nestin随着胚胎发育表达逐步增强,在胎龄11.5 d 至13.5 d时最强。尹晓娟等[19]通过Nestin免疫组化技术分别比较分析了不同胎龄人胎脑室下区NSCs在形态和存在方式上的差异,发现NSCs数量随着胎龄的增加而减少。杨蓬勃等[20]通过HE染色和免疫组化实验发现人胎脑VZ/SVZ内含有大量Nestin阳性细胞,随着发育进行Nestin免疫反应强度和阳性细胞数都逐步降低。此三者研究结果与本实验结果较一致。吴雨岭等[21]通过Nestin免疫组织化学方法检测11、15和19 d胎龄的 Wistar大鼠脑组织中Nestin阳性NSCs的分布及比例,发现随着胎龄增加脑室室管膜及管膜下区NSCs逐渐增多,19 d时Nestin阳性细胞多达86.1%±11.72%,此结果与本实验结果及大多数已报道实验结果有较大差异。
本实验通过将分离的脑细胞短暂贴壁培养后立即进行Nestin细胞免疫荧光染色,能真实反映所分离脑组织中NSCs数量及比例,且样品为单层细胞,便于统计分析,数据可靠性更高。另外,本方法还能检测分离脑组织细胞过程中操作是否合格,是否因操作不足有细胞团块存在或操作过度有细胞死亡或细胞碎片存在等。
综上所述,在分离培养小鼠NSCs实验中,我们推荐分离12.5 d胎龄的小鼠全脑或者14 d胎龄的小鼠大脑皮层进行培养,以获得起始纯度较高的NSCs,通过快速扩增,用于后期实验。
[1] English D, Sharma NK, Sharma K,et al. Neural stem cells-trends and advances[J]. J Cell Biochem,2013,114 (7):764-772.
[2] Murphy M, Reid K, Dutton R, et al. Neural stem cells[J]. J Investig Dermatol Symp Proc,1997,2 (1):8-13.
[3] Reynolds BA, Tetzlaff W, Weiss S.A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes[J]. J Neurosci,1992,12 (11):4565-4574.
[4] Conti L, Cattaneo E.Neural stem cell systems: physiological players or in vitro entities?[J]. Nat Rev Neurosci,2010,11(3):176-187.
[5] Walker T, Huang J, Young K.Neural stem and progenitor cells in nervous system function and therapy[J]. Stem Cells Int,2016:1890568.
[6] Steffenhagen C, Kraus S, Dechant FX, et al. Identity, fate and potential of cells grown as neurospheres: species matters[J]. Stem Cell Rev,2011,7(4):815-835.
[7] Yamaguchi M, Seki T, Imayoshi I,et al. Neural stem cells and neuro/gliogenesis in the central nervous system: understanding the structural and functional plasticity of the developing, mature, and diseased brain[J]. J Physiol Sci,2016,66(3):197-206.
[8] 唐玺和,陈志国,张愚.诱导神经干细胞的研究进展及应用前景[J].中国比较医学杂志, 2015, 25(2): 67-70.
[9] Azari H, Sharififar S, Rahman M, et al. Establishing embryonic mouse neural stem cell culture using the neurosphere assay[J]. J Vis Exp,2011,114(4):764-772.
[10] Louis SA, Mak CK, Reynolds BA.Methods to culture, differentiate, and characterize neural stem cells from the adult and embryonic mouse central nervous system[J]. Methods Mol Biol,2013,946:479-506.
[11] Morte MI, Carreira BP, Machado V, et al. Evaluation of proliferation of neural stem cells in vitro and in Vivo[M].Curr Protoc Stem Cell Biol,2013, Chapter 2: Unit 2D. 14.
[12] Sirko S, von Holst A, WizenmannA, et al. Chondroitin sulfate glycosaminoglycans control proliferation, radial glia cell differentiation and neurogenesis in neural stem/progenitor cells[J]. Development,2007,134 (15):2727-2738.
[13] Torrado EF, Gomes C, Santos G, et al.Directing mouse embryonic neurosphere differentiation toward an enriched neuronal population[J]. Int J Dev Neurosci,2014,37:94-99.
[14] Gritti A, Dal Molin M, Foroni C, et al. Effects of developmental age, brain region, and time in culture on long-term proliferation and multipotency of neural stem cell populations[J]. J Comp Neurol,2009,517 (3):333-349.
[15] Kawaguchi A, Miyata T, Sawamoto K,et al. Nestin-EGFP transgenic mice: visualization of the self-renewal and multipotency of CNS stem cells[J]. Mol Cell Neurosci,2001,17(2):259-273.
[16] 曲春辉,张玲,武杰,等.大鼠羊膜细胞体外培养及其干细胞标记物的表达[J].中国比较医学杂志, 2015, 35(4): 61-65.
[17] Gilyarov AV.Nestin in central nervous system cells[J]. Neurosci Behav Physiol,2008,38 (2):165-169.
[18] 刘晓梅.Nestin基因敲除对小鼠胚胎发育和神经干细胞的增殖与分化的影响[D].广州:中山大学. 2007.
[19] 尹晓娟,巨容,封志纯.不同胎龄人胎脑室下区神经干细胞生长特征及增殖分化实验研究[J]. 中华儿科杂志, 2006, 44 (7): 500-504.
[20] 杨蓬勃,靳辉,肖欣莉,等. 人胎脑额叶下VZ/SVZ的发育及其内nestin阳性细胞的分布[J]. 南方医科大学学报, 2013, 33(5): 708-712.
[21] 吴雨岭,余鸿,郭勇,等. 不同胎龄大鼠大脑神经干细胞的分布比较[J]. 四川解剖学杂志, 2005, 13 (2): 1-3.
Proportion of neural stem cells in brain tissues of miceat different embryonic days
ZHANG Feng-lan1, YANG Lu-jun2, 3, ZHU Hong-mei1, ZHANG Nan-yang1,SHA Xue-fang4, ZHU Ke-ying4, XIAO Zhi-cheng1, 5*
(1.Key Laboratory of Stem Cell And Regenerative Medicine, Institute of Molecular And Clinical Medicine, KunmingMedical University, Kunming 650500, China; 2.Department of Neurosurgery, Baoan People’s Hospital of Shenzhen,Shenzhen 518101; 3.Neurosurgery Institute, Key Laboratory on Brain Function Repair And Regeneration ofGuangdong Province, Department of Neurosurgery, Zhujiang Hospital of Southern Medical University, Guangzhou510282; 4.Basic Medical College, Kunming Medical University, Kunming 650500; 5.Department of Anatomy AndDevelopmental Biology, Monash University, Clayton, Victoria 3800 Australia)
Objective To understand and compare the proportion of neural stem cells (NSCs) in the whole brain and cerebral cortex of mice at different embryonic days, and provide quantitative data for the later optimization of NSCs isolation and culture. Methods The whole brains (at embryonic 12.5, 14, 16 and 18 days) and cerebral cortex (at embryonic14, 16 and 18 days) were isolated and digested into single cell suspension, and were adherently cultured for 3-4 h.Immunofluorescence staining of Nestin, a NSCs specific marker, was used to statistically analyze the proportion of NSCs in each group.Expression of Nestin mRNA in the cerebral cortex of mice at E12.5, E14, E16, and E18 was detected by real-time fluorescence quantitative PCR. Results The result of immunofluorescence assay showed that there were Nestin-positive cells in the whole brain and cerebral cortex of mice at different embryonic days. In the whole brain,the proportion of NSCs was highest at E12.5 (53.42±1.57%) and lowest at E18(25.96±1.31%), and the proportions at E14 and E16 were placed in the middle among the groups. In the cerebral cortex, the highest proportion of NSCs was at E14 (33.65±0.29%), and the lowest at E18(25.29±0.28%), and the middle at E16 (26.82±0.30%).The result of real-time PCR showed that when the mRNA expression of Nestin in the cerebral cortex was set to 1, the relative mRNA expression of Nestin was 0.83±0.04 at E14, 0.77±0.05 at E16, and 0.44 ±0.05 at E18. Thus, the mRNA expression level of Nestin in the mouse cerebral cortex was gradually decreasing with the increase of embryonic days. Conclusions During the brain development, the proportion of NSCs is gradually decreasing in the whole brain and cerebral cortex of mice with the increase of embryonic days.
Mouse; Embryonic days; Neural stem cells; Brain development; Cerebral cortex
云南省高端人才引进计划(编号:20080A004);云南省干细胞和再生医学重点实验室(编号:2015DG027)。
张凤兰(1986-),女,博士研究生,研究方向:神经干细胞与miRNAs。Email: FenglanZhang2016@126.com
肖志成(1957-),男,教授,博士导师,研究方向:神经退行性疾病。Email: zhicheng.xiao@monash.edu
研究报告
R-33
A
1671-7856(2017) 07-0048-05
10.3969.j.issn.1671-7856. 2017.07.009
2017-01-08

