血液分离利奈唑胺耐药头状葡萄球菌耐药性及相关临床特征分析
杨 洋, 吴 湜, 郭 燕, 叶信予, 朱德妹, 林东昉, 徐晓刚
血液分离利奈唑胺耐药头状葡萄球菌耐药性及相关临床特征分析
杨 洋, 吴 湜, 郭 燕, 叶信予, 朱德妹, 林东昉, 徐晓刚
目的 了解利奈唑胺耐药头状葡萄球菌血流感染的临床及病原菌耐药特点。方法 收集利奈唑胺耐药头状葡萄球菌血液分离株,并测定药敏;PCR及测序检测耐药基因cfr及23S rRNA耐药突变;临床分离株用脉冲场凝胶电泳(PFGE)进行同源性分析;病例资料分析。结果 从3例患者血标本中分离到5株利奈唑胺耐药头状葡萄球菌;这些临床分离株对苯唑西林、左氧氟沙星、庆大霉素等常用抗菌药物耐药,仅对糖肽类、利福平和甲氧苄啶-磺胺甲唑敏感;5株耐药菌的23S rRNA均存在突变,4株携带cfr基因;PFGE显示5株临床株属同一谱型;3例患者均有留置深静脉导管,2例曾接受利奈唑胺治疗。结论 利奈唑胺耐药头状葡萄球菌呈多重耐药表型;头状葡萄球菌对利奈唑胺耐药由23S rRNA突变及cfr基因导致;长疗程使用利奈唑胺及留置深静脉导管可能是此类耐药菌感染的危险因素。
利奈唑胺; 耐药; 血培养; 头状葡萄球菌
头状葡萄球菌(Staphylococcus capitis)属凝固酶阴性葡萄球菌,既是人类皮肤正常菌群,又是一种条件致病菌,可引起皮肤软组织感染、血流感染等感染性疾病。利奈唑胺是第一个批准用于临床的唑烷酮类抗菌药物,是目前治疗甲氧西林耐药金黄色葡萄球菌(MRSA)、万古霉素耐药肠球菌(VRE)等临床重要耐药病原菌感染的主要药物之一。随着该药的广泛应用,各类细菌对其耐药的报道日益增多,获得外源性耐药基因cfr及23S rRNA基因突变是导致细菌耐药的主要机制[1]。近年我国浙江、江苏等省份已有多所医院报道利奈唑胺耐药头状葡萄球菌所致血流感染[2-4]。我院也曾出现头状葡萄球菌引起的血流感染病例,本研究拟对此类耐药菌的耐药性、耐药机制、同源性以及相关临床资料进行分析,初步了解其耐药性形成机制及传播特点,为防治其感染提供客观依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 5株头状葡萄球菌临床株于2012年分离自上海华山医院3例血流感染患者,12-53、12-86分离自患者1非同次标本,12-400分离自患者2,12-498、12-535分离自患者3非同次标本。药敏试验质控株金黄色葡萄球菌ATCC29213为本研究所保存菌株;含cfr基因的利奈唑胺耐药头状葡萄球菌对照株由浙江大学医学院张嵘教授惠赠。
1.1.2 主要试剂及仪器 Mueller Hinton(MH)培养基 、哥伦比亚培养基(英国OXOID公司);合成引物(上海生工生物工程技术服务有限公司);E试验条(法国生物梅里埃公司);琼脂糖(美国Bio-Rad公司);核酸纯化试剂盒QIAamp DNA mini kit(德国Qiagen公司);限制性内切酶SmaI、PCR试剂(TaKaRa公司)。TP-600型PCR仪(TaKaRa公司);脉冲场电泳系统及凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 病例资料分析 对3例患者的病史进行分析,了解其基础疾病、抗菌药物使用、深静脉导管留置、血培养细菌检出等资料。
1.2.2 临床株菌种确认 采用通用引物8F、1492R(序列见表1)扩增临床株的16S rRNA基因[5],测序后与GenBank序列进行比对,以确认菌种。
1.2.3 药敏试验 采用琼脂稀释法测定常用抗菌药物对临床分离株的最低抑菌浓度(MIC),利奈唑胺的MIC用E试验方法进行确认,判断标准参照CLSI M100-S22。
1.2.4 核酸纯化 细菌基因组DNA采用QIAamp DNA mini kit,按试剂盒说明书进行提取、纯化,作为PCR扩增模板。
1.2.5 耐药相关基因检测及分析 采用表1所列引物进行PCR扩增,检测临床株中的cfr基因,获取23S rRNA基因全序列,阳性扩增产物进一步测序及比对分析。
1.2.6 脉冲场凝胶电泳(PFGE)分析 头状葡萄球菌临床分离株SmaI酶切后进行PFGE电泳,分析其同源性,具体方法见参考文献[2]。
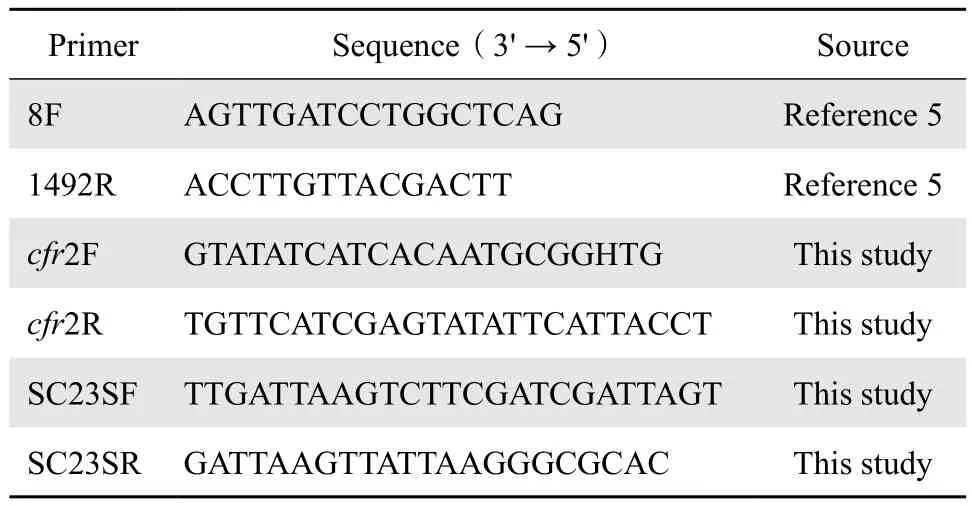
表1 基因测序PCR引物Table 1 Primers used for PCR in this study
2 结果
2.1 病例资料
患者1,女性,51岁,患者2与患者3均为男性,年龄分别为52岁和78岁。3例患者均因脑外伤或脑出血等行颅脑手术后入住ICU,均留置深静脉导管;住院期间均并发肺部感染,反复发热,痰培养分离到肺炎克雷伯菌、鲍曼不动杆菌等革兰阴性杆菌,均接受了美罗培南、酶抑制剂复方制剂等广谱抗菌药物的治疗。患者1和患者3在应用利奈唑胺治疗约2周后血培养检出利奈唑胺耐药头状葡萄球菌,更换万古霉素、利福平等药物治疗后体温下降。患者2病程中未曾接受利奈唑胺治疗,在分离到菌株后更换了深静脉导管,未使用新抗菌药物,24 h后体温下降至正常。
2.2 临床株菌种确认
5株头状葡萄球菌临床株的16S rRNA基因序列与GenBank序列进行比对,与数据库中登录号为L37599.1的头状葡萄球菌16S rRNA序列一致,证实此5株临床株均为头状葡萄球菌。
2.3 对常用抗菌药物敏感性
5株临床菌均为甲氧西林耐药凝固酶阴性葡萄球菌(MRCNS),对利奈唑胺、头孢唑林、苯唑西林、庆大霉素、左氧氟沙星等抗菌药物耐药,对万古霉素、替考拉宁、替加环素、利福平、甲氧苄啶-磺胺甲唑敏感。MIC测定结果见表2。
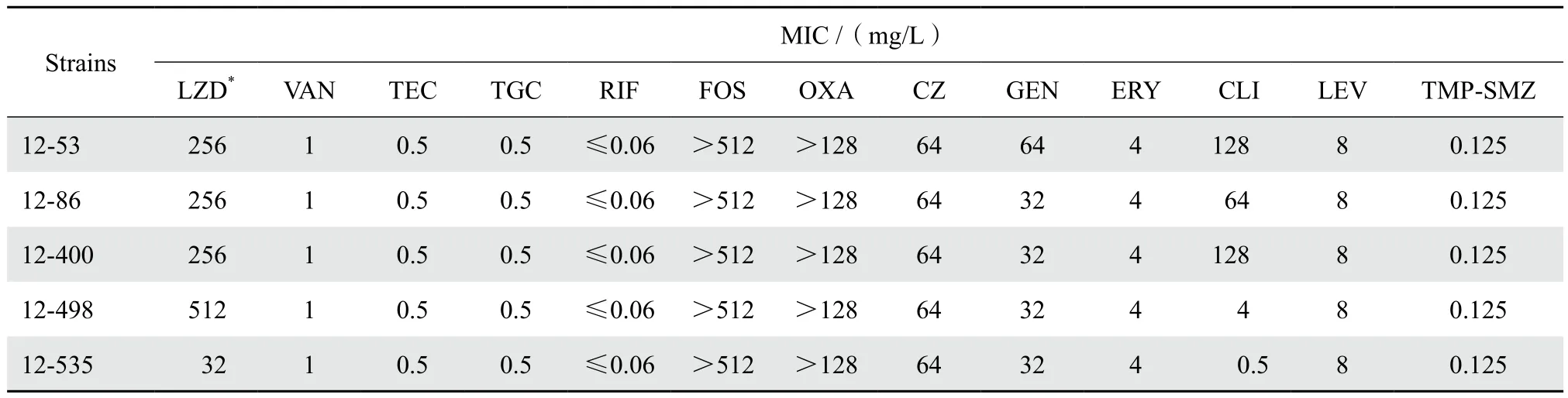
表2 常用抗菌药物对5株头状葡萄球菌临床株的最低抑菌浓度Table 2 Minimum inhibitory concentrations of selected antimicrobial agents against 5 clinical isolates of S. capitis
2.4 耐药相关基因分析
4株临床分离耐药株cfr基因PCR检测阳性,1株阴性(图1)。通过23S rRNA全序列分析发现,5株临床株均存在23S rRNA第V功能区G2576T突变;由于头状葡萄球菌有多个23S rRNA基因在染色体中有多个拷贝,部分位点的测序峰图显示为双峰,提示该株细菌中只有部分23S rRNA基因拷贝的相应位点发生突变(图2)。在其他功能区还有多个突变位点,如C1377G、C1472T、C2104T等。
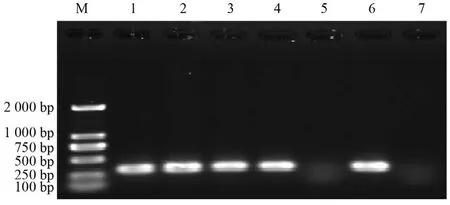
图1 cfr基因PCR扩增产物电泳结果Figure 1 Electrophoresis for PCR product of cfr gene
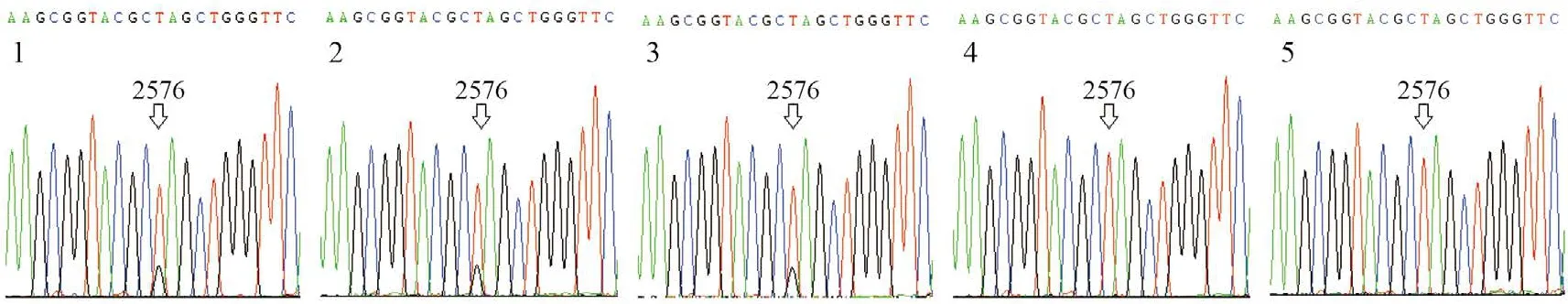
图2 含G2576T突变的23S rRNA的部分序列测序峰图Figure 2 Chromatogram of partial 23S rRNA sequences containing mutation G2576T
2.5 PFGE分析
5株临床株的PFGE谱型完全一致,且与分离自杭州地区的cfr基因阳性头状葡萄球菌对照株也相同。见图3。
3 讨论
利奈唑胺是一种新型化学合成的抗菌药物,对临床上重要的敏感和耐药革兰阳性菌,如MRSA、MRCNS、VRE、耐青霉素肺炎链球菌(PRSP)以及多重耐药结核分枝杆菌均有良好抗菌活性,是目前治疗上述临床耐药革兰阳性菌感染的重要药物。随着利奈唑胺临床应用增加,耐药株的出现不可避免。早在本世纪初,在临床试验过程中已经发现对利奈唑胺耐药的肠球菌菌株,近年我国浙江、江苏等地多所医院出现利奈唑胺耐药头状葡萄球菌感染病例[2-4]。
目前, 细菌对利奈唑胺耐药的较明确机制主要包括靶位突变(如:23S rRNA基因、核糖体L3或L4蛋白编码基因突变)以及cfr基因编码23S rRNA甲基转移酶的产生[1]。23S rRNA是细菌核糖体50S亚基的组成部分,其突变可导致50S亚基的药物作用靶位改变形成耐药,不同菌种的突变位点略有不同,在葡萄球菌属中以G2447U、U2500A、U2504C及G2576U突变常见[6]。细菌另一个耐利奈唑胺机制与细菌获得外源性氯霉素-氟甲砜霉素耐药基因cfr(chloramphenicol- fl orfenicol resistance)有关, 该基因编码一种rRNA 甲基转移酶,最初在分离自德国牛身上的1 株松鼠葡萄球菌质粒中发现, 其质粒可能在葡萄球菌之间转移[7]。该基因的存在可使核糖体大亚基23S rRNA的A2503 位发生甲基化,导致细菌对利奈唑胺和氯霉素耐药。
本研究中3例患者血标本中分离到的5株头状葡萄球菌均发现23S rRNA基因突变,其中4株携带cfr基因。既有23S rRNA基因突变,又携带cfr的3株头状葡萄球菌临床株利奈唑胺MIC≥256 mg/L。通过对这3株临床株23S rRNA基因测序峰图比较发现,12-498号株2576位呈现T碱基单一峰,提示其所有23S rRNA基因均发生突变,该菌株的利奈唑胺MIC为512 mg/L;而12-53号及12-86号株2576位呈现T/G碱基双峰,提示这2株细菌仅有部分23S rRNA基因拷贝发生突变,它们的利奈唑胺MIC为256 mg/L,表明23S rRNA基因耐药突变累积可使利奈唑胺MIC升高,与文献报道相符[1]。此次分离的12-535号株2576位也呈现T碱基单一峰,即所有23S rRNA基因拷贝都发生了突变,但该临床株的利奈唑胺MIC 仅为32 mg/L,与12-498号株不同之处是缺少cfr基因,此现象表明cfr基因在菌株利奈唑胺耐药性形成中具有重要作用。此外,这些耐药株在23S rRNA第V功能区外还有多个突变位点,如C1377G、C1472T、C2104T等,这些突变位点是否与耐药相关有待证实。
本研究中,同一病房3例患者先后分离的5株PFGE谱型完全一致,提示存在此类耐药菌株克隆散发。病史资料显示,3例患者均有留置深静脉导管,且接受多种抗菌药物治疗。2例患者使用利奈唑胺抗感染治疗2周期间,出现头状葡萄球菌耐药株。这些利奈唑胺耐药株对多数药物耐药,仅对万古霉素、利福平等少数抗菌药物敏感。2例患者检出耐利奈唑胺头状葡萄球菌后,应用万古霉素治疗后病情好转,提示这些耐利奈唑胺头状葡萄球菌为血流感染病原。另一例患者分离到头状葡萄球菌后接受除利奈唑胺外多种抗革兰阴性菌药物治疗,病情无好转,但更换深静脉导管后体温下降。按《血管内导管相关感染的预防与治疗指南(2007)》的诊断标准[8],患者1及患者3可诊断头状葡萄球菌所致的导管相关感染,患者2亦符合导管相关感染临床诊断标准。
总之,对有留置深静脉导管的患者,尤其长期使用利奈唑胺者,应加强此类耐药菌的监测。如考虑导管相关感染可能,应分别通过外周静脉及深静脉留置导管采集血标本进行培养,如病情允许可拔除或更换导管,并取导管尖端及皮下段进行培养以尽早明确诊断。此外,鉴于同一病房分离的5株利奈唑胺耐药头状葡萄球菌的PFGE谱型相同,提示存在克隆传播,故应加强消毒、隔离,控制其传播。
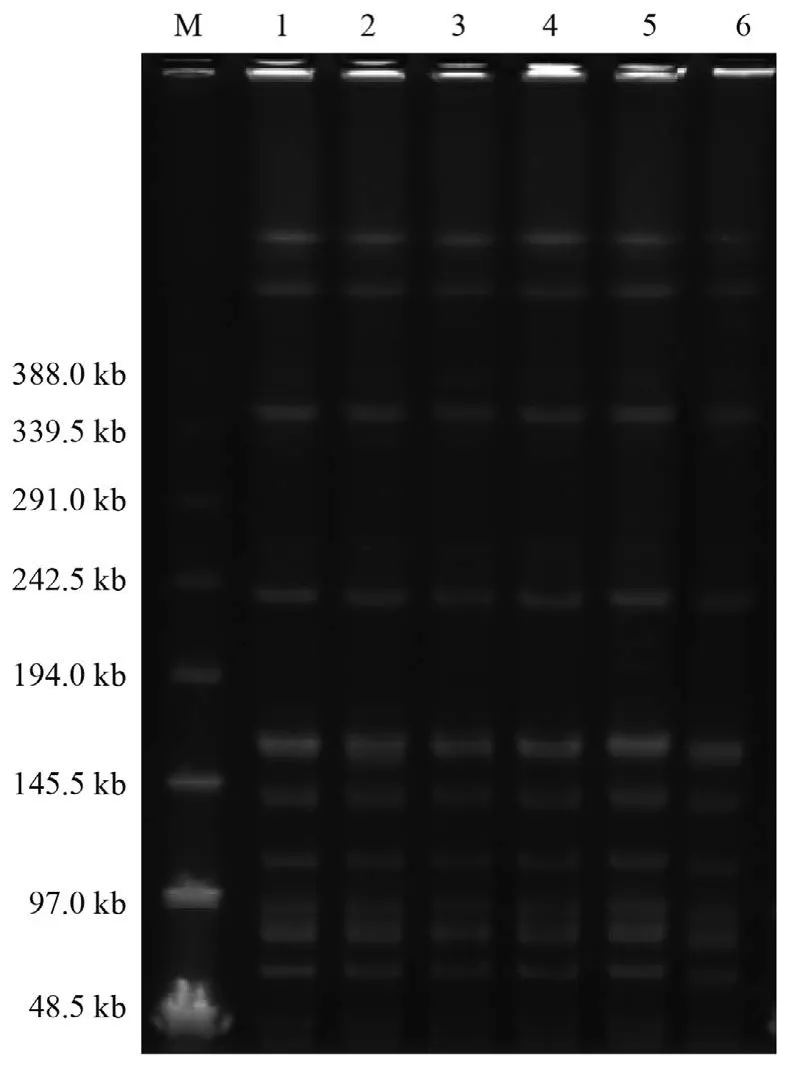
图3 利奈唑胺耐药菌株染色体DNA经SmaI酶切后的PFGE电泳图Figure 3 PFGE prof i les of SmaI-digested chromosomal DNA of linezolid-resistant strains
[1] TEWHEY R, GU B, KELESIDIS T, et al. Mechanisms of linezolid resistance among coagulase-negative staphylococci determined by whole-genome sequencing [J]. MBio, 2014, 5(3):e00894-e00914.
[2] CAI JC, HU YY, ZHANG R, et al. Linezolid-resistant clinical isolates of meticillin-resistant coagulase-negative staphylococci and Enterococcus faecium from China [J]. J Med Microbiol,2012, 61(Pt 11):1568-1573.
[3] YANG XJ, CHEN Y, YANG Q, et al. Emergence of cfrharbouring coagulase-negative staphylococci among patients receiving linezolid therapy in two hospitals in China [J]. J Med Microbiol, 2013, 62(Pt6): 845-850.
[4] HUANG Y, XU Y, LIU G, et al. Emergence of linezolid resistance in a clinical Staphylococcus capitis isolate from Jiangsu Province of China in 2012 [J]. J Thorac Dis, 2014, 6(5): e48-e53.
[5] GEE JE, DE BK, LEVETT PN, et al. Use of 16S rRNA gene sequencing for rapid confirmatory identification of Brucella isolates[J]. J Clin Microbiol, 2004, 42(8):3649-3654.
[6] LONG KS, VESTER B. Resistance to linezolid caused by modif i cations at its binding site on the ribosome [J]. Antimicrob Agents Chemother,2012, 56(2): 603-612.
[7] SCHWARZ S, WERCKENTHIN C, KEHRENBERG C. Identification of a plasmid-borne chloramphenicol-florfenicol resistance gene in Staphylococcus sciuri [J]. Antimicrob Agents Chemother, 2000, 44(9):2530-2533.
[8] 中华医学会重症医学分会. 血管内导管相关感染的预防与治疗指南(2007)[J]. 中华内科杂志, 2008,47(8): 691-699.
Resistance mechanism and clinical feature of linezolid-resistant Staphylococcus capitis isolated from blood samples
YANG Yang, WU Shi, GUO Yan, YE Xinyu, ZHU Demei, LIN Dongfang, XU Xiaogang. (Institute of Antibiotics, Huashan Hospital, Fudan University; Key Laboratory of Clinical Pharmacology of Antibiotics, Ministry of Health, Shanghai 200040, China)
Objective To understand the resistance mechanism and clinical feature of linezolid- resistant S. capitis isolated from blood samples. Methods Antimicrobial susceptibility testing was carried out to determine the susceptibility of clinical strains. PCR and sequencing analysis were used to analyze cfr gene and 23S rRNA mutation, which were associated with linezolid resistance. Patterns of pulsed-f i eld gel electrophoresis (PFGE) were analyzed in combination with clinical data to understand the clinical feature of S. capitis strains. Results Five linezolid-resistant S. capitis strains were isolated from blood samples of 3 patients. These strains were resistant not only to linezolid, but also to most of the commonly used antimicrobial agents except glycopeptides, rifampin, and trimethoprim-sulfamethoxazole. Mutation was identif i ed in 23S rRNA genes of all the f i ve strains and cfr gene was found in four of the f i ve strains. PFGE typing showed the same type, which supported the homology of the 5 strains. Three patients had deep vein indwelling catheter and two of them were treated with linezolid. Conclusions Linezolid-resistant S. capitis isolates showed the phenotype of resistance to multiple antimicrobial agents. Linezolid resistance may be mediated by cfr gene and 23S rRNA mutations in S. capitis. Long-term use of deep vein indwelling catheter and linezolid treatment may increase the risk of linezolid-resistant S. capitis infection.
linezolid; antibiotic resistance; blood culture; Staphylococcus capitis
R378.1
A
1009-7708 ( 2017 ) 04-0382-05
10.16718/j.1009-7708.2017.04.007
2017-01-07
2017-03-16
国家自然科学基金(81573470),复旦大学附属华山医院科研启动基金(2014QD18)。
复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040。
杨洋(1988—) 男,硕士研究生,技师,主要从事抗菌药物药效学及细菌耐药性研究。
林东昉,E-mail:lindongfang@fudan.edu.cn。

