多肽bCAT通过下调白念珠菌HWP1基因表达抑制生物被膜的形成机制
许 珊, 张 舒,张 丹, 刘思佚,刘梳柯
多肽bCAT通过下调白念珠菌HWP1基因表达抑制生物被膜的形成机制
许 珊, 张 舒*,张 丹, 刘思佚,刘梳柯
目的 明确多肽bCAT抑制白念珠菌生物被膜形成能力,并探索其与黏附基因HWP1表达的关系。方法 标准菌株白念珠菌ATCC10231和临床菌株作为研究对象,XTT法检测其生物被膜形成能力,bCAT抗浮游白念珠菌的MIC值以CLSI-M27-A3方法确定,XTT法及菌落计数检测bCAT抑制生物被膜形成作用,并计算代谢活性确定抑制50%生物被膜形成的MIC(BIC50),bCAT减少白念珠菌的黏附作用经倒置显微镜下观察及菌落计数法检测,并采用RT-PCR 通过2-ΔΔCt法计算HWP1的表达量。统计方法为单因素方差分析,组内比较采用Dunnett T3检验。结果 标准菌株及临床菌株均有较强生物被膜形成能力。bCAT抗浮游状态的白念珠菌MIC值为40~80 μmol / L,BIC50为80~160 μmol / L;并且bCAT能减少白念珠菌的黏附作用,空白对照组菌落计数为 (27 822.22±2 472.74) cfu, bCAT浓度为160、80、40、20、10 μmol / L时的菌落个数分别为(5 355.55±1 264.03)cfu、(11 377.78±2 232.58 )cfu、(17 488.89±1 136.27) cfu、(22 377.78±3 521.99)cfu、(26 044.44±1 329.57)cfu。组间差异具有统计学意义(F=147.018,P=0.001),组内比较发现160、80、40 μmol / L处理组与不含bCAT时差异具有统计学意义(P<0.05)。RT-PCR发现160 μmol / L处理组HWP1相对表达量为空白对照组的12.24 %。结论 bCAT能有效抑制白念珠菌生物被膜形成,其机制可能与降低HWP1基因的表达从而减少白念珠菌的黏附有关。具有一定的临床前景。
白念珠菌; 生物被膜形成; 嗜铬粒蛋白A; 抗黏附
白念珠菌(C. albicans)是目前最常见的机会性真菌感染病原体,其高死亡率与高治疗成本与生物被膜的形成有关[1]。白念珠菌生物被膜是由孢子、菌丝及假菌丝组成的三维立体结构[2],是病原体为适应环境变化的另一种生存形式,其生物学行为与浮游状态完全不同,对常用的抗菌药物耐药且能逃避免疫宿主反应[3-4],给临床治疗带来巨大困难,是目前抗感染治疗中亟待解决的重要问题。
抑制白念珠菌生物被膜形成的研究具有重要的临床意义。真菌细胞黏附于生物及非生物物质表面是白念珠菌生物被膜形成的一个关键步骤[5],HWP1是介导此过程的关键基因之一,有研究证实,不表达HWP1的白念珠菌突变株不能在血管导管表面形成生物被膜[6]。
嗜铬粒蛋白A(chromogranin A,CGA)是肾上腺髓质分泌的机体重要应激激素蛋白原,在牛、人等多种属内高度保守,能在体内水解生成一系列抗菌多肽,研究证实牛catestatin(bovinCGA344–364,bCAT)具有抗真菌作用[7],在1.2~8.0 μmol / L的浓度范围内产生抑菌效应[8]。但bCAT在抑制白念珠菌生物被膜形成方面尚无研究。本研究旨在明确bCAT是否具有抑制白念珠菌生物被膜形成作用,并进一步探索其与HWP1基因表达的关系。
1 材料与方法
1.1 菌株
标准菌株为白念珠菌ATCC10231(重庆博培生物技术有限公司)和临床菌株5株(编号分别为1、2、9、17、18,来源于重庆医科大学附属第一医院感染科实验室)。
1.2 实验材料和方法
1.2.1 主要实验材料 YPD(Yeast Extract Peptone Dextrose Medium)液体培养基组成:酵母膏10 g,葡萄糖20 g,蛋白胨20 g,蒸馏水1 L;沙氏琼脂培养基(SDA,Sabourand's agar medium)组成:葡萄糖40 g、酪蛋白胰酶消化物、动物组织的胃酶消化物等量混合10 g 、琼脂15 g加入纯化水1 000 mL,高温灭菌后倒入平皿。bCAT氨基酸序列:RSMRLSFRARGYGFRGPGLQL,由上海科肽生物科技有限公司合成;HWP1、ACT1引物由上海生工生物工程有限公司合成。XTT{c;3,3’-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠}(北京索来宝公司)。甲萘醌(Sigma公司,美国)。
1.2.2 菌种和培养条件 将冻存于-80 ℃白念珠菌接种于SDA平皿,37.0 ℃培养24~48 h,肉眼观察白色菌落形成;挑选单个白色菌落接种于YPD培养基中37.0 ℃、100 r/min培养24 h以保证菌株的纯度与活力。离心(1 000 r/min,10 min)后PBS溶液充分清洗残留的YPD培养基后加入RPMI-1640培养基(Sigma公司,美国),使用血细胞计数板计数后放置于4 ℃备用。
1.2.3 XTT法[9]判断白念珠菌生物被膜形成能力 RPMI-1640培养基将菌液浓度调至106cfu/ mL,96孔板每孔加入100 μL,密闭创造微氧环境后37 ℃生长24 h。PBS冲洗未形成生物被膜的浮游白念珠菌后,每孔加入100 μLXTT(0.5 mg / mL) / 甲萘醌(1 μmoL / L),37 ℃避光作用2 h 后于多功能酶标仪检测490 nm处的D值,每次设置3个实验孔,并在非同一天中重复3次实验。仅含XTT / 甲萘醌的空白对照孔D值(Dc)作为阴性对照判断生物被膜形成能力,判断标准如下[10]:D≤Dc,无生物被膜形成能力;Dc<D≤2Dc,生物被膜形成能力较弱;2Dc<D≤4Dc,生物被膜形成能力中等;D>4Dc,生物被膜形成能力强。1.2.4 bCAT抗浮游状态白念珠菌MIC值 抗浮游状态白念珠菌MIC值的测定依照CLSI M27-A3的方法[11],YPD培养基稀释最终的药物作用浓度为:bCAT 160~2.5 μmol / L。过程概括如下:96孔板每孔加入100 μL由YPD 培养基调至(1~5)×103/ mL 菌液,2倍稀释法依次加入100 μL药物至各孔,100 μL YPD培养基加100 μL菌液作为阳性对照孔菌液终浓度为(0.5~2.5)×103cfu/ mL,YPD 培养基200 μL作为阴性对照孔。37 ℃培养24 h,bCAT对浮游状态白念珠菌MIC 值判读的终点为肉眼与阳性对照孔比较为清澈培养基的最小药物浓度,每次设置3个实验孔,并在非同一天中重复3次实验。
1.2.5 bCAT抑制生物被膜形成实验方法 用XTT法和菌落计数法:RPMI-1640稀释最终的药物作用浓度为160~10 μmoL / L。96孔板各孔加入100 μL浓度为106cfu/ mL白念珠菌悬液,并采用2倍稀释法依次加入100 μL药物至各孔,阳性对照孔中加入100 μL RPMI-1640培养基,37 ℃培养24 h 后PBS清洗2次以除去与孔底黏附不紧密的真菌后判断结果。①XTT法计算代谢活性,方法同1.2.3。计算公式:代谢活性(metabolic activity)(%)=实验孔D490/ 阳性对照孔D490×100 %,当代谢活性小于50 %时定义为抑制生物被膜形成有效,此时的MIC即为抑制50%生物被膜形成的MIC(BIC50)。每次设置3个实验孔并在非同一天中重复3次统计结果。②菌落计数法:将96孔板底部形成的生物被膜充分洗涤后接种于SDA平皿上,放入37 ℃恒温箱中,24~48 h计数(cfu)。
1.2.6 bCAT抗白念珠菌黏附作用 设置药物浓度分别为160~10 μmoL / L。96孔板中加入菌液浓度106cfu/ mL,100 μL和100 μL药物,37 ℃作用4 h后PBS清洗2次,倒置显微镜下观察真菌黏附作用并采用菌落计数[12]。
1.2.7 QRT-PCR方法分析 HWP1的表达采用荧光定量核酸扩增检测系统(Real-time Quantitative PCR Detecting System, QRT-PCR)分析黏附基因HWP1的表达。标准菌株为白念珠菌ATCC10231,bCAT处理组浓度设置为160 μmoL / L,不含bCAT为对照组,按前述抑制生物被膜形成实验方法处理后收集各组菌液。离心收集白念珠菌细胞用于RNA提取[步骤按前述RNA提取试剂盒(美国OMEGA公司)说明进行],反转录[步骤见QRTPCR试剂盒(上海创英生物科技有限公司)]后使用SmartSpec TM Plus(Bio-Rad Laboratories公司)检测ssDNA浓度,加入引物及荧光剂后予以该公司生产的CFX96 Touch仪器检测各组Ct值。每次设置3个重复孔,一共3次。ACT1作为内参。引物碱基序列如下:
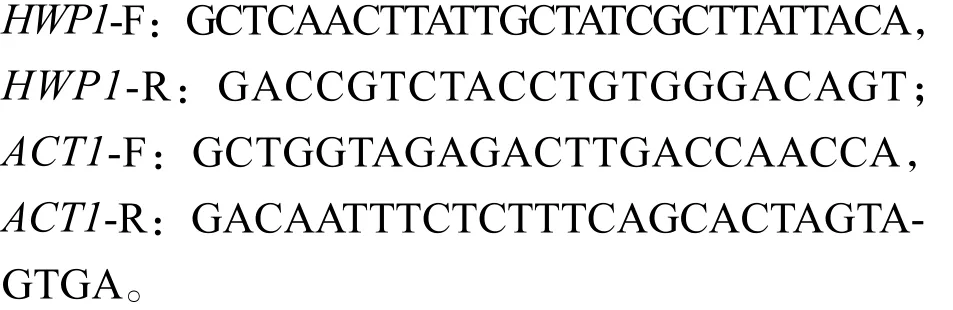
1.3 统计方法
采用SPSS 16.0软件进行统计学分析,所有计量资料采用均数±标准差(x±s)表示,bCAT抑制白念珠菌生物被膜形成作用结果及菌落计数法检测抗白念珠菌黏附作用结果多组间均数比较使用单因素方差分析,其两两比较使用T3检验,QRT-PCR检测bCAT下调白念珠菌HWP1基因表达实验中对照组和处理组结果采用2-ΔΔCt法。P<0.05为差异有统计学意义。结果采用Graphpad prism 5作图。
2 结果
2.1 XTT检测白念珠菌形成生物被膜能力
通过多功能酶标仪检测490 nm处的D值可用于检测生物被膜形成能力。结果显示:不含白念珠菌生物被膜空白对照孔Dc为0.122 6±0.012 8,ATCC10231的D为0.852 7±0.080 1,临床菌株编号1、2、17、18的D为0.738 5±0.110 6、0.783 2± 0.095 1、0.562 7±0.081 9、0.734 4±0.082 2。均显示较强生物被膜形成能力;9号临床菌株的D为0.124 6±0.009 3,无形成生物被膜能力。见图1。选择临床菌株1、2、17、18和标准菌株ATCC10231进行后续实验。
2.2 bCAT抗浮游白念珠菌作用
bCAT是bCGA的水解产物中抗菌作用较强的抗菌多肽。本研究证实其具有抗浮游状态白念珠菌作用,其MIC值为40~80 μmol / L(见表1)。临床菌株与标准菌株结果类似。
2.3 bCAT抑制白念珠菌生物被膜形成
通过XTT法计算不同浓度bCAT下白念珠菌生物被膜的代谢活性判断其抑制生物被膜形成能力。结果发现,bCAT能有效抑制白念珠菌生物被膜的形成,BIC50为40~80 μmol / L(见表1)。以不含bCAT作用时的生物被膜代谢活性为100 %,计算bCAT浓度为160、80、40、20、10 μmol / L时的96孔板中白念珠菌代谢活性分别为(35.66±7.01) %、(33.55±4.82) %、(49.55±15.32) %、(61.57±6.12) %、(76.92±8.05) %(见图2A)。表明bCAT能有效抑制白念珠菌生物被膜的形成。
菌落计数结果发现:不含bCAT处理时的96孔板中菌落个数为(114 422.2±22 998.14)cfu,bCAT浓度为160、80、40、20、10 μmoL / L时的菌落个数为(57 688.89±7 268.97)、(69 813.33± 5 565.60)、(81 106.67±9 804.20)、(103 228.9± 5 084.78)、(109 728.9±8 687.77)cfu(见图2B)。经单因素方差分析,组内差异具有统计学意义(F=35.840,P=0.001),组间比较采用T3检验,发现160、80、40 μmol / L处理组与不含bCAT时差异具有统计学意义(P<0.05)。
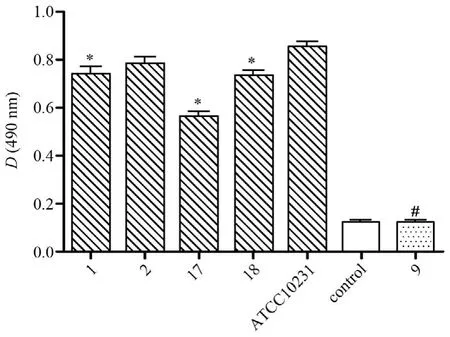
图1 XTT检测白念珠菌标准菌株ATCC10231和5株临床菌株生物被膜形成能力Figure 1 Bio fi lm formation ability of Candida albicans strains assessed by XTT assay, including standard strain ATCC 10231 and clinical strains
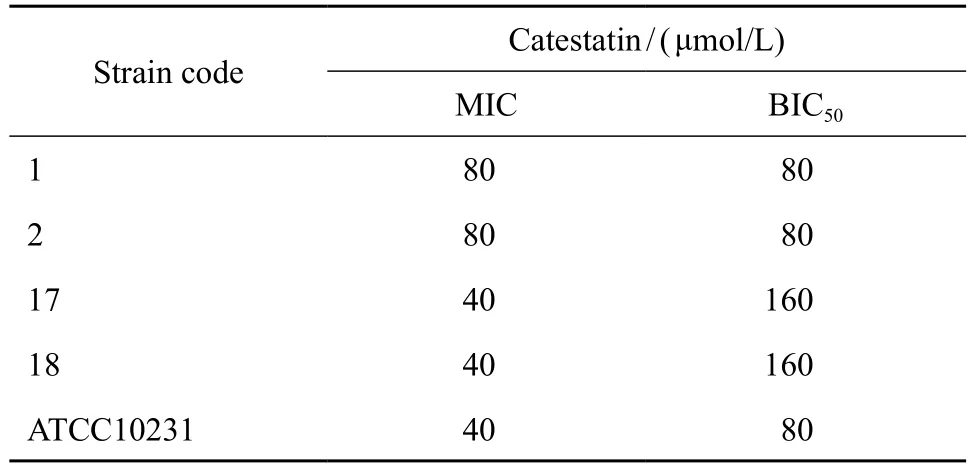
表1 bCAT抗白念珠菌参数Table 1 Minimum inhibitory concentration (MIC) and the lowest concentration showing 50 % inhibition on biof i lmformation (BIC50) of catestatin against C. albicans
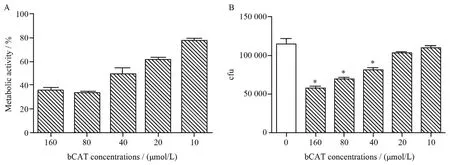
图2 XTT(A)及菌落计数(B)判断bCAT抑制白念珠菌生物被膜形成Figure 2 Effect of catestatin (bCAT) on C. albicans biof i lm formation estimated by XTT assay-based metabolic activity (A) and colony count (B)
2.4 bCAT抑制白念珠菌生物被膜形成的机制
倒置显微镜下初步判断bCAT能有效减少白念珠菌黏附于96孔板,不含bCAT的阳性对照孔可见微小菌落集落形成(见图3Aa),随着bCAT浓度升高,白念菌黏附数量明显减少,bCAT浓度10、20、40、80、160 μmol / L(见图3A b,c,d,e,f)的菌落依次减少,160 μmol / L仅见单个白念珠菌,未见集落形成。菌落计数发现,对照组的菌落数为(27 822.22±2 472.74)cfu,浓度为160、80、40、20、10 μmol / L时的菌落个数为(5 355.55±1 264.03) 、(11 377.78±2 232.58) 、(17 488.89±1 136.27) 、(22 377.78±3 521.99) 、(26 044.44±1 329.57) cfu。经单因素方差分析(AVONA),组内差异具有统计学意义(F=147.018,P<0.001),组间比较采用T3检验,发现160、80、40 μmol / L处理组与不含bCAT时差异具有统计学意义(P<0.05)(见图3B)。
为进一步探索bCAT抑制生物被膜形成的具体分子机制,我们采用RT-PCR检测对HWP1表达的影响,结果采用2-ΔΔCt法分析发现:浓度为160 μmol / L处理后的HWP1的相对表达量为12.24 %,有效减少了HWP1的表达(见图3C)。

图3 bCAT对白念珠菌黏附过程的影响Figure 3 Effect of catestatin (bCAT) on adhesion of C. albicans
3 讨论
生物被膜形成是中心静脉导管及其他植入生物材料应用后发生感染的主要危险因素之一[13]。被膜形成后白念珠菌的致病力增强,对棘白菌素类、三唑类等药物表现出耐药性,造成慢性感染,治疗困难,带来不良临床后果[14-15]。
XTT法是目前公认的研究生物被膜的标准方法[16]。XTT作为线粒体脱氢酶的作用底物,被活细胞还原成水溶性的橙黄色甲臜产物。当XTT与电子偶合剂(甲萘醌)联合应用时,其产生水溶性甲臜产物的吸光度与活细胞的数量成正比,本实验中XTT法证实了白念珠菌临床菌株具有不同的生物被膜形成能力。Rajendran等[17]研究发现,生物被膜形成能力是影响白念珠菌血流感染病死的主要危险因素。本研究还明确了bCAT具有抑制白念珠菌生物被膜形成的作用,其BIC50为80~160 μmoL / L,而游离状态白念珠菌的MIC值为40~80 μmoL / L。进一步验证了白念珠菌生物被膜状态生物学行为与浮游状态的不一致。
生物被膜形成过程包括黏附、小菌落形成、成熟及扩散,因此黏附是生物被膜形成的第一步,由一系列黏附素介导[5]。本研究在倒置显微镜下观察到不含bCAT的空白对照组中4 h时白念珠菌微小菌落聚集形成,而在bCAT处理时明显减少,高浓度(160 μmol / L)时未见微小菌落的聚集。因此初步证实bCAT抑制白念珠菌生物被膜形成与减少黏附相关。统计结果显示bCAT能有效减少白念珠菌黏附于96孔板,浓度大于40 μmol / L时与空白对照组比较差异具有统计学意义。白念珠菌作为一种机会性感染病原体,机体处于正常免疫状体时共生于胃肠道、阴道等部位,免疫状态低下时真菌细胞与宿主细胞相互作用并黏附于宿主细胞,是真菌细胞定植及致病的中心环节[18],也是形成生物被膜的关键步骤。
本研究中RT-PCR证实bCAT处理后HWP1基因mRNA的相对表达量为12.24 %。HWP1是白念珠菌重要的毒力因子之一,在菌丝相中高表达,还能介导生物被膜形成时真菌与细胞外基质以及真菌细胞与细胞间的相互作用[5,19],翻译后的HWP1蛋白是第1个经体外研究发现的介导生物被膜形成的细胞壁蛋白,不仅能介导白念珠菌与细胞外基质的黏附,同时能促进白念珠菌间的聚集,形成微菌落,进一步形成生物被膜。体外研究发现缺乏HWP1的白念珠菌突变株不能在中心静脉导管表现形成生物被膜[6]。Khodavandi等[20]研究证实,抑制白念珠菌生物被膜形成作用与下调HWP1基因的表达相关,且HWP1能介导白念珠菌黏附并入侵胃肠道上皮细胞并形成菌落而致病。HWP1作为介导白念珠菌黏附的关键基因之一,推测bCAT减少白念珠菌的黏附作用与下调该基因有关。本研究也证实了bCAT下调了黏附基因HWP1的表达。
由于生物被膜细胞外基质的屏障作用、持留细胞等机制,有生物被膜时白念珠菌细胞能逃避机体免疫反应,且目前多数抗真菌药物对生物被膜治疗作用不大[21]。因此,许多研究者将目光投向具有较强抗真菌作用的抗菌多肽[22]。bCAT作为抗菌多肽有可能成为新型抗真菌药物应用于临床,例如涂层于植入材料表面以抑制白念珠菌生物被膜的形成。
本研究证实了白念珠菌临床菌株生物被膜形成的不同能力,明确了bCAT能抑制白念珠菌形成生物被膜,其机制可能为下调HWP1的表达从而减少白念珠菌的黏附。这一结果具有一定的临床应用前景,需要在非白念珠菌及体内证实bCAT抑制真菌生物被膜形成的作用。
[1] JIA W, ZHANG H, LI C, et al. The calcineruin inhibitor cyclosporine a synergistically enhances the susceptibility of Candida albicans biofilms to fluconazole by multiple mechanisms[J]. BMC Microbiol, 2016, 16(1): 1-10.
[2] BORGHI E, BORGO F, MORACE G. Fungal biof i lms: update on resistance[J]. Adv Exp Med Biol, 2016,931:37-47.
[3] ZHANG L, KEOGH S, RICKARD CM. Reducing the risk of infection associated with vascular access devices through nanotechnology: a perspective[J]. Int J Nanomedicine, 2013, 8(1): 4453-4466.
[4] AKBARI F, KJELLERUP BV. Elimination of bloodstream infections associated with Candida albicans biofilm in intravascular catheters[J]. Pathogens, 2015, 4(3): 457-469.
[5] TRONCHIN G, PIHET M, LOPES-BEZERRA LM, et al. Adherence mechanisms in human pathogenic fungi[J]. Med Mycol, 2008, 46(8): 749-772.
[6] NOBILE CJ, NETT JE, ANDES DR, et al. Function of Candida albicans adhesin Hwp1 in biof i lm formation[J]. Eukaryot Cell,2006, 5(10): 1604-1610.
[7] 张丹. 嗜铬粒蛋白 A 及其衍生多肽在天然免疫系统中的作用[J]. 医学综述, 2013, 19(6): 967-969.
[8] ASLAM R, ATINDEHOU M, LAVAUX T, et al. Chromogranin A-derived peptides are involved in innate immunity[J]. Curr Med Chem, 2012, 19(24): 4115-4123.
[9] PIERCE CG, UPPULURI P, TUMMALA S, et al. A 96 well microtiter plate-based method for monitoring formation and antifungal susceptibility testing of Candida albicans biof i lms[J]. J Vis Exp, 2010,21 (44): pii2287.
[10] IBRAHIM NH, MELAKE NA, SOMILY AM, et al. The effect of antifungal combination on transcripts of a subset of drugresistance genes in clinical isolates of Candida species induced biof i lms[J]. Saudi Pharm J, 2015, 23(1): 55-66.
[11] Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of Yeasts[S]. CLSI,M27-A3,2008.
[12] OBŁĄK E, PIECUCH A, DWORNICZEK E, et al. The influence of biodegradable gemini surfactants, N, N'-bis (1-decyloxy-1-oxopronan-2-yl)-N, N, N’, N’-tetramethylpropane-1, 3-diammonium dibromide and N,N’-bis (1-dodecyloxy-1-oxopronan-2-yl)-N, N, N’, N’-tetramethylethane-1, 2-diammonium dibromide, on fungal biof i lm and adhesion[J]. J Oleo Sci, 2015,64(5):527-537.
[13] YOUSIF A, JAMAL MA, RAAD I. Biof i lm-based central lineassociated bloodstream infections[J]. Adv Exp Med Biol,2015,830:157-179.
[14] PIERCE C G, SRINIVASAN A, UPPULURI P, et al. Antifungal therapy with an emphasis on biof i lms[J]. Curr Opin Pharmacol, 2013, 13(5): 726-730.
[15] SHERRY L, RAJENDRAN R, LAPPIN D F, et al. Biofilms formed by Candida albicans bloodstream isolates display phenotypic and transcriptional heterogeneity that are associated with resistance and pathogenicity[J]. BMC Microbiol, 2014,14: 182.
[16] RAMAGE G,VANDE WALLE K, WICKES B L, et al. Standardized method for in vitro antifungal susceptibility testing of Candida albicansbiof i lms[J]. Antimicrob Agents Chemother,2001, 45(9): 2475-2479.
[17] RAJENDRAN R, SHERRY L, NILE CJ, et al. Biofilm formation is a risk factor for mortality in patients with Candida albicans bloodstream infection—Scotland, 2012–2013[J]. Clin Microbiol Infect, 2016, 22(1): 87-93.
[18] WILLIAMS DW, JORDANR PC, WEI XQ, et al. Interactions of Candida albicans with host epithelial surfaces[J]. J Oral Microbiol, 2013, 5:10.3402.
[19] FINKEL JS, XU W, HUANG D, et al. Portrait of Candida albicans adherence regulators[J]. PLoS Pathog, 2012, 8(2):e1002525.
[20] KHODAVANDI A, HARMAL N S, ALIZADEH F, et al. Comparison between allicin and fluconazole in Candida albicans biofilm inhibition and in suppression of HWP1 gene expression[J]. Phytomedicine, 2011, 19(1): 56-63.
[21] REICHHARDT C, STEVENS DA, CEGELSKI L. Fungal biofilm composition and opportunities in drug discovery[J]. Future Med Chem, 2016, 8(12): 1455-1468.
[22] DELATTIN N, DE BRUCKER K, DE CREMER K, et al. Antimicrobial peptides as a strategy to combat fungal biof i lms[J]. Curr Top Med Chem, 2016,33(3):176-183.
Effect of catestatin on inhibiting C. albicans biofilm formation by downregulating the expression of HWP1
XU Shan, ZHANG Shu, ZHANG Dan, LIU Siyi, LIU Shuke. (Department of Intensive Care Medicine, the First Aff i liated Hospital of Chongqing Medical University, Chongqing 400013, China)
Objective To investigate whether catestatin (bovine chromogranin A 344-364) can inhibit the biof i lm formation of Candida albicans and examine its relationship with the expression of adhesion gene HWP1. Methods Clinical strains and standard strain ATCC 10231 of C. albicans were studied. XTT [2,3-bis-(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide] method was used to assess the ability of C. albicans biof i lm formation. Antifungal activity against planktonic Candida cells was evaluated in terms of minimum inhibitory concentrations (MICs) according to the description in CLSI-M27-A3. XTT assay and colony count were used to assess the effect of catestatin on inhibiting C. albicans biofilm formation. The lowest concentration showing 50 % inhibition on biof i lm formation (BIC50) was decided by calculating the metabolic activity. The adhesion of C. albicans reduced by catestatin was visualized under an inverted microscope and quantified by colony count. The expression of HWP1 was analyzed by RT-PCR. One-way analysis of variance (ANOVA) and Dunnett’s T3 test were used to compare the results. Results Clinical strains and standard strain ATCC 10231 of C. albicans showed strong ability in forming biofilm. Catestatin exhibited MICs ranging from 40 μmol/L to 80 μmol/L against planktonic C. albicans cells, andBIC50of 80-160 μmol/L in inhibiting C. albicans bio fi lm formation. Catestatin reduced the adhesion of C. albicans. The colonyforming unit (CFU) was 27 822.22±2 472.74 in blank control group, while the CFU was 5 355.55±1 264.03, 11 377.78±2 232.58, 17 488.89±1 136.27, 22 377.78±3 521.99, and 26 044.44±1 329.57 in the presence of 160, 80, 40, 20, and 10 μmol/L catestatin, respectively (F=147.018, P=0.001). The difference between control group and 160, 80, and 40 μmol/L catestatin was statistically signi fi cant (P<0.05). RT-PCR found the expression of HWP1 in the presence of 160 μmol/L catestatin was about 12.24 % of that in blank control group. Conclusions Catestatin can effectively prevent C. albicans bio fi lm formation. This effect may be related to the down-regulated expression of adhesion gene HWP1 by catestatin, which results in reduced adhesion of C. albicans. Promising clinical prospect is expected for this fi nding.
C. albicans; bio fi lm formation; chromogranin A; anti-adherent
R978.5
A
1009-7708 ( 2017 ) 04-0387-06
10.16718/j.1009-7708.2017.04.008
2016-09-18
2017-02-02

