ILC2通过激活STAT6和分泌IL-13调节慢性肾功能衰竭患者的免疫功能*
孙占朋, 李 欣, 杨 焰, 黎 博, 魏红艳, 胡春林, 付清玲, 廖晓星△
(1中山大学附属第一医院急诊科,2广东省人民医院急危重症医学部, 广东 广州 510080;3林芝市人民医院, 西藏 林芝 860000; 4中山大学附属第一医院耳鼻喉科, 广东 广州 510080)
ILC2通过激活STAT6和分泌IL-13调节慢性肾功能衰竭患者的免疫功能*
孙占朋1, 李 欣2,3, 杨 焰1, 黎 博1, 魏红艳1, 胡春林1, 付清玲4, 廖晓星1△
(1中山大学附属第一医院急诊科,2广东省人民医院急危重症医学部, 广东 广州 510080;3林芝市人民医院, 西藏 林芝 860000;4中山大学附属第一医院耳鼻喉科, 广东 广州 510080)
目的: 探讨II型固有淋巴细胞(ILC2)在慢性肾衰发生发展中的作用及其可能机制。方法: 选择中山大学附属第一医院2016年3月~2016年12月入院的慢性肾功能衰竭患者36例,选取同期健康体检者32例为对照。流式细胞术(FCM)检测外周血单个核细胞(PBMC)中ILC2的比例;ELISA技术检测血浆中白细胞介素(IL)-13的浓度;提取慢性肾衰患者及健康对照者PBMC后分别分为3组(对照组、细胞因子刺激组、干预组)进行体外培养3 d后,ELISA法测定上清液中IL-13浓度;Western blot法对健康对照者PBMC在刺激前及刺激后15 min、30 min、1 h、2 h的转录活化因子6(STAT6)的磷酸化水平进行检测。结果: 慢性肾功能衰竭患者PBMC中ILC2比例及血浆IL-13浓度均较健康人高(P<0.05); 体外培养上清液中,慢性肾功能衰竭患者的3个亚组中IL-13浓度均较健康人高(P<0.05),且2类人群中均呈现出细胞因子刺激组较对照组升高,干预组较细胞因子刺激组降低的现象;Western blot结果显示p-STAT6的蛋白水平随时间的延长逐渐增高。结论: 慢性肾衰患者外周血中ILC2的比例升高,同时ILC2内STAT6活化并分泌大量IL-13,介导Th2细胞的极化而调节免疫。
II型固有淋巴细胞; 流式细胞术; 慢性肾功能衰竭; 信号转导及转录活化因子6; 白细胞介素-13
2型固有淋巴细胞(type 2 innate lymphoid cell,ILC2)是近期发现的一类新型的免疫细胞,该类细胞在固有免疫、淋巴组织形成、组织重塑、肿瘤以及代谢稳态中具有重要的作用。ILC2具有典型的淋巴细胞的形态,但缺乏T细胞、B细胞和髓系细胞的标志,且高表达IL-7受体(CD127)。ILC2早期被不同的研究者所发现,分别被命名为NHCs、nuocyte或Ih2[1-4]。此外,有研究表明ILC2高表达MHCⅡ类分子和共刺激分子[5]。ILC2与Th2细胞相类似,广泛存在于肠、肠系膜淋巴结、肺、肺引流淋巴结、气管、皮肤、动物脂肪和血液中。目前已有大量研究表明ILC2能快速分泌Th2型细胞因子如IL-5、IL-13等,并且是其主要的细胞来源。
有文献表明,ILC2在哮喘、变应性鼻炎等疾病患者中含量升高,且ILC2可能通过产生IL-5、IL-13导致疾病进展。体外研究发现IL-25、IL-33可以激活ILC2,导致IL-5、IL-13等细胞因子大量产生[6-7]。慢性肾功能衰竭(chronic renal failure,CRF)在其疾病进程中存在着长期的慢性炎症,但CRF中关于ILC2的比例及功能变化情况尚未明确。为此,我们拟以CRF的患者为研究对象,采用密度梯度离心法提取出其中的单个核细胞(包括淋巴细胞和单核细胞),观测其中ILC2细胞的比例及功能变化情况,并探索可能的干预方式,以期为CRF的诊治提供新的实验依据。
材 料 和 方 法
1 标本获取
本课题获得中山大学附属第一医院医学伦理委员会的同意和批准,以及患者或家属的同意并签订知情同意书。选择2016年3月~2016年12月期间我院收治明确诊断为CRF的患者36例,其中男性20例,女性16例,年龄(54.3±16.3)岁。所有患者的临床和实验室及影像学检查均符合CRF的诊断标准;排除风湿免疫性疾病(如系统性红斑狼疮、类风湿性关节炎等)、肿瘤、支气管哮喘、变应性鼻炎等疾病;患有精神疾患、严重心脑血管疾病、近2月内做过胸腹部手术等患者及有大面积烧伤者亦不列为选择对象。选取同期于我院门诊健康体检者32例作为对照组,其中男性18例,女性14例,平均年龄(52.8±17.4)岁,既往无泌尿系统疾病史,经询问病史、体格检查等均未发现异常。两组性别、年龄构成差异无统计学意义,具有可比性。
2 实验方法
2.1 ILC2的检测 诊断为CRF后取5 mL肝素抗凝管采集全血标本,于3 h内进行外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的分离,采用Ficoll密度梯度离心,获取外周血单个核细胞,细胞总量达1~5×106个。血浆冻存于-80 ℃冰箱备用。分离出的PBMC根据ILC2的表面标记进行染色[染色方案为FITC Lin-(BD)、FITC FceRI-(eBioscience)、PE CRTH2+(BD)、PE-CyTM7 CD127+(eBioscience)],4 ℃孵育30 min,PBS重悬,300×g离心5 min后去上清,再次加入300 μL PBS重悬,转移入流式管内,10色科研用分析型流式细胞仪(Beckman-Gallios)检测ILC2占PBMC的比例(若不能立刻上机检测,需使用4%多聚甲醛固定,但一般于固定12 h内上机),实验重复3次。在淋巴细胞中标记为Lin-(CD2-、CD3-、CD14-、CD16-、CD19-、CD56-、CD235a-)、FceRI-、CRTH2+和CD127+的细胞即为ILC2。
2.2 细胞培养 同时获取健康体检者与CRF患者的PBMC,将其接种于96孔板内,每位患者或健康对照(healthy control,HC)者的PBMC细胞分别分为3组,第1组为对照组,除培养基外不加任何成分;第2组为细胞因子刺激组(cytokine组),加入刺激剂IL-2(50 μg/L)、IL-25(10 μg/L)和IL-33(10 μg/L);第3组为干预组,除加入上述刺激剂外,再加入治疗用甲强龙(methylprednisolone,MP; 10 mg/L)。于含5% CO2的37 ℃恒温培养箱中共培养3 d。
2.3 IL-13测定 严格按照IL-13 ELISA检测试剂盒(Amershan life science)说明书操作。取冻存血浆,室温解冻后,ELISA测定IL-13的含量;收集96孔板内培养3 d后的细胞及培养液后离心,取上清液进行适当倍数的稀释后行ELISA检测。将100 μL样本加入IL-13单抗包被孔中,加入已标记生物素的IL-13多抗,形成双夹心抗原抗体复合物,再加入酶标的生物素抗体,加入酶的底物发生显色反应,酶标仪450 nm处读吸光度值。描绘不同稀释浓度IL-13标准品曲线,计算样品IL-13含量,以上实验重复3次。
2.4 Western blot法检测信号转导及转录活化因子6(signal transducers and activators of transcription 6,STAT6)的磷酸化水平 对健康人PBMC在加刺激剂(IL-2、IL-25、IL-33)前及刺激后15 min、30 min、1 h、 2 h的p-STAT6蛋白水平进行检测。取健康人PBMC细胞,提取全蛋白,用BCA蛋白定量试剂盒对所提蛋白进行定量,并进行蛋白预处理。取50 μg蛋白进行聚丙烯酰胺凝胶电泳, 按湿转法将电泳产物转移到PVDF 膜, 5%的脱脂奶粉封闭2 h, 滴加 I 抗4 ℃过夜,TBST洗膜(5 min、3次), 滴加HRP标记的 II 抗,室温下孵育1 h,TBST 洗膜(5 min、3 次),胶片曝光,显影、定影,并计算蛋白灰度值,实验重复3次。
3 统计学处理
应用Graph Pad Prism 5.0统计软件对所得数据进行统计学处理,计量资料采用均数±标准差(mean±SD)表示,两组间差异采用独立样本t检验方法进行比较;多组比较采用单因素方差分析,用SNK-q检验进行均数间两两比较,以P<0.05为差异有统计学意义。
结 果
1 CRF患者中ILC2比例的变化
在CRF组中ILC2在PBMC中的占比为(0.03±0.02)%。ILC2在PBMC中的比例消除了Lin-细胞和PBMC绝对数量变化带来的影响,最能反应其在炎症反应中的功能活化情况,这一比例在CRF组显著高于健康对照组(P<0.05),见图1。
2 CRF患者血浆中IL-13含量的变化
CRF组患者血浆中IL-13的含量为(2.58±0.73) ng/L,健康对照组血浆中IL-13的含量为(0.84±0.58) ng/L,两组相比差异有统计学意义(P<0.05),见图2。
3 体外细胞因子刺激及激素干预后IL-13含量的变化
CRF患者PBMC体外培养的上清液中,对照组、细胞因子刺激组和干预组的IL-13的含量分别为(12.77±8.01) ng/L、(454.54±339.60) ng/L和(114.57±58.47) ng/L;在健康成年人组,上述3组IL-13的含量分别为(1.26±0.67) ng/L、(66.06±18.24) ng/L和(8.34±1.99) ng/L。CRF患者的细胞因子刺激组IL-13含量较对照组显著升高(P<0.01),干预组IL-13的含量较刺激组有所下降(P<0.01),健康人亚组亦表现出这一规律,差异有统计学意义。CRF患者PBMC体外培养的上清液中对照组、细胞因子刺激组和干预组的IL-13含量均较健康人升高,且两两相比差异有统计学意义,见图3。
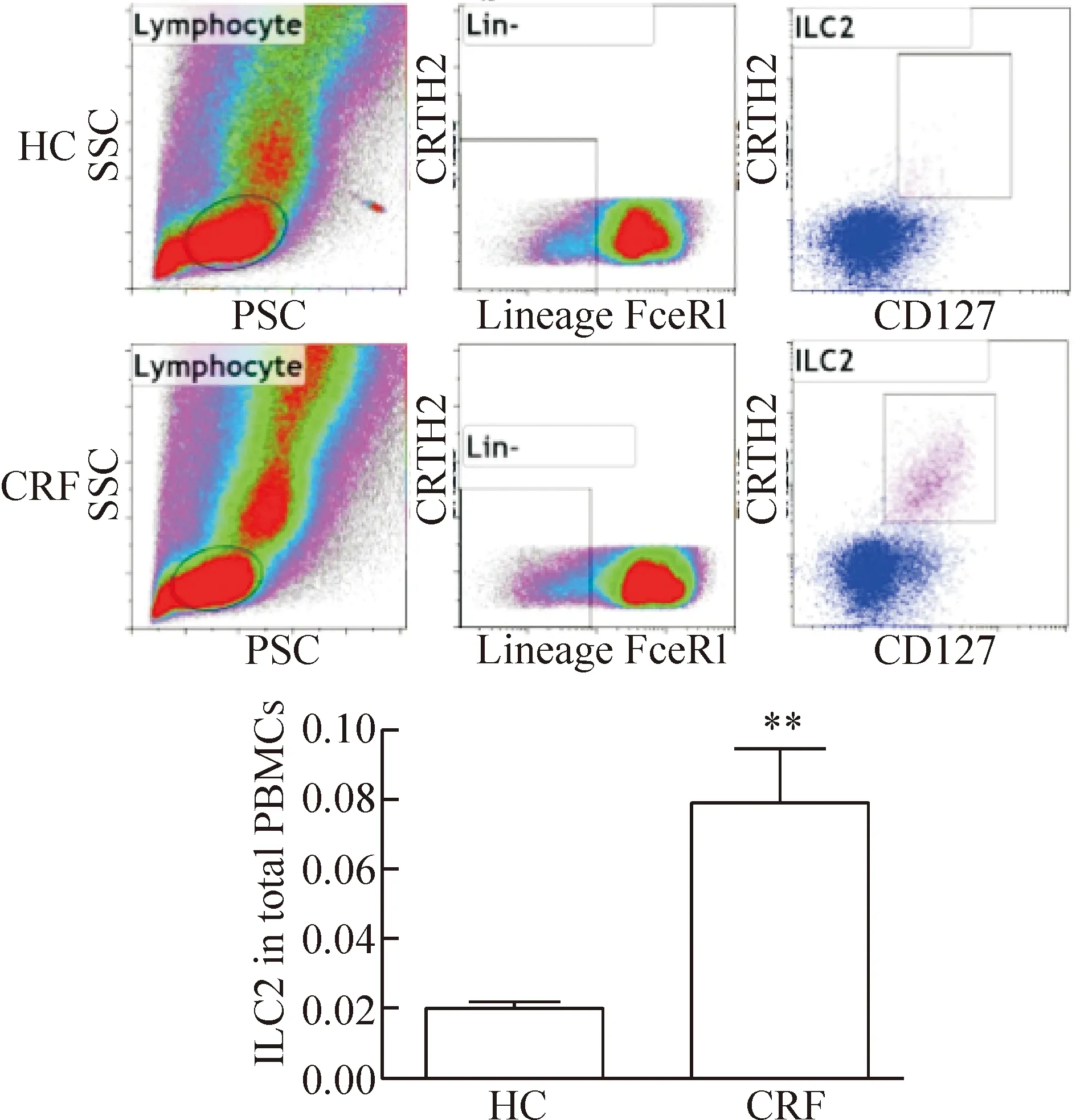
Figure 1.Ratio of ILC2 in total PBMCs. Mean±SD.n=3.**P<0.01vsHC group.
图1 PBMC中ILC2的流式细胞术分析

Figure 2.IL-13 concentration in plasma. Mean±SD.n=3.**P<0.01vsHC group.
图2 CRF患者与健康人血浆中IL-13含量的比较
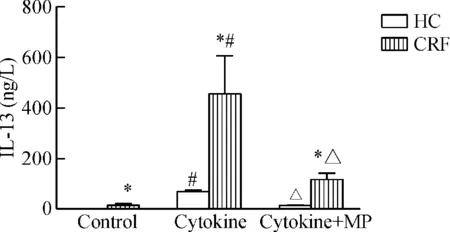
Figure 3.Changes of IL-13 content in, PBMCinvitro. Mean±SD.n=3.*P<0.05vsHC;#P<0.05vscontrol;△P<0.05vscytokine.
图3 CRF患者与健康人PBMC体外培养干预后IL-13含量的变化
4 PBMC中p-STAT6活化情况
Western blot结果显示p-STAT6的蛋白水平随细胞因子刺激时间的延长逐渐增高,见图4。这表明p-STAT6在刺激剂的作用后逐渐激活。
Figure 4.The protein levels of p-STAT6 after stimulation. Mean±SD.n=3.**P<0.01vs0 min group.
图4 健康人PBMC体外刺激后不同时点p-STAT6蛋白水平的比较
讨 论
ILC2起源于骨髓淋巴祖细胞,在转录因子RORα和GATA3的调控下发育成熟,其在发育和形态上属于淋巴细胞谱系,但不表达T细胞或B细胞表面的特异性识别受体TCR或BCR,不表达谱系发育分子Lineage[8]。人ILC2特异性表达IL-7受体α链(CD127)以及Th2细胞的化学诱导趋向性受体CRTH2;在IL-33、IL-25及胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的刺激下可产生大量2型细胞因子[9]。小鼠实验中还发现ILC2可以对抗寄生虫感染,通过分泌大量IL-13使杯状细胞大量分泌黏液、平滑肌收缩以清除寄生虫[7]。
2型细胞因子既可以由Th2细胞产生,也可以由ILC2产生;然而IgE的产生主要还是依赖T细胞分泌的2型细胞因子。ILC2在IgE介导的炎症反应中所起作用较小,充其量为辅助作用。结合临床实践中,很多患者并无IgE升高证据,推测ILC2在Th2免疫反应主导的疾病中是Th2细胞因子的重要来源,且ILC2的作用不依赖T细胞和B细胞。
IL-13是一种重要的Th2细胞因子。现已经明确,IL-13是一种10 kD含有112个氨基酸的蛋白质,3个α螺旋疏水结构构成其核心。其编码基因位于第5条染色体长臂的3区1带(5q31),由4个外显子和3个内含子构成[10]。IL-13对单核巨噬细胞、B淋巴细胞、中性粒细胞和血管内皮细胞等具有多种生物学活性。Minty等[11]报道,IL-13可明显抑制由细菌脂多糖诱导的单核巨噬细胞产生IL-1β、IL-6、IL-8及TNF-α等细胞因子,在急慢性炎症反应中发挥抗炎作用。
人 IL-13 主要由 CD4、CD8 T 细胞产生,部分由肥大细胞、嗜酸性粒细胞分泌。IL-13 通过与细胞表面的IL-13受体结合而发挥生物学效应。已经证实多种免疫性肾小球疾病存在NO产生亢进,IL-13可抑制NO产生及NO合成酶mRNA表达,因此IL-13在肾小球肾炎发病中发挥着重要作用[12]。Lakkis等[13]的实验表明,用抗肾小球基膜抗体诱发大鼠肾小球肾炎后,测得IL-13 mRNA的表达显著增高,提示IL-13在调节肾脏炎症中有重要意义。
慢性肾衰竭是各种原发性或继发性肾脏疾病进行性发展的共同转归。IL-13作为多功能的免疫调节性细胞因子在肾脏病中的表达和作用机制的研究已备受重视。有研究显示CRF患者血浆中IL-13水平较正常对照组增高,且随着肾功能损害程度的加重而增高,至尿毒症时达最高,且与肌酐呈负相关[14-15],从而推测CRF患者血浆IL-13增加,可能作为一种重要的防御机制拮抗肾小球系膜细胞的增殖和炎症介质产生的损害作用。
本实验结果显示,CRF患者PBMC中ILC2的比例明显升高,与健康对照组相比差异显著,且同时血浆中IL-13水平明显高于正常人,推测在CRF患者常有低水平的内毒素血症发生,机体处于炎症状态,受炎症刺激,外周血中PBMC处于激活状态,尤其是ILC2体积增大,功能被激活,炎症因子产生增加,同时IL-13分泌也随之增加,以拮抗炎症介质生物活性,调节机体免疫功能。
体外刺激结果发现,在IL-2、IL-25和IL-33联合刺激下,无论是健康人还是CRF患者,IL-13的水平显著增高,且CRF组较健康对照组升高更为明显,进一步证明IL-13的分泌主要来自于ILC2细胞功能的激活,而非T细胞。再加入激素干预后,健康对照组和CRF组IL-13的分泌量均较不加激素组下降,说明了激素对炎症反应的抑制作用,也为临床上慢性肾炎、慢性肾衰患者的激素治疗提供了新的依据。
STAT是一种新型的转录因子家族,可与靶基因调控区DNA结合,且与酪氨酸磷酸化信号偶联,发挥转录调控作用[16-17]。哺乳动物的STAT家族成员包括STAT1(αβ)、STAT2、STAT3(αβγ)、STAT4、STAT5a、STAT5b、STAT6等共7种[18]。新近研究发现,STAT6在Th2分化中起关键作用,而且是Th2分化的特异性转录因子,可促进Th2细胞增殖和产生IL-4、IL-13等细胞因子,使Th1/Th2比例失衡[19]。
STAT6在胞质内是作为一种潜在的单体形式存在。当IL-13同膜受体(IL-4Rα)结合,酪氨酸系统被激活后进而激活胞浆内STAT6,引起该蛋白Y641位点上的酪氨酸残基磷酸化,激活的SH2区域发生同源或异源二聚化而形成二聚体;二聚体进入细胞核内与特定的DNA位点结合,引起相关基因(如IgE、IL-4R、eotaxin等)的表达。在生理情况下正常细胞STAT6的配体依赖性激活是一个短暂的过程,STAT6 蛋白的异常表达与许多疾病的发生密切相关。STAT6 不仅诱导并确保Th细胞分化为Th2,为细胞表型维持所必需,同时可使已经分化的Th1细胞重新表现出Th2的表型特征。
本实验中正常人PBMC中p-STAT6随时间的延长表达量逐渐增高,表明在刺激剂的作用下,p-STAT6逐渐被IL-13通过一系列反应激活,产生相应的抗炎作用。综上,ILC2可能通过调控STAT6所介导的信号转导系统来调控慢性肾衰患者免疫系统。
[1] Saenz SA, Siracusa MC, Perrigoue JG, et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses[J]. Nature, 2010, 464(7293):1362-1366.
[2] Price AE, Liang HE, Sullivan BM, et al. Systemically dispersed innate IL-13-expressing cells in type 2 immunity[J]. Proc Natl Acad Sci U S A, 2010, 107(25):11489-11494.
[3] Moro K, Yamada T, Tanabe M, et al. Innate production of Th2 cytokines by adipose tissue-associated c-Kit+Sca-1+lymphoid cells[J]. Nature, 2010, 463(7280):540-544.
[4] Neill DR, Wong SH, Bellosi A, et al. Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity[J]. Nature, 2010, 464(7293):1367-1370.
[5] Oliphant CJ, Hwang YY, Walker JA, et al. MHCII-mediated dialog between group 2 innate lymphoid cells and CD4+T cells potentiates type 2 immunity and promotes parasitic helminth expulsion[J] . Immunity, 2014, 41(2):283-295.
[6] Fort MM, Cheung J, Yen D, et al. IL-25 induces IL-4, IL-5, and IL-13 and Th2-associated pathologiesinvivo[J]. Immunity, 2001, 15(6):985-995.
[7] Fallon PG, Ballantyne SJ, Mangan NE, et al. Identification of an interleukin (IL)-25-dependent cell population that provides IL-4, IL-5, and IL-13 at the onset of helminth expulsion [J]. J Exp Med, 2006, 203(4):1105-1116.
[8] Spits H, Artis D, Colonna M, et al. Innate lymphoid cells-a proposal for uniform nomenclature[J]. Nat Rev Immunol, 2013, 13(2):145-149.
[9] Mjösberg JM, Trifari S, Crellin NK, et al. Human IL-25- and IL-33-responsive type 2 innate lymphoid cells are defined by expression of CRTH2 and CD161 [J]. Nat Immunol, 2011, 12(11):1055-1062.
[10]McKenzie AN, Li X, Largaespada DA, et al. Structural comparison and chromosomal localization of the human and mouse IL-13 genes[J]. J Immunol, 1993, 150(12):5436-5444.
[11]Minty A, Chalon P, Derocq JM, et al. Interleukin-13 is a new human lymphokine regulating inflammatory and immune responses[J]. Nature, 1993, 362(6417):248-250.
[12]Saura M, Martínez-Dalmau R, Minty A, et al. Interleukin-13 inhibits inducible nitric oxide synthase expression in human mesangial cells[J]. Biochem J, 1996, 313(Pt 2):641-646.
[13]Lakkis FG, Cruet EN. Cloning of rat interleukin-13 (IL-13) cDNA and analysis of IL-13 gene expression in experimental glomerulonephritis[J]. Biochem Biophys Res Commun, 1993, 197(2):612-618.
[14]刘海燕, 陈孝文, 江黎明, 等.慢性肾衰竭患者白细胞介素13水平及血液透析对其影响[J]. 中国中西医结合肾病杂志, 2003, 4(5):259-261.
[15]张 毅, 刘海燕, 陈孝文. 血液透析对慢性肾衰竭患者血浆白细胞介素13水平的影响[J]. 广东医学院学报, 2003, 21(2):115-117.
[16]廖静秋, 林佳琼, 张伟杰. JAK/STAT信号通路在高糖诱导人脐静脉内皮细胞损伤中的作用[J]. 中国病理生理杂志, 2016, 32(3):392-397.
[17]林佳琼, 陈景福, 廖静秋. 外源性硫化氢通过抑制JAK/STAT通路对抗高糖引起的人脐静脉内皮细胞损伤[J]. 中国病理生理杂志, 2016,32(7):1161- 1166.
[18]Chatterjee-Kishore M, van den Akker F, Stark GR. Association of STATs with relatives and friends[J]. Trends Cell Biol, 2000, 10(3):106-111.
[19]Kaplan MH, Grusby MJ. Regulation of T helper cell differentiation by STAT molecules[J]. J Leukoc Biol, 1998, 64(1):2-5.
(责任编辑: 林白霜, 余小慧)
ILC2 regulates chronic renal failure patients’ immunity by secretion of IL-13 through activating of STAT6
SUN Zhan-peng1, LI Xin2, 3, YANG Yan1, LI Bo1, WEI Hong-yan1, HU Chun-lin1, FU Qing-ling4, LIAO Xiao-xing1
(1DepartmentofEmergencyMedicine,TheFirstAffiliatedHospitalofSunYat-senUniversity,2DepartmentofEmergency&CriticalCareMedicine,GuangdongProvincialPeople’sHospital,Guangzhou510080,China;3ThePeople’sHospitalofLinzhiCity,Linzhi860000,China;4DepartmentofOtorhinolaryngology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:liaowens@163.com)
AIM: To explore the effect and possible mechanism of type 2 innate lymphoid cell (ILC2) on the development of chronic renal failure (CRF). METHODS: The patients with chronic renal failure (n=36) in the Fist Affiliated Hospital of Sun Yat-sen University from March 2016 to December 2016 were selected, and 32 healthy persons in the same period were enrolled in the study for control. The proportion of ILC2 in the PBMC of CRF patients and healthy controls was detected by flow cytometry, IL-13 concentration in the plasma was measured by ELISA. The isolated PBMCs from the patients and healthy persons were divided into 3 groups (control group, cytokine group, intervention group) and culturedinvitrofor 3 days, respespestively, then IL-13 concentration was measured by ELISA. The protein levels of phosphorylated signal transducers and activators of transcription 6 (p-STAT6) in the PBMC of healthy controls before stimulation and after stimulation for 15 min, 30 min, 1 h, 2 h were determined by Western blot. RESULTS: The proportion of ILC2 in the PBMC and the plasma IL-13 concentration of CRF patients was higher than that in the healthy controls (P<0.05). In the culture supernatantinvitro, IL-13 concentration in the 3 subgroups of CRF patients (control group, cytokine group, intervention group) were all higher than that in the healthy controls (P<0.05), both the 2 groups showed a trend that the active IL-13 concentration in cytokine group was higher than that in control group, and that in intervention group was lower than that in cytokine group. The protein levels of p-STAT6 in cytokine stimulated-PBMC with a time dependent manner. CONCLUSION: The percentage of ILC2 in the PBMC is elevated in CRF patients. Furthermore, the ILC2 secret large amount of IL-13 to mediate the polarization of Th2 cells to regulate immunity through activating p-STAT6.
Type 2 innate lymphoid cells; Flow cytometry; Chronic renal failure; Signal transducers and activators of transcription 6; IL-13
1000- 4718(2017)07- 1301- 05
2016- 11- 28
2017- 03- 17
国家自然科学基金资助项目(No. 81671882; No. 81471832; No. 81272062);广东省自然科学基金资助项目(No. 2016A030311039);广东省科技计划(No. 2015A020212012);广东省人民医院人才引进项目
R392.32; R692.5
A
10.3969/j.issn.1000- 4718.2017.07.024
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-87755766; E-mail: liaowens@163.com

