高原湖泊湿地草海沉积物胞外酶与有机碳的时空动态
黎 杨,夏品华,葛 皓,郭光霞(.贵州师范大学生命科学学院,贵州 贵阳 55000;2.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 55000;.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 20008)
高原湖泊湿地草海沉积物胞外酶与有机碳的时空动态
黎 杨1,夏品华2*,葛 皓1,郭光霞3(1.贵州师范大学生命科学学院,贵州 贵阳 550001;2.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;3.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008)
于2015年3、5~12月每月进行一次采样,对贵州草海不同水位梯度湿地沉积物有机碳含量与胞外酶活性及其环境因子进行了研究.结果表明,草海湿地沉积物有机碳碳含量在243.03~37.35g/kg之间,水位降低湿地退化有机碳含量大幅降低,土壤碳库损失;深水区眼子菜湿地多酚氧化酶(PPO)活性较低,水位降低湿地退化过程中多酚氧化酶活性增加,但是水解酶(蔗糖酶、脲酶和磷酸酶)并未沿着水位的降低而增大;沉积物中PPO活性与有机碳含量极显著负相关,与磷酸酶活性显著负相关,与蔗糖酶、尿酶相关性不显著;植物生物量和土壤理化因子(TN、TP、pH值、SMC)能够很好解释酶活性时空动态.水位降低PPO活性升高是草海湿地沉积物碳库损失的重要机制,但水解酶活性并未随着PPO活性升高而增大,这表明我们的结果与“酶锁”机制假说不完全相符.
碳循环;水解酶;多酚氧化酶;酶锁假说;草海湿地
湿地由于碳的产生超过了碳的分解成为一个重要的碳库,湿地碳储量约为455Pg[1-2],占地球陆地碳储量的 15~30%,在全球碳平衡中具有重要的作用.湿地生态系统中土壤碳库的微小变化都可能对大气CO2浓度产生重大影响.过去一直认为湿地碳库积累归因于淹水缺氧[1,3],寡营养、低温和低pH值等[1,4].近年研究表明,湿地中碳是被酚氧化酶锁住[5-7].
酚氧化酶是氧化还原酶中的一类,有单酚氧化酶、二酚氧化酶和多酚氧化酶等多种形式,在植物、真菌中广泛分布[8].Freeman[5]报道了全球泥炭湿地循环的“酶锁”机制假说,即在淹水条件由于氧的限制酚氧化酶活性受到抑制,导致酚类物质积累,酚类物质与水解酶结合抑制其水解功能.北方泥炭湿地、高山湿地和红树林湿地中低的酚氧化酶活性促进了土壤有机碳累积[5-6,9].在积水条件下,酚氧化酶活性较低,抑制水解酶活性,从而促进了有机碳的积累[10-12].但是,最近的一些研究发现,湿地干旱,酚氧化酶活性的增加并未增加水解酶的活性[7,13].云贵高原湖泊湿地中有机碳的累积是否可以运用Freeman“酶锁”机制来解释,湿地退化土壤碳库损失与土壤酶活性之间有何关系尚不清楚.为此,本文通过对比分析不同水位梯度湿地沉积物有机碳、多酚氧化酶和水解酶活性的时空动态,分析了酶活性与有机碳及土壤理化之间的关系,为揭示高原草海土壤碳库损失的酶学机制奠定基础.
1 材料与方法
1.1 研究区概况
草海湿地位于贵州省威宁县西南,是一个典型的、完整的高原湖泊湿地生态系统[14].草海属温带气候,年平均温度 10.5℃,年平均降水量约950mm,平均相对湿度79%.海拔2170~2527m,湖区面积 24.59hm2,水域面积 20.98km2,林地面积8.64km2,灌草面积0.13km2,旱地0.79km2.湖区水深 2.4~5m.草海水体偏碱性(平均值为 8.0),水源补给主要是雨水其次是地下水.干湿季分明,干季为11月~次年4月,湿季为5~10月.根据水文条件及植被组成,可将草海湿地划分为 4种湿地类型,其中深水区为眼子菜(Potamogetonlucens)湿地(YZC),代表沉水植被区;浅水区为水葱(Scirpustabernaemontani)湿地(SC),代表挺水植被区;干湿过渡区为藨草(Scirpustriqueter)湿地(BC),代表沼泽植被区;落干区灯芯草(Juncuseffusus)湿地(DXC),代表湿草甸区.
1.2 样地设置与采集
于2015年3月、5~12月每月采集一次土壤样品.在每个类型湿地随机选取3个 1.0m×1.0m样地,共计12个样方,每个样地采集3个重复土壤样品,现场将3个重复样品混匀成一个复合样品.采样前先去除地表植物,采集土壤深度为0~10cm,采集样品工具为柱状采样器.采集的土壤样品彻底混合后立即放入塑料真空袋密封,并储存在冰盒中直至返回实验室.除去可见的石头,植株和根系残留后,新鲜的土壤样品分为 2个样本,一份保存在 4℃冰箱中;另一份风干后过筛避光密闭保存.
1.3 分析方法
土壤有机碳(SOC)采用重铬酸钾容量法-外加热;土壤溶解性有机碳(DOC)采用去离子水常温下振荡浸提30min,重铬酸钾容量法-外加热法测定;总氮(TN)采用开氏定氮法测定.总磷(TP)采用酸溶-钼锑抗比色法测定;土壤pH采用玻璃电极法;含水率的测定采用的是烘干差重法[15].土壤多酚氧化酶( PPO)活性采用邻苯三酚比色法,以1g土壤在30℃下恒温培养3h释放的紫色没食子素的 mg数表示;土壤蔗糖酶(SC)活性采用3,5-二硝基水杨酸比色法,以1g土壤在37℃下恒温培养24h释放的葡萄糖的mg数表示;土壤脲酶(UE)活性靛酚比色法,以 1g土壤在 37℃恒温下培养24h释放的NH3-N的mg数表示;土壤碱性磷酸酶(AKP)活性采用磷酸苯二钠比色法,以100g土壤在37℃下恒温培养2h释放的P2O5的mg数表示[16].
1.4 数据分析与处理
采用 SPSS23.0进行数据分析,通过Pearson相关系数检验数据相关性,Origin8.5成图.此外采用 RAD 进行排序分析环境变量和酶的关系,RAD计算通过Canoco5软件进行.
2 结果与分析
2.1 数据分析与处理沉积物理化因子的季节性变化
从表1可知,采样期间深水区YZC湿地水深(WL)在 81.7~179.0cm之间,浅水区 SC湿地在24.3~111.7cm之间,干湿过渡区 BC湿地在0.0~ 91.0cm之间,落干区DXC湿地在3~6月处于落干状态;含水量(SMC)YZC>SC>BC>DXC;YZC湿地和SC湿地土壤呈弱酸性,BC和DXC湿地土壤呈碱性;YZC湿地和SC湿地土壤氮磷含量远远高原BC和DXC湿地;植被生物量(PM) BC湿地最高,YZC湿地最低;土壤温度(T)3~8月逐渐升高,9~12月逐渐降低.

表1 不同采样点的环境因子Table 1 Environmental factor of different sampling points
2.2 沉积物中有机碳的季节性变化
草海湿地沉积物有机碳含量沿水位降低呈先降低后升高趋势[图1(a)].深水区YZC湿地有机碳含量最高,在 214.39~272.83g/kg之间,平均值243.03g/kg;干湿过渡区 BC湿地最低,在 24.55~100.85g/kg之间,平均值37.35g/kg;浅水区SC湿地有机碳含量略低于深水区 YZC湿地的,在 95.88~ 148.19g/kg之间,平均值115.84g/kg;落干区DXC湿地有机碳含量略高于干湿过渡区 BC湿地,在27.37~44.47g/kg之间,平均值37.93g/kg.在季节的变化上,YZC、SC和BC湿地有机碳含量均呈波浪式变化,其中YZC和BC湿地10月含量较低,而7月为全年最高;SC湿地,11月达到最大值,7月含量较低;DXC湿地有机碳含量较为稳定,季节变化不大.
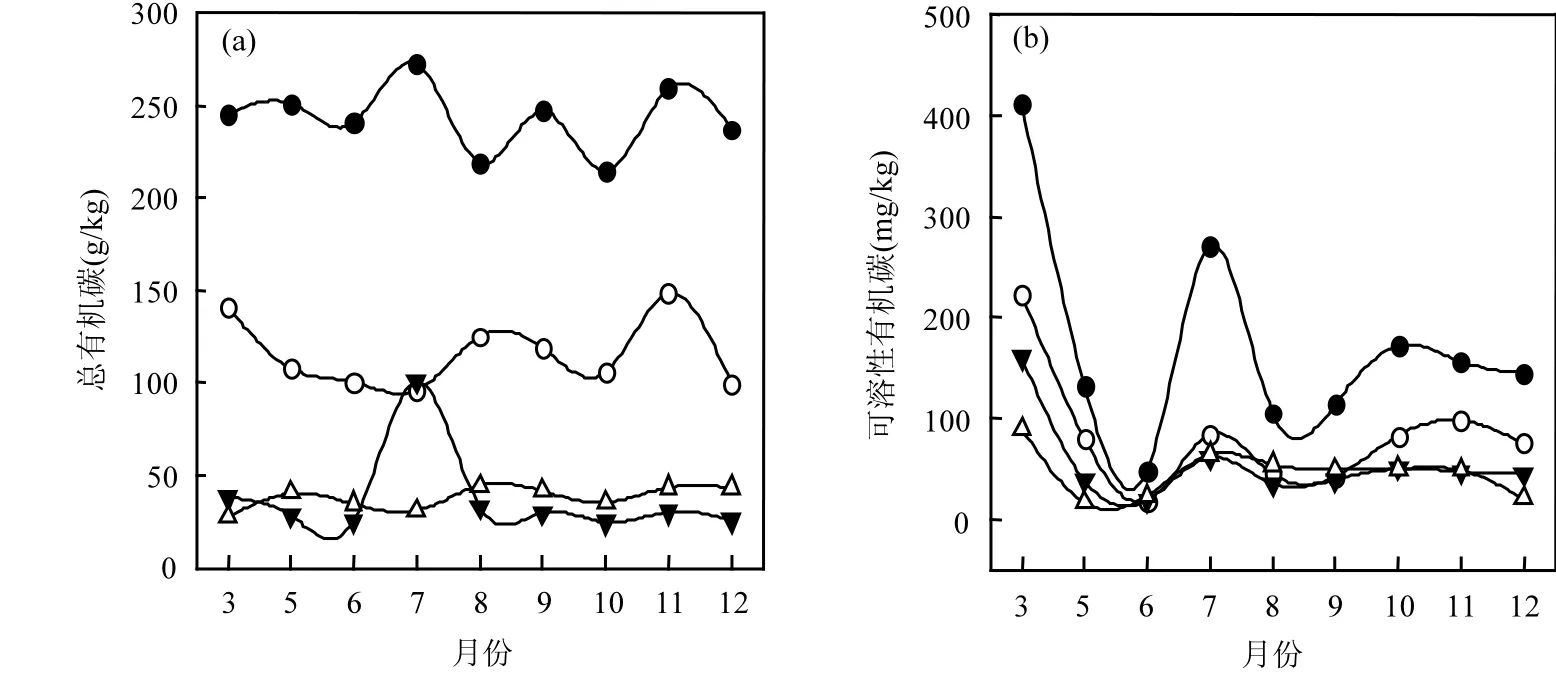
图1 沉积物有机碳和可溶性有机碳变化趋势Fig.1 Variation trend of organic carbon and soluble organic carbon in sediments
草海湿地沉积物可溶性有机碳(DOC)含量沿水位降低而逐渐减少[图1(b)].深水区YZC湿地DOC含量最高,在48.20~411.52mg/kg之间,平均值 172.65mg/kg;落干区 DXC湿地含量最低,在16.09~89.21mg/kg之间,平均值45.95mg/kg;浅水区SC湿地DOC含量不到深水区YZC湿地的1/2,在18.04~223.08mg/kg之间,平均值82.89mg/ kg;干湿过渡区 BC湿地可溶性有机碳含量略高于DXC湿地,在18.85~160.22mg/kg之间,平均值54.80mg/kg.在季节的变化上,4种类型湿地从3~6月逐渐降低,7月出现小高峰后逐渐降低.其中YZC湿地、SC湿地和BC湿地可溶性有机碳含量的最小值在6月,而DXC湿地为5月.
2.3 沉积物中酶活性的季节性变化
PPO能把土壤腐殖质组织中的多酚氧化成醌,在土壤酚转化为腐殖质组分的过程中起着重要作用[17].由图2(a)可知,沿着水位降低PPO活性逐渐升高.深水区 YZC湿地 PPO活性最低,在0.05~0.61mg/g之间,平均值0.20mg/g;落干区DXC湿地最高,在 0.88~1.49mg/g之间,平均值为1.13mg/g.PPO活性的季节变化为 3月要高于 5月,6月为全年最高,6~12月呈降低趋势,但也有一些波动,如DXC湿地9月和12月PPO酶活性明显升高,而YZC湿地在9月降到最低,10月又升高.

图2 土壤酶活性变化趋势Fig.2 Changes of soil enzyme activity
SC活性是土壤微生物活性的指标,它能反应碳代谢强度与规律,是表征碳循环的重要酶[18]. SC活性大小依次为DXC>YZC>SC>BC[图2(b)].落干区 DXC 湿地 SC 活性最高,为 4.63~ 10.58mg/g之间,平均值为 8.26mg/g;干湿过渡区BC湿地最低,在 0.17~1.71mg/g间,平均值为0.83mg/g.在季节的变化上,YZC湿地与DXC湿地呈波浪式变化,但两者的变化趋势刚好相反;BC湿地季节变化不大,而SC湿地在8~11月要明显高于其它月份.
UE是土壤中氮素转化的关键酶[19].由图2(c)可知,UE随湿地退化呈现出先降低后升高趋势.深水区YZC湿地活性最高,在0.24~2.00mg/g之间,平均值为 0.92mg/g,明显高于其它 3种湿地;干湿过渡区BC湿地活性最低,在0.30~0.62mg/g之间,平均值为0.46mg/g,浅水区SC湿地和落干区DXC湿地略高于BC湿地,平均值分别为0.55和0.63mg/g.在季节的变化上,深水区YZC湿地和浅水区SC湿地变化较大,YZC湿地呈波浪式的变化趋势,而SC湿地在3~8月明显低于9~12月;BC湿地和DXC湿地变化较小,从3~7月逐渐升高,8~12月逐渐降低.
AKP是评价土壤磷素生物转化方向和强度的指标,也可以作为早期预警湿地水体富营养化指标之一[20].从图2(d)可知,AKP活性大小依次为YZC>DXC>SC>BC,深水区YZC湿地活性最高,在25.92~68.91mg/100g之间,平均值为42.85mg/ 100g;干湿交替区 BC湿地活性最低,在 8.12~11.73mg/100g之间,平均值为 9.42mg/100g;浅水区SC湿地和落干区DXC湿地较为接近,平均值分别为 16.74和 17.67mg/100g.在季节变化上, YZC湿地从 3~7月逐渐升高,之后呈降低趋势;其它3种湿地有一定波动,但变化不大.
3 讨论
3.1 湿地土壤碳库与多酚氧化酶活性的关系
草海湿地沉积物有机碳含量与三江平原湿地、纳帕海湿地相近[21-22],随着水位的降低湿地退化过程中,沉积物中有机碳大幅降低.但是,退化演替过程中有机碳的输入量并未减少(通过表1植被生物量来看).可见,土壤碳库的减少是由于水位降低分解加速所致.

图3 胞外酶活性与有机碳的关系Fig.3 Relationship between extracellular enzyme activity and organic carbon
土壤碳库的“酶锁”机制认为,湿地淹水缺氧限制了酚氧化酶活性,导致酚类物质积累,抑制了水解酶活性,促进碳储存[5-6,23].本研究中,深水区YZC湿地尽管植被生物量低,碳输入少,但是,其有机碳含量最高,多酚氧化酶活性最低,多酚氧化酶活性与SOC极显著负相关(见图3);沿着水位降低,有机碳含量减少,多酚氧化酶活性增大.可见,草海湿地深水区YZC湿地大量有机碳的累积与其淹水缺氧多酚氧化酶活性较低有关,而水位降低有机碳的减少与复氧能力增加,酚氧化酶活性升高促进有机碳分解.酚氧化酶活性对氧敏感.加氧与不加氧对比实验发现加氧后酚氧化酶活性增加了 7倍[5];酚氧化酶活性和氧的关系在弗洛里达州湿地得到证实,仅有氧条件弗洛里达州湿地酚氧化酶活性才能检出[24].湿地水位降低,土壤复氧,酚氧化酶活增加,促进土壤有机碳转化为CO2向大气排放.
酚氧化酶活性增加将促进酚类物质的降解,从而提高水解酶的活性,进而促进有机碳的分解[5,23].增加酚氧化酶活性在 18h酚类物质减少27%,去除酚类物质显著提高水解酶活性[5].本研究中,水解酶的活性并未随着水位的降低而增加(见图2b、c、d),3种水解酶活性在深水区眼子菜湿地都最高.这与水位降低酚类物质的减少并未提高水解酶活性研究结果相似[13],红树林湿地酚氧化酶活性的增加也没有促进水解酶活性[7].相关性分析表明(见表2),PPO与AKP显著负相关,与 UE和 SC相关性不显著.这与滨海湿地土壤PPO与AKP显著负相关的研究结果相似[25].PPO会影响水解酶,特别是 AKP,因为多酚可以通过络合AKP所需的金属来影响酶活性[26].UE与土壤氮循环相关,且氮饱和的情况下可以降低 PPO的活性,所以当UE活性高时,可能发生氮饱和,故而影响 PPO的活性[27-28].SC活性被认为是与土壤有机碳密切相关的一种酶,有研究结果表明PPO活性受到抑制时会造成土壤中多酚化合物积累,多酚化合物能够抑制不需要氧的 SC活性,进而抑制土壤有机质的降解速率[10].然而,本研究中PPO与SC的相关性并不显著,原因还有待于进一步研究.可见,草海湿地水位降低土壤碳库损失与其PPO活性升高密切相关,但是,PPO活性升高并没有增加水解酶活性,这与土壤碳储存的“酶锁”机制不完全相符.
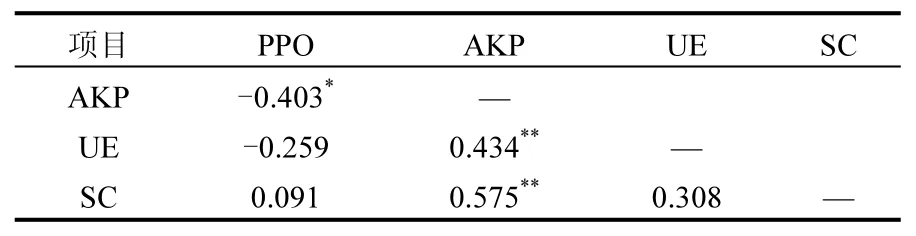
表2 酶活性间相关性分析Table 2 Analysis of the correlation between enzyme activities
3.2 酶活性与环境因子的关系
为了了解水位降低湿地退化过程中环境要素变化如何影响酶活性,本研究中运用冗余分析(RDA)法分析环境变量与酶活性的数据,其结果列于表3.事实上RDA的第一轴是一个复合环境梯度,与第一轴相关性显著的环境因子包括TN、TP、pH、SMC和WL,解释了胞外酶活性变化的46.07%,与第二轴相关显著的是植被生物量,与第二轴相关显著的是 WL;环境因子与第四轴相关性不显著.

表3 沉积物中环境变量和酶的RDA轴之间的相关系数Table 3 Correlation coefficients between environmental variables and RDA axes of enzymes in sedments
水位降低湿地退化过程中,土壤理化因子发生改变,理化因子的变化影响酶活性时空分布.本研究中PPO活性与pH值之间存在极显著正相关关系,这与Sinsabaugh[29]的研究结果一致,香港红树林湿地沉积物中 pH值的变化强烈影响 PPO活性季节变化[9].此外,TN、TP对PPO活性时空分布也具有明显的影响.

图4 草海湿地土壤中4个酶和7个环境变量的RAD双序图Fig.4 RAD dual sequence diagram of 4enzymes and 7environmental variables in Caohai wetland
土壤AKP活性与土壤磷循环密切相关,能将有机磷化合物分解为无机磷化合物,并对微生物提供维持其生物活性的磷素,从而影响土壤 UE和SC酶活性.本研究中土壤AKP与UE、SC呈极显著正相关关系.此外土壤AKP与pH值呈极显著负相关,与土壤TN、SOC以及含水率均呈极显著正相关关系,这一结果与刘存歧等在崇明滩的结果相似[30].土壤 UE与土壤氮素的转化密切相关,UE的水解尿素转化为氨,并向环境释放C、N.本研究中UE活性与TN含量呈极显著正相关关系.C、N、P是大多数微生物主要营养,因此,AKP、UE及SC活性通常与之表现出相同或者相似的趋势,这种变化也可以反应微生物所需的营养物质及生态系统的条件.土壤理化性质可通过不同途径影响土壤微生物的生长发育进而影响酶的分泌[31].
4 结论
4.1 草海湿地沉积物有机碳含量在 243.03~37.35g/kg之间,随着水位降低而减少,湿地退化导致了碳库的损失.
4.2 多酚氧化酶随着水位降低湿地退化而增加,水解酶对水位降低的影响不敏感,植物生物量和土壤理化因子(TN、TP、pH值、SMC)能够很好地解释酶活性的时空动态.
4.3 水位降低PPO活性升高是草海湿地沉积物碳库损失的重要机制.
[1] Gorham E. Northern Peatlands: Role in the Carbon Cycle and Probable Responses to Climatic Warming [J]. Ecological Applications, 1991,1(2):182-195.
[2] Limpens J, Berendse F, Blodau C, et al. Peatlands and the carbon cycle: from local processes to global implications ¨C a synthesis [J]. Biogeosciences, 2008,5(6):1475-1491.
[3] Mclatchey G P, Reddy K R. Regulation of organic matter decomposition and nutrient release in a wetland soil [J]. Journal of Environmental Quality, 1998,27(5):1268-1274.
[4] Laiho R. Decomposition in peatlands: Reconciling seemingly contrasting results on the impacts of lowered water levels [J]. Soil Biology & Biochemistry, 2006,38(8):2011-2024.
[5] Freeman C, Ostle N, Kang H. An enzymic 'latch' on a global carbon store [J]. Nature, 2001,409(6817):149.
[6] Freeman C, Ostle N J, Fenner N, et al. A regulatory role for phenol oxidase during decomposition in peatlands [J]. Soil Biology & Biochemistry, 2004,36(10):1663-1667.
[7] Saraswati S, Dunn C, Mitsch W J, et al. Is peat accumulation in mangrove swamps influenced by the "enzymic latch"mechanism? [J]. Wetlands Ecology & Management, 2016:1-10.
[8] Mayer A M. Polyphenol oxidases in plants and fungi: going places? A review [J]. Cheminform, 2006,67(21):2318-2331.
[9] Luo L, Gu J D. Seasonal variability of extracellular enzymes involved in carbon mineralization in sediment of a subtropical mangrove wetland [J]. Geomicrobiology Journal, 2015,32(1):68-76.
[10] 马瑞萍,安韶山,党廷辉,等.黄土高原不同植物群落土壤团聚体中有机碳和酶活性研究 [J]. 土壤学报, 2014(1):104-113.
[11] 孙兴庭.水热条件变化对泥炭沼泽中酚类物质和酚氧化酶的影响及其意义 [D]. 武汉:中国地质大学, 2011.
[12] 李 娜,汤 洁,张 楠,等.冻融作用对水田土壤有机碳和土壤酶活性的影响 [J]. 环境科学与技术, 2015,38(10):1-6.
[13] Romanowicz K J, Kane E S, Potvin L R, et al. Understanding drivers of peatland extracellular enzyme activity in the PEATcosm experiment: mixed evidence for enzymic latch hypothesis [J]. Plant & Soil, 2015,397(1/2):1-16.
[14] 夏品华,寇永珍,喻理飞,等.喀斯特高原退化湿地草海土壤微生物群落碳源代谢活性研究 [J]. 环境科学学报, 2015,35(8): 2549-2555.
[15] 鲁如坤.土壤农业化学分析方法 [M]. 北京:中国农业科技出版社, 2000:13-289.
[16] 关松荫.土壤酶及其研究法 [M]. 北京:农业出版社, 1986: 274-325.
[17] 熊汉锋,黄世宽,陈治平,等.梁子湖湿地土壤酶初步研究 [J]. 生态环境学报, 2006,15(6):1305-1309.
[18] 鹿士杨,彭晚霞,宋同清,等.喀斯特峰丛洼地不同退耕还林还草模式的土壤微生物特性 [J]. 生态学报, 2012,32(8):2390-2399.
[19] 李传荣,许景伟,宋海燕,等.黄河三角洲滩地不同造林模式的土壤酶活性 [J]. 植物生态学报, 2006,30(5):802-809.
[20] 袁轶君,毕永红,朱孔贤,等.三峡水库沉积物中碱性磷酸酶的活性 [J]. 环境科学与技术, 2014,37(1):60-64.
[21] 赖建东,田 昆,郭雪莲,等.纳帕海湿地土壤有机碳和微生物量碳研究 [J]. 湿地科学, 2014,12(1):49-54.
[22] 殷书柏,杨 青,吕宪国.三江平原典型环型湿地土壤有机碳剖面分布及碳贮量 [J]. 土壤通报, 2006,37(4):659-661.
[23] Fenner N, Freeman C. Drought-induced carbon loss in peatlands [J]. Nature Geoscience, 2011,4(12):895-900.
[24] Calvert G A, Bullmore E T, Brammer M J, et al. Activation of auditory cortex during silent lipreading [J]. Science, 1997, 276(5312):593-596.
[25] Ayuso S V, Guerrero M C, Montes C, et al. Regulation and spatiotemporal patterns of extracellular enzyme activities in a coastal, sandy aquifer system (Do~nana, SW Spain). [J]. Microbial Ecology, 2011,62(1):162-176.
[26] Boavida M J, Wetzel R G. Inhibition of phosphatase activity by dissolved humic substances and hydrolytic reactivation by natural ultraviolet light [J]. Freshwater Biology, 1998,40(2):285-293.
[27] Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale [J]. Ecology Letters, 2008,11(11):1252-1264.
[28] Toberman H, Evans C D, Freeman C, et al. Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathland [J]. Soil Biology & Biochemistry, 2008,40(40):1519-1532.
[29] Sinsabaugh R L. Phenol oxidase, peroxidase and organic matter dynamics of soil [J]. Soil Biology & Biochemistry, 2010,42(3): 391-404.
[30] 刘存歧,陆健健,李贺鹏.长江口潮滩湿地土壤酶活性的陆向变化以及与环境因子的相关性 [J]. 生态学报, 2007,27(9):3663-3669.
[31] 杨文彬,耿玉清,王冬梅.漓江水陆交错带不同植被类型的土壤酶活性 [J]. 生态学报, 2015,35(14):4604-4612.
Temporal and spatial dynamics of enzyme activities and organic carbon in sediments of Caohai wetland of Guizhou Plateau.
LI Yang1, XIA Pin-hua2*, GE Hao1, GUO Guang-xia3 (1.College of Life Science, Guizhou Normal University, Guiyang 550001,China;2.Guizhou Key Laboratory of Mountainous Environment Information System and Eco-Environmental Protection, Guizhou Normal University, Guiyang 550001, China;3.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China). China Envirenmental Science, 2017,37(7):2723~2730
The present study focused on the investigation on the contents of organic carbon and the activities of extracellular enzymes as well as the related environmental factors in the sediments of different water level gradients in Caohai County, Guizhou Provincewere, from March to Decemberin 2015 with an interval of one month. The results showed that the organic carbon content in the sediments of the grassland ranged between 243.03~37.35g/kg. Along with the declining of water level, the wetland was degraded, organic carbon was largely reduced and the soil carbon pool was lost. Polyphenol oxidase (PPO) exhibited a low activity in the Yanzicai wetland of profundal zone, and this enzyme activity increased with the decline of water level. However, the activities of hydrolases, such as invertase, urease and phosphatase, were not elevated, which is not totally consistant with the "enzyme lock" mechanism hypothesis. Moreover, a strongly negative correlation was observed between the PPO activity and organic carbon content in sediments, and a certain negative correlation between PPO activity and phosphatase activity. No significant correlation existed between PPO activity and invertase or urease. The temporal and spatial dynamics of enzyme activity could be well explained by phytomass and soil physio-chemical indicators (TN, TP, pH, SMC). Based on the above results, it is suggested that the increase of PPO activity caused by the water level declining could be an important mechanism underlying carbon pool loss in sediments of grassland wetland.
carbon cycle;hydrolases;polyphenol oxidase;enzyme lock hypothesis;Caohai wetland
X524
A
1000-6923(2017)07-2723-08
黎 杨(1989-),女,辽宁抚顺人,贵州师范大学硕士研究生,主要从事退化湿地生态恢复研究.
2016-11-07
贵州省科技合作计划资助项目(20167200);贵州师范大学2017年博士科研启动项目;贵州省重大科技专项课题(20163022-2);国家自然科学基金资助项目(41401287);湖泊与环境国家重点实验室开放基金资助项目(2014SKL010)
∗ 责任作者, 副研究员, pinhuaxia@gznu.edu.cn

