氧化石墨烯对双壳类动物文蛤的亚致死毒性研究
段伟艳,杜永祥,孟范平,林怡辰,周 琦 (中国海洋大学,海洋环境与生态教育部重点实验室,山东 青岛266100)
氧化石墨烯对双壳类动物文蛤的亚致死毒性研究
段伟艳,杜永祥,孟范平*,林怡辰,周 琦 (中国海洋大学,海洋环境与生态教育部重点实验室,山东 青岛266100)
为全面评价纳米材料对海洋生物的毒性效应,将文蛤暴露于含氧化石墨烯(GO,5mg/L)的人工海水,测定其内脏中的还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、丙二醛(MDA)、乙酰胆碱酯酶(AChE)、金属硫蛋白(MTs)以及血细胞的微核率(MNF)和溶酶体膜稳定性(LMS)等7种生物标志物的变化,分析GO对双壳类的亚致死毒性机制.结果表明,GO能够诱导文蛤内脏的氧化逆境,表现为GSH含量降低、GSSG含量增加和MDA含量增加;GO产生的神经毒性较小,AChE活性仅在暴露初期与结束时短暂受抑;GO对MTs无诱导作用;GO暴露4d后即产生显著的遗传毒性和溶酶体膜失稳,MNF达到对照组的6.1~9.0倍,中性红保留时间(NRRT)降幅达到24.2%~49.2%.除AChE、MTs外,其它生化指标均适于作为指示GO亚致死毒性的敏感生物标志物.
氧化石墨烯(GO);双壳类;氧化逆境;微核率(MNF);溶酶体膜稳定性(LMS)
纳米材料因其具有独特的电学、催化和化学性质而被大量应用于商品和工业生产中[1].这不可避免造成其随着废水排入外部环境并最终进入海洋中.海洋双壳类属于滤食性动物,可通过内吞作用和吞噬作用内化纳米粒子[2].因而成为纳米材料毒理学研究的独特目标群体.同时,双壳类的某些生理生化指标能够对无机、有机污染物产生灵敏响应,常被用作污染暴露和毒性效应的早期预警[3-8].双壳类动物的健康直接关系到区域性水产品的产量,对人类社会的食品质量和食品结构有很大影响.因此,研究纳米材料对海洋双壳类的毒性效应十分必要.
氧化石墨烯(GO)是一种具有极高抗菌活性的新型二维碳纳米材料,由氧化石墨经超声或热剥离得到,其片层上分布有羟基、环氧官能团、羰基、羧基等含氧官能团[9].毒理学研究证明,GO可以对生物造成明显的不利影响.GO对斑马鱼(Danio rerio)具有中等生物毒性和一定的潜在环境风险,浓度为 50mg/L时轻微延迟胚胎脱壳,但不会导致胚胎明显凋亡[10].GO对原生动物小眼虫(Euglena gracilis)的96h半效应浓度(96h EC50)为(3.76±0.74)mg/L;2.5mg/L的GO即对小眼虫产生明显不利影响,其毒性来自遮光效应和氧化逆境[11].GO对人类肝癌细胞株HepG2毒性实验表明[12],GO(<20mg/L)不会降低细胞存活率、产生活性氧(ROS),或破坏线粒体功能,但低水平(0.05mg/L)GO可显著降低细胞对其他外源性物质的耐受性.
目前有关氧化石墨烯(GO)对海洋双壳类毒理学效应的研究报道很少.生态毒理学的研究认为,外源性污染物能诱导机体产生大量 ROS,攻击细胞内的DNA、蛋白质等生物大分子并引起生物膜发生脂质过氧化反应,而生物体可通过还原型谷胱甘肽(GSH)等非酶类抗氧化物质消除污染逆境产生的 ROS,以维持细胞稳态,期间, GSH自身被氧化为氧化型谷胱甘肽(GSSG)[13],而丙二醛(MDA)则是脂质过氧化的主要产物[14].因此,细胞中GSH、GSSG、MDA含量的变化常用于指示污染胁迫下的氧化逆境程度.ROS能引起DNA双链断裂,进而造成微核数量增加[15],微核率(MNF)可在染色体水平上表征污染暴露下的遗传毒性[16].污染胁迫还会导致细胞免疫中具有重要作用的溶酶体发生肿胀、破裂,释放其中的水解酶到细胞质中从而损伤细胞.因此,溶酶体膜稳定性(LMS)可从细胞水平上反映环境胁迫造成的功能性受损程度[17].另外,在GO分散液中存在一定浓度的 Mn2+[18],而金属离子既能诱导双壳类动物的金属硫蛋白(MTs)合成还能影响乙酰胆碱酯酶(AChE)的活性,从而表现出一定的金属毒性和神经毒性[13,19].据此,本研究以中国沿海分布广泛的双壳类动物文蛤(Meretrix meretrix)为研究对象,通过测定其暴露于含GO的海水后,内脏中的GSH、GSSG、MDA、AChE、MTs以及血细胞的MNF和LMS等7种生物标志物的变化,分析GO对双壳类的亚致死毒性机制,以期评价纳米材料对海洋生物的毒性效应,为利用生物标志物进行海域水质监测提供科学依据.
1 材料与方法
1.1 材料
人工海水:将一定量的海水晶(山东潍坊市海佳海水晶厂)溶于蒸馏水配制而成(盐度(25±0.1),pH (7.9±0.1)).
GO分散液(棕色):购自中国厦门凯纳石墨烯技术有限公司,采用改进的Hummer法制备,浓度3000mg/L,介质为超纯水,pH值为5~7.使用前,将其分别用超纯水和人工海水稀释成浓度为5mg/L的工作液,超声振荡(45kHz,30min)使纳米材料分散均匀.
文蛤:平均壳长为(3.9±0.3)cm,购自青岛市崂山湾大管岛海域养殖区,在温度(15±1)°C条件下以人工海水驯养7d.期间每天更换新配制的人工海水,定时投加密度为 1.3×107cells/(L⋅d)的海水小球藻(Chlorella pacifica)作为文蛤的饵料,同时利用空气泵持续充氧,使溶解氧(DO)保持在(6± 0.5)mg/L.
试剂:测定蛋白质和 MDA的试剂盒购自南京建成生物工程研究所.Giemsa染色液、1-氯-2,4-二硝基苯(CDNB)、谷胱甘肽(GSH)、5,5-二硫代-双(2-硝基苯甲酸)(DTNB)、苯甲基磺酰氟(PMSF)、多聚赖氨酸(MW 150000-300000)、碘化硫代乙酰胆碱(ATChI)为 Sigma公司产品;邻 苯 二 甲 醛 (OPT)、 NaH2PO4·2H2O、Na2HPO4·12H2O、EDTA-2Na、β-巯基乙醇、三羟甲基胺基甲烷(Tris碱)等均为国产分析纯;中性红染料为国产生化试剂.
1.2 方法
1.2.1 GO性质的表征方法 将GO工作液(超纯水介质)旋涂(旋速2680g,时间30s)于云母基板上,45℃下自然风干3h,置于Agilent 5400型原子力显微镜(AFM,美国安捷伦科技)下,采用轻敲模式观察,利用PicoViewer软件分析GO的直径及厚度.将 GO分散液(超纯水介质)加入干净比色皿中,置于Nano S90型激光粒度分析仪(英国马尔文公司)固定槽内,测量GO的粒径分布.将GO分散液(超纯水和人工海水介质)滴加在覆盖碳膜的铜网上,自然干燥后在 JEM-1200型透射电镜(TEM,日本电子株式会社)下观察 GO的形态.GO工作液(超纯水和人工海水介质)的Zeta电位采用JS94J2型Zeta电位仪(上海中晨数字技术设备有限公司)测定.
1.2.2 暴露培养方法 采用GO浓度为5mg/L的人工海水进行文蛤的亚致死暴露培养.选择该浓度的依据为:预实验发现,在 GO 浓度为1~100mg/L的人工海水中暴露96h期间,文蛤死亡率均低于50%,且只在GO浓度大于5mg/L时观察到个体开始死亡,并且死亡率随 GO浓度的增大而升高.由于死亡个体所释放的黏液易引起细菌滋生,会干扰亚致死毒性实验的结果.
GO处理组设3个平行,即:在3个玻璃缸中,分别加入含 GO(5mg/L)的人工海水 5L,各投放经驯养的文蛤40只.另设一组(3只)玻璃缸,各加入5L人工海水(不含GO)和40只文蛤,作为对照组.在水温(15±1)℃、盐度(25±0.1)、DO(6± 0.5)mg/L和 pH值为(7.9±0.1)的条件下,于黑暗处连续培养16d[20-21].每天更换含GO的人工海水(对照组不含 GO),定时投加密度为 1.3× 107cells/(L·d)的海水小球藻.培养期间未观察到个体死亡.暴露开始时和暴露 1、2、4、8、16d后,分别从每个玻璃缸中随机取出 6只文蛤,其中2只抽取闭壳肌血窦处的血淋巴液,分别用于血细胞MNF和LMS测定;另外4只个体立即在冰上解剖,将分离出的内脏切细混匀,于-80℃保存,用于生化指标分析.
1.2.3 生物标志物分析方法 (1)氧化应激标志物、AChE和蛋白质测定 称取适量解冻后的文蛤内脏样品混合样,按照质量体积比 1:4与Tris-HCl缓冲溶液(pH7.8, 20mmol/L)混匀,匀浆后离心(13000g,4℃,15min)得到上清液(避免取出其表层的脂肪层),用于测定GSH、GSSG、MDA含量以及AChE活性和蛋白质浓度.
GSH和 GSSG测定:采用分光光度法[22]测定.GSH存在时,OPT与氨基酸、肽等反应生成荧光化合物,在激发波长350nm,发射波长430nm下,可用分子荧光光度计定量测定.GSSG测定原理与其相似,但需加入一定量的 N-乙基顺丁烯二酰亚胺(NEM),以避免GSH与OPT反应造成干扰.根据荧光强度值计算GSH、GSSG含量,单位为µmol/g prot.
MDA测定[23]:MDA等脂质过氧化产物可与硫代巴比妥酸(TBA)缩合,形成红色产物,根据532nm波长处吸光度对MDA进行定量,单位为nmol/mg prot.
AChE测定:参照 Ellman等[24]的方法测定.测定原理:在AChE作用下,ATChI的分解产物与DTNB反应生成 5-巯基-2-硝基苯甲酸,于412nm 波长处进行比色测定,酶活力表示为μmol/(min·g prot).
蛋白质测定:蛋白质含量用于上述生物标志物含量/活性计算.采用考马斯亮蓝法[25]测定,单位为g/L.
(2)MTs测定 将内脏组织按质量体积比1:4加入 pH 7.8的缓冲液(含 0.5mol/L 蔗糖, 0.02mol/L Tris-HCl,0.5mmol/L PMSF,0.01% β-巯基乙醇)中,于4℃下25000g离心30min后,上清液中MTs含量参照Viarengo等[26]的紫外分光光度法测定.根据MTs分子中-SH与DTNB反应生成的黄色物质在波长412nm具有最大吸收,进行MTs定量,单位为µmol-SH/g ww(组织湿重).
(3)MNF测定 参照Baršienė等[16]的Giemsa染色法.对于每只文蛤,吸取100μL血淋巴涂布于多聚赖氨酸处理过的载玻片,室温培养 30min.甲醇固定5min后,滴加10% Giemsa染液室温染色15min,中性树胶和盖玻片封存后,在 100×油镜下观察计数(1000cells/个体),根据镜检发现的微核数量计算MNF(‰).
(4)LMS测定 采用Lowe等[17]的中性红保留时间(NRRT)法.每只文蛤抽取40μL血淋巴液,涂布在多聚赖氨酸处理过的载玻片上,于潮湿箱中固定 3min.滴加 40μL中性红使用液(0.01%),放置15min后进行镜检.视野中约30%的细胞变红之前,每隔15min镜检一次.之后改为每隔5min观察一次,以细胞变红数量达到50%的时间(min)作为 NRRT.如果在两个相邻时刻中间观测到50%细胞变红,则采用内插法计算NRRT并取整. 1.2.4 数据统计与处理 处理组、对照组中每种生物标志物的测定结果均表示为3个玻璃缸的文蛤相应指标测定值的(平均值±标准差);MNF和LMS结果以3只文蛤(来自3个平行)测定值的(平均值±标准差)表示.采用SPSS 18.0软件进行单因素方差分析,检验每种生化因子在一定暴露时间下与对照组的差异显著性(P<0.05, P<0.01).同时,采用双变量Pearson相关性分析,研究生化因子之间的关系,统计显著性水平为P<0.05.
2 结果
2.1 纳米材料的特性
由粒度分布图(图 1)和 AFM图(图 2)可见,超纯水中,GO 为二维片层结构,长度 171.0~412.5nm(平均291.3nm),厚度为1.25nm.根据图3,超纯水中,GO表面为大量褶皱起伏的片层结构,相对较薄且透明;但是,人工海水中的GO颜色加深,呈深棕色,表明其在海水中发生一定程度的团聚.此外,Zeta电位测定结果表明,GO在海水中的Zeta电位绝对值(17.18mV)低于其在超纯水中的Zeta电位(47.05mV).
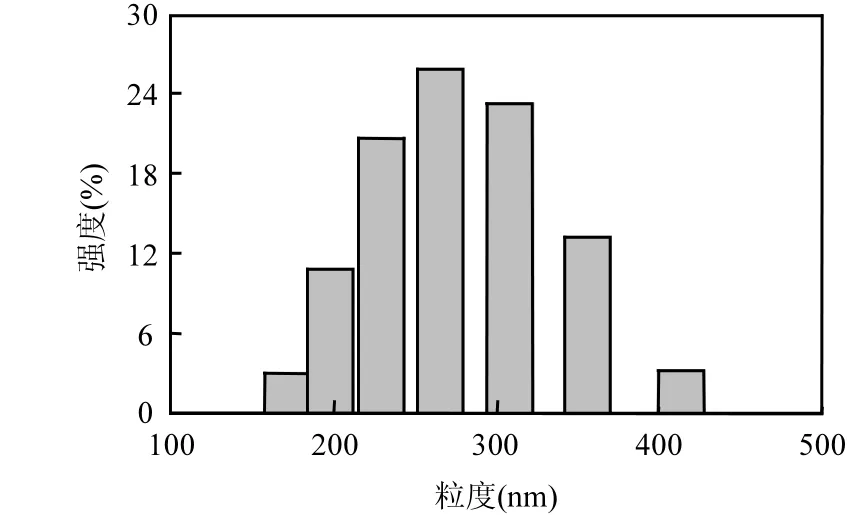
图1 GO的粒径分布Fig.1 The particle size distribution for GO

图2 GO的AFM图Fig.2 AFM image of GO
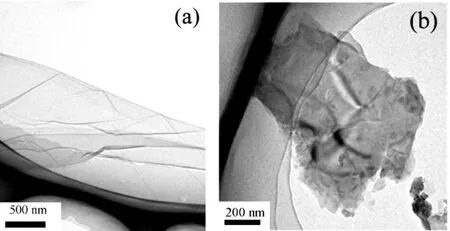
图3 超纯水(a)和人工海水(b)中GO的TEM图Fig.3 The TEM images of GO in Mili-Q water (a) and artificial seawater (b)
2.2 文蛤内脏的GSH和GSSG水平
图4显示了GO暴露下文蛤内脏中GSH、GSSG含量随时间的变化.培养16d期间,对照组中两种生物标志物的含量变化范围分别为1.54~1.58和 0.65~0.67µmol/g prot,波动幅度不大.GO暴露下,内脏 GSH含量始终低于对照组(P<0.05),降幅最大值为58.77%,出现在暴露1d后.随后GSH含量有所回升,但始终显著低于同期的对照组水平(P<0.05).伴随着GSH含量的降低,内脏GSSG主要表现为含量上升,且在大多数暴露时间内(除暴露 4d外)显著高于对照组(P<0.05),最高值(0.88µmol/g prot)出现在暴露1d后.

图4 GO暴露下文蛤内脏GSH、GSSG的含量变化Fig.4 Variation of GSH and GSSG in the viscera of M. meretrix exposed to GO as a function of time
2.3 文蛤内脏的脂质过氧化程度
培养16d期间,对照组的文蛤内脏MDA含量变化范围为 2.41~2.57µmol/g prot,波动幅度不大(图5).暴露于GO后,内脏MDA含量显著高于对照组(P<0.05),以暴露 2d后的增幅最大(23.79%).
2.4 文蛤内脏的AChE活性和MTs含量
根据图6,GO仅在暴露初期(第1d)和暴露末期(第16d)对AChE活性产生抑制,抑制率分别为34.41%(P<0.01)和 8.88%(P<0.05).而在暴露 4d后,AChE活性受到刺激(P<0.05),其最大值为2.59μmol/(min·g prot),比对照组上升19.91%.GO暴露期间,未见到内脏 MTs含量的显著变化(P>0.05).
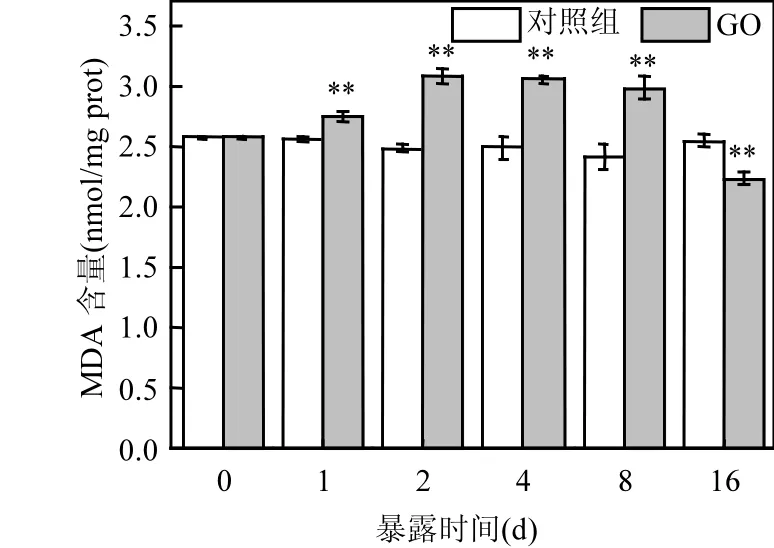
图5 GO暴露下文蛤内脏MDA含量变化Fig.5 Variation of MDA in the viscera of M. meretrix exposed to GO as a function of time

图6 GO暴露下文蛤内脏AChE活性(a)和MTs含量(b)随暴露时间的变化Fig.6 Variation of AchE and MTs in the viscera of M. meretrix exposed to GO as a function of time
2.5 文蛤血细胞的微核率和溶酶体膜稳定性
根据图 7(a),培养期间对照组文蛤的血细胞MNF在0.66‰~1.97‰之间小幅波动.GO处理组的血细胞MNF自暴露4d后开始显著高于对照组(P<0.05),并随着暴露时间延长不断升高,暴露结束时达到对照组的 8.58倍.文蛤血细胞的LMS(以 NRRT表示)总体上随暴露时间延长呈逐渐降低态势(图 7(b)).自 GO暴露 4d后开始,NRRT显著低于对照水平,降幅为 24.68%~50.67%.
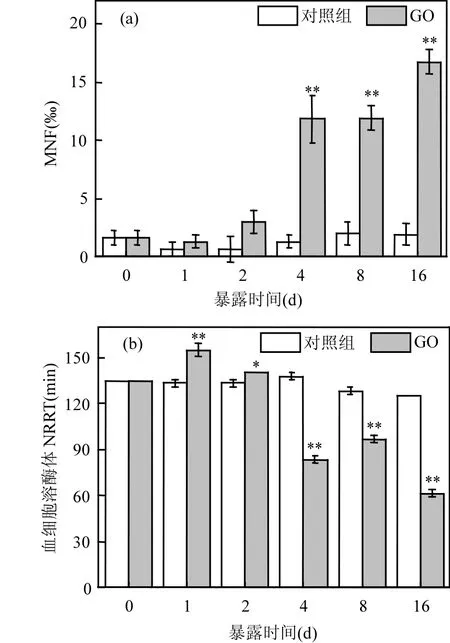
图7 GO暴露下文蛤血细胞MNF和NRRT的变化Fig.7 Variation of MNF and NRRT in the hemolymph of M. meretrix exposed to GO as a function of time
3 讨论
3.1 文蛤对GO的摄入
GO在超纯水中分散均匀,呈单层或多层薄片状,但在人工海水中则形成较大的聚集体.这与其在海水中的 Zeta电位(绝对值)较低相一致. Zeta电位是胶体粒子之间相互排斥或吸引强度的度量,可表征胶体分散系的稳定性.一般认为[27],当Zeta电位值(绝对值)在40~60mV之间时稳定性较好;30~40mV时稳定性一般,低于30mV胶体就开始变得不稳定,至0~5mV时胶体会快速凝结或凝聚.根据Zeta电位(绝对值)判断,GO在海水中处于不稳定状态,这是高浓度电解质引起电荷屏蔽效应增强的结果,GO片层易于团聚或通过与周围粒子相互作用而团聚,导致厚度增加和颜色加深.这种团聚可促进 GO在海洋中的沉积,增加其被底栖生物摄食的可能性[28-29],进而提高其对双壳类动物的污染风险.Hu等[30]采用荧光素标记的 GO(10mg/L)对普通小球藻(C. vulgaris)暴露培养,在藻细胞内检测到很强的荧光信号,表明GO能够进入藻细胞内部.但是尚未见到有关 GO能否进入海洋动物细胞的研究报道.有文献提出生物对GO的摄取机制为: 500nm以下的小片层 GO主要通过网格蛋白介导内吞作用或丝状伪足包裹进入细胞,而1~2µm的大片层GO则主要通过吞噬作用进入细胞[31-32].
3.2 GO暴露下文蛤内脏氧化应激响应
GSH是生物细胞中一种重要的抗氧化剂.细胞内GSH含量保持在一定水平,对于维护细胞稳态和抵抗重金属毒性以及氧化胁迫至关重要.目前普遍认为碳纳米材料致毒机制是通过诱导活性氧(ROS)而对生物体造成氧化性损伤[33].GSH在清除体内ROS的过程中被氧化为GSSG,因此,在污染逆境造成GSH含量降低的同时,GSSH含量则相应增加[34].对于轻微氧化逆境,细胞自身可通过调节 GSH含量以维持细胞正常代谢,即:细胞中GR(谷胱甘肽还原酶)利用NADPH作为电子供体,催化 GSSG的二硫键还原,重新生成GSH,以保持氧化逆境下适宜的GSH/GSSG比值,维持细胞内的氧化还原动态平衡[35].但是,严重的氧化逆境会破坏这种适应性机制,造成GSH降低[36],导致 ROS大量积累,使生物膜发生脂质过氧化,形成MDA等活性物质.
GO可对文蛤内脏组织产生氧化胁迫,表现为内脏 GSH含量在整个暴露期的降低(图 4(a))和GSSG含量显著增加(图4(b)).这表明GSH在消除ROS方面起着主要作用,且在暴露初期消耗较多;暴露后期,GSH含量有所回升(但始终显著低于对照组),相应地,GSSG含量增幅减小,可能是因为细胞内GR活性受到诱导而催化GSSG快速还原为GSH所致.低浓度污染物能够刺激双壳类动物 GR活性已在室内研究[37]和现场调查[38]中得到证实.暴露期间的GSH、GSSG含量呈显著负相关(R=-0.872,P<0.05),进一步证明两者之间的此消彼长关系,也意味着 GO引起的文蛤内脏氧化损害主要是通过积累ROS而实现.GO对文蛤产生氧化胁迫的另一个证明是,内脏 MDA含量在整个暴露期间显著增加(除暴露 16d外) (图6).这是内脏中的GSH无法及时清除ROS的结果,即:过度积累的 ROS攻击细胞中的生物大分子,引起膜脂质过氧化.暴露末期,MDA含量显著低于对照组水平(P<0.01),可能是因为文蛤内脏中的其它抗氧化成分受到激活,与GSH协同作用,而使ROS被有效清除.
3.3 GO对文蛤的金属毒性与神经毒性
作为生物体内一类富含半胱氨酸的非酶蛋白,MTs通过其分子中的-SH与金属离子结合而起到重金属解毒作用[39].本研究中,文蛤内脏MTs始终对 GO无显著响应(P>0.05)(图 6(b)),表明GO在海水中所释放的金属离子不足以诱导MTs合成.GO分散液中的主要金属离子为Mn2+,因为Hummer法制备GO时需使用KMnO4[40],MnO4-在酸性GO分散液中被还原为Mn2+.有文献报道厂家提供的 GO 分散液中 Mn2+浓度小于10mg/L[18].按此计算,本研究中,由 GO分散液稀释600倍而成的含GO人工海水中Mn2+浓度不会超过20µg/L.逯云召[41]将海洋双壳类—马氏珠母贝(Pinctada martensii Dunker)暴露于200µg/L的Mn2+,荧光定量PCR检测结果表明,其金属硫蛋白基因在暴露 15d后才出现显著上调,而同样条件下,10µg/L的Cu2+、40µg/L的Zn2+则在暴露10d时即能诱导金属硫蛋白基因的显著表达. Mn2+对金属硫蛋白基因的弱诱导能力,可以解释本研究的暴露体系中低浓度Mn2+对文蛤MTs无诱导能力的现象.
AChE是生物神经传导中的一种关键酶,能催化乙酰胆碱(ACh)水解生成胆碱和乙酸,终止神经递质对突触后膜的刺激,使神经冲动在动物体内能够正常传递.污染物暴露下,生物体 AChE活性常被抑制,影响到生物的摄食、游泳行为以及识别、规避天敌的能力,从而降低生物的生存能力[42],因此常被作为评价污染物亚致死毒性效应的敏感标志物之一[43].一般认为[44],AChE活性抑制率大于 20%时,只能显示暴露毒性作用的存在;抑制率大于50%时才能对生物生存产生危害.目前,有关GO对水生生物AChE的影响未见报道.本研究中,GO处理组的文蛤内脏AChE活性在暴露初期、末期明显降低(P<0.05),但是抑制率均不足50%(图6(a)),表明暴露期间GO对文蛤只是表现出暴露毒性作用,尚未威胁到文蛤生存.暴露 1d后的 AChE活性受抑,可能是进入内脏的GO 诱导 ROS所致.有文献报道[45],高浓度ROS(H2O2等)对AChE活性具有抑制作用;暴露末期,内脏中的氧化逆境程度减弱,ROS产生量相应较低,此时的AChE活性抑制则可能是由于GO自身所含Mn2+[46]在文蛤内脏中积累所致.今后应进行更长时间的暴露研究,以便更好理解文蛤AChE对GO暴露的响应机制.暴露4d时内脏AChE活性受到短暂诱导,这种现象仅见于少数研究报道.Gonzalez-Rey等[47]用75ng/L的氟西汀(FLX,治疗抑郁症的一种药物)暴露培养地中海贻贝(Mytilus galloprovincialis),至第3d时贻贝鳃AChE活性显著上升,且在暴露末期(第15d)受到抑制,与本研究结果有相似之处.至于AChE活性受到诱导的原因,有待进一步研究.
3.4 GO对文蛤的遗传损伤
生物体暴露于某些化学物质时,处于分裂间期的细胞染色体受到伤害而断裂,这些断片在进入分裂后期时滞留在赤道板附近,形成圆形或椭圆形小核(即微核)并游离于子细胞质中.通过微核试验测定的微核率(MNF)可在染色体水平上表征 DNA的损伤程度[48].已有学者利用地中海贻贝(M. galloprovincialis)、紫贻贝(M. edulis)等双壳类动物的MNF监测海洋环境污染物的致畸性和遗传毒性效应,其中,血细胞是常用的试验材料[16,49].GO 对水生生物的遗传毒性研究尚未见报道,但有学者[50]将人骨髓间充质干细胞暴露于GO(10mg/L,24h)观察到明显的细胞 DNA损伤,并推测毒性作用可能通过氧化应激介导.根据本研究的文蛤血细胞 MNF测定结果(图 7(a)),GO能够在短时间内(暴露 4d后)对文蛤造成遗传损害,且随着暴露时间延长而不断加重.血细胞MNF的这种高敏感性使其在指示GO的海洋生态毒性方面具有较大优势.GO对生物体产生的遗传毒性可能来自两种途径:①在生物体内诱导生成的ROS攻击染色体;②GO直接进入细胞与DNA相互作用[51].
3.5 GO暴露下的文蛤整体健康状态
溶酶体是由单层膜包裹的细胞器,在细胞免疫中发挥着重要作用,是许多环境污染物的共同靶点.在污染物胁迫下,双壳类血细胞的溶酶体会发生肿胀或出现膜稳定性(LMS)下降[52].LMS常以 NRRT表征,可指示细胞的整体健康状态[53].该生物标志物被联合国环境规划署“地中海污染监测项目(MEDPOL)”专家认为是水质评价中最可靠的生物标志物[54].国际海洋勘探委员会《奥斯陆巴黎保护东北大西洋海洋环境公约》研究小组[55]基于双壳贝类LMS(以NRRT表征)制定的细胞健康分级阈值如下:当NRRT>120min时,认为贝类是健康的;当 NRRT 在 50~120min时,贝类受到胁迫但可恢复;当 NRRT<50min时,贝类则遭受严重胁迫,可能出现病理特征.据此推断,本研究所用文蛤在GO暴露前以及暴露1~2d后处于健康状态(图 7(b)),但是,自暴露 4d开始NRRT值显著降低(97~62min),表明文蛤血细胞溶酶体膜因 GO胁迫而受到明显损伤.目前虽然未见GO对双壳类LMS的研究报道,但是,已有研究发现,纳米炭黑(NCB)、富勒烯(C60)等碳纳米材料的浓度为0.05~5mg/L时,可观察到地中海贻贝(M. galloprovincialis)血细胞的溶酶体膜失稳[56].双壳类属于滤食性动物,水中的纳米材料等污染物被其鳃捕获后,转移至内脏,最后进入血淋巴参与血液循环[4],在血细胞中产生和积累ROS,导致溶酶体膜的损伤.与血细胞MNF相同,LMS同样可作为敏感指示海洋环境中 GO污染水平的生物标志物.暴露期间两者呈显著负相关(R=-0.990, P<0.01),则表明血细胞MNF和LMS联合应用于GO亚致死毒性评价具有更好的效果.
4 结论
4.1 GO对文蛤内脏能够产生氧化胁迫,主要表现在两个方面:①内脏GSH含量降低和GSSG含量的增加;②内脏 MDA含量几乎在整个暴露期持续受到诱导.这是过度积累的ROS攻击细胞生物大分子引起膜脂过氧化所致.
4.2 GO对文蛤的神经毒性较小,仅在暴露初期(第1d)和暴露末期(第16d)受到短暂抑制.GO对文蛤不产生金属毒性,表现为内脏MTs未受诱导.
4.3 GO对文蛤的遗传毒性很高,并能造成血细胞溶酶体膜失稳.血细胞MNF和NRRT均在暴露4d后即出现显著变化,前者达到对照组的6.1~9.0倍,后者降幅达到 24.2%~49.2%.因此,两者可作为指示 GO对双壳类亚致死毒性的重要生物标志物.
[1] Bour A, Mouchet F, Silvestre J, et al. Environmentally relevant approaches to assess nanoparticles ecotoxicity: A review [J]. Journal of Hazardous Materials, 2015,283:764-777.
[2] Moore M N. Do nanoparticles present ecotoxicological risks for the health of the aquatic environment [J]. Environment International, 2006,32(8):967-976.
[3] 孟范平,高 鹰,赵顺顺,等.双壳类分子生物标志物对海水重金属的响应评述 [J]. 中国海洋大学学报, 2011,41(5):100-109.
[4] Canesi L, Ciacci C, Fabbri R, et al. Bivalve molluscs as a unique target group for nanoparticle toxicity [J]. Marine Environmental Research, 2012,76:16-21.
[5] Al-Sid-Cheikh M, Rouleau C, Pelletier E. Tissue distribution and kinetics of dissolved and nanoparticulate silver in Iceland scallop (Chlamys islandica) [J]. Marine Environmental Research, 2013,86:21-28.
[6] Buffet P E, Pan J F, Poirier L, et al. Biochemical and behavioural responses of the endobenthic bivalve Scrobicularia plana to silver nanoparticles in seawater and microalgal food [J]. Ecotoxicology and Environmental Safety, 2013,89:117-124.
[7] Gomes T, Araújo O, Pereira R, et al. Genotoxicity of copper oxide and silver nanoparticles in the mussel Mytilus galloprovincialis [J]. Marine Environmental Research, 2013,84:51-59.
[8] Côté C, Lemarchand K, Desbiens I, et al. Immunotoxicity of silver nanoparticles in blue mussel (Mytilus edulis) [J]. Journal of Xenobiotics, 2014,4(2):68-69.
[9] 吕小慧,陈白杨,朱小山.氧化石墨烯的水环境行为及其生物毒性 [J]. 中国环境科学, 2016,36(11):3348-3359.
[10] Chen L, Hu P, Zhang L, et al. Toxicity of graphene oxide and multi-walled carbon nanotubes against human cells and zebrafish [J]. Science China Chemistry, 2012,55(10):2209-2216.
[11] Hu C, Wang Q, Zhao H, et al. Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilis [J]. Chemosphere, 2015,128:184-190.
[12] Liu S, Jiang W, Wu B, et al. Low levels of graphene and graphene oxide inhibit cellular xenobiotic defense system mediated by efflux transporters [J]. Nanotoxicology, 2016,10(5):597-606.
[13] Regoli F, Principato G. Glutathione, glutathione-dependent and antioxidant enzymes in mussel, Mytilus galloprovincialis, exposed to metals under field and laboratory conditions: implications for the use of biochemical biomarkers [J]. Aquatic Toxicology, 1995,31(2):143-164.
[14] 王志峰.生物标志物指数法评价人为活动对东山湾底栖环境的无机污染压力 [D]. 青岛:中国海洋大学, 2013.
[15] Van Goethem F, Lison D, Kirsch-Volders M. Comparative evaluation of the in vitro micronucleus test and the alkaline single cell gel electrophoresis assay for the detection of DNA damaging agents: genotoxic effects of cobalt powder, tungsten carbide and cobalt–tungsten carbide [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 1997,392(1):31-43.
[16] Baršienė J, Lazutka J, Šyvokienė J, et al. Analysis of micronuclei in blue mussels and fish from the Baltic and North Seas [J]. Environmental Toxicology, 2004,19(4):365-371.
[17] Lowe D M, Soverchiab C, Moore M N. Lysosomal membrane responses in the blood and digestive cells of mussels experimentally exposed to fluoranthene [J]. Aquatic Toxicology, 1995,33(2):105-112.
[18] 张 倩.氧化石墨烯对 4种微藻的致毒效应研究 [D]. 青岛:中国海洋大学, 2015.
[19] Gomes T, Pereira C G, Cardoso C, et al. Effects of silver nanoparticles exposure in the mussel Mytilus galloprovincialis [J]. Marine Environmental Research, 2014,101:208-214.
[20] Koehler A, Marx U, Broeg K, et al. Effects of nanoparticles in Mytilus edulis gills and hepatopancreas–a new threat to marine life [J]. Marine environmental research, 2008,66(1):12-14.
[21] Buffet P E, Tankoua O F, Pan J F, et al. Behavioural and biochemical responses of two marine invertebrates Scrobicularia plana and Hediste diversicolor to copper oxide nanoparticles [J]. Chemosphere, 2011,84(1):166-174.
[22] 张迺哲,赵会军,付宏杰,等.组织中氧化型和还原型谷胱甘肽荧光测定法 [J]. 生物化学与生物物理进展, 1993,20(2):136-138.
[23] Buege J A, Aust S D. Microsomal lipid peroxidation [J]. Methods in Enzymology, 1978,52:302-310.
[24] Ellman G L, Courtney K D, Andres V, et al. A new and rapid colorimetric determination of acetylcholinesterase activity [J]. Biochemical Pharmacology, 1961,7(2):88-95.
[25] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72(1): 248-254.
[26] Viarengo A, Ponzano E, Dondero F, et al. A simple spectrophotometric method for metallothionein evaluation in marine organisms: an application to Mediterranean and Antarctic mollusks [J]. Marine Environmental Research, 1997,44(1):69-84.
[27] Gomes T, Pereira C G, Cardoso C, et al. Effects of silver nanoparticles exposure in the mussel Mytilus galloprovincialis [J]. Marine Environmental Research, 2014,101:208-214.
[28] Fabrega J, Luoma S N, Tyler C R, et al. Silver nanoparticles: behaviour and effects in the aquatic environment [J]. Environment International, 2011,37(2):517-531.
[29] Buffet P E, Amiard-Triquet C, Dybowska A, et al. Fate of isotopically labeled zinc oxide nanoparticles in sediment and effects on two endobenthic species, the clam Scrobicularia plana and the ragworm Hediste diversicolor [J]. Ecotoxicology & Environmental Safety, 2012,84(10):191–198.
[30] Hu X, Lu K, Mu L, et al. Interactions between graphene oxide and plant cells: Regulation of cell morphology, uptake, organelle damage, oxidative effects and metabolic disorders [J]. Carbon, 2014,80:665-676.
[31] Yue H, Wei W, Yue Z, et al. The role of the lateral dimension of graphene oxide in the regulation of cellular responses [J]. Biomaterials, 2012,33(16):4013-4021.
[32] Mu Q, Su G, Li L, et al. Size-dependent cell uptake of protein-coated graphene oxide nanosheets [J]. ACS Applied Materials & Interfaces, 2012,4(4):2259-2266.
[33] Garza K M, Soto K F, Murr L E. Cytotoxicity and reactive oxygen species generation from aggregated carbon and carbonaceous nanoparticulate materials [J]. International Journal of Nanomedicine, 2008,3(1):83.
[34] Radwan M A, El-Gendy K S, Gad A F. Oxidative stress biomarkers in the digestive gland of Theba pisana exposed to heavy metals [J]. Archives of Environmental Contamination and Toxicology, 2010,58(3):828-835.
[35] Meyer J N, Smith J D, Winston G W, et al. Antioxidant defenses in killifish (Fundulus heteroclitus) exposed to contaminated sediments and model prooxidants: short-term and heritable responses [J]. Aquatic Toxicology, 2003,65(4):377-395.
[36] Van der Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review [J]. Environmental Toxicology and Pharmacology, 2003,13(2):57-149.
[37] Verlecar X N, Jena K B, Chainy G B N. Modulation of antioxidant defences in digestive gland of Perna viridis (L.), on mercury exposures [J]. Chemosphere, 2008,71(10):1977-1985.
[38] Cheung C CC, Zheng G J, Li A M Y, et al. Relationships between tissue concentrations of polycyclic aromatic hydrocarbons and antioxidative responses of marine mussels, Perna viridis [J]. Aquatic Toxicology, 2001,52(3):189-203.
[39] Nordberg M. Metallothioneins: historical review and state of knowledge [J]. Talanta, 1998,46(2):243-254.
[40] 邓 尧,黄肖容,邬晓龄.氧化石墨烯复合材料的研究进展 [J].材料导报, 2012,26(15):84-87.
[41] 逯云召.金属离子对马氏珠母贝珍珠层颜色和金属硫蛋白基因表达的影响 [D]. 广东海洋大学, 2012.
[42] Üner N, Oruç E Ö, Sevgiler Y, et al. Effects of diazinon on acetylcholinesterase activity and lipid peroxidation in the brain of Oreochromis niloticus [J]. Environmental Toxicology and Pharmacology, 2006,21(3):241-245.
[43] Amiard-Triquet C. Behavioral disturbances: the missing link between sub-organismal and supra-organismal responses to stress? Prospects based on aquatic research [J]. Human and Ecological Risk Assessment, 2009,15(1):87-110.
[44] 蔡文超,黄 韧,李建军,等.生物标志物在海洋环境污染监测中的应用及特点 [J]. 水生态学杂志, 2012,33(2):137-146.
[45] Schallreuter K U, Elwary S M A, Gibbons N C J, et al. Activation/deactivation of acetylcholinesterase by H2O2: more evidence for oxidative stress in vitiligo [J]. Biochemical and biophysical research communications, 2004,315(2):502-508.
[46] Finkelstein Y, Milatovic D, Aschner M. Modulation of cholinergic systems by manganese [J]. Neurotoxicology, 2007,28(5):1003-1014.
[47] Gonzalez-Rey M, Bebianno M J. Does selective serotonin reuptake inhibitor (SSRI) fluoxetine affects mussel Mytilus galloprovincialis [J]. Environmental Pollution, 2013,173:200-209.
[48] Sundt R C, Pampanin D M, Grung M, et al. PAH body burden and biomarker responses in mussels (Mytilus edulis) exposed to produced water from a North Sea oil field: laboratory and field assessments [J]. Marine Pollution Bulletin, 2011,62(7):1498-1505.
[49] Arslan Ö Ç, Parlak H, Katalay S, et al. Detecting micronuclei frequency in some aquatic organisms for monitoring pollution of Izmir Bay (Western Turkey) [J]. Environmental Monitoring and Assessment, 2010,165(1-4):55-66.
[50] Wang A, Pu K, Dong B, et al. Role of surface charge and oxidative stress in cytotoxicity and genotoxicity of graphene oxide towards human lung fibroblast cells [J]. Journal of Applied Toxicology, 2013,33(10):1156-1164.
[51] Wang K, Jing R, Song H, et al. Biocompatibility of Graphene Oxide [J]. Nanoscale Research Letters, 2011,6(4):1-8.
[52] Moore M N, Viarengo A, Donkin P, et al. Autophagic and lysosomal reactions to stress in the hepatopancreas of blue mussels [J]. Aquatic Toxicology, 2007,84(1):80-91.
[53] Cong Y, Banta G T, Selck H, et al. Toxicity and bioaccumulation of sediment-associated silver nanoparticles in the estuarine polychaete, Nereis (Hediste) diversicolor [J]. Aquatic Toxicology, 2014,156:106-115.
[54] UNEP. Report of the meeting of experts to review the MEDPOL biomonitoring programme [R]. UNEP-(OCA)/MED WG, Athens, Greece, 1997,132/7.
[55] ICES/OSPAR, 2009. Report of the joint ICES/OSPAR study group on integrated monitoring contaminants and biological effects [R]. (SGIMC) ICES CM, 2009,30.
[56] Canesi L, Fabbri R, Gallo G, et al. Biomarkers in Mytilus galloprovincialis exposed to suspensions of selected nanoparticles (Nano carbon black, C60fullerene, Nano-TiO2, Nano-SiO2) [J]. Aquatic Toxicology, 2010,100(2):168-177.
The sublethal toxicity of graphene oxide to bivalve Meretrix meretrix.
DUAN Wei-yan, DU Yong-xiang, MENG Fan-ping*, LIN Yi-chen, ZHOU Qi (Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China). China Environmental Science, 2017,37(7):2755~2764
In the present study, the experimental clams Meretrix meretrix were exposed to GO in artificial seawater (5mg/L) in order to comprehensively evaluate the toxicity of graphene nanomaterials to marine organisms. Mechanism of the sublethal toxicity caused by GO to clams was explored by monitoring of seven biomarkers including the reduced glutathione (GSH), oxidized glutathione (GSSG), malondialdehyde (MDA), acetylcholinesterase (AChE) and metallothioneins (MTs) in the digestive gland, as well as micronucleus frequency (MNF) and lysosomal membrane stability (LMS) of hemolymph. Results demonstrated that the oxidative stress was induced by GO in the digestive gland of clams, while the content of GSH decreased and both of GSSG and MDA increased. Weak neurotoxicity was caused by GO, which was indicated by the temporary inhibition of AChE activity at the initial and end of exposure stages. No obvious induction of MTs was observed in the whole period of exposure. However, significant genotoxicity and lysosomal membrane instability occurred after 4-d exposure. The MNF of experimental groups reached to 6.1~9.0 times of the blank control levels, but the neutral red retention time (NRRT) decrease of the positive treatments was about 24.2%~49.2% of the blank control group. Except for the biomarkers AChE and MTs, other parameters were testified as suitable and sensitive indicators to assess the sublethal toxicity of GO in this study.
graphene oxide (GO);bivalves;oxidative stress;micronucleus frequency (MNF);lysosomal membrane stability (LMS)
X171,X835
A
1000-6923(2017)07-2755-10
段伟艳(1992-),女,河北沙河人,中国海洋大学博士研究生,主要从事海洋污染生态效应研究.
2016-11-29
国家自然科学基金资助项目(41276104)
* 责任作者, 教授, mengfanping@ouc.edu.cn

