印楝素对果蝇厌恶性味觉记忆的诱导及多巴胺能神经元的影响
燕 颍, 顾怀宇, 徐汉虹, 张志祥
(1天然农药与化学生物学教育部重点实验室/华南农业大学 农学院,广东 广州 510642;2 中山大学 中山医学院,广东 广州 510080)
印楝素对果蝇厌恶性味觉记忆的诱导及多巴胺能神经元的影响
燕 颍1, 顾怀宇2, 徐汉虹1, 张志祥1
(1天然农药与化学生物学教育部重点实验室/华南农业大学 农学院,广东 广州 510642;2 中山大学 中山医学院,广东 广州 510080)
【目的】明确印楝素是否能诱导果蝇产生厌恶性味觉记忆,并探讨多巴胺信号在这种记忆形成中的调控作用。【方法】利用印楝素诱导果蝇产生短期厌恶性味觉记忆,并通过昆虫口器伸展反应测试诱导结果;采用压力注射给药方式及果蝇全脑膜片钳记录,研究印楝素对果蝇脑内不同亚群多巴胺能神经元兴奋性及受体电流的影响。【结果】印楝素A及印楝素干粉均能显著抑制果蝇口器伸展的概率,口器伸展反应(PER)分别为60.34%和17.24%,(P<0.007),并且干粉的效果更加明显;印楝素对不同亚群的多巴胺能神经元的兴奋性有不同的作用,PPL1、PAM和PPM2亚群兴奋性呈现增加趋势,其中PPL1亚群兴奋性改变最为显著;印楝素对多巴胺D1受体具有激动效应,这种激动效应可被D1受体特异性拮抗剂抑制。【结论】印楝素可以诱导果蝇产生厌恶性味觉记忆,这种记忆受果蝇脑内多巴胺能信号的调控。
印楝素; 厌恶性味觉记忆; 多巴胺; 神经兴奋性; 果蝇
印楝素是当今世界公认的最优秀的生物农药之一,属于柠檬素类物质,也是一种苦味剂,具有拒食、忌避、抑制生长发育、诱导凋亡和自噬等多种作用机制[1]。印楝素在实际应用中不稳定、易降解,但对害虫具有持续效果,目前仍无法解释这种现象。近期有研究提出印楝素具有味觉记忆性的观点,并通过取食行为观察和分子生物学检测发现,印楝素对斜纹夜蛾Spodopteralitura幼虫的拒食活性与长时程记忆相关蛋白CREB mRNA的表达量一致,认为两者可能存在关联[2]。果蝇Drosophila是神经生物学的重要模式生物之一,因其详实的遗传背景和便捷的试验操作手段,在学习记忆功能研究中具有其他试验动物模型无法比拟的优势。多巴胺(Dopamine,DA)是生物体广泛存在的一种神经递质,参与调控昆虫的多种生理和行为过程,如学习、记忆、认知、抉择、运动以及型变等[3]。在昆虫联合学习记忆中,多巴胺介导着非条件化(强化)刺激的传导,尤其是负向强化(电击、高热或苦味物质)刺激[4]。果蝇脑内大约有600个多巴胺神经元,根据解剖学位置分为不同的细胞亚群,其中PPL1、PAM、PPL2ab 这3个神经元群投射至蘑菇体(果蝇的学习记忆中心)神经纤维网[5]。目前已经明确PPL1与PAM亚群参与调控果蝇厌恶性学习记忆[6-8]。DA释放后需要通过结合突触后膜特异性的多巴胺受体 (Dopamine receptors, DARs) 来发挥作用。果蝇脑内存在4个G-蛋白偶联性DARs,包括2个D1型受体(DopR1、DopR2)、1个D2型受体D2R和1个非经典型受体DopEcR[9]。已有研究证实,果蝇对厌恶性进食行为的学习依赖于蘑菇体内部神经元中多巴胺D1受体的存在,当D1受体发生突变时,果蝇几乎丧失学习能力[10]。驱蚊胺(N,N-Diethyl-m-toluamide,DEET)是常用的趋避剂,有研究报道其效应是由于同时诱导害虫产生了嗅觉和味觉躲避反应[11]。DEET可以强化刺激诱导果蝇产生短期厌恶性记忆,而这种记忆同时接受特定多巴胺能神经元的调控[12]。动物可以根据先前的经历形成强烈的味觉记忆来躲避有毒食物[13]。昆虫口器伸展反应(Proboscis extension reflex,PER)是分析昆虫味觉行为的一种经典的行为范式,其抑制程度可以代表化合物效应的强弱,能够快速地检测厌恶性味觉记忆的形成[14-15]。本研究以黑腹果蝇D.melanogaster为材料,利用PER测试和果蝇全脑膜片钳记录研究印楝素是否能够诱导果蝇产生味觉厌恶性记忆,并探讨这种记忆形成的细胞机制,以期解释印楝素存留期与持效期不一致的矛盾现象。
1 材料与方法
1.1 材料
1.1.1 药剂 试验用的化合物:印楝素A(文中简称为印楝素),由华南农业大学天然农药与化学生物学教育部重点实验室提供;印楝素干粉(印楝素A质量分数为40.59%),由成都绿金生物科技有限责任公司提供;蔗糖、奎宁、多巴胺、DMSO及电生理溶液配制试剂购自Sigma-Aldrich上海分公司。行为学试验中印楝素A纯品及印楝素干粉用水溶解,电生理试验中印楝素A纯品用DMSO配制成高浓度(10 mmol·L-1)溶液分装备用。
1.1.2 果蝇品系及饲养 野生型Canton-S,特异标记多巴胺神经元的品系TH-Gal4>UAS-mCD8::GFP。饲养果蝇的食物选用标准的玉米粉培养基,饲养温度24 ℃,相对湿度60%~70%,12 h光:12 h暗循环光照。行为学试验选用1~3日龄的雌性和雄性Canton-S,电生理记录选用TH-Gal4>UAS-mCD8::GFP子一代雌性果蝇。
1.2 方法
1.2.1 厌恶性味觉记忆检测 收集羽化后5~7 d的果蝇转移至新鲜的食物中放置24 h,然后再将果蝇转移至装有湿润滤纸的培养管中饥饿48 h。用CO2麻醉后将果蝇背部黏至载玻片上,放入湿盒内恢复2~3 h。试验时将载玻片固定在解剖显微镜下(Olympus, SZ61)进行训练和测试。训练前用100 mmol·L-1的蔗糖刺激果蝇口器,出现口器伸展的个体用于训练。用水喂饱果蝇后,用蔗糖(作为条件化刺激)刺激足部2~3 s,连续3次,每次间隔10 s,选取3次刺激都能够伸喙的果蝇用于进一步的测试。每次给予刺激时,在蔗糖刺激足部的同时将奎宁、印楝素等不同的化合物溶液(非条件化刺激)运送至果蝇口器,让果蝇取食直至缩回口器。训练结束用水清洗足部和口器,并用水将果蝇喂饱。5 min后用蔗糖刺激足部,观察口器是否伸展。每种化合物用3批果蝇测试,每批20~30只果蝇。
1.2.2 电生理记录 果蝇全脑制备方法参照Gu等[16]的报道。在含有木瓜蛋白酶(Papain, 20 U·mL-1;Worthington, Freehold, NJ, USA)及激活剂(L-cystein, 1 mmol·L-1)的解剖液[用V(O2)∶V(CO2)为95∶5的混合气充分饱和]中将果蝇整个大脑从头部中摘除,去除脑壳和脑组织表面的结缔组织,将脑组织移至含有记录液的浴槽中,将脑组织背侧或腹侧面朝上放置并用自制的U形铂金框架固定,记录前用连续流动的含氧记录液孵育至少10 min。试验中含氧记录液灌流贯穿整个记录过程。在荧光蛋白标记指引下,定位不同亚群的多巴胺神经元作为记录对象。正常记录外液成分及浓度(单位:mmol·L-1): NaCl 101、CaCl21、MgCl24、KCl 3、葡萄糖5、NaH2PO41.25、NaHCO320.7,pH 7.2,渗透压250 Osm。全细胞记录电极电阻为10~15 MΩ。电极内液成分及浓度(单位:mmol·L-1):葡萄糖酸钾102、CaCl20.085、MgCl21.7、NaCl 17、EGTA 0.94、HEPES 8.5,pH 7.2,渗透压235 Osm。记录过程中,印楝素通过灌流的方式施加入浴液,观察10~20 min。多巴胺受体电流通过程控灌流给药系统以压力注射的方式触发多巴胺电流。采用BX51WI正置固定载物台显微镜(Olympus, Lehigh Valley, PA,USA)、Multiclamp700B放大器和Digital 1440A D-A转换器(Molecular Devices, Foster City, CA, USA)。
1.2.3 免疫荧光 利用全脑制备方法分离TH-Gal4>UAS-mCD8::GFP品系果蝇的全脑,转移至入体积分数为4%的多聚甲醛中,冰上固定1~3 h,室温下用 PBS清洗3次,再用含体积分数为10%正常山羊血清和体积分数为 0.3%Triton X-100的 PBS 溶液(PBST)在室温下封闭1~3 h,然后用兔抗GFP抗体(Cell signaling technology, 体积比1∶500)4 ℃孵育24 h;PBST室温清洗30 min后将脑孵育于含有山羊抗兔Alexa Fluor488(分子探针,体积比1∶200)二抗中,4 ℃放置 24~48 h;最后,室温下清洗后用抗荧光淬灭封片剂进行封片。成像采用蔡司公司LSM780激光共聚焦显微镜(Oberkochen, Germany),在20倍物镜下进行全脑拍照。
1.2.4 数据分析 电生理数据分析采用pClamp 10软件包中的clampfit功能,用于分析印楝素对多巴胺神经元自发电活动、静息膜电位、膜电导及多巴胺受体电流的影响。所有数据的统计分析采用生物统计软件SPSS20.0,行为学试验结果分析采用Fisher精确检验,电生理数据采用t检验或单因素方差分析,数据均以平均值±标准误表示。P<0.007(行为学数据)或P<0.05(电生理数据)时认为有统计学差异。
2 结果与分析
2.1 印楝素诱导果蝇短期厌恶性味觉记忆形成
采用改进的单只果蝇味觉条件化行为范式(图1),通过训练果蝇对甜味觉条件化蔗糖刺激与厌恶性非条件化刺激进行关联,从而诱导果蝇对特定化合物的厌恶反应。在给予果蝇蔗糖与印楝素、印楝素干粉、奎宁配对刺激后,果蝇形成了条件化PER抑制。图2a显示,随训练次数增加,印楝素A、印楝素干粉及奎宁抑制果蝇PER的作用逐渐增强;纯净水和蔗糖刺激时,果蝇PER在训练前、训练中和测试时无明显差异。图2b比较了测试时各化合物组间的记忆指数,印楝素A纯品、印楝素干粉、奎宁与对照(纯净水)均有显著差异(P<0.007);印楝素A与印楝素干粉组间也存在明显差异(P<0.007);印楝素干粉组与奎宁组差异不显著。
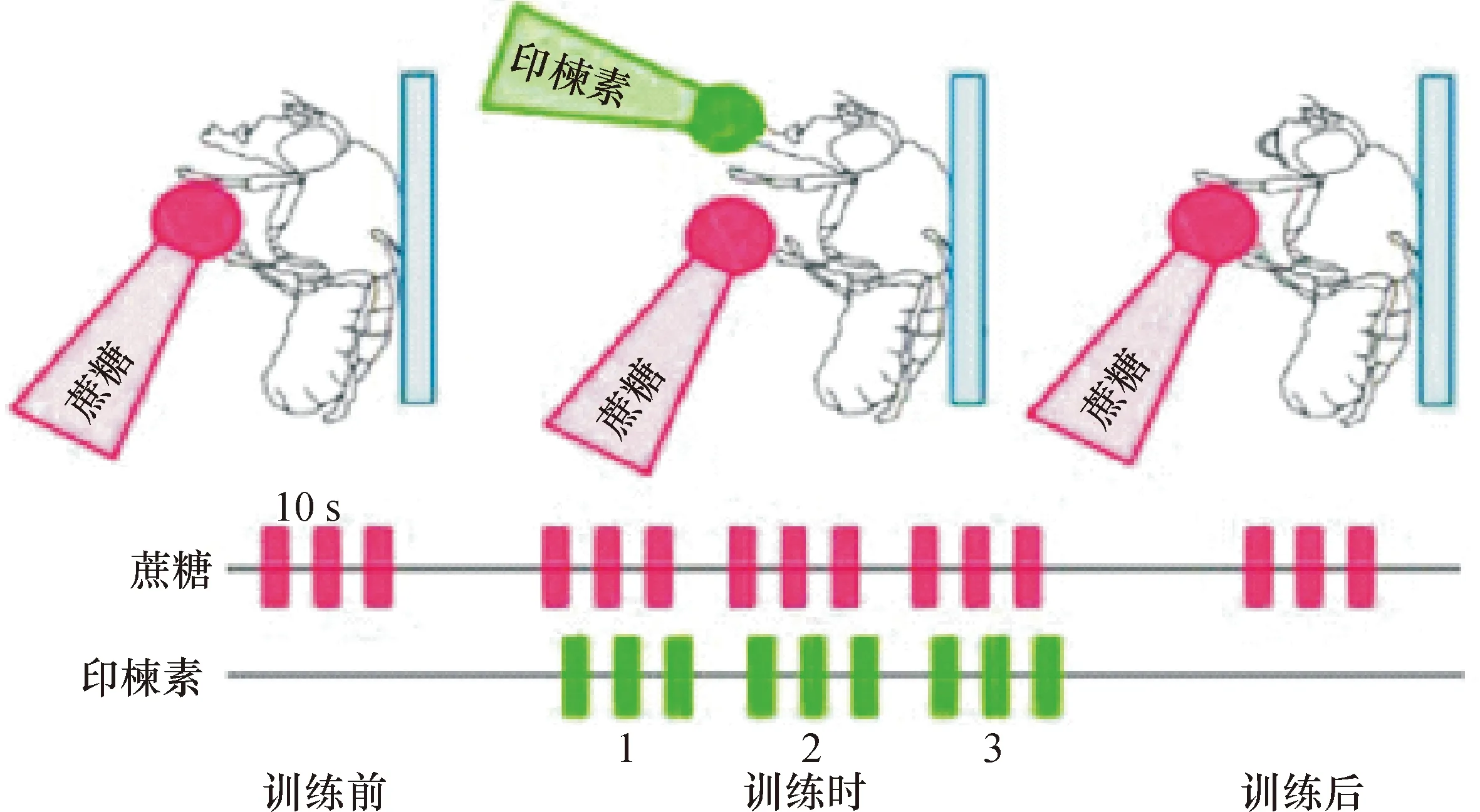
训练前先用100 mmol·L-1蔗糖刺激足部3次,以诱导果蝇口器伸展;训练时给予3串训练,每串含3次蔗糖刺激,口器伸展后给予1 mmol·L-1印楝素;测试时只给蔗糖刺激足部,检测口器伸展情况。
图1 味觉厌恶记忆测试示意图(修改自文献[8])
Fig.1 The testing scheme of aversive taste memory of fruit fly (revised from literature[8])
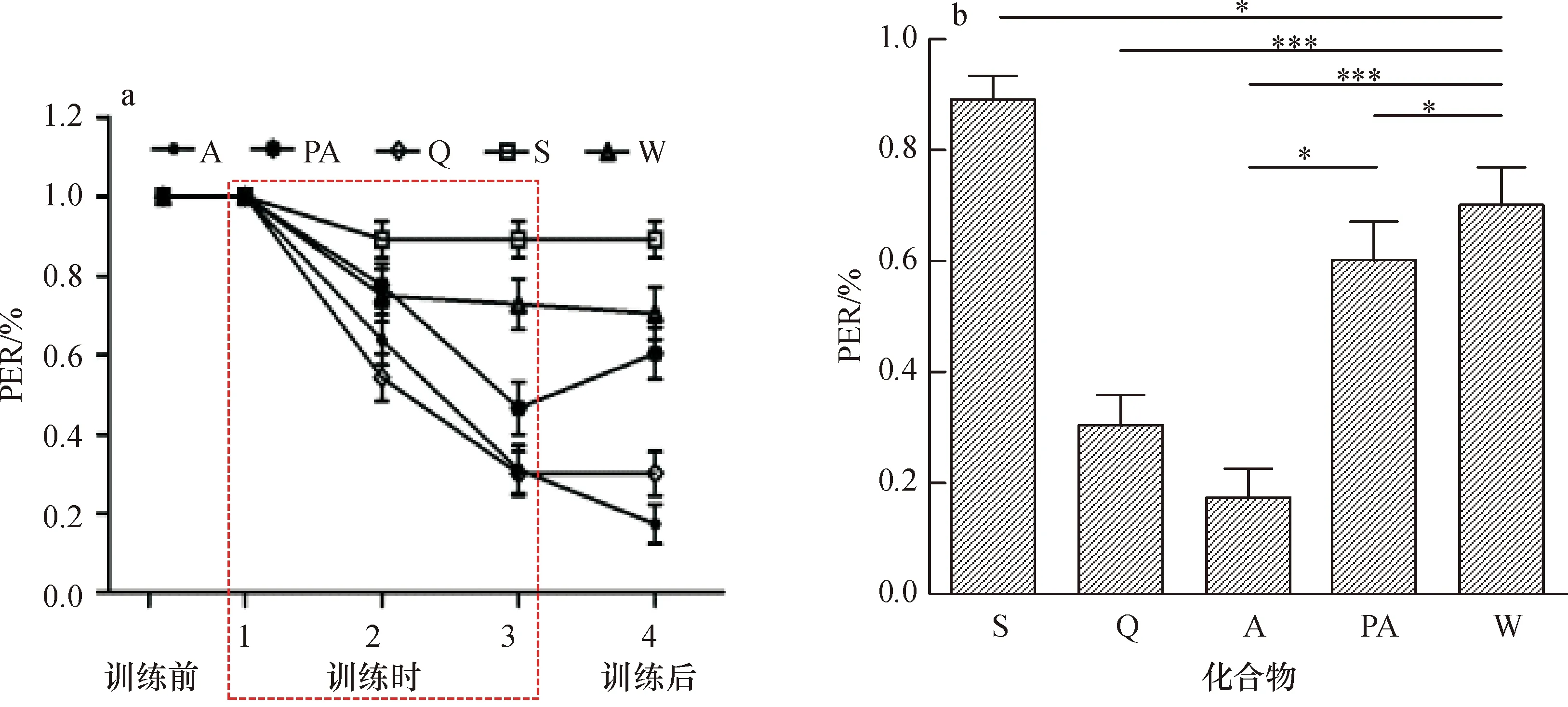
a:印楝素纯品及干粉明显抑制果蝇口器伸展的概率,干粉的抑制效果尤为显著,提示厌恶性味觉记忆的产生; b:测试时不同化合物组间记忆指数比较。A─印楝素干粉(2.46 mmol·L-1, 其中印楝素A 为1 mmol·L-1),PA─印楝素A(1 mmol·L-1),Q─奎宁(10 mmol·L-1),S─蔗糖(100 mmol·L-1),W─纯净水;*和***分别表示对比的两组间差异达显著和极显著(*P<0.007,***P<0.000 01,Fisher精准检验)。
图2 印楝素诱导的条件化味觉抑制
Fig.2 Azadirathin-induced conditional gustatory suppression
2.2 印楝素对不同亚群多巴胺能神经元兴奋性的影响
果蝇脑内的多巴胺能神经元散布于全脑,根据其胞体位置分为15个亚群,本试验电记录时主要选取蘑菇体附近的6个亚群(PPL1、PPL2、PPM1/2、PPM3、PAL、PAM)进行记录。图3显示利用GAL4/UAS二元表达系统及绿色荧光蛋白标记的果蝇脑内6个亚群多巴胺能神经元的脑区分布。全细胞电流钳模式下,6个亚群多巴胺神经元静息膜电位基本一致,为(-50±5.4)mV,但各自的自发电活动特征有明显的不同;在2 μmol·L-1印楝素作用下6个亚群呈现不同的反应特征,PPL1亚群兴奋性增加显著,膜电位去极化幅度为(7.2±3.3)mV(P<0.05,n=6),PAM和PPM2亚群兴奋性轻度提高,而其余3个亚群兴奋性呈降低趋势(图4)。电压钳斜坡电压注入下[(-90~80)mV],6个亚群多巴胺神经元膜电流激活阈值也各不相同,PAM、PPM1/2、PPM3、PAL亚群激活阈值较低,而PPL1、PPL2亚群激活阈值较高。加入印楝素(2 μmol·L-1)5 min 后,PPL1电导增加明显并可触发动作电位(阈值约-45 mV),其他亚群电导变化不显著(图5)。

a:TH-GAL4>UAS-mCD8::GFP品系果蝇标记的多巴胺能神经元亚群的背侧面观; b:TH-GAL4>UAS-mCD8::GFP品系果蝇标记的多巴胺能神经元亚群的腹侧面观。标尺代表100 μm。
图3 果蝇脑内6个不同亚群多巴胺能神经元的解剖位置
Fig.3 The anatomical locations of six different clusters of dopaminergic neurons inDrosophilabrain
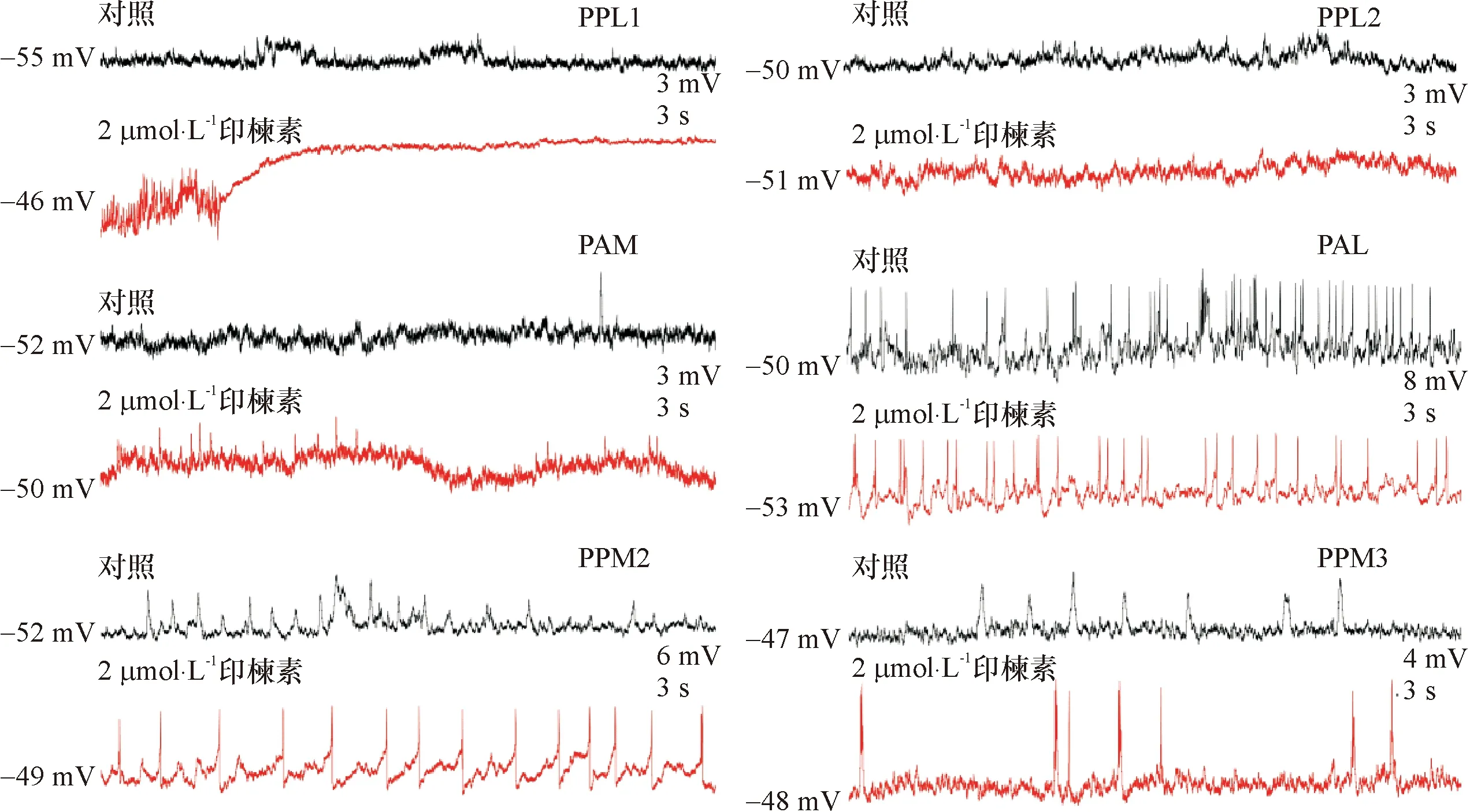
图4 印楝素对6个亚群多巴胺能神经元静息膜电位与自发电活动的影响
Fig.4 Effects of azadirachtin on resting membrane potential and spontaneous activities of six clusters of dopaminergic neurons

图5 印楝素对6个亚群多巴胺能神经元膜电导的影响Fig.5 Effects of azadirachtin on membrane conductances of six clusters of dopaminergic neurons
2.3 印楝素对多巴胺受体的影响
鉴于D1型受体在厌恶性记忆的形成与遗忘过程中的重要作用[17],试验进一步检测印楝素对多巴胺受体功能的影响。通过压力注射给药方法,在蘑菇体内的神经元上我们记录到多巴胺受体电流(图6a),提前孵育2 μmol·L-1印楝素增强了电流幅值,当印楝素与D1受体特异性拮抗剂SCH23390同时使用则明显降低了印楝素的增强效应(图6b)。
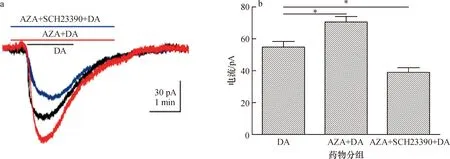
a:多巴胺受体电流曲线记录示例,提前孵育2 μmol·L-1印楝素增加了电流幅值,提前孵育印楝素与D1受体特异性拮抗剂SCH23390抑制了印楝素的增强效应。b:不同条件下触发的受体电流总结图,*P<0.05(One-way ANOVA)。DA:500 μmol·L-1多巴胺;AZA+DA:印楝素预孵育,2 μmol·L-1印楝素+500 μmol·L-1多巴胺;AZA+SCH23390+DA:印楝素与SCH23390提前共同预孵育,2 μmol·L-1印楝素+10 μmol·L-1SCH23390+500 μmol·L-1多巴胺。
图6 印楝素对多巴胺受体电流的影响
Fig.6 Effect of azadirachtin on dopamine receptor current
3 讨论与结论
本研究根据印楝素半衰期与持效期不一致的现象,从昆虫记忆的角度检测了印楝素与味觉记忆的关系,发现印楝素可诱导果蝇产生短期厌恶性味觉记忆,且这种记忆的形成与印楝素对脑内多巴胺能神经元及其受体的作用有关。
与哺乳类动物类似,昆虫也可以根据先前的经历形成味觉记忆,以利于将来的食物选择[13]。苦味觉刺激可以作为诱导剂,与甜味觉配对可诱导PER抑制,且先前的经历可调控PER[15, 18]。与昆虫嗅觉记忆研究相比,有关味觉记忆的研究较少。近年的研究显示昆虫不仅可以形成味觉关联性记忆,还与嗅记忆类似,要求蘑菇体与多巴胺能神经元参与这种记忆的形成与调控。本研究中,与公认的苦味剂奎宁效应类似,印楝素A纯品和印楝素干粉也可以诱导果蝇形成短期厌恶性记忆,而且印楝干粉对PER的抑制程度高于奎宁。印楝干粉的效果好于印楝素A纯品提示印楝素干粉中的其他成分起到了协同增效的作用。果蝇嗅觉学习记忆按时程可分为短期(持续数分钟至1 h)、中期(持续数小时)和长期记忆(持续24 h至1周)[19]。目前味觉记忆的研究只关注了训练后30 min(短期)的记忆[15, 20]。印楝素能否诱导更长期的厌恶性味觉记忆形成有待进一步检测。
果蝇脑内支配蘑菇体不同区域的多巴胺能神经元具有不同的功能特点。已经证实参与调控厌恶性记忆的有PPL1亚群的MB-MP1、MB-MV1 亚类及PAM亚群的MB-M3亚类[6-8]。本研究中不同亚群多巴胺能神经元对印楝素的不同反应特征提示,印楝素可以作为强化刺激,进而选择性地激活调控厌恶记忆的多巴胺能神经元亚群。电击及DEET诱导的厌恶记忆研究表明,不同的厌恶性记忆共用介导负向强化刺激的多巴胺能神经元。印楝素特异性地提高PPL1亚群神经元的兴奋性进一步支持了这一规律。今后将进一步开展研究,以明确印楝素激活的PPL1亚群中的具体亚类。
多巴胺释放后需要结合突触后膜的多巴胺受体才能发挥其功能。蘑菇体是昆虫的学习记忆中枢,也是多巴胺能神经元最重要的突触后靶点之一,其内在神经元中表达的2个D1R(DopR1和DopR2)已被证实参与调控厌恶性记忆的形成与遗忘[17]。印楝素可以兴奋PPL1亚群神经元、增加多巴胺释放,极有可能直接作用于多巴胺受体。本研究的结果显示,印楝素确实增加了蘑菇体内在神经元上的多巴胺受体电流;此外,D1受体特异性拮抗剂降低印楝素的增强效应,提示D1受体可能是印楝素的作用靶标。果蝇脑内不同类型的多巴胺受体有着不同的功能,近期研究发现突触前和突触后膜的D2R皆参与了调控学习记忆[21]。印楝素是否也能够影响D2R将是一个有趣的方向。
[1] 程东美, 张志祥, 田永清, 等. 印楝杀虫作用机理[J]. 植物保护, 2007, 33(4):11-15.
[2] 张宁. 印楝素对斜纹夜蛾学习记忆能力的影响[D]. 广州: 华南农业大学, 2014.
[3] 吴顺凡, 徐刚, 齐易香, 等. 昆虫多巴胺及其受体的研究进展[J]. 昆虫学报, 2013, 56 (11): 1342-1358.
[4] WADDELL S. Reinforcement signalling inDrosophila; dopamine does it all after all[J]. Curr Opin Neurobiol, 2013, 23(3): 324-329.
[5] MAO Z, DAVIS R L. Eight different types of dopaminergic neurons innervate theDrosophilamushroom body neuropil: Anatomical and physiological heterogeneity[J]. Front Neural Circuits, 2009, 3: 5.
[6] ASO Y, SIWANOWICZ I, BRCKER L, et al. Specific dopaminergic neurons for the formation of labile aversive memory[J]. Curr Biol, 2010, 20(16): 1445-1451.
[7] ASO Y, HERB A, OGUETA M, et al. Three dopamine pathways induce aversive odor memories with different stability[J]. PLoS Genet, 2012, 8(7): e1002768.
[8] MASEK P, WORDEN K, ASO Y, et al. A dopamine-modulated neural circuit regulating aversive taste memory inDrosophila[J]. Curr Biol, 2015, 25(11): 1535-1541.
[9] MUSTARD J A, BEGGS K T, MERCER A R. Molecular biology of the invertebrate dopamine receptors[J]. Arch Insect Biochem Physiol, 2005, 59(3): 103-117.
[10]KIM Y C, LEE H G, HAN K A. D1 dopamine receptor dDA1 is required in the mushroom body neurons for aversive and appetitive learning inDrosophila[J]. J Neurosci, 2007, 27(29): 7640-7647.
[11]LEE Y, KIM S H, MONTELL C. Avoiding DEET through insect gustatory receptors[J]. Neuron, 2010, 67(4): 555-561.
[12]DAS G, KLAPPENBACH M, VRONTOU E, et al.Drosophilalearn opposing components of a compound food stimulus[J]. Curr Biol, 2014, 24(15): 1723-1730.
[14]DETHIER V G. The hungry fly[M]. Cambridge: Harvard University Press, 1976.
[15]KEENE A C, MASEK P. Optogenetic induction of aversive taste memory[J]. Neuroscience, 2012, 222: 173-180.
[16]GU H, O′DOWD D K. Whole cell recordings from brain of adultDrosophila[J]. J Vis Exp, 2007 (6): e248-e248.
[17]BERRY J A, CERVANTES-SANDOVAL I, NICHOLAS E P, et al. Dopamine is required for learning and forgetting inDrosophila[J]. Neuron, 2012, 74(3): 530-542.
[18]MASEK P, SCOTT K. Limited taste discrimination inDrosophila[J]. Proc Natl Acad Sci USA, 2010, 107(33): 14833-14838.
[19]DAVIS R L. Traces ofDrosophilamemory[J]. Neuron, 2011, 70(1): 8-19.
[20]KIRKHART C, SCOTT K. Gustatory learning and processing in theDrosophilamushroom bodies[J]. J Neurosci, 2015, 35(15): 5950-5958.
[21]QI C, LEE D. Pre- and postsynaptic role of dopamine D2 receptor DD2R inDrosophilaolfactory associative learning[J]. Biology, 2014, 3(4): 831-845.
【责任编辑 周志红】
Induction of aversive taste memory by azadirachtin and its effects on dopaminergic neurons of Drosophila
YAN Ying1, GU Huaiyu2, XU Hanhong1, ZHANG Zhixiang1
(1 Key Laboratory of Natural Pesticide and Chemical Biology, Ministry of Education/College of Agriculture, South China Agricultural University, Guangzhou 510642, China; 2 Zhongshan School of Medicine, Sun Yat-sen University, Guangzhou 510080, China)
【Objective】 To investigate the inductive effects of azadirachtin on taste memory inDrosophilamelanogaster(fruit fly) and the regulation of dopamine signaling in such memory formation. 【Method】Aversive taste memory induced by azadirachtin was tested by proboscis extension reflex (PER). Effects of azadirachtin on membrane excitability and receptor currents of dopaminergic neurons inD.melanogasterbrain were studied using pressure injection combined with whole-cell patch clamp recording. 【Result】Both azadirachtin A and the azadirachtin dry powder could significantly inhibit the probability of PER,which were 60.34% and 17.24% respectively(P<0.007). The effect of dry powder was more obvious. Different clusters of dopaminergic neurons responded variously to azadirachtin. PPL1, PAM and PPM2 subgroups showed increasing trends in excitability, in which the changes of PPL1 cluster neurons were most pronounced. Azadirachtin showed agonistic effect on D1 receptor, and such effect could be inhibited by D1 receptor specific antagonists.【Conclusion】Azadirachtin can induce aversive taste memory inDrosophila, and such memory is regulated by dopaminergic signals in the brain.
azadirachtin; aversive taste memory; dopamine; neuronal excitability;Drosophila
2016- 02- 21 优先出版时间:2017- 06-21
燕 颍(1982─),女,博士,E-mail:yyingyan200@126.com;通信作者:徐汉虹(1961─),男,教授,博士,E-mail: hhxu@scau.edu.cn; 张志祥(1974—),男,教授,博士,E-mail:zdsys@scau.edu.cn
中国博士后基金(2015M572330);国家自然科学基金(31471793)
S482.1
A
1001- 411X(2017)04- 0012- 07
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170621.1907.002.html
燕 颍, 顾怀宇, 徐汉虹, 等.印楝素对果蝇厌恶性味觉记忆的诱导及多巴胺能神经元的影响[J].华南农业大学学报,2017,38(4):12- 18.

