防治设施蔬菜土传病害生防菌株B1619生物学特性的研究
王璐瑶,甘 颖,刘永峰,陈志谊*
(1.江苏省农业科学院植物保护研究所,江苏 南京 210014;2.南京农业大学植物保护学院,江苏 南京 210014)
防治设施蔬菜土传病害生防菌株B1619生物学特性的研究
王璐瑶1,2,甘 颖1,刘永峰1,陈志谊1,2*
(1.江苏省农业科学院植物保护研究所,江苏 南京 210014;2.南京农业大学植物保护学院,江苏 南京 210014)
【目的】生防菌株 B1619是一株能够防控设施蔬菜土传病害的生防菌株。本文从分泌代谢物种类、生物膜形态、最佳碳源、氮源、无机盐、微量元素、pH 和温度方面研究生防菌株B1619 的生物学特性。【方法】最佳碳氮源、无机盐、微量元素、pH和温度的研究稀释平板法进行;生物膜通过Msgg培养基培养。【结果】生防菌株 B1619 可产生蛋白酶、纤维素酶和嗜铁素蛋白酶培养基、嗜铁素培养基和纤维素酶培养基上产生晕圈,几丁质酶培养基上未产生分解晕圈;可形成致密、厚实的生物膜;最适生长温度为 27 ℃,最适 pH 为5.9,最佳碳源为甘露醇,最佳氮源为牛肉膏,微量元素丙氨酸、VB1能促进 B1619 的生长,其中丙氨酸有显著促进作用;无机盐CaCl2和MgSO4促进B1619 生长。生防菌株 B1619在 24 h前处于对数生长期,24 h生长数量最大,24 48 h之后,菌体生长基本达到稳定;24 h 主要以菌体形式存在,24 h 之后,开始出现芽孢,到72 h达到90 %以上的芽孢率。【结论】B1619可以产生蛋白酶、纤维素酶和嗜铁素,但不分泌几丁质酶;B1619在大多数速效碳源下生长良好,在无机氮源中的生长优于有机氮源;适宜的温度、pH、微量元素和无机盐可以促进B1619的生长;B1619的生长在48 h后基本达到稳定。此外,电镜观察了B1619 24、48、72 h生长过程中的菌体形态变化。
生防菌株; B1619 ;生物学特性
【研究意义】近年来,设施蔬菜的栽培面积近逐年扩大,重茬连作加重,使得土传病害发生日趋严重,一般发病导致减产20 %以上,发病严重者甚至绝收,严重影响蔬菜的产量和质量[1]。以往主要以化学农药防治为主,化学农药的大量使用污染环境,危害人类健康,同时容易导致抗药性产生。为了解决设施蔬菜产量和质量之间矛盾,达到有效控制连作障碍、减少化学农药使用量的目的,使用生物防治技术控制设施蔬菜土传病害的策略越来越受到国内外科研人员的关注,并初见成效[2]。【前人研究进展】江苏省农业科学院植物保护研究所植病生防研究室从2008年起,以番茄枯萎菌、青枯菌为指示菌,筛选拮抗细菌,获得生防菌株B1619,经鉴定为解淀粉芽孢杆菌Baicllusamyloliquefaciens;生防菌 B1619 对枯萎病菌Fusariumoxysporum有很强的抑制作用;在江苏省沭阳、铜山、溱潼多地进行田间试验示范,结果表明, B1619 对设施番茄枯萎病、青枯病和线虫病均有较好防治作用,对番茄枯萎病的田间防效达到67.5 %~75.8 %[3-4],对线虫病的防效达到60.217 %~70.9 %,并且对番茄植株有一定的促生作用[3-4](待发表)。【本研究切入点】本研究通过实验室保存的菌株,对B1619的基本生物学特性和本试验主要针对 B1619 的最佳实验室培养条件和生物学特性进行研究,揭示B1619的基本特性和生长规律。【拟解决的关键问题】为今后深入研究 B1619 的防病机理、提高其防效和产业化生产提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 生防菌株 B1619,由江苏省农业科学院植物保护研究所提供。
1.1.2 培养基 YPG培养基[5]:葡萄糖 5 g,胰蛋白胨 5 g,酵母膏 5 g,定容至1000 mL,pH 7.0。
YPGA培养基[5]:葡萄糖 5 g,胰蛋白胨 5 g,酵母膏 5 g,琼脂粉 18 g,定容至 1000 mL, pH 7.0。
NA 培养基[6]:牛肉浸膏 3 g,酵母膏 1 g,蛋白胨 5 g,葡萄糖 10 g,定容至 1000 mL, pH 7.0。
蛋白酶培养基[7]: 脱脂奶粉 8 g,溶于300 mL水中,pH 7.0, 120 ℃ 灭菌 10 min;琼脂8 g,定容至 300 mL,pH 7.0,120 ℃ 灭菌 20 min,A与B分别灭菌后混合。
嗜铁素培养基[8]:A: 60.5 mg 铬天青S溶于 50 mL去离子水;10 mL三价铁溶液(1 mmol/L FeCl3·6H2O,10 mmol/L 盐酸为溶剂); 72.9 mg CTAB 溶于 40 mL去离子水;上述 3 个溶液混合定容至 100 mL, pH 调至中性,120 ℃ 灭菌 20 min。B: 30.24 g Pipes 加入 900 mL WA 培养基,pH 7.0,121 ℃灭菌20 min。A、B 液混合倒平板。
纤维素酶培养基[9]:蛋白胨 10 g,酵母粉10 g,羧甲基纤维素钠 10 g, NaCl 5 g, KH2PO41 g,琼脂 20 g,定容至 1000 mL,pH 7.0。
几丁质培养基[10]: 胶状几丁质 15 g, MgSO4·7H2O 0.5 g, FeSO4·7H2O 0.01 g, K2HPO40.7 g, KH2PO40.3 g,琼脂 20 g,定容至 1000 mL, pH 7.0。
Msgg培养基: 100 mmol/L 苯磺酸钠(MOPS)(pH 7.0), 50 μg/mL 络氨酸, 50 μg/mL 苯丙氨酸, 2 mmol/L 氯化镁, 700 μmol/L氯化钙, 50 μmol/L 三氯化铁, 50 μmol/L 氯化锌, 2 μmol/L VB1。
1.2 试验方法
1.2.1 菌液的制备 将在斜面试管中培养 1 d(28 ℃)的B1619 移至YPG培养液中,置于 28 ℃、180 r/min 振荡培养24 h。
1.2.2 生防菌株B1619产酶和次生代谢物的检测 蛋白质酶测定:在蛋白酶检测平板上放置 6 mm 滤纸片,滴加 5 μl菌液,每个处理重复 5 次。 28 ℃恒温培养 1~2 d观察,接菌的滤纸片周围产生透明圈则视为能产生蛋白质。
嗜铁素测定:在嗜铁素测定平板上放置 6 mm 滤纸片,滴加 5 μl 菌液,每个处理重复 5 次。 28 ℃恒温培养 3~7 d 后观察,接菌的滤纸片周围的培养基是否产生橘黄色晕圈,产生橘黄色晕圈则为可以产生嗜铁素。
纤维素酶测定:即在维素酶测定平板放置 6 mm滤纸片,滴加 5 μl菌液上,每个处理重复 5 次。28 ℃ 培养 3 d后,用 1 g/L 的刚果红染 1 h后,倒掉染液,用 1 mol/L的 NaCl 浸泡 1 h,观察有透明圈的则能产生纤维素酶。
几丁质酶检测:在几丁质酶检测平板上放置 6 mm滤纸片,滴加 5 μl菌液,每个处理重复 5次。 28 ℃恒温培养 3~7 d 后观察,接菌滤纸片周围的培养基是否产生透明圈。
1.2.3 生防菌株B1619 的生物膜观察 挑取 B1619 的单菌落接种至含有 4 mL LB培养液的试管在 28 ℃培养过夜。吸取 100 μl培养液接种至 12 孔板,每孔加入 4 mL含有 20 μg/mL 的刚果红的Msgg培养液,28 ℃培养 48 h后观察生物膜的形成情况;挑取生物膜至 2 mL EP管中放于 37 ℃温室培养箱中烘干 12 h,称量生物膜的干重。
1.2.4 碳源、氮源对生防菌株B1619 生长的影响 分别以 10 g/L 的蔗糖、麦芽糖、D-甘露醇、菜籽油、甘油、可溶性淀粉、玉米粉、藕粉、糯米粉替换 NA 培养基中的葡萄糖,其他成分不变,NA 作为对照,将不同碳源制成的培养基 pH调至 7.0,取在 28 ℃、 180 r/min 培养 24 h 的生防菌 B1619 菌液 1 mL于装液量为 100 mL NA培养液的 250 mL三角瓶中,将接种后的三角瓶置于 28 ℃、 180 r/min 振荡培养,48 h后采用稀释平板法计算活菌数。
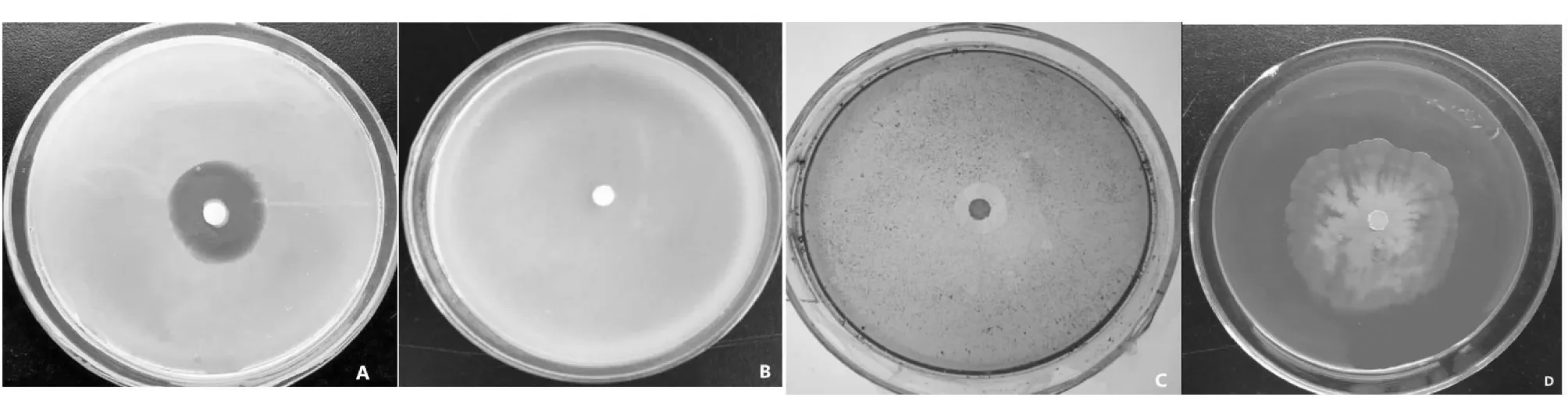
A:蛋白酶检测; B:几丁质酶检测; C:嗜铁素检测;D:纤维素酶检测.A: Detection of protease; B: Detection of chitinase; C: Detection of siderophore; D: Detection of cellulase图1 代谢分泌物检测结果Fig.1 Analysis of metabolism secretions
分别以 8 g/L 鱼粉、黄豆粉、胰蛋白胨、牛肉膏、(NH4)2SO4、NH4Cl、NH4NO3、蛋白栋、尿素替换 NA 中的牛肉膏和蛋白胨,其他成分不变,以NA培养基为对照,将不同氮源制成的培养基pH调至 7.0,其他过程同上。
1.2.5 微量元素、无机盐对生防菌株B1619生长的影响 在 NA 培养基中添加 0.01 g/L 的 天冬氨酸、甘氨酸、谷氨酸、丙氨酸、VB1、VB2、VB6、赤霉素和肌醇,以 NA 为对照,将添加不同微量元素制成的培养基pH调至7.0,其他过程同 1.2.4。
在 NA 培养基中添加 1 g/L 的 NaCl、MnSO4、CaCl2、KH2PO4、MgSO4、Na2CO3、ZnSO4、FeSO4、KNO3,以 NA 为对照,将添加不同微量元素制成的培养基pH调至7.0,其他过程同 1.2.4。
1.2.6 温度、pH对生防菌株B1619 生长的影响 取在 28 ℃、 180 r/min 培养 24 h 的生防菌 B1619 菌液 1 mL于装有 100 mL NA培养液的 250 mL 三角瓶中,分别置于 20、25、26、27、28、30、33、40 ℃共 8个温度梯度下 180 r/min 振荡培养, 48 h后采用稀释平板法计算活菌数。
NA培养液用 1 mol/L 盐酸或 1 mol/L 氢氧化钠调到 pH为 4.0、5.0、5.5、6.0、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.5、8.0、9.0 几个处理, 每个处理 4 瓶,由于高温灭菌后pH变化,取2瓶记录pH ,另2瓶在 28 ℃、180 r/min 培养 24 h 的 B1619 菌液 1 mL于装有 100 mL NA培养液的 250 mL三角瓶中,置于28 ℃、180 r/min 振荡培养,48 h后用稀释平板法计数。
1.2.7 生防菌株B1619的生长曲线 将在 28 ℃、180 r/min 培养 24 h的生防菌 B1619 液移 1 mL至装有 100 mL NA培养液的 250 mL三角瓶中,置于 28 ℃、180 r/min振荡培养,分别 在 4、8、12、16、20、24、28、32、36、40、44、48 h时用平板稀释法计数, 以不加菌液的培养基为空白对照,同时在8、16、24、28、32、36、40、44、48、52、56、60、64、68、72、76 h 时观察产芽孢率。
1.2.8 生防菌株B1619菌体和芽孢形态的电镜观察 取在28 ℃、180 r/min培养24 h的生防菌B1619菌液1 mL加入2 mL EP管中,5000 r/min,沉淀2~3 mm,去除上清,沉淀加PBS缓冲液混匀,吹打静泡10 min,离心重复4次,去除上清,沉淀与2 %~3 %戊二醛混匀,4 ℃冰箱过夜;48,72 h的处理同上;使用扫描电子显微镜ZX-01(EVO-LS10)10 000倍下观察菌体形态。
2 结果与分析
2.1 生防菌株B1619产酶和次生代谢物的检测结果
按照测定代谢分泌物的方法,对 B1619 的代谢分泌物进行了测定(图1),图1-A为透明圈,图1-D为透明圈,可得知 B1619 分泌蛋白酶纤维素酶和代谢物质嗜铁素,由图1-C为橘黄色晕圈,可知 B1619 也分泌代谢物质嗜铁素,图1-B为几丁质酶检测培养基,可知 B1619 不产生几丁质酶。
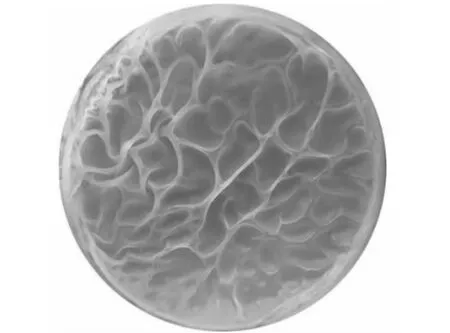
图2 B1619 的生物膜Fig.2 Pellicle of B1619
2.2 生防菌株B1619 的生物膜观察
24 h时,培养液表面形成少量膜状皱褶;48 h时,培养液表面形成紧密、坚固、厚实的生物膜,表面有波浪状凸起;由图 2 可得知,B1619 的菌株在Msgg培养液液相-空气交界处形成致密、厚实的生物膜; 称量干重得,B1619 的膜干重达到 10.3 mg。
2.3 碳源、氮源对生防菌株B1619生长的影响
由图3可获知,当用不同碳源替换NA培养基中的葡萄糖时,甘露醇、麦芽糖和玉米粉对 B1619 的生长促进作用大于葡萄糖,而蔗糖、可溶性淀粉、甘油对B1619的生长促进作用小于葡萄糖,菜籽油、藕粉对B1619的生长有抑制作用。其中甘露醇和麦芽糖对B1619的生长促进作用相对NA中的葡萄糖分别提高了80.0 %和39.0 %。
由图4可知,当用不同氮源替换NA培养基中的牛肉膏和蛋白胨时,牛肉膏、胰蛋白胨对B1619的生长促进作用大于NA中牛肉膏和蛋白栋混用,有机氮源蛋白栋、黄豆粉、鱼粉和无机氮源硝酸铵、氯化铵、硫酸铵、尿素对B1619的生长促进作用小于牛肉膏和蛋白栋,总体上,B1619对无机氮源的利用效率低于有机氮源,牛肉膏对B1619的生长促进作用相对NA中的牛肉膏和蛋白栋提高了32.5 %。

图3 碳源对B1619生长的影响Fig.3 Effects of carbon sources on the growth of B1619

图4 氮源对B1619 生长的影响Fig.4 Effects of nitrogen source on the growth of B1619

图5 微量元素对B1619 生长的影响Fig.5 Effects of trace elements on the growth of B1619
2.4 微量元素、无机盐对生防菌株B1619 生长的影响
由图5可知,在NA中添加微量元素时,其影响为Ala>VB1>肌醇>NA>赤霉素>VB6>Glu>VB2>Gly>Asp,其中Ala和VB1对 B1619 的生长有显著的促进作用,其菌含量分别比NA培养基提高了 155.5 %和 113.7 %,肌醇、赤霉素和VB6对 B1619 的生长作用不明显,Glu、Gly、Asp和VB2对 B1619 的生长存在抑制作用。
由图6可知,在NA培养基中添加无机盐时,其影响为MgSO4>CaCl2>NA>NaCl>Na2CO3>MnSO4>KH2PO4>KNO3>FeSO4=ZnSO4,其中MgSO4和CaCl2对 B1619 的生长有显著的促进作用,其菌含量分别比NA培养基提高了 42.9 %和 37.5 %,MnSO4、KH2PO4、KNO3对 B1619 的生长存在一定的抑制作用,添加FeSO4和ZnSO4的培养基上没有生长任何菌落,说明Fe2+和Zn2+对 B1619 的生长有毒害作用。
2.5 温度、pH对生防菌株B1619 生长的影响
由图7可知,随着温度的升高, B1619 的活菌含量呈现一个先上升后下降的趋势,在 20~27 ℃,活菌含量呈上升趋势, 28 ℃之后其活菌含量逐渐下降。 B1619 在 25~27 ℃之间生长良好, 27 ℃下其生长周期较短,故取 27 ℃作为其最适生长温度。
由图 8 可得,pH 在 4.5~8.374,生防菌 B1619 均能生长,pH 在 5.6~6.7 ,菌体含量最高,其最适pH为 5.9。

图6 无机盐对B1619 生长的影响Fig.6 Effects of inorganic salts on the growth of B1619
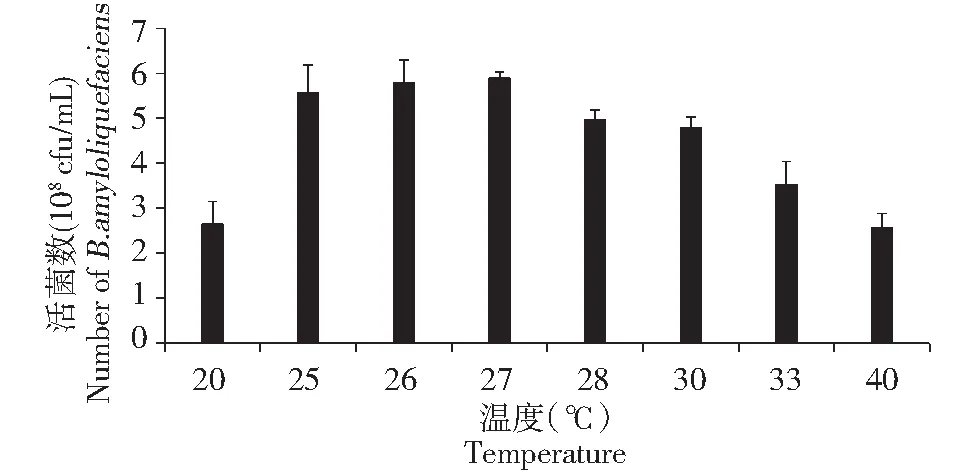
图7 温度对B1619 生长的影响Fig.7 Effects of temperature on the on the growth of B1619

图8 pH 对B1619 生长的影响Fig.8 Effects of pH on the growth of B1619
2.6 生防菌株B1619 的生长曲线
由图 9 可知,生防菌 B1619 在24 h前处于对数生长期,生长速度很快; 24 h时达到菌体数量达到最大值, 24~48 h菌体数量稳定,无明显变化趋势;B1619在24 h之前产芽孢率几乎为零,培养24 h后开始产生芽孢,随着时间增加芽孢数量增加,培养72 h后芽孢数量达到最大,约为90 %以上;综合B1619的生长曲线和芽孢产生曲线,24 h处于B1619对数生长期末期,此时产生的芽孢数量少,从24 h之后芽孢数量上升,到48 h芽孢率大约达到50 %。
2.7 生防菌株B1619菌体和芽孢形态的电镜观察
在电镜下分别观察24、48、72 h B1619的菌体形态,可以发现24 h菌体(图11-A)端部未产生芽孢,48 h菌体(图11-B)端部凸起,芽孢产生,72 h(图11-C)已经完全形成芽孢。
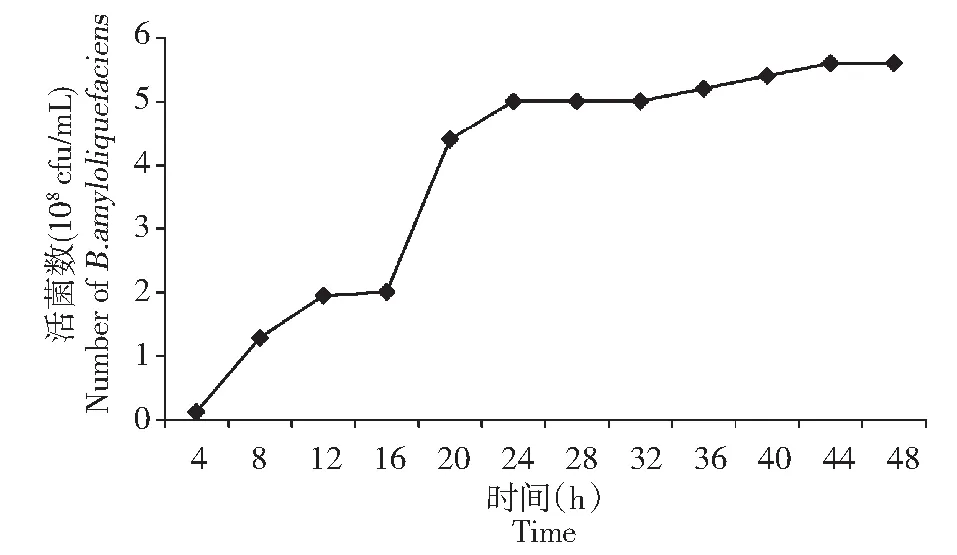
图9 B1619 的生长曲线Fig.9 The growth curve of B1619
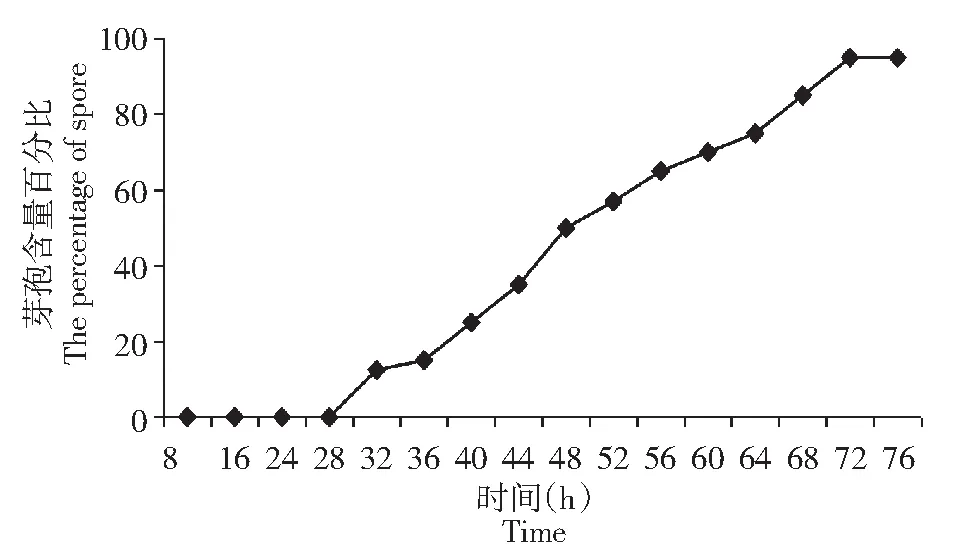
图10 B1619 的产芽孢率Fig.10 The sporulation rate of B1619
3 讨 论
解淀粉芽胞杆菌最初是由 Priest等发现鉴定的,模式菌株为ATCC23350,1980 年之前鲜有研究解淀粉芽胞杆菌的报道。最初解淀粉芽孢杆菌属于枯草芽孢杆菌,直到1967年之后才正式从枯草芽孢杆菌中分离出来[11-13]。解淀粉芽孢杆菌和枯草芽孢杆菌表型极相似,很容易混淆,并且同源性高,仅从16S rRNA序列同源性上很难将它们区分开来,所以,长期以来一直将解淀粉芽孢杆菌和枯草芽孢杆菌归属于同一个的种,直到1967年Welker等人才将其从枯草芽孢杆菌中分离为独立物种[13]。随着生物技术的发展,目前可以通过多种基因(如:gyrA、cheA等)进行枯草芽孢杆菌和解淀粉芽孢杆菌的分类研究[14-15]。还有报道表明,可以利用基因yyaR、yyaO、tetL、tetB排列顺序的差异,对这两个种的菌株进行分类鉴定[15]。目前绝大多数的生防菌均为解淀粉芽孢杆菌。

A:24 h,B:48 h;C:72 h图11 B1619 的菌体形态变化Fig.11 The mycelial morpHology change of B1619
解淀粉芽孢杆菌主要通过营养和空间位点的竞争、分泌抗菌物质、溶菌作用和促进植物生长等几个方面来对植物进行保护[16-18]。蛋白酶、纤维素酶等酶类可以降解真菌发育需要的物质,破坏真菌生长蛋白酶可以通过降解各种蛋白类物质破坏真菌生长,几丁质酶可通过降解真菌菌丝生长末端新合成的几丁质而破坏菌丝端部生长,达到抑制病原真菌生长的目的[19]。纤维素酶中的β-1,3-葡聚糖酶直接攻击真菌菌丝上的葡聚糖,抑制真菌的生长[19-20]。嗜铁素通过配基的螯合使环境中的铁浓度降低,从而使病原微生物缺铁而不能生长繁殖,进而达到控制植物病害的目的[21]。本试验发现 B1619 分泌产生蛋白酶,纤维素酶和嗜铁素,不产生几丁质酶。B1619的代谢物测定表明,B1619对病原菌具备良好抑制作用的物质基础,有研发成生物杀菌剂的潜力。
近年来研究表明,芽孢杆菌可在植物根部群集,形成一层保护屏障,起到保护植物免受病原菌侵染、促进植物生长的作用。芽孢杆菌的群集运动在定殖和保护屏障的形成中发挥关键作用,而芽孢杆菌的群集运动与其生物膜之间有着密切的相关性[22]。本试验中观察到 B1619 在Msgg上能够形成了紧密、厚实的生物膜,这种生物学特性有利于B1619群集在植物根围,有利于其在土壤中定植,发挥生防效果。
生物杀菌剂中含菌量的高低直接影响生防菌的定殖能力及其生防效果,因此,了解生防菌的生物学特性,探明生防菌适宜的培养条件,这对于将来产业化生产出含菌量高的生物农药产品具有重要意义。本研究通过单因素试验,我们发现不同的碳源,氮源,无机盐,微量元素以及温度和pH对 B1619 的生长均具一定影响。试验表明,B1619 菌株在绝大多数速效碳源下生长良好,而在几种缓效碳源中,只有玉米粉中生长正常,藕粉、可溶性淀粉、糯米粉、菜籽油作为碳源时,该菌株生长量较小。这与章四平[23]等的研究结果相似。在筛选氮源的过程中,我们发现该菌对无机氮源的利用能力低于有机氮源。无机盐试验表明,Ca2+、Mg2+对 B1619 的生长有促进作用,而Fe2+、Zn2+对 B1619 的生长有强烈的抑制作用,在今后生防菌B1619推广应用过程中,应当避免与含有重金属离子的化肥或农药混用,防止生防效益降低。微量元素试验发现,丙氨酸、VB1对 B1619 的生长具有明显的促进作用,因此在B1619发酵过程中可以考虑适当加入这两种物质,以达到提高 B1619发酵液的含菌量。温度和pH试验发现,该菌的最适温度为 27 ℃,从 30 ℃以后该菌的生长量显著降低,说明该菌不耐高温,同时该菌的最适pH为 5.9 ,说明该菌喜在偏酸的环境中生长。B1619 的生长曲线表明,生防菌B1619生长繁殖很快,在0~24 h内菌量繁殖具有较高的速率,处于对数生长时期,24 h后其菌量达到最大,随后24~48 h内菌量处于平稳。
4 结 论
B1619可以产生多种抑菌物质:蛋白酶、纤维素酶和嗜铁素,不产生几丁质酶;B1619具有紧密、厚实的生物膜,有利于其在植物根部的定殖;B1619对速效碳源的利用能力优于缓效碳源,对无机氮源的利用能力优于有机氮源,丙氨酸、VB1、Ca2+、Mg2+促进B1619的生长,而Fe2+、Zn2+对 B1619 的生长有强烈的抑制作用,在B1619的发酵过程中应注意此类物质的利用;B1619发酵的最适温度为27 ℃,最适pH 为5.9,其在0~24 h 具有较高的生长速率,48 h后菌体数量稳定;24 h后开始产生芽孢,到72h时芽孢数量达到最大。本试验通过对解淀粉芽孢杆菌 B1619 的主要生物学特性进行研究,得到了其较为适宜的生长条件,为以后生防菌B1619的产业化发酵生产和田间应用技术研究提供了科学依据。但是,这些适宜B1619生长的环境条件,对生防菌抗菌物质生长代谢的影响;以及多种因素对B1619生长的综合作用还有待于今后深入研究与分析。
[1]刘少杰,于立芝,毕美光,等.设施蔬菜土传病害的发生特点及综合防治[J]. 山东蔬菜,2003,23(4):33-34.
[2]陈志谊,刘邮洲,乔俊卿,等.利用芽孢杆菌生防菌防控土传病害引起的设施蔬菜连作障碍[J]. 中国蔬菜, 2012,14(15): 29-30.
[3]张 斌,杨晓云,陈志谊,等.江苏省3个番茄种植基地枯萎病菌种群数量监测及生防菌 B1619 的控病效果[J]. 西南农业学报,2015,28(6):2521-2526.
[4]杨晓云,张 斌,陈志谊,等. 4种常用杀菌剂对江苏省番茄枯萎病菌的毒力[J]. 植物保护,2016,42(1):208-213.
[5]戴秀华,张荣胜,陈志谊. 解淀粉芽胞杆菌Lx-11生物学特性研究[J]. 中国生物防治学报,2014,30(4):573-580.
[6]方中达. 植病研究方法[M]. 北京: 中国农业出版社,2007:132.
[7]Ghose T K.Measurement of cellulase activities [J]. Pure and Applied Chemistry,1987,5(9): 257-268.
[8]Shin S H, Lim Y, Lee S E, et al. CAS agar diffusion assay for the measurement of sideropHores in biological fluids[J]. Journal of Microbiological Methods,2001,2(4): 89-95.
[9]Ghose T K. Measurement of cellulase activities[J].Pure & Applied Chemistry, 1987, 4(5): 257-268.
[10]日本土壤生物研究会,叶维青,等译. 土壤微生物实验法[M]. 北京: 科学出版社, 1983.
[11]Priest F G, Goodfellow M, Shute L A, et al.Bacillusamyloliquefacienssp. nov., norn. rev.[J]. International Journal of Systematic Bacteriology, 1987, 37(1): 69-71
[12]Welker N E, L.L.Campbell.Comparison of the a-amylase ofBacillussubtili,Bacillusamyloliquefaciens.[J]. Journal of Bacteriology,1967,94(4):1131-1135.
[13]Welker N E, L.Leon Campbell. Unrelatedness of Bacillus amyloliquefaciens and Bacillus subtilis[J]. Journal of Bacteriology,1967, 94(4):1124-1130.
[14]喻国辉,牛春艳,陈远凤,等. 利用16S rDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J]. 中国生物防治,2010, 26(2): 160-166.
[15]权春善,王军华,徐洪涛,等. 一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].微生物学报,2006,46(1):7-12.
[16]宋卡魏,王星云,张荣意. 培养条件对枯草芽孢杆菌 B 68芽孢产量的影响[J]. 中国生物防治,2007,23(3):255-259.
[17]Luo C P, Liu X H, Zhou H F, et al. Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis inBacillussubtilis916 and their phenotypic functions[J].Applied and Environmental Micronmental Microbiology, 2015, 81(1): 422-431.
[18]Cawoy H, Debois D, Franzil L, et al. Lipopeptides as main ingredients for inhibition of fungal phytopathogens byBacillussubtilisamyloliquefaciens[J].Microbial Biotechnology, 2015, 8(2): 281-295.
[19]Nam J, Yun H, Kim J, et al. Isolation and NMR analysis of antifungal fengycin A and B fromBacillusamyloliquefacienssubsp.plantarumBC32-1[J].Bulletin of the Korean Chemical Society, 2015, 36(5): 1316-1321.
[20]Gond S K, Bergen M S, Torres M S, et al. EndophyticBacillusspp. produce antifungal lipopeptides and induce host defence gene expression in maize[J].Microbiological Research, 2015, 172(1): 79-87.
[21]王焰玲,秦 敏,周 青,等.抑制稻瘟病菌生长的几丁质酶产生菌的分离和鉴定[J]. 植物保护学报,1998, 25(4):289-294.
[22]程洪斌,刘晓桥, 陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J]. 上海农业学报, 2006, 22(1): 109-112.
[23]章四平,刘圣明,王建新,等.枯草芽孢杆菌生防菌株 NJ18的发酵条件优化[J]. 南京农业大学学报, 2010,33(2):58-62.
(责任编辑 李 洁)
Study on Biological Characteristics of B1619 Preventing Soil-borne Diseases of Facility Vegetable
WANG Lu-yao1,2, GAN Ying1, LIU Yong-feng1, CHEN Zhi-yi1,2*
(1. Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Jiangsu Nanjing 210014, China;2. College of Plant Protection, Nanjing Agricultural University, Jiangsu Nanjing 210014, China)
【Objective】Strain B1619 can prevent soil-borne diseases of facility vegetables. In this article, we studied its biological characteristics in respects of metabolite species, biofilm morphology, temperature, pH, carbon nitrogen sources, trace elements, inorganic salt and growth curve. 【Method】Dilution-plate method was used to find out the best culture conditions and Msgg medium was used for the observation of its biofilm. 【Result】Results showed there were halos in the protease medium, siderophore medium and cellulase medium, but no the phenomenon in the chitinase medium;B1619 can produce protease, cellulose and iron, B1619it also can form a dense and thick biofilm, at the same time, 27 ℃, pH 5.9, mannitol, beef extract, Ala, CaCl2and MgSO4were optimum for its growth. Logarithmic growth was at the first 24 hours, the cell number reach maximum at 24 h and its growth keep stable after 24 48 hours, it mainly keeps thalli before 24 hours while producing spores after 24 hours, the spore number reach maximum at 72 hours and its sporulation rate was high, even over 90 %. 【Conclusion】B1619 can produce cellulase, siderophore and protease. Inorganic nitrogen , available carbon source and suitable trace elements are beneficial to the growth of B1619, suitable temperature, pH also make difference. The growth of B1619 reach the dynamic balance after 48 hours.In addition, we observe the cell morphology changes of B1619 at 24,48 and 72 h by scanning electron microscopy.
Bio-control bacteria strain;B1619; Biological characteristics
1001-4829(2017)6-1350-08
10.16213/j.cnki.scjas.2017.6.020
2016-08-11
江苏省农业科学院科技自主创新资金[CX(14)2128];江苏省农业科技自主创新资金[CX(12)1004-6]
王璐瑶(1993-) ,女,山东泰安人,硕士研究生,主要从事植病生防研究,E-mail:578835259@qq.com;*为通讯作者:陈志谊,Tel:025-84390393;E-mail: chzy84390393@163.com。
S476
A

