甘薯茄镰孢菌的生物学特性及其致病条件研究
薛陈心,高波,马娟,李秀花,陈书龙,王容燕*
(1.河北省农林科学院 植物保护研究所,河北 保定 071000; 2.河北省农业有害生物综合防治工程技术研究中心,河北 保定 071000; 3.农业部华北北部作物有害生物综合治理重点实验室,河北 保定 071000)
甘薯茄镰孢菌的生物学特性及其致病条件研究
薛陈心1,2,3,高波1,2,3,马娟1,2,3,李秀花1,2,3,陈书龙1,2,3,王容燕1,2,3*
(1.河北省农林科学院 植物保护研究所,河北 保定 071000; 2.河北省农业有害生物综合防治工程技术研究中心,河北 保定 071000; 3.农业部华北北部作物有害生物综合治理重点实验室,河北 保定 071000)
[目的]明确甘薯腐烂溃疡病病原菌茄镰孢菌(Fusariumsolani)的生物学特性及其致病条件。[方法]采用菌丝生长速率法、菌丝称重法、孢子萌发计数法和人工接种薯块的方法,对影响病原菌生长和侵染的碳源、氮源、pH值和温湿度条件进行了研究。[结果]碳源中的葡萄糖、乳糖和氮源中的蛋白胨、硝酸钾促进菌丝生长作用较强,碳源中的麦芽糖和氮源中的蛋白胨促进菌丝生长量作用较强,碳源中的乳糖、葡萄糖和氮源中的硝酸钾、甘氨酸、蛋白胨处理的孢子萌发率较高;菌丝生长的最适pH为5~6,最适温度为28 ℃;孢子萌发的最适温度为25 ℃,致死温度为54 ℃处理10 min;在9~19 ℃温度范围内,9 ℃处理的菌丝生长最慢,24 h孢子不能萌发;在30%~70%相对湿度范围内,30%相对湿度的病害发病程度较轻;在11~19 ℃范围内,11 ℃处理病害发病程度较轻。[结论]综合分析,甘薯茄镰孢菌菌丝生长和孢子萌发的最适碳源为乳糖和葡萄糖,最适氮源为蛋白胨和硝酸钾;菌丝在28 ℃条件下生长最快,最适pH值为5~6;孢子在25 ℃萌发率最高,致死温度为54 ℃处理10 min。在模拟贮藏温湿度条件下,随着温度和湿度的降低,孢子萌发和菌丝生长受到抑制,病害发展显著减轻。
茄镰孢菌; 生物学特性; 甘薯; 腐烂溃疡病
甘薯(IpomoeabatatasL.)采后病害主要包括黑斑病、软腐病、细菌性腐烂病等,每年由于烂窖造成的减产达20%以上,是制约鲜食甘薯生产的主要因素[1]。2014年,我国首次报道了雄县发现的由茄镰孢菌(Fusariumsolani)引起的甘薯镰孢菌根腐烂和茎溃疡病(Fusarium Root Rot and Stem Canker),简称甘薯腐烂溃疡病[2]。通过对河北省甘薯腐烂溃疡病发生情况调查发现,该病害在雄县、易县、藁城、元氏、保定等河北省甘薯主产区普遍发生,影响了窖藏甘薯的品质且造成严重的经济损失;此外,在对育秧田病害的调查中发现该病害对育秧田薯秧的侵染[3],也是威胁健康种苗生产的主要病害。
镰孢菌(Fusarium)是国内外植物病理学研究的热点,种群复杂,寄主范围广泛。关于镰孢菌生物学特性的研究报道较多,但是不同种类镰孢菌之间,以及不同寄主作物间的同种镰孢菌之间,对碳源、氮源、pH值等的需求呈现差异[4~6]。山药茄镰孢菌最适碳氮源为蔗糖和蛋白胨,最适pH为5;辣椒茄镰孢菌最适pH为7;马铃薯硫色镰孢菌最适碳源为葡萄糖,氮源为硝酸钠和蛋白胨,最适pH为8。甘薯在贮藏期间,块根所处环境温湿度相对可控,因此,研究病原菌对温湿度环境条件的需求,对于制定贮藏期病害科学防治措施具有重要意义。
为了明确甘薯茄镰孢菌的生物学特性以及致病条件,本文从碳源、氮源、pH值及温度等方面对甘薯腐烂溃疡病病原菌的生物学特性开展了研究,并观察了不同低温和湿度条件下病原菌生长和病害发生发展情况,为进一步认识甘薯腐烂溃疡病的发生规律和有效地控制该病害提供理论依据。
1 材料与方法
1.1 供试培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[3]:去皮马铃薯200 g、琼脂20 g、葡萄糖20 g,水1 000 mL。
查氏(Czapek)固体培养基[4]:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,琼脂20 g,水1 000 mL。
查氏(Czapek)液体培养基不加琼脂。
1%水琼脂(WA):琼脂1 g,水100 mL。
1.2 供试菌株
茄镰孢菌(Fusariumsolani)X14011菌株分离自河北雄县贮藏窖薯块。按照常规方法在PDA培养基上分离并纯化[7],依照柯赫氏法则[7]接种到龙薯9号薯块上,测定其致病性,然后将康乃馨叶片水琼脂培养基(CLA)培养14 d得到的大孢子放入15%甘油中,保存在-80 ℃冰箱中。将X14011菌种接种在PDA平板上,25 ℃黑暗培养5 d,用于菌丝生长试验;培养7 d后用无菌蒸馏水冲洗菌落表面的孢子,4层纱布过滤,血球计数板计数,稀释成1×106个·mL-1的悬浮液,用于孢子萌发和薯块接种试验。
1.3 仪器
相差显微镜(Nikon 80i),体视显微镜(Leica,MC170HD),光照培养箱(GXZ2300B),Bio Multi Incubator人工气候箱(日本,LP-80CCFL-6CTAR)。
1.4 茄镰孢菌营养生长的影响因素
1.4.1 碳源对茄镰孢菌菌丝生长及菌丝体干重的影响
用与蔗糖等量的葡萄糖、可溶性淀粉、羧甲基纤维素钠、果胶、麦芽糖、果糖和乳糖为碳源配制固体和液体Czapek培养基,对照培养基不加碳源。固体培养基制成平板(90 mm)。从PDA培养5 d的病原菌菌落边缘打取直径5 mm的菌饼,菌丝面向下接种于上述培养基中央,25 ℃黑暗培养,5 d后测量各处理的菌落直径(十字交叉法),并观察菌落生长情况。试验设5次重复。
250 mL三角瓶装100 mL液体培养基,灭菌后晾至室温,每瓶接种5 mm菌饼5个,25 ℃,80 r·min-1振荡培养7 d。用已知重量的滤纸(双圈定性滤纸,15 cm)过滤,鼓风干燥箱80 ℃,烘干2 h,称重计算茄镰孢菌菌丝体干重。
1.4.2 氮源对茄镰孢菌菌丝生长及菌丝体干重的影响
用与硝酸钠等量的硝酸钾、硝酸铵、氯化铵、硫酸铵、草酸铵、蛋氨酸、亮氨酸、半胱氨酸、甘氨酸、谷氨酸、苯丙氨酸、蛋白胨为氮源配制固体和液体Czapek培养基,对照培养基不加氮源。接种培养及菌落直径测量、菌丝体干重测定同1.4.1。
1.4.3 pH值对甘薯茄镰孢菌菌丝生长的影响
用1 mol·L-1的NaOH和HCl溶液调整Czapek固体培养基初始pH值为4、5、6、7、8、9、10,灭菌后制成平板,接种培养及菌落直径测量同1.4.1。
1.4.4 温度对甘薯茄镰孢菌菌丝生长的影响
以Czapek培养基制成平板,接种直径5 mm菌饼后,分别放置在16、20、25、28、30和35 ℃恒温培养箱,5 d暗培养后测量菌落直径,并观察菌落生长情况,每处理重复5次。
1.5 茄镰孢菌分生孢子萌发的影响因素
1.5.1 碳源对分生孢子萌发的影响
碳源(同1.4.1)分别称取0.16 g,溶解在8 mL蒸馏水中,以水为对照,高温高压灭菌。取50 μL各碳源水溶液涂布于1%水琼脂平板上,再加入10 μL孢子悬浮液,28 ℃暗培养5 h,试验设3次重复,显微镜观察孢子100个左右,孢子萌发以芽管长度大于分生孢子长度2倍为标准,计算孢子萌发率。孢子萌发率/%=萌发孢子数/观察总孢子数*100。
1.5.2 氮源对分生孢子萌发的影响
氮源(同1.4.2)分别称取0.16 g,溶解在8 mL蒸馏水中,以水为对照,高温高压灭菌。取50 μL各氮源水溶液涂布于1%水琼脂平板上,再涂布10 μL孢子悬浮液,28 ℃黑暗培养5 h,试验设3次重复,显微镜观察,计算孢子萌发率。
1.5.3 温度对分生孢子萌发的影响
1 mL孢子悬浮液涂布于WA平板,分别置于10、15、20、25、28、30、35和40 ℃黑暗培养,5 h后镜检,试验设3次重复,计算孢子萌发率。
1.5.4 甘薯茄镰孢菌分生孢子致死温度
将装有1 mL孢子悬浮液的Eppendorf管分别置于48、49、50、51、52、53、54、55和56 ℃恒温水浴锅中处理10 min,颠倒混匀2次,立即冰上冷却,再将孢子液全部移至PDA平板上,25 ℃黑暗培养,7 d后观察病原菌生长状况,试验设3次重复。
1.6 低温对茄镰孢菌菌丝生长和孢子萌发的影响
PDA平板(90 mm)接种直径5 mm菌饼后,放置在9、11、13、15、17和19 ℃人工气候箱内,7 d和14 d后测量菌落直径,试验设3次重复。
取孢子液涂布于WA平板上,放置在9、11、13、15、17和19 ℃人工气候箱内,18 h和24 h后镜检,计算孢子萌发率。
1.7 不同低温和湿度对甘薯腐烂溃疡病发生的影响
挑选健康大小均匀的龙薯9号薯块,流水冲洗后,0.05% NaClO表面消毒5 min,晾干,在无菌条件下,薯块中央位置针刺伤口5 mm深,接种2 μL孢子液,装入无菌纸袋,放置在人工气候培养箱不同温度和湿度的培养室中保存。在15 ℃条件下,采用不同表面积的水盆调整相对湿度条件为30%、50%和70%;在60%湿度的条件下,设置11、15和19 ℃不同温度处理,第7、14、21、35 天检测病斑直径。每个处理接种5块薯块,试验设3次重复。
1.8 数据分析
使用统计软件DPS(7.05)对试验数据进行Duncan方差分析,检验P<0.05差异显著性。
2 结果与分析
2.1 碳源对菌丝生长、菌丝体干重和分生孢子萌发的影响
在所有供试碳源固体培养基上,X14011菌株均能生长,但对不同碳源的利用能力存在差异(图1)。在葡萄糖、乳糖和麦芽糖培养基上,菌丝生长较快且厚密,与对照差异不显著(P<0.05);在果胶、蔗糖和可溶性淀粉中菌丝生长较慢些;在羧甲基纤维素钠和果糖中生长最慢。所有供试碳源的液体培养基中,除羧甲基纤维素钠外均能增加菌丝体干重。在以麦芽糖和可溶性淀粉为碳源的培养基中,菌丝体产量最高,为对照的4.8倍和4.5倍。在葡萄糖、果糖和乳糖液体培养基中菌丝生长量次之。培养5 h后茄镰孢菌分生孢子在乳糖溶液中萌发率显著高于其它处理,达86%,在葡萄糖、果糖、果胶、羧甲基纤维素钠、蔗糖和麦芽糖中的萌发率次之,在53%~78%间,显著高于对照(48%)。综上所述,乳糖和葡萄糖为甘薯茄镰孢菌萌发生长的最佳碳源。

图1 不同碳源对F. solani菌丝生长、干重和孢子萌发的影响Fig.1 Effect of different carbon sources on hyphal growth, mycelium dry weight and conidial germination of Fusarium solani 注:C1葡萄糖;C2麦芽糖;C3果糖;C4可溶性淀粉;C5乳糖;C6羧甲基纤维素钠;C7果胶;C8蔗糖Note:C1 Glucose; C2 Maltose; C3 Fructose; C4 Soluble starch; C5 Lactose; C6 Sodium carboxymethyl cellulose; C7 Pectin; C8 Sucrose

图2 不同氮源对F. solani菌丝生长、干重和孢子萌发的影响Fig.2 Effect of different nitrogen sources on hyphal growth, mycelium dry weight and conidial germination of Fusarium solani 注:N1硝酸钾;N2硝酸铵;N3氯化铵;N4硫酸铵;N5草酸铵;N6蛋氨酸;N7亮氨酸;N8半胱氨酸;N9甘氨酸;N10谷氨酸;N11苯丙氨酸;N12蛋白胨;N13 硝酸钠Note:N1 Potassium nitrate;N2 Ammonium nitrate; N3 Ammonium chloride; N4 Ammonium sulfate; N5 Ammonium oxalate; N6 Methionine; N7 Leucine; N8 Cysteine; N9 Leucine; N10 Glutamic acid; N11 Phenylalanine; N12 Peptone;N13 Sodium nitrate
2.2 氮源对菌丝生长、菌丝体干重和分生孢子萌发的影响
病原菌对不同氮源的利用情况差异较大(图2)。固体培养基上,以蛋白胨和硝酸钾为氮源时,能显著促进甘薯茄镰孢菌菌丝生长,菌丝浓密,长势健壮;其次为硝酸钠、蛋氨酸、亮氨酸、甘氨酸和苯丙氨酸,较对照生长健壮,菌丝生长亦显著高于对照;草酸铵、硫酸铵、半胱氨酸、氯化铵和硝酸铵处理的菌丝生长直径显著低于对照,但比对照生长健壮;对照菌丝稀疏,长势不良。液体培养基中,蛋白胨明显优于其它氮源,菌丝体干重为对照的4.7倍。甘氨酸和谷氨酸中菌丝生长量次之,为对照的3.3和3.2倍。在另外10种氮源培养基中,菌丝体生长量亦显著高于对照。培养5 h后分生孢子在硝酸钾中萌发率最高,达88%,其次为甘氨酸和蛋白胨,分别为80%和77%,在硝酸钠、氯化铵、亮氨酸、草酸铵和硝酸铵中的萌发率亦显著高于对照。综上所述,蛋白胨和硝酸钾为甘薯茄镰孢菌孢子萌发和菌丝生长的最佳氮源。
2.3 pH值对茄镰孢菌菌丝生长的影响
病菌在培养基初始pH值为4~10范围内均能生长(图3),最适pH为5~6,在pH为5的条件下5 d菌落直径可达57 mm,在pH为6的条件下5 d菌落直径可达56.2 mm。
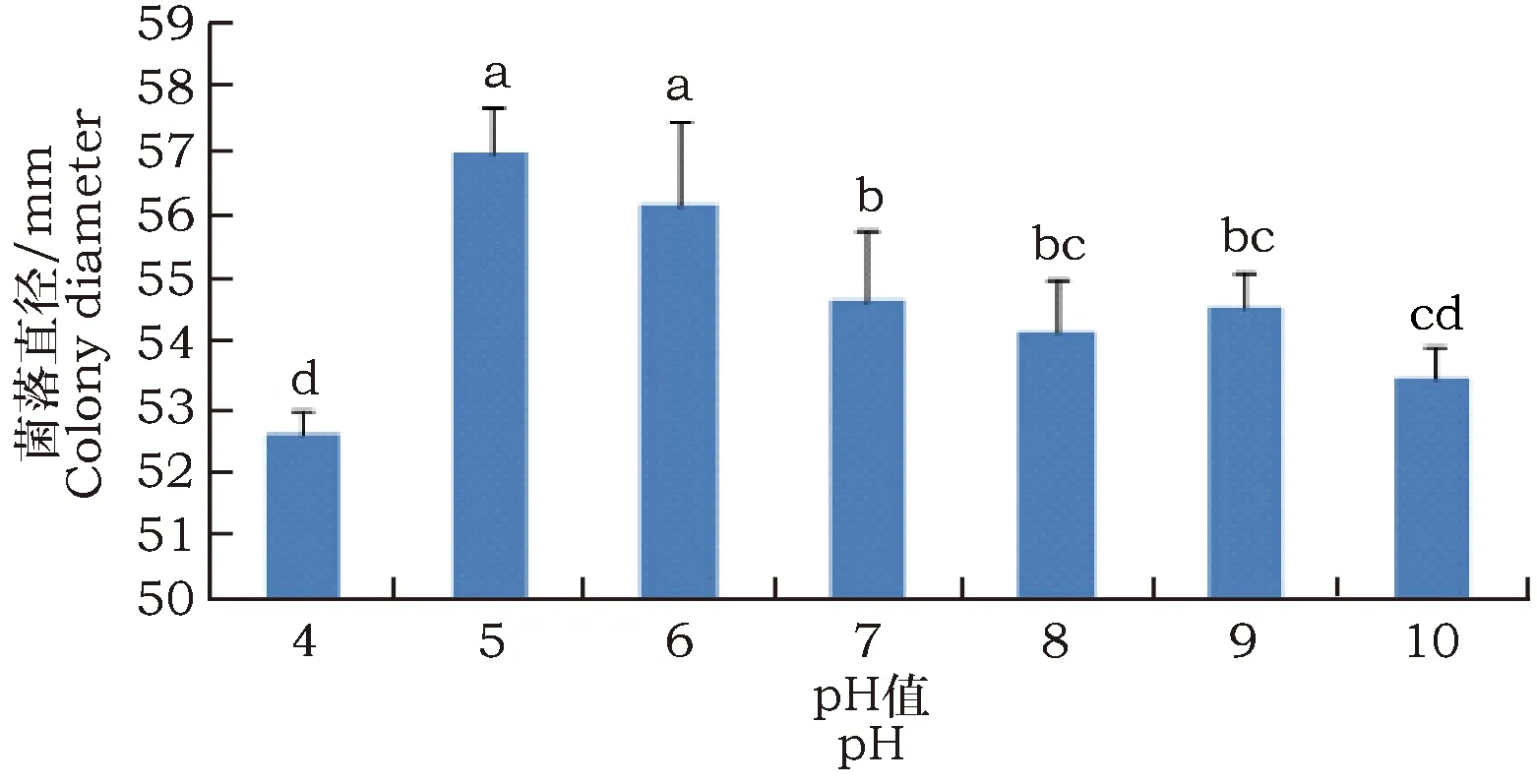
图3 pH值对F. solani菌丝生长的影响Fig.3 Effect of pH value on hyphal growth ofFusarium solani
2.4 温度对甘薯茄镰孢菌菌丝生长的影响
由图4可见,病菌在16~35 ℃范围内均可生长,最适菌丝生长温度为28 ℃,5 d菌落直径达73 mm,与其它温度处理的菌落直径差异显著;其次是25 ℃,菌落直径可达65 mm;在16 ℃低温或35 ℃高温条件下菌落生长受到显著抑制。
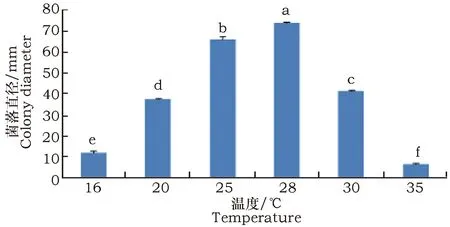
图4 温度对F. solani菌丝生长的影响Fig.4 Effect of temperature on hyphal growth ofFusarium solani
2.5 温度对茄镰孢菌分生孢子萌发的影响
分生孢子培养5 h后,在10~35 ℃范围内均有孢子萌发,25 ℃处理的孢子萌发率显著高于其它处理,可达76.4%,28 ℃次之,萌发率为48%。10~20 ℃萌发率显著低于25~35 ℃高温处理,低温不利于甘薯茄镰孢菌的孢子萌发。

图5 温度对F. solani菌丝分生孢子萌发的影响Fig.5 Effect of temperature on conidial germination rate ofFusarium solani
2.6 甘薯茄镰孢菌分生孢子致死温度测定
病原菌分生孢子液在48~56 ℃恒温水浴中处理10 min后,在PDA培养基上培养7 d后,48~53 ℃处理均能形成菌落,而在54 ℃处理后,孢子不能萌发,不能形成菌落。由此可见,甘薯茄镰孢菌孢子的致死温度为54 ℃处理10 min。
2.7 不同低温和湿度对菌丝生长和分生孢子萌发的影响
在9~19 ℃温度范围内,病原菌分生孢子萌发率存在显著差异,温度越低萌发率也越低,9 ℃处理24 h的孢子,未见孢子萌发,11 ℃处理萌发率仅为5.5%(表1)。
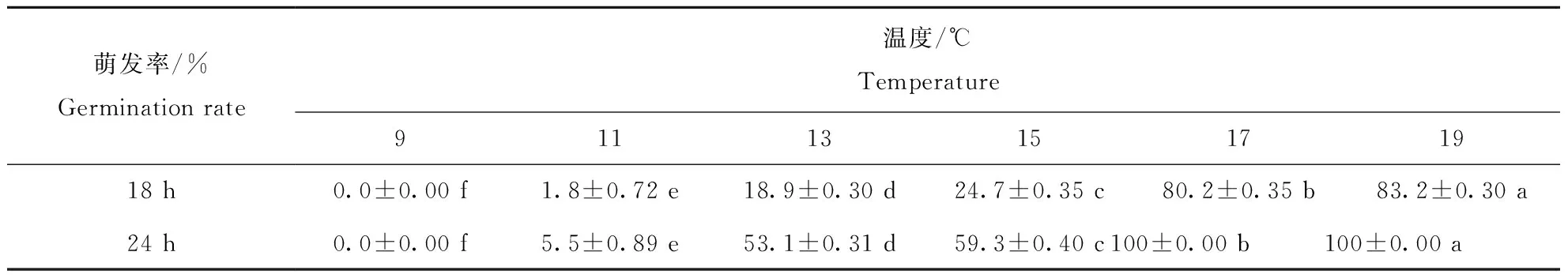
表1 不同低温条件下茄镰孢菌分生孢子萌发情况Table 1 Effect of low temperature on the conidial germination rate of Fuasarium solani
注:同行不同字母表示差异极显著(P<0.05)。下同。
Note:Different letters show significant difference at the 0.05 level in the same row. The same below.
在上述温度条件下,病菌菌丝生长存在显著差异。培养7 d,9 ℃菌落直径仅9 mm,19 ℃菌落直径40 mm,比9 ℃的大4.4倍;培养14 d,菌落直径相应的增大1倍,9 ℃仍然最小,19 ℃最大(表2)。因此,菌丝生长随着温度的降低而显著变慢,随着时间的延长而不断延展。
2.8 甘薯腐烂溃疡病的发病条件
模拟储藏温湿度条件,在15 ℃接种后7 d左右,不同湿度条件下均出现可见病斑;接种后14 d,70%相对湿度下病斑显著大于30%和50%相对湿度;但到接种后35 d,病斑大小无显著差异(表3)。因此,较高的空气相对湿度有利于腐烂溃疡病病斑早期形成和发展。

表2 不同低温条件下茄镰孢菌菌丝的生长情况Talbe 2 Effect of low temperature on the colony growth of Fusarium solani
表3 不同湿度条件下茄镰孢菌对甘薯的侵染作用(T:15 ℃)
Table 3 Effect of storage relative humidity on theFusariumsolaniinfectecd on sweetpotato root (T:15 ℃)

相对湿度/%Relativehumidity病斑直径/mmDecaydiameter7d14d21d35d304.510.5±1.17b15.4±3.00b25.6±5.21a5009.2±1.04ab13±1.90ab23.8±3.63a70511.3±0.76a16.3±1.25a26.7±2.44a
在相对湿度60%时,不同温度条件,接种后7 d,仅19 ℃处理出现可见病斑;接种后14 d和21 d,病斑大小差异显著,温度越低,病斑越小;接种后35 d,11和15 ℃处理病斑大小差异不显著,19 ℃处理病斑显著高于前两者(表4)。因此,在11~19 ℃范围内,温度越高、湿度越大越有利于腐烂溃疡病病斑的形成和发展。
表4 不同低温条件下茄镰孢菌对甘薯的侵染作用(RH60%)
Table 4 Effect of storage temperature on theFusariumsolaniinfectecd on sweetpotato root (RH60%)
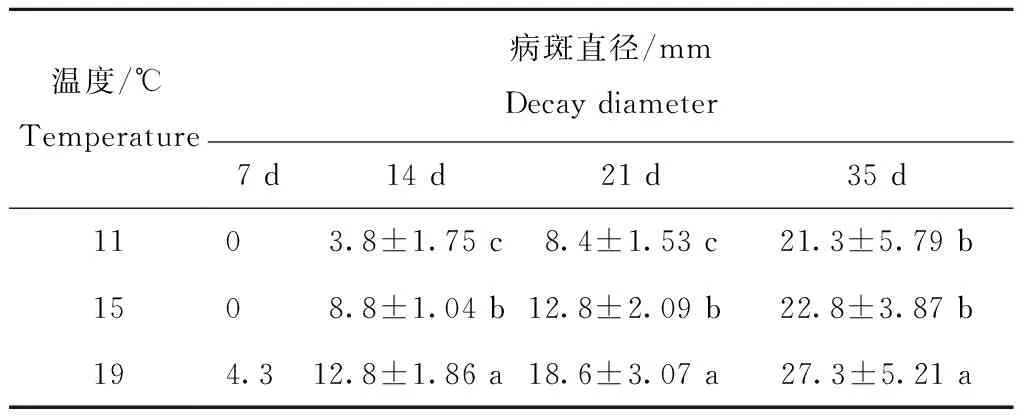
温度/℃Temperature病斑直径/mmDecaydiameter7d14d21d35d1103.8±1.75c8.4±1.53c21.3±5.79b1508.8±1.04b12.8±2.09b22.8±3.87b194.312.8±1.86a18.6±3.07a27.3±5.21a
3 讨论与结论
本文采用固体培养测量菌落直径(或生长速率)、液体培养测量菌丝体干重,并在琼脂平板上测定孢子萌发率,证明了不同碳氮营养、pH及温度等对甘薯茄镰孢菌的菌丝生长和分生孢子萌发存在显著影响。乳糖、葡萄糖和蛋白胨、硝酸钾分别为茄镰孢菌菌丝生长和孢子萌发的最佳碳源和氮源,它们能显著促进菌丝体干重的增加及孢子萌发率。菌丝体生长的最佳pH为5~6。菌丝在28 ℃下生长最佳,分生孢子在25 ℃萌发率最高,两者不一致。Neilsen等[8]研究显示F.solani在培养基上生长的最适温度是28 ℃,但病害发展最快是在24 ℃,与本研究的结果相一致。
杨冬静等[9]研究甘薯黑斑病菌的生物学特性认为,甘薯在育苗前将薯块进入55 ℃温水中10 min,可培育无病壮苗防控病害发生。在本项研究中,甘薯茄镰孢菌孢子的致死温度为54 ℃处理10 min,在育苗前进行合理的温汤浸种,可以有效防治苗期腐烂溃疡病的发生。
美国学者Arancibia等[10]研究显示,在甘薯采收前喷施乙烯利或洪水泛滥均可造成腐烂溃疡病的端腐症状的加重。收获后,采用“愈合”处理,即将薯块放置在相对湿度85%,30 ℃,7 d,可以加快伤口愈合减少病菌进入和水分损失,从而减轻该病害的发生。Silva等[11]研究表明F.solani病菌能在采收前侵染储藏薯块,潜伏在薯块内部的病菌遇到适宜的条件就会萌发致病。因此了解和调控甘薯采收前后环境条件,在生产和储藏时应避免利于病害发生发展的条件,对减少病菌侵染危害具有很大的潜在意义。从甘薯茄镰孢菌生物学特性的研究结果分析,该菌生长的温度及pH值范围较大,且高温高湿和酸性环境有利于菌丝生长和孢子萌发,因此应严格控制贮藏窖的温湿度等环境条件,在避免冻害发生和水分散失的前提下,适当降低储藏温度和湿度,可有效减轻病害的发生。
[1]Loebenstein G,Thottappilly G.The sweetpotato[M].New York:Springer Science and Business Media BV,2009:9-103.
[2]Wang RY,Gao B,Li XH,et al.First report ofFusariumsolanicausing Fusarium root rot and stem canker on storage roots of sweet potato in China[J].Plant Disease,2014,98(1):160.
[3]王容燕,高波,陈书龙,等.河北省甘薯镰孢菌腐烂与溃疡病的病原鉴定[J].植物保护学报,2016,43(2):241-247.
[4]沈丽淘,李平,王学贵,等.山药根腐病菌(Fusarium solani)的生物学特性[J].四川农业大学学报,2012,30(3):313-318.
[5]刘丽云,刘晓林,刘志恒,等.辣椒根腐病菌生物学特性研究[J].沈阳农业大学学报,2007,38(1):54-58.
[6]杨志敏,毕阳,李永才,等.马铃薯干腐病菌硫色镰孢的生物学特性[J].菌物学报,2012,31(4):574-583.
[7]方中达.植病研究法[M].北京:中国农业出版社,2007:62-145.
[8]Nielsen L W, Moyer J W. A Fusarium Root Rot of Sweetpotatoes[J]. Plant Disease,1979,63:400-406.
[9]杨冬静,孙厚俊,赵永强,等.甘薯黑斑病菌的生物学特性研究及室内药剂筛选[J].西南农业学报,2013,26(6):2336-2339.
[10]Arancibia R A, Main J L, Clark C A. Sweetpotato tip rot incidence is increased by preharvest applications of ethephon and reduced by curing[J]. Hort Technology,2013,23(3):288-293.
[11]Da Silva W L, Clark C A. Infection of sweetpotato byFusariumsolaniandMacrophominaphaseolinaprior to harvest[J]. Plant Disease,2013,97(12):1636-1644.
(编辑:韩志强)
Biological characteristics and pathogenic conditions ofFusariumsolani
Xue Chenxin1,2,3, Gao Bo1,2,3, Ma Juan1,2,3, Li Xiuhua1,2,3, Chen Shulong1,2,3, Wang Rongyan1,2,3*
(1.InstituteofPlantProtection,HebeiAcademyofAgriculturalandForestrySciences,Baoding071000,China; 2.IntegratedPestManagementCentreofHebeiProvince,Baoding071000,China; 3.KeyLaboratoryofIntegratedPestManagementonCropsinNorthernRegionofNorthChina,MinistryofAgriculture,Baoding071000,China)
[Objective]The aim of this study was to observe the biological characteristics and infection conditions ofFusariumsolani, causing Fusarium Root Rot and Stem Canker of sweetpotato(IpomoeabatatasL.[Methods]The mycelial growth rate, dry weight, germination rate and artificial inoculation on storage root were adopted to investigate the effects of carbon sources, nitrogen sources, pH and temperature and moisture on growth of hyphae and germination of conidia and infection of the tested fungus.[Result]Lactose, glucose, peptone and KNO3could dramatically increase the growth rate of mycelia; maltose and peptone could promote the dry weight of mycelia; lactose, glucose, KNO3, glycine and peptone could accelerate the germination of conidia. The most suitable pH and temperature for the growth of hyphae were pH 5~6 and 28 ℃, respectively; the temperature for the conidial germination was 25 ℃. The conidial lethal temperature was 54 ℃ for 10 minutes. From tested 9 ℃ to 19 ℃,the mycelia growth was the slowest and the conidia could not germinate after 24 h at the storage temperature of 9 ℃.The infection damages were milder at the relative humidity (RH) of 30% within the scope of RH 30%~70% and the temperature of 11 ℃ within the scope of 11~19 ℃.[Conclusion]The most suitable conidial germination and hyphal growth ofF.solani, carbon sources were lactose and glucose, nitrogen sources were peptone and KNO3. For the growth of hyphae, optimum pH and temperature were 5~6, 28 ℃, respectively. The suitable temperature for the conidial germination was 25 ℃. The conidial lethal temperature was 54 ℃ for 10 minutes. In the simulation of storage temperature and moisture, conidial germination and mycelial growth were suppressed, disease development was dramatically slowed down when the temperature and relative humidity decreased.
Fusariumsolani, Biological characteristics, Sweetpotato, Fusarium root rot and stem canker
2017-02-01
2017 -02-27
薛陈心(1981-),女(汉),河北定州人,硕士,研究方向:甘薯病虫害研究
*通信作者:王容燕,研究员,Tel:0312-5915369;E-mail: rongyanw@163.com
国家甘薯产业技术体系(CARS-11-B-08);河北省财政基本科研业务费项目(494-0401-JBN-6440)
S435.672
A
1671-8151(2017)08-0557-06

