土耳其斯坦叶螨对杀螨剂的抗性选育及解毒酶活力变化
王小军, 包建红, 张燕娜, 祝儒伟, 赵伊英
(石河子大学农学院, 石河子 832000)
土耳其斯坦叶螨对杀螨剂的抗性选育及解毒酶活力变化
王小军, 包建红, 张燕娜, 祝儒伟, 赵伊英*
(石河子大学农学院, 石河子 832000)
为探索土耳其斯坦叶螨的抗药性及其生化机理,在室内对敏感系土耳其斯坦叶螨分别用螺螨酯、甲氰菊酯和阿维菌素逐代处理,选育出抗性种群。结果表明,选育至15代,土耳其斯坦叶螨对螺螨酯、甲氰菊酯和阿维菌素的抗性指数分别达到268.63、37.98和112.68倍。分别测定敏感品系(SS)、抗螺螨酯(RS)、抗甲氰菊酯(RF)、抗阿维菌素(RA)品系的解毒酶活性显示,3种不同抗性品系相对SS品系的羧酸酯酶(CarE)、谷胱甘肽S-转移酶(GSTs)和多功能氧化酶(MFO)的比活力均有不同程度的提高,差异均达到显著水平(P<0.05)。其中,RF品系的MFO比活力上升最快,是SS品系的12.7倍;RA品系的MFO比活力次之,是SS品系的5.76倍;RS品系的3种解毒酶比活力均增长较慢,其中CarE比活力上升最慢,是SS品系的1.31倍。由此表明, CarE、GSTs、MFO的活性增大可促进土耳其斯坦叶螨对3种杀虫剂的抗性形成;螺螨酯的抗性增强可能与CarE关系甚微; MFO活性的增加可能与甲氰菊酯抗性升高密切相关;GSTs、MFO的活性升高可能是土耳其斯坦叶螨对阿维菌素产生抗性的主要原因。
土耳其斯坦叶螨; 抗性选育; 解毒代谢酶; 抗性机理
土耳其斯坦叶螨Tetranychusturkestani(UgarovetNikolski)分布于俄罗斯、哈萨克斯坦、美国、中东等地,在中国分布于新疆,其他地区未见报道[1-6]。土耳其斯坦叶螨可为害25科150多种植物,主要为害棉花、豆类、玉米、马铃薯、黄瓜、葡萄、草莓、梨、啤酒花等[7-9]。在新疆普遍发生,为北疆棉花害螨优势种群,也是果树、蔬菜的主要害螨。土耳其斯坦叶螨繁殖速率快,世代周期短,在短期内可对一些常用杀虫剂产生高抗性,对化学防治带来很大的困难和挑战。其抗药性的产生已经逐步上升为限制新疆棉花、果树、蔬菜生产发展的制约性因素。
目前,对甲氰菊酯、螺螨酯和阿维菌素的杀虫机理研究已经比较明确。由于其具有杀螨广谱,持效期长,防效突出等优点被广泛运用于害螨防治[10],但是随着近年来的广泛连续使用,其防效大大降低,所以对害螨的抗药性研究首当其冲。何林等用甲氰菊酯筛选朱砂叶螨Tetranychuscinnabarinus(Boisduval),至40代时,抗性增长到68.5倍,GSTs比活力增加是朱砂叶螨抗甲氰菊酯的机制之一[11];沈慧敏等用甲氰菊酯对李始叶螨Eotetranychuspruni(Oudemans)种群16次喷雾处理(约16代)后,抗性指数达到153.63倍[12];Leeuwen和Pottelberge等报道二斑叶螨种群对拟除虫菊酯类杀虫剂抗性水平已达到2 000倍[13-14];Gotoh和Ullah在室内测定了螺螨酯对枣树截形叶螨T.truncatus(Ehara)卵和成螨的毒力,发现雌成螨和卵对螺螨酯的抗性都在迅速发展,并指出螺螨酯不再适宜防治孟加拉国的截形叶螨[15];Vassilis等测定了塞浦路斯的5个不同地理种群的二斑叶螨对阿维菌素的抗性,发现二斑叶螨对阿维菌素抗性倍数在248~3 822倍之间[16]。前人研究说明解毒代谢酶活性的升高与害螨抗药性形成密切相关。 关于土耳其斯坦叶螨的抗药性仅于20世纪70年代到90年代初进行了少量研究[17],该螨对以上3种杀虫剂的抗性及抗性机理研究少之又少。
本研究对土耳其斯坦叶螨用螺螨酯、甲氰菊酯和阿维菌素选育出其抗性种群。分别测定敏感品系(SS)和抗螺螨酯品系(RS)、抗甲氰菊酯品系(RF)、抗阿维菌素品系(RA)的羧酸酯酶(CarE)、谷胱甘肽S-转移酶(GSTs)和多功能氧化酶(MFO)活性,并对不同抗性品系的3种解毒酶活性变化加以比较和分析。旨在探究土耳其斯坦叶螨抗性形成的生化机制,期望为土耳其斯坦叶螨的防治提供理论参考。
1 材料和方法
1.1 供试土耳其斯坦叶螨
敏感品系土耳其斯坦叶螨:引自石河子大学昆虫生理实验室的敏感品系,在盆栽豇豆苗上饲养160代。
抗螺螨酯品系(RS)、抗甲氰菊酯品系(RF)和抗阿维菌素品系(RA)土耳其斯坦叶螨:从敏感品系(SS)中扩繁出3组,然后分别用螺螨酯、甲氰菊酯和阿维菌素进行处理,选育15代后作为抗螺螨酯、抗甲氰菊酯、抗阿维菌素品系。
饲养条件:温度条件(28±1)℃,相对湿度(65±5)%,光周期L∥D=14 h∥10 h。
1.2 供试药剂和仪器
螺螨酯(spirodiclofen)24 g/L悬浮剂(美国默赛技术公司),甲氰菊酯(fenpropathrin)20%乳油(浙江威尔达化工有限公司),阿维菌素(abamectin)5%乳油(河北亨升化工有限公司),考马斯亮蓝G-250(上海生物试剂有限公司);牛血清蛋白(BSA)(上海化学试剂有限公司);α-醋酸萘酯(α-NA)(上海化学试剂公司);α-萘酚(上海青浦合成试剂厂);毒扁豆碱(Sigma公司);坚固蓝B盐(上海沪宇生物试剂公司);十二烷基硫酸钠(SDS)(Fluka公司);还原型谷胱甘肽(GSH)(上海化学试剂有限公司);1-氯-2,4-二硝基苯(CDNB)(上海青浦试剂厂);氢氧化钠(重庆生物试剂有限公司);三羟甲基氨基甲烷(Sigma公司);对硝基苯酚(上海圣宇化工有限公司);对硝基苯甲醚(上海沪宇生物试剂公司);还原性辅酶Ⅱ(NADPH)(Sigma公司);氯仿(天津永晟精细化工有限公司);丙酮(天津永晟精细化工有限公司)。
仪器:HITACHI CT15RE高速冷冻离心机(日本);Multiskan FC型酶标仪。
1.3 试验方法
1.3.1 土耳其斯坦叶螨抗性选育方法
待从敏感品系中扩繁出3组土耳其斯坦叶螨在豇豆上有一定的种群密度时,分别用螺螨酯、甲氰菊酯和阿维菌素药剂处理,用微型喷雾器以杀死种群65%~75%的选择压喷雾处理,叶面、叶背喷雾均匀,但不流失,存活个体继续饲养,适当加大药剂浓度累代处理存活个体子代。每3代进行一次室内毒力测定,计算3种药剂对土耳其斯坦叶螨的致死中浓度(LC50)。并与敏感品系作比较,计算抗性指数。
抗性指数(RI)=抗性品系雌成螨LC50/敏感品系雌成螨LC50。
1.3.2 室内毒力测定方法
测定方法参照FAO推荐的玻片浸渍法,并稍作改进[18]。将双面胶贴在显微镜载玻片的一端,用小号毛笔挑取体色鲜亮、大小一致、行动活泼的土耳其斯坦叶螨雌成螨,将其背部粘在载玻片上,每片粘35头。置于温度条件(28±1)℃,相对湿度(65±5)%,光周期L∥D=14 h∥10 h的光照培养箱中4 h,在显微镜下观察并剔除死亡或不活泼的螨。将螺螨酯、甲氰菊酯和阿维菌素药剂分别稀释成5~8个浓度,将粘螨的一端玻片置于药液中,轻轻晃动5 s后取出,迅速用滤纸吸干玻片周围的残留液体(不能触及螨,以免发生机械损伤),每个浓度3个重复,以清水作为对照。将其置于温度条件(28±1)℃,相对湿度(65±5)%,光周期L∥D=14 h∥10 h的光照培养箱中,24 h后在显微镜下检查其死亡情况,用毛笔轻轻触动螨体,观察其足不动者为死亡。
1.3.3 土耳其斯坦叶螨体内解毒酶和靶标酶活性分析方法
1.3.3.1 CarE活性测定
测定方法参照何恒果[19]的方法。分别挑取敏感品系、抗螺螨酯品系、抗甲氰菊酯品系、抗阿维菌素品系土耳其斯坦叶螨雌成螨各400头, 测定时采用3次生物重复和2次技术重复。以α-醋酸萘酯(α-NA)(3×10-4mol/L,含毒扁豆碱)作为底物,与酶液在30℃下反应10 min,然后加入25 μL显色剂,用酶标仪于600 nm处测定A值。所测A值减去对照A值, 根据标准曲线计算酶液生成α-萘酚量。测定蛋白质含量(μg/mL),即得酶比活力[μmol/(L·mg·min)]。
1.3.3.2 GSTs活性测定
参照Clark等[20]的方法。分别挑取敏感品系,抗螺螨酯品系、抗甲氰菊酯品系、抗阿维菌素品系土耳其斯坦叶螨雌成螨各400头,测定时采用3次生物重复和2次技术重复。以1-氯-2,4-二硝基苯(CDNB)和还原性谷胱甘肽(GSH)为底物, 在GSTs催化下, 用酶标仪于340 nm处测定其A值, 并计算GSTs比活力[nmol/(L·μg·min)]。参照Habig等[21]方法, 依据以下公式计算酶活力:
GSTs活力单位(nmol/min)=(ΔA340·υ)/ΔA340(ε·L)式中,ΔA340为光吸收每分钟的变化值(A340/min),υ为酶促反应体系、ε为产物的消光系数[0.009 6 L/(μmol·cm)],L 为光程(1 cm)。GSTs比活力[nmol/(L·μg·min)]=酶活力单位/酶液蛋白含量。
1.3.3.3 MFO活性测定
参照Kim等[22]的方法。分别挑取敏感品系、抗螺螨酯品系、抗甲氰菊酯品系、抗阿维菌素品系土耳其斯坦叶螨雌成螨约400头,测定时采用3次生物重复和2次技术重复。对硝基苯甲醚作底物,氧和NADPH作为电子供体,MFO催化发生氧脱甲基作用生成对硝基苯酚,37℃下反应30 min,用盐酸终止反应, 先后用氯仿、NaOH溶液萃取,用酶标仪于400 nm处测定A值, 根据对硝基苯酚标准曲线方程求得酶促反应生成的对硝基苯酚量, 求出MFO氧脱甲基的活性[μmol/(L·mg·min)]。
1.3.3.4 酶源蛋白含量的测定
参照Bradford[23]的方法,采用考马斯亮蓝G-250染色法进行测定。
1.3.3.5 动力学常数测定
参照Wilkinson[24]的方法。将底物稀释为不同浓度梯度,采用Lineweaver-Burk 双倒数作图法计算Vmax和Km值。
1.4 数据统计与分析
甲氰菊酯、螺螨酯、阿维菌素对土耳其斯坦叶螨的生测数据采用SPSS 来进行处理,求出毒力回归直线方程、拟合度卡方检验卡方值(χ2)、95%置信区间(95%CL)、致死中浓度(LC50);解毒酶数据处理采用SPSS进行差异显著性分析。
2 结果与分析
2.1 土耳其斯坦叶螨对螺螨酯、甲氰菊酯和阿维菌素的抗性选育
土耳其斯坦叶螨对螺螨酯的抗性选育结果见表1。用24 g/L螺螨酯悬浮剂对土耳其斯坦叶螨筛选15代后,其LC50由3.882 mg/L上升至1 042.806 mg/L,抗性指数(RI)为268.63。土耳其斯坦叶螨对甲氰菊酯的抗性选育结果见表2。用20%甲氰菊酯乳油对土耳其斯坦叶螨筛选15代后,其LC50由4.937 mg/L上升至187.529 mg/L,抗性指数(RI)为37.98。土耳其斯坦叶螨对阿维菌素的抗性选育结果见表3。用5%阿维菌素乳油对土耳其斯坦叶螨筛选15代后,其LC50由0.069 mg/L上升至7.775 mg/L,抗性指数(RI)为112.68。
表1 土耳其斯坦叶螨对螺螨酯的室内抗性选育
Table 1 The laboratory selection for resistance ofTetranychusturkestanito spirodiclofen

筛选代数Selectedgeneration回归方程Regressionequationχ2LC50(95%CL)/mg·L-1抗性指数(RI)ResistanceindexF0Y=-1.268+2.153X0.502 3.882(3.336~4.550)-F3Y=-2.976+2.070X0.53727.411(24.232~31.395)7.06F6Y=-6.225+3.202X2.88987.964(81.083~95.514)22.66F9Y=-9.217+3.718X0.121301.352(281.033~326.712)77.63F12Y=-10.341+3.583X3.145769.110(714.654~846.285)198.12F15Y=-5.509+1.825X2.9481042.806(889.469~1285.179)268.63
表2 土耳其斯坦叶螨对甲氰菊酯的室内抗性选育
Table 2 The laboratory selection for resistance ofTetranychusturkestanito fenpropathrin
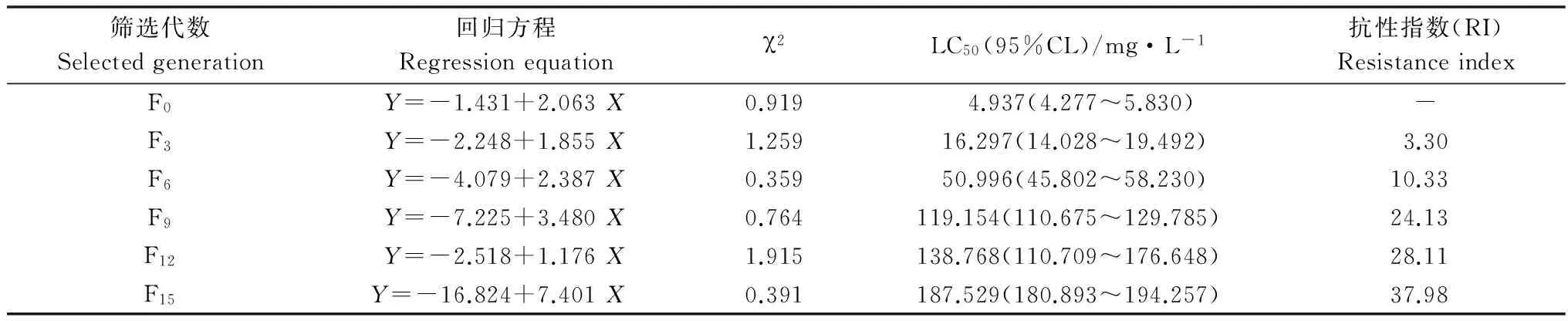
筛选代数Selectedgeneration回归方程Regressionequationχ2LC50(95%CL)/mg·L-1抗性指数(RI)ResistanceindexF0Y=-1.431+2.063X0.919 4.937(4.277~5.830)-F3Y=-2.248+1.855X1.25916.297(14.028~19.492)3.30F6Y=-4.079+2.387X0.35950.996(45.802~58.230)10.33F9Y=-7.225+3.480X0.764119.154(110.675~129.785)24.13F12Y=-2.518+1.176X1.915138.768(110.709~176.648)28.11F15Y=-16.824+7.401X0.391187.529(180.893~194.257)37.98
表3 土耳其斯坦叶螨对阿维菌素的室内抗性选育
Table 3 The laboratory selection for resistance ofTetranychusturkestanito abamectin

筛选代数Selectedgeneration回归方程Regressionequationχ2LC50(95%CL)/mg·L-1抗性指数(RI)ResistanceindexF0Y=2.796+2.410X0.3790.069(0.060~0.080)-F3Y=2.098+2.049X1.8700.095(0.083~0.113)1.38F6Y=2.799+4.187X2.6620.215(0.201~0.229)3.12F9Y=0.134+4.527X2.5610.934(0.880~0.992)13.54F12Y=-1.386+3.141X2.2742.762(2.555~3.012)40.03F15Y=-1.391+1.562X2.4237.775(6.443~9.234)112.68
2.2 土耳其斯坦叶螨不同品系解毒酶比活力测定
土耳其斯坦叶螨SS、RS、RF和RA品系解毒酶比活力测定结果见表4。抗性品系相对敏感品系3种解毒代谢酶比活力均有提高,除RS品系的GSTs和MFO比活力外均达到显著水平(P<0.05)。RF品系3种解毒代谢酶比活力升高最为明显,其中MFO比活力是敏感品系的12.7倍。RA品系则是MFO和GSTs比活力增长较快,MFO是敏感品系的5.76倍。说明MFO活性升高可能是导致RF品系和RA品系抗性形成的关键因素。
表4 土耳其斯坦叶螨不同品系谷胱甘肽硫转移酶、羧酸酯酶和多功能氧化酶比活力1)
Table 4 Activities of GSTs, CarE and MFO in differentTetranychusturkestanistrains
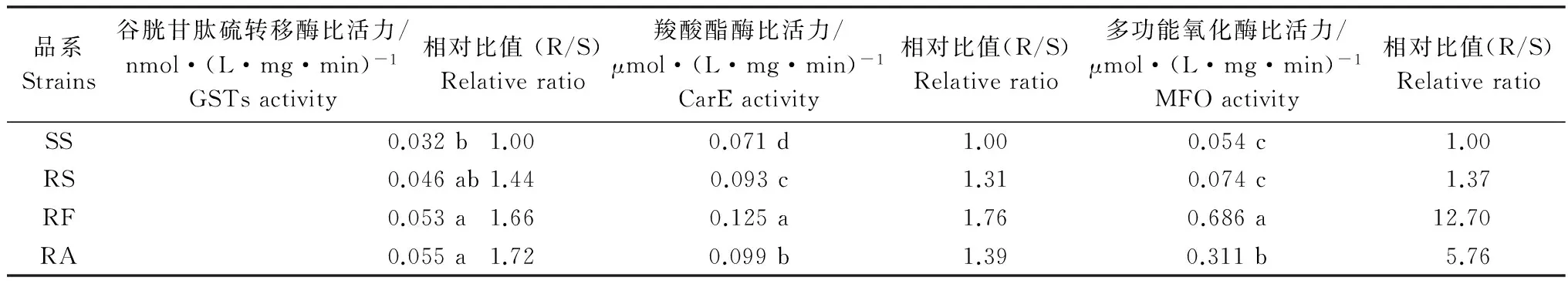
品系Strains谷胱甘肽硫转移酶比活力/nmol·(L·mg·min)-1GSTsactivity相对比值(R/S)Relativeratio羧酸酯酶比活力/μmol·(L·mg·min)-1CarEactivity相对比值(R/S)Relativeratio多功能氧化酶比活力/μmol·(L·mg·min)-1MFOactivity相对比值(R/S)RelativeratioSS0.032b1.000.071d1.000.054c1.00RS0.046ab1.440.093c1.310.074c1.37RF0.053a1.660.125a1.760.686a12.70RA0.055a1.720.099b1.390.311b5.76
1) 同一种酶数据后不同小写字母表示不同品系间差异显著(Duncan氏新复极差检验)(P<0.05)。 Data marked with different lowercase letters for the same enzyme are significantly different among different strains by Duncan’s test (P<0.05).
2.3 土耳其斯坦叶螨不同品系解毒酶动力学常数测定
土耳其斯坦叶螨SS、RS、RF和RA品系CarE、GSTs和MFO动力学常数测定结果分别见表5~7。结果显示,3种抗性品系的CarE、GSTs和MFO的Km值均大于敏感品系,差异均显著(P<0.05)。其中RA品系GSTs和MFO的Km升高最快,分别为敏感品系的3.81倍和3.63倍;RA 和RS 品系的CarE 的Km升高最慢,分别为敏感品系的1.44倍和1.45倍。由此可知RA品系GSTs和MFO 对各自底物对1-氯-2,4二硝基苯和硝基苯甲醚的亲和力显著降低了。 3种抗性品系的CarE、GSTs和MFO的Vmax均大于敏感品系,其中RA品系的GSTs 的Vmax升高最快为敏感品系的2.39倍,结合Km的测定结果可证明RA品系的GSTs不仅发生了显著的量变,而且有明显的质变。而RS品系的3种解毒代谢酶的Vmax升高均较慢,结合Km的测定可知,CarE可能对螺螨酯的抗性形成影响较小。
表5 土耳其斯坦叶螨不同品系羧酸酯酶动力学常数1)
Table 5 Kinetic constants of CarE in differentTetranychusturkestanistrains

品系Strain米氏常数/μmol·L-1Km相对比值(R/S)Relativeratio最大反应速度/μmol·(L·mg·min)-1Vmax相对比值(R/S)RelativeratioSS0.385c1.0029.835d1.00RS0.560b1.4547.334c1.59RF0.655a1.7062.132a2.08RA0.554b1.4449.134b1.65
1) 同列数据后不同小写字母表示不同品系间差异显著(Duncan氏新复极差检验)(P<0.05)。下同。 Data marked with different lowercase letters in the same column are significantly different among different strains by Duncan’s test (P<0.05). The same below.
表6 土耳其斯坦叶螨不同品系谷胱甘肽硫转移酶动力学常数
Table 6 Kinetic constants of GSTs in differentTetranychusturkestanistrains

品系Strain米氏常数/nmol·L-1Km相对比值(R/S)Relativeratio最大反应速度/nmol·(L·mg·min)-1Vmax相对比值(R/S)RelativeratioSS0.093d1.001.307b1.00RS0.213c2.292.066ab1.58RF0.314b3.382.986ab2.28RA0.354a3.813.124a2.39
表7 土耳其斯坦叶螨不同品系多功能氧化酶动力学常数
Table 7 Kinetic constants of MFO in differentTetranychusturkestanistrains

品系Strain米氏常数/μmol·L-1Km相对比值(R/S)Relativeratio最大反应速度/μmol·(L·mg·min)-1Vmax相对比值(R/S)RelativeratioSS0.024c1.001.050d1.00RS0.066b2.751.858c1.77RF0.066b2.752.456a2.34RA0.087a3.631.956b1.86
3 结论与讨论
采用螺螨酯、甲氰菊酯和阿维菌素对土耳其斯坦叶螨进行室内强化筛选,F0代到F5代抗药性发展较为缓慢,以上3种杀螨剂对土耳其斯坦叶螨均具有较强的毒杀作用,故时有种群数量过少的危机。F6代到F9代抗药性稳定上升,F9代以后抗药性快速上升,其中对螺螨酯的抗性上升最快,到F15代抗性指数达到268.83;对阿维菌素和甲氰菊酯的抗性上升相对较慢,到F15代抗性指数分别为112.68和37.98。土耳其斯坦叶螨对阿维菌素的抗性形成趋势基本与沈一凡等[25]报道的二斑叶螨对阿维菌素抗性选育一致。土耳其斯坦叶螨对甲氰菊酯的抗性形成趋势符合何林等[11]用甲氰菊酯筛选朱砂叶螨至40代时的抗性增长倍数(68.5倍);也与王兴全[26]关于二斑叶螨对甲氰菊酯的生化抗性机理研究中抗性选育结果(至F14代时抗性倍数为58.05倍)一致。本研究的抗性选育结果符合常用杀螨剂的抗性形成趋势。若继续用高强度的药剂筛选,抗性还会不断上升,所以对螺螨酯、甲氰菊酯和阿维菌素的使用时应该注意(尤其是螺螨酯)用不同杀螨剂或常用混配杀螨剂交互轮用,以减缓土耳其斯坦叶螨抗药性的形成。
本研究通过对土耳其斯坦叶螨SS和RS、RF、RA品系解毒酶活性的分析可知,3种抗性品系与敏感品系相比,抗性品系GSTs、MFO和CarE比活力均显著上升,相对比值均大于1,表明螺螨酯、甲氰菊酯和阿维菌素对以上3种解毒酶有诱导效应。其中RS品系3种解毒酶比活力上升比较均衡,但均增长较慢,由此可知,3种解毒代谢酶都参与了螺螨酯的解毒代谢,但它们可能并不是土耳其斯坦叶螨对螺螨酯产生抗性的关键因素。RF品系的MFO比活力比SS品系显著增高,说明MFO可能是土耳其斯坦叶螨形成甲氰菊酯抗药性的主导因子。RA品系的MFO和GSTs相对敏感品系均有显著升高,这两种解毒酶活性增强促使土耳其斯坦叶螨形成代谢抗性可能是产生阿维菌素抗性的主要机理。从3种解毒代谢酶对3种不同杀虫剂的解毒活性的角度比较分析可知,MFO作用最显著,GSTs次之。表明MFO对杀虫化合物进行多种类型的催化反应,在杀虫剂代谢中起着中心作用,MFO的活性增强可能与多种杀虫剂抗药性形成有关。本研究也证实了土耳其斯坦叶螨不同抗性品系的三大解毒代谢酶活性相对敏感品系升高程度不同,但在土耳其斯坦叶螨解毒代谢中起协同作用。这为进一步研究土耳其斯坦叶螨抗药性形成的生化机理提供理论依据和参考。
[1] Hill R L, O’Donnell D J.Reproductive isolation betweenTetranychuslinteariusand two related mites,T.urticaeandT.turkestani(Acarina: Tetranychidae)[J]. Experimental and Applied Acarology, 1991, 11 (4): 241-251.
[2] Navajas M, Boursot P.Nuclear ribosomal DNA monophyly versus mitochondrial DNA polyphyly in two closely related mite species: the influence of life history and molecular drive[J]. Proceedings Biological Sciences / The Royal Society, 2003, 270 (S1): S124-S127.
[3] Ben-David T,Sarah M,Uri G,et al.ITS2 sequences as barcodes for identifying and analyzing spider mites (Aeari:Tetranychidae)[J].Experimental and Applied Acarology, 2007,41:169-181.
[4] Ros V,Breeuwer J.Spider mite (Acari:Tetranychidae) mitochondrial COⅠ phylogeny reviewed:host plant relationships phylogeography,reproductive parasites and barcoding[J].Experimental and Applied Acarology,2007,42:239-262.
[5] Tselila Ben-David,Uri Gerson,Shai Morin. Asymmetric reproductive interference between two closely related spider mites:TetranychusurticaeandT.turkestani(Acari: Tetranychidae) [J]. Experimental and Applied Acarology, 2009, 48 (3): 213-227.
[6] Imani Z,Shishehbor P,Sohrabi F.The effect ofTetranychusturkestaniandEutetranychusorientalis(Acari:Tetranychidae)on the development and reproduction ofStethorusgilvifrons(Coleoptera:Coccinellidae)[J].Journal of Asia Pacific Entomology,2009,12:213-216.
[7] 鲁素玲, 罗明. 新疆蔬菜害螨种类调查初报[J].新疆农业科学,1990(1):25-27.
[8] 鲁素玲. 土耳其斯坦叶螨研究初报[J].新疆农业科学,1990(3):118-119.
[9] 邓慧君,南更明. 库尔勒香梨主要病虫害及其防治技术[J].中国果树,2001(5):37-40.
[10]李海屏.杀虫剂新品种开发进展及特点[J].江苏化工,2004,32(1):6-11.
[11]何林, 谭仕禄, 曹小芳, 等.朱砂叶螨的抗药性选育及其解毒酶活性研究[J].农药学学报,2003,5(4):23-29.
[12]沈慧敏,张新虎,陈琳.李始叶螨对甲氰菊酯和速螨酮的抗性选育及交互抗性研究[J].甘肃林业科技,2001,26(1):5-8.
[13]van Leeuwen T,Vontas J,Tsagkarakou A,et al.Mechanisms of acaricide resistance in the two spotted spider miteTetranychusunicae[M]∥Ishaaya I, Horowitz R A, Rami A.Biorational Control of Arthropod Pests: Application and Resistance Management. The Netherlands, Springer, 2009:347-393.
[14]van Pottelberge S, van Leeuwen T,Nauen R,et al. Resistance mechanisms to mitoehondrial electron transport inhibitors in a field-collected strain ofTetranychusunicaeKoch (Aeari: Tetranychidae) [J].Bulletin of Entomological Research, 2009,99(1):23-31.
[15]Ullah M S, Gotoh T.Laboratory-based toxicity of some acaricides toTetranychusmacfarlaneiandTetranychustruncatus(Acari: Tetranychidae)[J]. International Journal of Acarology, 2013, 39(3): 244-251.
[16]Vassilis A V, Pavlos K. Acaricide resistance inTetranychusurticae(Acari: Tetranychidae) populations from Cyprus [J]. Journal of Economic Entomology, 2012, 106(4): 1848-1854.
[17]Trichilo P J, Wilson L T, Gonzalez D.Relative abundance of three species of spider mites (Acari:Tetranychidae) on cotton, as influenced by pesticides and time of establishment [J]. Journal of Economic Entomology, 1990, 83(4): 1604-1611.
[18]何林,赵志模,邓新平,等.朱砂叶螨对三种杀螨剂的抗性选育与抗性风险评估[J].昆虫学报,2002,45(5):688-692.
[19]何恒果. 桔全爪螨对甲氰菊酯和阿维菌素的抗性及其酯酶基因的克隆与表达研究[D].重庆:西南大学,2010.
[20]Clark A G, Dick G L, Smith J N.Kinetic studies on a glutathioneS-transferase from the larvae ofCostelytrazealandica[J]. The Biochemical Journal, 1984, 217 (1): 51-58.
[21]Habig W H,Pabst M J,Jakoby W B.GlutathioneS-transferase. The first enzymatic step in mercapturic acid formation[J].The Journal of Biological Chemistry,1974,249(22):7130-7139.
[22]Kim Young-Joon,Lee Si-Hyeock,Lee Si-Woo,et al. Fenpyroximate resistance inTetranychusurticae(Acari:Tetranychidae): cross-resistance and biochemical resistance mechanisms[J]. Pest Management Science,2004,60(10):1001-1006.
[23]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry,1976,72(1):248-254.
[24]Wilkinson G N.Statistical estimations in enzyme kinetics [J]. The Biochemical Journal, 1961, 80 (2): 324-332.
[25]沈一凡, 沈慧敏, 岳秀利, 等.二斑叶螨抗阿维菌素品系选育及其解毒酶系活力变化[J].植物保护,2014,40(5):44-48.
[26]王兴全. 二斑叶螨对甲氰菊酯的生化抗性机理研究[D].兰州:甘肃农业大学,2008.
(责任编辑:田 喆)
Selection for insecticide resistance ofTetranychusturkestanistrains and change in the activity of detoxification enzymes
Wang Xiaojun, Bao Jianhong, Zhang Yanna, Zhu Ruwei, Zhao Yiying
(CollegeofAgriculture,ShiheziUniversity,Shihezi832000,China)
In order to study the resistance and biochemical resistance mechanisms ofTetranychusturkestanito insecticides, the related susceptible strains ofT.turkestaniwere separately treated with spirodiclofen, fenpropathrin and abamectin in order to select their resistance in the laboratory. The results showed that the resistance ofT.turkestanireached 268.63 folds to spirodiclofen, 37.98 folds to fenpropathrin and 112.68 folds to abamectin after treatment for 15 generations. The resistance mechanism was evaluated by activity measurement of detoxification enzymes. The activities for susceptible strains (SS), resistant strains to spirodiclofen (RS), resistant strains to fenpropathrin (RF) and resistant strains to abamectin(RA)were measured, and compared with susceptible strains, the fastest growing activity was observed in the mixed function oxidase (MFO) of RF, reaching 12.7 folds; the MFO activity of RA reached 5.76 folds, and the carboxylesterase (CarE) was the slowest in activity growth (1.31 folds for the 3 detoxification enzymes of RS). It was concluded that the increase in the activities of CarE, glutathione-S-transferase (GSTs) and MFO were induced by resistance to insecticides; the rise in resistance to spirodiclofen was not independent of carboxylesterase; the resistance to fenpropathrin was mainly associated with increased activity of mixed function oxidase; the main cause of resistance to abamectin was the increased activity of glutathione-S-transferase and mixed function oxidase.
Tetranychusturkestani; resistance selection; detoxifying metabolic enzymes; resistance mechanism
2016-08-08
2016-09-17
国家自然科学基金(31560532)
S 481.4
A
10.3969/j.issn.0529-1542.2017.04.013
* 通信作者 E-mail:2235804670@qq.com

