普洱茶固态发酵过程中联苯菊酯降解规律研究
单治国, 张春花, 满红平, 魏朝霞, 周红杰, 赵 明, 段双梅, 张乃明
(1. 云南农业大学植物保护学院, 昆明 650201; 2. 普洱学院, 普洱 665000; 3. 普洱市质量技术监督综合检测中心, 普洱 665000; 4. 云南农业大学龙润普洱茶学院, 昆明 650201; 5. 云南省土壤培肥与污染修复工程实验室, 昆明 650201)
普洱茶固态发酵过程中联苯菊酯降解规律研究
单治国1,2, 张春花2, 满红平3, 魏朝霞4, 周红杰4, 赵 明4, 段双梅4, 张乃明1,5*
(1. 云南农业大学植物保护学院, 昆明 650201; 2. 普洱学院, 普洱 665000; 3. 普洱市质量技术监督综合检测中心, 普洱 665000; 4. 云南农业大学龙润普洱茶学院, 昆明 650201; 5. 云南省土壤培肥与污染修复工程实验室, 昆明 650201)
为了研究微生物在普洱茶发酵中对联苯菊酯的降解规律,以人工添加180倍液联苯菊酯的云南大叶种晒青毛茶为材料,分别设置接种黑曲霉、酿酒酵母、产黄青霉以及不接菌的对照进行普洱茶固态发酵,应用气相色谱质谱联用分析方法测定茶叶中联苯菊酯的残留,分析比较微生物在普洱茶固态发酵中对联苯菊酯农药的降解规律。结果表明,普洱茶固态发酵中联苯菊酯残留量降低,接种微生物能够有效降低联苯菊酯的含量25%左右(P<0.05),其中酿酒酵母发酵对联苯菊酯农药残留的降解效果显著高于黑曲霉、产黄青霉处理(P<0.05)。联苯菊酯在黑曲霉、酿酒酵母、产黄青霉以及不接菌固态发酵普洱茶过程中的降解动态规律符合一级动力学模型C=C0e-kt,降解曲线方程分别为:C=12.889e-0.043t,C=13.348e-0.057t,C=13.309e-0.042t,C=14.458e-0.04t。综上,研究表明,由于优势微生物的作用,晒青毛茶上的联苯菊酯在固态发酵中显著降低,残效期缩短。
普洱茶; 微生物; 固态发酵; 联苯菊酯; 残留; 降解
食品安全问题已经引起了全球的关注[1-2],并且由农药残留引起的食品污染问题也变得越来越重要[3]。如何将化学农药控制在对人类安全的范围内是目前我国农药应用和解决农药残留问题的重要研究课题。茶叶是我国传统的经济作物,由于茶园病虫害严重,农药不合理使用、超量使用、长期使用都会造成茶叶中农药残留超标,影响茶叶质量,进而引发食品安全问题。茶叶作为直接冲泡饮用的食品,溶入茶汤的残留农药会对人体健康造成危害,因此,农药残留是当前茶叶出口和内销中遇到的最为敏感、最大的质量安全问题[4],加之国外“技术壁垒”,农药残留已成为制约我国茶叶出口的主要难题。
联苯菊酯(bifenthrin),是茶园中常用农药,具有杀虫谱广、低毒、用量少、残留期短的特点[5]。吴光远等[6]研究表明联苯菊酯主要通过触杀和胃毒作用杀虫,能有效防治鳞翅目幼虫、小绿叶蝉、茶蚜、茶叶螨等茶园害虫。由于联苯菊酯使用广泛[7],在茶叶出口中检出率高。目前中国、日本、欧盟规定联苯菊酯的残留限量分别是5、25、5 mg/kg[8]。目前,就茶叶生产中应用量较大的联苯菊酯的研究主要集中在茶园管理[6,9-12]、茶叶加工[13-16]、茶叶储藏、茶叶冲泡[15,17]中的降解动态和降解途径。随着消费者对于农产品安全问题的日益关注,保障茶叶产量的同时,在生产、消费各个环节尽可能减少茶叶中农药含量,提高茶叶的安全品质显得极为重要。而加工过程的不同对茶叶中农药的残留会有不同程度的影响,大部分加工过程可以降低残留农药浓度,也有些加工过程会导致残留升高,甚至代谢为毒性更强的产物。目前,国外已经对加工过程降低农残进行了系统的研究,并将研究数据用于食品安全风险评估和风险预警上,而我国在这方面的研究相对较少且缺乏系统性[18]。
与其他茶叶不同,普洱茶加工的关键工序是固态发酵,该过程中存在多种微生物作用,有可能对农药残留具有降解作用,但联苯菊酯在普洱茶固态发酵中的消解动态未见研究报道,因此,本研究分析不同微生物固态发酵对普洱茶中联苯菊酯残留量的影响,以比较其消解差异,从而进一步明确微生物固态发酵过程对农药残留变化起关键作用以及农药降解对普洱茶理化性质的影响,并在此基础上,探索普洱茶发酵过程对农药降解的机制与方法,以期为普洱茶的安全生产提供理论和技术指导。
1 材料与方法
1.1 材料
供试茶叶发酵原料为普洱市茶树良种场采摘的生态有机鲜叶加工而成的晒青毛茶。
供试菌种包括黑曲霉Aspergillusniger2005-10010941.4,2005、酿酒酵母Saccharomycescerevisiae200510010940.X,2005、产黄青霉Penicilliumchrysogenum,是由云南农业大学普洱茶加工技术研究实验室从普洱茶固态发酵体系中所分离、纯化、鉴定、保存、筛选、扩繁而得的优势有益菌。
联苯菊酯标准品(纯度为99.7%),中国计量科学院化学所提供;2.5%联苯菊酯乳油(江苏富美实),弗罗里硅土(农残分析级,150~250 μm,美国Sigma公司),经140℃活化2 h后使用;氯化钠、石油醚、正己烷、乙酸乙酯等所用试剂均为分析纯;试验用水均为去离子水。
气相色谱质谱联用仪:HP 5890/5971,美国安捷伦公司;色谱柱为30 m×0.32 mm×0.25 μm规格的毛细管柱;旋涡混合器,上海琪特分析仪器有限公司;数控超声波清洗仪,昆山市超声仪器有限公司;氮气浓缩干燥仪:HGC-12A,上海禾工科学仪器有限公司;旋转蒸发仪:IKA RV10,德国IKA公司。
1.2 试验设计
采用2.5%联苯菊酯乳油180倍液处理,取50 mL药液,兑水9 L(用药量按实际每重复喷施重量折算,按照晒青毛茶固态发酵潮水量为30%,即每30 kg晒青毛茶叶用水量9 L),用背负式手动喷雾器均匀喷雾于准备用于固态发酵的晒青毛茶(30 kg)上,使大叶种晒青毛茶含有一定浓度的农药残留,进行固态发酵降解试验。药后2 h采样,室内自然晾干,至茶样含水量为10%,-30℃保存,以测定联苯菊酯含量。
试验设置4个处理:施药2 h并采样后,分别接种酿酒酵母、黑曲霉、产黄青霉进行固态发酵和传统发酵(不接菌种,其他条件同接菌固态发酵)。用小型喷雾器将3种有益菌种按液茶比为1∶10的比例均匀洒在晒青毛茶上进行普洱茶固态发酵,每个处理设置3个重复,每个重复30 kg茶叶,控制发酵茶堆温度40~60℃,湿度35%,发酵环境温度25℃,环境湿度为80%,翻堆6次,分别于发酵后的7、14、21、28、35、42 d翻堆,并按五点取样法分别采集固态发酵的5个点(固态发酵中心点和距离中心点1 m处的4个点),合并为一个混合待测样品,设3个重复,各1 kg,室内自然晾干,含水量为10%,以测定联苯菊酯在普洱茶各翻堆样中的残留量。
1.3 分析方法
1.3.1 样品制备
样品提取:茶叶样品磨碎、过20目筛备用,称取2.50 g于50 mL具塞锥形瓶中,加入10 mL正己烷/丙酮混合提取液(97.5∶2.5,V/V),置于温度为40~45℃的摇床中振荡40 min。
样品净化:玻璃层析柱(5 mm×70 mm)内装约300 mg的弗罗里硅土,柱头加约15 mg的活性炭,用5.0 mL石油醚/乙酸乙酯(9∶1,V/V)洗脱液预淋洗柱子,吸取1.0 mL样品提取液注入层析柱,用25.0 mL的石油醚/乙酸乙酯(9∶1,V/V)混合液洗脱,收集全部淋洗液;然后用高纯氮气吹扫浓缩近干,加2.0 mL正己烷溶解,待气相色谱测定。
1.3.2 色谱条件
采用HP5890/5971型气相色谱仪进行检测。色谱柱:石英毛细管柱(30 m×0.32 mm×0.25 μm)。操作条件如下:流动相流速1.0 mL/min;检测波长254 nm;进样口及温度:毛细管进样口,250℃;分流模式:不分流;进样量1.0 μL;检测器温度300℃,柱前压55 kPa;柱升温程序:起始温度75℃,恒温2 min后,以25℃/min的速率升温至200℃,恒温2 min后,再以6℃/min的速率升温至260℃,继续恒温15 min;载气:高纯氮气(>99.999%)1.2 mL/min,恒流;尾吹:高纯氮气60.0 mL/min。
1.3.3 联苯菊酯农药的消解率
消解率计算公式:D(%)=(C0-Ct)/C0×100,其中D为农药固态发酵加工后的消解率(mg/kg);C0为固态发酵处理前联苯菊酯的原始附着量(mg/kg);Ct为固态发酵处理后联苯菊酯残留量(mg/kg)。
1.3.4 联苯菊酯在茶叶中半衰期的计算
一级动力学方程Ct=C0e-kt是当前阐述农药在田间消解规律最为常用的数学模型,具有良好的拟合性[19-24]。当农药残留量降低至原始附着量的一半时所需时间称为该药的半衰期,通常用t1/2表示。半衰期的长短与农药消解速率呈显著的负相关。在Ct=C0e-kt中,Ct为施药后t时刻联苯菊酯在茶叶中的残留量(mg/kg);C0为施药后2 h的原始残留量(mg/kg);t为施药后天数(d),k为消解速率;再由半衰期公式t1/2=ln2/k计算联苯菊酯在茶叶中的半衰期(d)。
1.4 数据处理
所有试验数据由SPSS 17.0统计分析软件进行单因素ANOVA分析。用最小显著性差异检验(LSD test)检验数据的差异性。所有数值均以3个重复的平均值±标准偏差(means±SD)表示。
2 结果与分析
2.1 联苯菊酯在普洱茶发酵过程中的降解动态
采用2.5%联苯菊酯乳油180倍液处理,取50 mL,兑水9 L直接喷施于30 kg晒青毛茶上,进行固态发酵。结果表明,在普洱茶固态发酵过程中联苯菊酯残留量随固态发酵时间的延长呈指数型曲线下降(见表1、图1)。试验数据表明,在固态发酵过程中受到潮水量、微生物、pH、自身分解和稀释等影响,随着时间的推移,普洱茶中联苯菊酯残留量逐渐降低,前期消解速率快,中期消解速率慢,后期消解速率较快。从表1和图1可知,接种微生物固态发酵能够有效降低联苯菊酯的含量。
施药后采用传统固态发酵,发酵第7天,联苯菊酯降解幅度较大,消解率为9.19%;发酵第7、14、21天,联苯菊酯残留量随时间增长而不同程度增加,分别是12.14、12.76、12.84 mg/kg;可能由于随着发酵时间的延长,农药被转移到茶叶上,至发酵第42天,消解率为21.83%。随着药后取样时间的延长,普洱茶固态发酵中联苯菊酯残留量呈逐渐下降趋势。
施药后接种酿酒酵母菌进行固态发酵,发酵第7天,联苯菊酯消解幅度较大,消解率为18.02%;发酵后第14、21天,联苯菊酯的残留量随时间的增长而微量增加,分别是10.57、11.38 mg/kg;发酵后42 d,下降为8.45 mg/kg,消解率为36.79%。
施药后接种黑曲霉进行固态发酵,发酵第7天,联苯菊酯消解幅度较大,消解率为19.97%;发酵后第14、21天,联苯菊酯的残留量随时间的增长而微量增加,分别为11.40和12.06 mg/kg;发酵后42 d,消解率为26.47%。
表1 不同固态发酵过程下普洱茶中联苯菊酯的消解动态1)
Table 1 Degradation dynamics of bifenthrin in different processes of solid-state fermentation of Pu-erh tea

取样间隔时间Samplinginterval传统发酵Traditionallyfermented残留量/mg·kg-1Residualquality消解率/%Degradationrate酿酒酵母Saccharomycescerevisiae残留量/mg·kg-1Residualquality消解率/%Degradationrate黑曲霉Aspergillusniger残留量/mg·kg-1Residualquality消解率/%Degradationrate产黄青霉Penicilliumchrysogenum残留量/mg·kg-1Residualquality消解率/%Degradationrate2h13.37±0.170.00 13.37±0.160.00 13.37±0.110.00 13.37±0.140.00 7d12.14±0.049.19dD10.96±0.1718.02cC10.70±0.1519.97bB10.66±0.1720.26aA14d12.76±0.234.56dD10.57±0.1020.94aA11.40±0.1914.73bB12.46±0.246.80cC21d12.84±0.113.96dD11.38±0.2714.88aA12.06±0.229.79bB12.47±0.326.73cC28d12.00±0.3410.24dD10.25±0.0723.33aA10.45±0.1721.83bB10.69±0.1020.04cC35d10.73±0.0919.74cC9.91±0.3425.87aA10.72±0.2619.82cC10.27±0.2323.18bB42d10.45±0.1321.83dD8.45±0.1136.79aA9.83±0.0926.47bB9.92±0.1125.80cC消解方程DegradationequationC=14.458e-0.04tC=13.348e-0.057tC=12.889e-0.043tC=13.309e-0.042t相关系数CorrelationcoefficientR2=0.7567R2=0.7889R2=0.574R2=0.5622半衰期/dHalflife17.3212.1516.1116.50
1) 表中数据为平均值±标准差(n=3);根据多重比较检验,相同取样时间不同处理所得的消解率后标不同小写和大写字母分别表示在P<0.05和P<0.01水平上差异显著。 Data are mean±SD (n=3); data followed by different letters in the same sampling time are significantly different at 5% and 1% levels between different treatment.
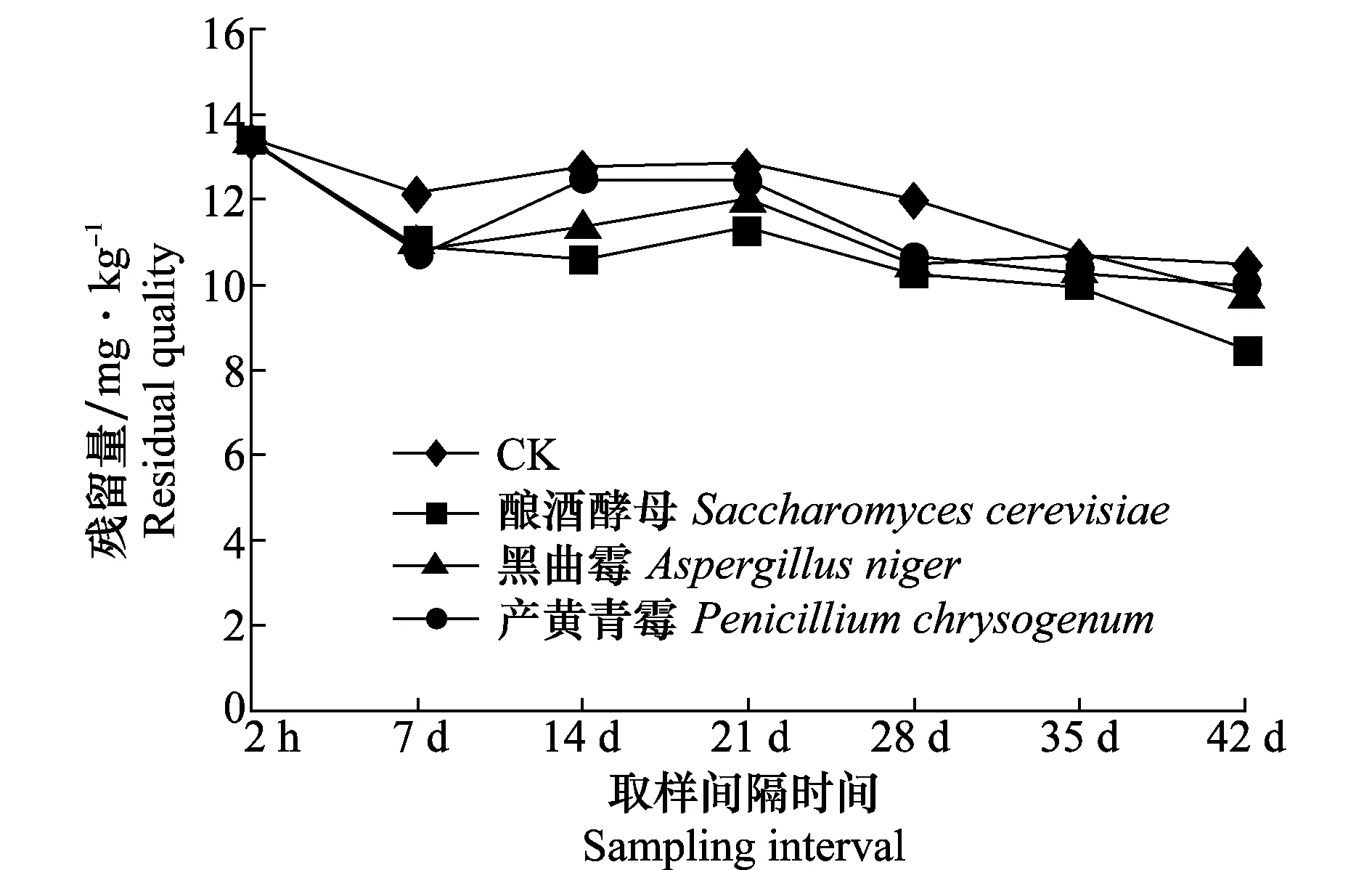
图1 联苯菊酯在不同处理普洱茶固态发酵过程中的消解曲线Fig.1 The degradation curve of bifenthrin in SSF of Pu-erh tea
施药后接种产黄青霉进行固态发酵:发酵后第7天,联苯菊酯消解幅度较大,消解率为20.26%;发酵后第7、14、21天,联苯菊酯的残留量随时间的增长而微量增加,分别是10.66、12.46、12.47 mg/kg;发酵后第42天,消解率为25.80%。
与传统发酵方法相比,接种酿酒酵母、黑曲霉、产黄青霉固态发酵普洱茶中的联苯菊酯残留量降低,消解速率提高,这可能与酵母菌、黑曲霉、青霉所分泌的胞外酶有关,化学农药可以作为营养源被微生物分解利用,生成无机物、二氧化碳和水。在普洱茶发酵体系中接种优势微生物,发酵过程中优势微生物分泌胞外酶的数量和活力与发酵体系的pH、温度、湿度密切相关,在适宜的pH、温度、湿度下,联苯菊酯的消解速度加快。在用于发酵的优势微生物中,酿酒酵母相对于黑曲霉和产黄青霉而言,其分泌的胞外酶对联苯菊酯降解的专一性可能较强,故而接种酵母菌、黑曲霉和青霉的降解效果显著高于传统发酵,其中接种酵母菌降解效果最显著。
将试验结果进行分析表明,传统发酵方法、酿酒酵母、黑曲霉、产黄青霉固态发酵普洱茶中联苯菊酯的消解曲线方程分别为:C=14.458e-0.04t、C=13.348e-0.057t、C=12.889e-0.043t、C=13.309e-0.042t。消解符合一级动力学公式C=C0e-kt。相关系数R2分别为0.756 7、0.788 9、0.574、0.562 2,根据半衰期t1/2=ln2/k计算可得对照(传统发酵)、接种酿酒酵母、黑曲霉、产黄青霉普洱茶固态发酵中联苯菊酯残留的半衰期分别为17.32、12.15、16.11、16.50 d。
2.2 微生物固态发酵对普洱茶中联苯菊酯消解动态的影响
微生物固态发酵对普洱茶中联苯菊酯消解动态的影响如表2所示。随着发酵时间的延长,普洱茶中联苯菊酯的残留量呈逐渐下降趋势。接种不同微生物进行固态发酵对普洱茶中残留的联苯菊酯具有明显的消解作用,由表2数据可知,发酵过程对普洱茶中联苯菊酯消解率的影响并不是很大。其中酿酒酵母处理的联苯菊酯残留消解率最高,为36.79%,显著高于传统发酵、黑曲霉、产黄青霉处理(P<0.05),与传统发酵和黑曲霉、青霉处理的差值分别为14.96%、10.32%、10.99%;黑曲霉、青霉处理的联苯菊酯残留消解率与传统发酵处理的差值分别为4.64%、3.97%;残留的含量差异不大,各处理之间差异显著(P<0.01),这与微生物种类密切相关。
表2 不同发酵处理对联苯菊酯残留消解率的影响
Table 2 Effects of different fermentation treatments on reduction rates of bifenthrin residues in Pu-erh tea

处理Treatment发酵前残留量/mg·kg-1Residualcontentbeforefermentation发酵后残留量/mg·kg-1Residualcontentafterfermentation消解率/%Degradationrate传统发酵Traditionalfermention13.37±0.1710.45±0.1321.83dD酿酒酵母Saccharomycescerevisiae13.37±0.168.45±0.1136.79aA黑曲霉Aspergillusniger13.37±0.119.83±0.0926.47bB产黄青霉Penicilliumchrysogenum13.30±0.149.92±0.1125.80cC
3 讨论
孔志强[25]研究发现,发酵微生物或某些发酵代谢产物会促进农药的消解,因此发酵加工处理对农残有一定的去除效果,发酵过程中,发酵微生物会吸收一部分残留农药而将其代谢,其代谢产物如乳酸等也会促进某些农药的分解[26]。本试验发现普洱茶的传统固态发酵对联苯菊酯农药的降低有一定的作用,但是降低水平有限,这与前人[27-29]的研究结果类似;而接种微生物固态发酵对联苯菊酯的消解效果优于传统发酵。人工合成的拟除虫菊酯杀虫剂光学稳定性很好,在环境中残留期较长。联苯菊酯在农田和河流沉积中半衰期分别为36 d和163 d[30];本试验发现茶叶经过传统固态发酵、接种酿酒酵母、黑曲霉、产黄青霉固态发酵后,联苯菊酯半衰期分别为17.32,12.15、16.11、16.50 d,进一步证明固态发酵对联苯菊酯农药含量的降低有一定的作用,接种微生物固态发酵对联苯菊酯消解效果优于传统发酵。
微生物降解农药是一种高效、经济的治理农药污染途径。农药的微生物降解是通过环境中包括真菌、藻类和细菌在内的微生物把农药分子作为其生存所需要碳源、氮源等营养物质来消化吸收而实现降解。因此,农药的微生物降解速度取决于微生物对环境的适应情况,当微生物在适合的温度和湿度条件下,微生物表现出较强的代谢能力,其消费农药的速度就快,农药降解速率就高[26,31]。
不同的微生物类群降解农药的机理、途径和过程不同,微生物的种类、代谢活性、适应性等都直接影响到对农药的降解与转化[32-33]。首先,本试验发现接种酿酒酵母处理的联苯菊酯残留降解率最高,为36.79%,显著优于传统发酵、黑曲霉、产黄青霉处理(P<0.05),4种处理之间的差异显著,分别是:酵母菌>黑曲霉>青霉>传统发酵,说明微生物在联苯菊酯的降解过程中起着关键作用[34-36]。毛雪飞等[18]通过试验发现,酵母发酵对农药残留的降解效果优于曲霉发酵,本试验结果与其相似。其次,本试验发现普洱茶固态发酵中的联苯菊酯残留量随施药后固态发酵时间的延长呈指数型曲线下降,随着时间的推移,残留量降低,前期消解速率快,中期消解速率慢,后期消解速率快,降解动态规律符合一级动力学模型。究其原因:微生物参与的生物降解起了很大作用,联苯菊酯可能作为有机碳源被微生物利用[37]。反过来微生物的代谢作用对其进行降解或生物修复[38],可能因固态发酵过程中微生物的呼吸作用导致堆温的升高使水分损失,可能导致联苯菊酯农药残留升高,或者母体农药分解成一些毒性更高的化合物;也可能固态发酵过程的高温作用,可使农药分子挥发或分解;也可能因发酵中活性酶,如磷酸酶、水解酶等,裂解P-O键、C-P键、P-S键等形式促进农药分子的降解[39],酶的活性越高,与农药分子的接触越密切,降解越快。最后,因联苯菊酯是茶园中广泛使用的农药,检出率高,3次冲泡后有4.4%进入茶汤[15],严重影响普洱茶的品质和安全性,若被人体少量摄入,对人体健康有着潜在的风险。因此,本研究发现在普洱茶发酵初期接入按液茶比为1∶10的比例的有益微生物酿酒酵母、黑曲霉、产黄青霉,特别是酵母菌可以有效降低普洱茶中联苯菊酯的含量。初步建立了控制联苯菊酯含量的方法,为利用微生物及其降解酶降低普洱茶中菊酯类农药含量提供了良好的应用前景,具有一定的实践性指导意义,同时,提升了普洱茶的品质和安全性,降低了农药残留对人体健康的危害,对于保障食品安全有重大意义。接种微生物降解与传统的物理、化学方法相比较,具有投入低、治理效果明显、不易产生副作用的特点。
微生物降解农药研究已经较多,其降解机制有:直接作用于农药,通过一系列酶促反应(水解、氧化、还原、脱氧、合成)来降解农药,或者通过微生物的活动改变化学(共代谢作用)或物理环境(生物浓缩、矿化作用或累积作用)而发生间接作用来降解农药,如氯氰菊酯在微球菌Micrococcussp.作用下酯键断裂生成 3-苯氧基苯甲酸,进一步二苯醚键断裂生成苯酚和原儿茶酸[40],米曲霉Aspergillusoryzae通过关键磷酸酯酶对 P-O烷基和 P-O 芳基键的水解作用将久效磷降解为二氧化碳、可溶性无机磷酸盐和氨[41],呋喃丹在微生物作用下快速水解为呋喃酚,经氧化生成2-羟基-呋喃酚,然后慢速开环反应,完全降解生成CO2和H2O[42]。本文发现酵母菌、黑曲霉、青霉这3种菌可降解联苯菊酯。Cabras等[43]发现能够降解拟除虫菊酯和硫代磷酸盐类(甲基毒死蜱,杀螟硫磷,对硫磷和喹硫磷)农药;Fatichenti等[44-45]发现,高活性酿酒酵母可以使溴氰菊酯、氰戊菊酯和氯菊酯在发酵中被完全降解;特种微生物可以有效地降解部分有机磷、有机氯和菊酯类农药残留[46]。目前关于3种微生物降解联苯菊酯农药未见相关研究,其机理还不清楚,本文尚未做深入研究,关于联苯菊酯是否在真菌作用下通过菊酯酯键断裂作用完成降解,本研究后续将进一步深化,总结以往的相关科研成果,有针对性地对联苯菊酯的降解机理开展进一步研究,研究真菌及其酶活性与作用机制,提高酶的降解谱和降解活性,从而为普洱茶安全生产提供理论依据。
4 结论
研究显示接种酿酒酵母、黑曲霉、产黄青霉进行固态发酵,可以有效降低普洱茶中联苯菊酯的残留量,为控制茶叶产品农药残留提供了新的技术思路。因此,普洱茶固态发酵过程中利用微生物来降解联苯菊酯农药残留,对提高普洱茶品质和安全性,降低消费者的健康风险具有重要的理论意义和现实意义,为今后进一步研究微生物对于联苯菊酯农药的降解机理研究提供参考,为安全健康的无公害食品提供科学技术保障。
[1] Barrett C B.Measuring food insecurity [J]. Science, 2010, 327(5967): 825-828.
[2] Godfray H C J, Beddington J R, Crute I R, et al. Food security: the challenge of feeding 9 billion people [J]. Science, 2010, 327(5967): 812-818.
[3] Ling Yun, Wang Han, Yong Wei, et al. The effects of washing and cooking on chlorpyrifos and its toxic metabolites in vegetables [J]. Food Control, 2011, 22(1): 54-58.
[4] 张海伟, 冯慧, 文一, 等. 联苯菊酯在干茶中的残留和降解行为研究[J]. 河南农业科学, 2013, 42(10): 84-87.
[5] 刘瑜, 张友炯, 任明兴, 等. 联苯菊酯等菊酯类农药在茶叶上使用安全性研究[J]. 茶叶, 2015, 41(4): 207-211.
[6] 吴光远, 曾明森, 夏会龙, 等. 联苯菊酯茶园残留与使用安全[J].福建农业学报,2013, 28(4):366-371.
[7] 谭济才. 茶树病虫害防治学[M]. 北京: 中国农业出版社, 2011: 231.
[8] 马惠民, 王永强, 钱和. 国内外茶叶农药残留限量标准的比较分析[J]. 中国茶叶加工, 2012(4): 18-22.
[9] 周晓东, 王润龙, 黄亚辉, 等. 天王星(联苯菊酯)在茶叶生产上的安全性试验[J]. 茶叶通讯, 2002(3): 24-25.
[10]姚剑敏. 甲氰菊酯、联苯菊酯、溴氰菊酯在有机溶液中的光化学降解研究[D]. 厦门: 厦门大学, 2006.
[11]康燕玉. 联苯菊酯在土壤中残留动态以及相关降解影响因子的研究[J]. 农业环境与发展, 2013, 30(1): 86-89.
[12]李睿. 拟除虫菊酯在土壤中迁移降解规律的研究[D]. 南京: 南京理工大学, 2005.
[13]陈宗懋, 岳瑞芝. 化学农药在茶叶中的残留降解规律及茶园用药安全性指标的设计[J]. 中国农业科学, 1983(1): 62-70.
[14]王运浩, 万海滨, 薛玉柱, 等. 拟除虫菊酯类农药对茶树害虫的生物活性与残留降解[J]. 昆虫学报, 1991,34(1): 20-25.
[15]中国农业科学院茶叶研究所,中国茶叶学会. 陈宗懋论文集[M]. 北京:中国农业科学技术出版社,2004:328,369,378-381.
[16]刘文涛. 烟叶烘烤贮藏期间S-氰戊菊酯和溴氰菊酯残留消解动态研究[D]. 泰安: 山东农业大学, 2008:
[17]Barooah A K, Borthakur M, Kalita J N, et al. Pesticide residues in tea and their intake assessment using brew factor[J]. Journal of Tea Science, 2011, 31(5): 419-426.
[18]毛雪飞, 焦必宁, 钱永忠, 等. 发酵过程对橙皮渣中农药残留的影响[J]. 食品与发酵工业, 2008, 34(7): 59-63.
[19]朱成莲. 农药残留降解模型的参数估计[J]. 安徽农业科学, 2008, 36(17): 7053.
[20]闫亚杰. 农药残留降解动态数学模型的研究进展[J]. 甘肃农业科技, 2005(7): 57-59.
[21]宋萍, 洪伟, 吴承祯, 等. 农药降解动力学模型的改进研究[J]. 中国生态农业学报, 2005, 13(2): 68-70.
[22]赵红杰, 叶非. 农药降解与残留分析中数学模型的应用[J]. 东北农业大学学报, 2007, 38(1): 68-72.
[23]杨怀金,叶芝祥,徐成华,等.基于IEA优化的农药降解GM(1,1)预测模型[J].农业环境科学学报,2007,26(4):1469-1472.
[24]王新洲. 非线性模型参数估计理论与应用[M]. 武汉: 武汉大学出版社, 2002: 51-81.
[25]孔志强. 农产品加工及储存过程中农药残留变化规律研究[D]. 北京: 中国农业科学院, 2012.
[26]Ruediger G A, Pardon K H, Sas A N, et al. Fate of pesticides during the winemaking process in relation to malolactic fermentation [J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 3023-3026.
[27]Navarro S, Vela N, Navarro G.Fate of triazole fungicide residues during malting, mashing and boiling stages of beermaking[J]. Food Chemistry, 2011, 124(1): 278-284.
[28]Fernandez M J, Oliva J, Barba A, et al. Effects of clarification and filtration processes on the removal of fungicide residues in red wines (var. Monastrell)[J]. Journal of Agricultural and Food Chemistry, 2005, 53(15): 6156-6161.
[29]Cus F, Cesnik H B, Bolta S V, et al. Pesticide residues in grapes and during vinification process [J]. Food Control, 2010, 21(11): 1512-1518.
[30]Lee S, Gan Jianying, Kim J S, et al. Microbial transformation of pyrethroid insecticides in aqueous and sediment phases [J]. Environmental Toxicology and Chemistry, 2004, 23(1): 1-6.
[31]谷方红, 江伟, 胡京奕, 等. 加工过程啤酒大麦农药残留的变化[J]. 食品与发酵工业, 2010, 36(5): 90-95.
[32]崔中立, 李顺鹏. 化学农药的微生物降解及其机制[J]. 江苏环境科技, 1998(3): 1-5.
[33]陈亚丽, 张先恩, 刘虹, 等. 甲基对硫磷降解菌假单胞菌WBC-3的筛选及其降解性能的研究[J]. 微生物学报, 2002, 42(4): 490-497.
[34]Sogorb M A, Vilanova E.Enzymes involved in the detoxification of organophosphorus, carbamate and pyrethroid insecticides through hydrolysis [J].Toxicology Letters,2002,128(1/3):215-228.
[35]Yu Y L, Chen Y X, Luo Y M, et al. Rapid degradation of butachlor in wheat rhizosphere soil [J]. Chemosphere, 2003, 50(6): 771-774.
[36]Zhang Weijian, Rui Wenyi, Tu C, et al. Responses of soil microbial community structure and diversity to agricultural deintensification [J]. Pedosphere, 2005, 15(4): 440-447.
[37]罗天雄. 联苯菊酯降解微生物生长环境的优化作用研究[J]. 安徽农学通报, 2009, 15(21): 35.
[38]张久刚, 闫艳春. 微生物对拟除虫菊酯类农药残留的生物修复[J].生物技术通讯, 2006, 17(6): 1004-1007.
[39]刘建利. 有机磷农药降解酶的研究进展[J]. 广东农业科学, 2010(1): 60-64.
[40]Tallur P N, Megadi V B,Ninnekar H Z. Biodegradation of cypermethrin byMicrococcussp. strain CPN 1[J]. Biodegradation, 2008, 19: 77-82.
[41]Bhalerao T S, Puranik P R.Microbial degradation of monocrotophos byAspergillusoryzae[J]. International Biodeterioration & Biodegradation, 2009, 63(4): 503-508.
[42]Ogram A V, Duan Y P, Trabue S L, et al. Carbofuran degradation mediated by three related plasmid systems [J]. FEMS Microbiology Ecology, 2000, 32: 197-203.
[43]Cabras P, Angioni A.Pesticide residues in grapes, wine, and their processing products [J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 967-973.
[44]Fatichenti F, Farris G A, Deiana P, et al. Preliminary investigation into the effect ofSaccharomycescerevisiaeon pesticide concentration during fermentation [J]. European Journal of Applied Microbiology and Biotechnology, 1983, 18(5): 323-325.
[45]Fatichenti F, Farris G A, Deiana P, et al. The effect ofSaccharomycescerevisiaeon concentration of dicarboximide and acylanilide fungicides and pyrethroid insecticides during fermentation [J]. Applied Microbiology and Biotechnology, 1984, 20(6): 419-421.
[46]王兆守,林淦,李秀仙,等.拟除虫菊酯降解菌的分离、筛选及鉴定[J].福建农林大学学报(自然科学版),2003,32(2):176-180.
(责任编辑:田 喆)
The residues and degradation of bifenthrin in solid-state fermentation of Pu-erh tea
Shan Zhiguo1,2, Zhang Chunhua2, Man Hongping3, Wei Zhaoxia4, Zhou Hongjie4, Zhao Ming4, Duan Shuangmei4, Zhang Naiming1,5
(1.CollegeofPlantProtection,YunnanAgriculturalUniversity,Kunming650201,China; 2.PuerUnivercity,Puer665000,China; 3.PuerComprehensiveTechnicalTestingCenter,Yunnan665000,China; 4.CollegeofLongrunPu-erhTea,YunnanAgriculturalUniversity,Kunming650201,China; 5.YunnanSoilFertilizerandPollutionRepairEngineeringLaboratory,Kunming650201,China)
In order to study the degradation of bifenthrin in solid-state fermentation of Pu-erh tea, the sun-dried leaves of the large-leaf tea speciesCamelliasinensis(Linn.) var.assamica(Masters) Kitamura in Yunnan Province were added with 180 times of bifenthrin and used as raw materials. Three solid-state fermentations (SSF) of Pu-erh tea inoculated withAspergillusniger,SaccharomycescerevisiaeandPenicilliumchrysogenum, and a traditional SSF with no-inoculation were developed, respectively. Then the residues of bifenthrin in tea leaves were measured by gas chromatography-mass spectrometry (GC-MS). The degradation of bifenthrin by microorganisms in solid-state fermentation of Pu-erh tea was analyzed. The results showed that the residues of bifenthrin were decreased during SSF of the Pu-erh tea. Inoculation of fungi could effectively reduce the content of bifenthrin in the SSF of Pu-erh tea. The degradation effect of bifenthrin in theSaccharomycescerevisiaefermentation was significantly higher than that inAspergillusnigerandPenicilliumsp. (P<0.05). The degrading dynamics of bifenthrin was the first-order kinetic model:C=C0e-kt. The degradation curve equation wereC=12.889e-0.043t,C=13.348e-0.057t,C=13.309e-0.042t,C=14.458e-0.04t, respectively of three solid-state fermentations (SSF) of Pu-erh tea inoculated withAspergillusniger,SaccharomycescerevisiaeandPenicilliumchrysogenum, and traditional SSF with no-inoculation. In conclusion, the content of bifenthrin was significantly decreased in SSF of Pu-erh tea, due to the degradation by microorganisms. It is worth to further study the degradation effect of SSF in Pu-erh tea on other pesticides.
Pu-erh tea; microorganism; solid-state fermentation; bifenthrin; pesticide residue; degradation
2016-08-26
2016-12-12
科技创新人才计划(2015HC018);对外科技合作计划-院士专家工作站(2015IC022);云南省科技创新强省计划(2014AE014);普洱学院高层次人才科研启动项目(K2015032);农学专业普洱茶实验实习实训基地与加工技术创新服务中心(A03047-16)
S 481.8
A
10.3969/j.issn.0529-1542.2017.04.017
* 通信作者 E-mail:zhangnaiming@sina.com

