一种改进的尖孢镰刀菌的实时荧光定量PCR检测方法
黄怀冬, 肖姬玲, 张 屹, 阮万辉, 魏 林, 梁志怀*
(1. 中南大学研究生院隆平分院, 长沙 410125; 2. 湖南省西瓜甜瓜研究所, 长沙 410125; 3. 湖南省植物保护研究所, 长沙 410125)
一种改进的尖孢镰刀菌的实时荧光定量PCR检测方法
黄怀冬1,2, 肖姬玲2, 张 屹2, 阮万辉2, 魏 林3, 梁志怀1,2*
(1. 中南大学研究生院隆平分院, 长沙 410125; 2. 湖南省西瓜甜瓜研究所, 长沙 410125; 3. 湖南省植物保护研究所, 长沙 410125)
为实现荧光定量PCR对土壤病原真菌数量更为高效、灵敏的检测,本研究将液体培养的孢子悬浮液和长年耕作的水稻土制作成孢子浓度为4×101~4×106spore/g的带菌土,采用MoBio PowerSoil@DNA Isolation Kit提取模拟带菌土壤总DNA,引入常规PCR预扩增包含qPCR目标序列的1 446 bp片段,以预PCR产物为模板进行qPCR,构建荧光定量PCR标准曲线。研究结果表明:以试剂盒提取的带菌土壤总DNA为模板绘制的qPCR标准曲线相关系数r为0.985,检测下限为4×103spore/g土;引入预PCR后,qPCR标准曲线相关系数r为0.974,检测下限为4×102spore/g土,较未引入时提高了10倍,结合不同土壤病原真菌的特异性引物,该检测方法可为土壤病原真菌的有效定量检测提供技术支撑。
实时荧光定量PCR; 土壤病原真菌; 尖孢镰刀菌; 检测下限
土壤是农业生产的基本资料,土壤供给和协调农作物生长发育所需要的水分、养分、空气、热量、扎根条件等。但是土壤中同样存在危害农作物生长的土传病原菌,这些病原菌在条件适宜时从作物根部或茎部侵入作物而引起病害,且具有传播途径多样,暴发迅速和应急防治难的特点,给农业生产造成重大经济损失[1]。若能快速及时地鉴定土壤中病原菌的种类和数量,在病菌侵染和暴发初期采取有效的防治措施可最大限度地避免经济损失。随着对病害研究的深入,对病原菌的研究和检测进入到专化型和生理小种的层次。以往对土壤病原菌的诊断主要依靠病原菌的分离培养,采用特异性的分离培养基能有效定量土壤中活体菌株的数量,但因分离培养基的局限性要实现对土壤中病原菌各专化型及各生理小种的分离定量较为困难,加之分离培养耗时相对较长,不能确定有效防治时期。因此,建立一种快速、准确、定量检测土壤病原菌的技术,对于病害的诊断和防治具有重要意义。
实时荧光定量PCR(real-time fluorescent quantitative PCR)技术是一种新型核酸定量技术[2]。与普通PCR相比,具有自动化程度高、重复性好、定量准确等特点,目前在动物医学病理和分子生物学研究领域应用十分广泛[3]。近年来,随着新一代基因测序技术的发展,测序成本大大降低,越来越多的植物病原菌的DNA测序工作完成,随之开发的不同病原菌的特异分子标记为实时荧光定量PCR技术应用于植物病原菌的检测开启了大门[4-7]。
由于土壤环境中含有大量腐殖质酸、酚类化合物等化学特性与DNA十分相近的有机质[8],高效获取高质量的土壤总DNA较为困难,而总DNA的提取效率和质量与荧光定量PCR检测结果的准确性密切相关[9]。以往土壤病原菌数量检测体系的建立多采用带目标扩增片段的质粒标准品为模板,或是采用带菌基质模拟带菌自然土壤建立标准曲线[10],标准曲线建立的背景与农业生产中的土壤背景出入太大,且由于模板浓度的限制和腐殖质的干扰,土壤含菌量的定量检测下限较高[11],因此已建好的检测体系难以应用于实际生产。鉴于此,本研究采用南方广泛用于西瓜种植的水稻土壤模拟含菌量4×101~4×106spore/g土6个浓度梯度的带菌土壤,使用MoBio PowerSoil@DNA Isolation Kit提取模拟带菌土壤总DNA,引入一轮预PCR扩增包含qPCR目标序列的1 446 bp片段,以预PCR产物为模板进行qPCR构建荧光定量PCR标准曲线,成功实现4×102~4×106spore/g土的尖孢镰刀菌检测。
1 材料与方法
1.1 试验材料
菌株与土壤:西瓜枯萎病菌尖孢镰刀菌西瓜专化型Fusariumoxysporumf.sp.niveum1号生理小种来自湖南省西瓜甜瓜研究所;土壤取自湖南省水稻研究所多年连作水稻的水稻试验田。
1.2 仪器与试剂
IQ5多重实时荧光定量PCR仪,美国Bio-Rad生产;Μltrospec 3300pro紫外分光光度计,美国Amersham生产;TransStart®Tip green qPCR SuperMix和MoBio PowerSoil@DNA Isolation Kit购自全式金生物技术公司;其他化学试剂为Sigma公司产品或国产AR级试剂。
引物由上海生工生物有限公司合成。Fonq-2F: CTTCCAAGTACCCTTTAGCCTAC;Fonq-2R: CTGGTCTTCAGACCGTCCATCT;Fon-4R:TTGCA-GTGCTCGGTCATACATC。Fonq-2F/Fonq-2R扩增片段大小为244 bp;Fonq-2F/Fon-4R扩增片段大小1 446 bp。
1.3 方法
1.3.1 带菌土壤的制备
灭菌土壤样品制备:从湖南省水稻研究所连作多年的水稻试验田中取稻田土,高压蒸汽灭菌2 h,80℃烘干至重量无变化后过200目筛,过筛土壤用于制备不同孢子浓度的带菌土。孢子悬浮液的制备:利用PD培养液对尖孢镰刀菌1号生理小种进行摇培,5 d后用4层纱布过滤去除菌丝,得到孢子悬浮液。带菌土壤的制备:将孢子悬浮液离心浓缩,利用显微镜和血球计数板测定孢子浓度,并进行10倍梯度稀释。准确称取0.4 g灭菌水稻土6份,分别置于2 mL离心管中加入100 μL各浓度孢子悬浮液,配制成含水量约为20%,孢子浓度为4×101~4×106spore/g标准含菌土。
1.3.2 带菌土壤DNA提取
采用MoBio PowerSoil@DNA Isolation Kit提取带菌土壤DNA。真菌细胞壁的破除是影响土壤DNA提取效果的重要因素,所以本研究在采用该试剂盒提取时增加了20次反复冻融操作,具体过程为:取6个离心管,分别加入0.4 g不同孢子浓度带菌土,加入60 μL Solution C1充分摇匀,先70℃水浴2 min再液氮冷冻1 min,反复冻融20次;再70℃水浴10 min后于室温下10 000 r/min离心30 s,取上清于干净的2 mL离心管中,加入250 μL Solution C2,摇匀,4℃ 静置5 min,室温下10 000 r/min离心1 min,取600 μL上清液至新的离心管中,加入200 μL Solution C3,充分混匀,4℃静置10 min,室温下10 000 r/min离心1 min,取750 μL上清液,加入1.2 mL Solution C4,振荡5 s后转移到吸附柱中,室温10 000 r/min离心1 min,加入500 μL Solution C5,室温10 000 r/min离心30 s,将吸附柱至于新的2 mL离心管,加入100 μL Solution C6溶液至白色网膜中心,室温10 000 r/min离心30 s,置于-20℃保存备用。
1.3.3 荧光定量PCR标准曲线的建立
1.3.3.1 以带菌土壤DNA为模板绘制荧光定量PCR标准曲线
例如这一届评选出的两组纪实片,虽然看似离人像可能远一点,但是很有体温,能闻到泥土的芳香,能看到沙漠,能看到童真,有温暖,有品味。以及入选的名人肖像,并不是因为拍摄的是名人,而是因为拍摄手法很简单,摒除了一切装饰,人物本身精气神突出来了。
按照TransStart®Tip green qPCR SuperMix说明书推荐的20 μL体系,退火温度以58.0℃为基础,设定51.0、51.9、53.3、55.2、58.1、60.1、61.4和62.0℃ 8个温度梯度进行退火温度优化,根据扩增曲线和熔解曲线图以最高突光值(ARn)、最小Ct值且在熔解曲线分析中不产生非特异性峰为标准选择最优退火温度。实时荧光定量PCR反应体系为:TransStart®Tip green qPCR SuperMix 10 μL,模板DNA 1.0 μL,引物Fonq-2F (10 μmol/L)和Fonq-2R(10 μmol/L)各0.5 μL,dd H2O 8 μL。扩增条件为:95℃ 10 min;95℃ 15 s,60℃ 30 s,45个循环。熔解反应:95℃ 1 min,55℃ 30 s(每次循环温度变化0.5℃;结束温度95℃),共81个循环。
以浓度为4×101~4×106spore/g的6个带菌土壤DNA为模板,按优化的最佳退火温度60℃进行实时荧光定量PCR扩增,用仪器自带软件进行数据分析,以土壤含菌量的对数值(x)和对应的Ct值(y)绘制标准曲线。
1.3.3.2 以常规PCR预扩增产物为模板绘制荧光定量PCR标准曲线
常规PCR预扩增:以4×101~4×106spore/g的6个梯度带菌土壤DNA为模板,进行常规PCR扩增。采用20 μL反应体系:模板DNA 1 μL,10 μmol/L Fonq-2F和10 μmol/L Fon-4R各0.5 μL,dNTPs 2 μL,10×Buffer (Mg2+)2 μL,ddH2O 14 μL,EasyTaqⅠ0.5 μL。反应条件:94℃预变性4 min;94℃ 40 s,60℃ 40 s,72℃ 70 s,18个循环;72℃ 10 min。
标准曲线构建:以1.0 μL PCR预扩增产物为模板,按1.3.3.1的反应体系和扩增程序进行实时荧光定量PCR,以土壤含菌量的对数值(x)和对应的Ct值(y)绘制标准曲线。
1.3.4 稀释平板法验证
本研究采用的菌株为尖孢镰刀菌西瓜专化型1号生理小种,而能够从土壤中特异性筛选分离尖孢镰刀菌西瓜专化型的选择培养基目前还未见报道。因此,验证试验采用不含尖孢镰刀菌西瓜专化型的连作水稻田土,经过高温灭菌后按照1.3.1中的方法制备成孢子浓度为1.9×101~1.9×106spore/g 6个模拟带菌土壤样品,分别采用改良qPCR法和稀释平板法检测同一浓度带菌土壤中病原菌数量,以此对改良的qPCR检测方法进行综合评价。平板验证试验所用的选择培养基参照韩宝坤等[12]的方法配制。取去皮马铃薯块200 g加适量水熬煮20 min,取滤液加琼脂18~20 g煮熔,凉至45~50℃时加入95%乙醇17 mL、95%敌克松(fenaminosulf)结晶粉1.0 g、硫酸链霉素(streptomycin sulfate) 0.5~1.0 g,加水补足1 000 mL,搅拌均匀后倒平板。
分别取1.9×101~1.9×106spore/g的带菌土壤0.5 g按照1.3.3.2改良的qPCR法进行病原菌数量的定量检测;同时分别称取各浓度带菌土壤1 g,加9.9 mL无菌水,用干净的玻璃棒搅拌均匀后用移液枪吸取100 μL溶液于平板中,涂布均匀,置于28℃恒温箱中培养5 d后统计计数。
2 结果与分析
2.1.1 荧光定量PCR标准曲线的建立
以孢子浓度为4×101~4×106spore/g的6个带菌土壤的DNA及空白对照为模板进行荧光定量PCR反应,反应结束后,以土壤含菌量的对数值(x)和对应的Ct值(y)绘制标准曲线。熔解曲线(图1)峰单一无杂峰,扩增产物Tm值均一,为(86.5±0.5)℃,表明本试验所采用的西瓜枯萎病菌特异性引物专一性好,无非特异性扩增。带菌土壤中孢子含量在4×104~4×106spore/g时土壤含菌量的对数值与Ct值具有良好的线性关系(图2),相关系数r为0.985,扩增效率E为132.5%,斜率为-2.755 7,截距为43.285,从而得出土壤含菌量的对数值(x)与Ct值(y)之间的线性关系式为:y=-2.755 7x+43.285。

图1 荧光定量PCR熔解曲线Fig.1 Quantitative PCR melting curve

图2 荧光定量PCR标准曲线Fig.2 Fluorescence quantitative PCR standard curve
2.1.2 重复性和再现性评价
通过SPSS软件对前后3次重复试验的数据进行统计分析表明,各个浓度梯度的土壤样品在3次重复试验中的检测结果变化不大,组间变异系数为0.4%~1.59%(表1),证明建立的标准曲线具有较好的重复性。采用Duncan氏法对各浓度样品的Ct均值进行多重比较表明,孢子浓度为4×101spore/g带菌土壤的Ct值和空白对照差异不显著,4×102spore/g和4×103spore/g带菌土壤的Ct值差异不显著(表1),表明直接以提取的带菌土壤DNA为模板绘制荧光定量PCR标准曲线,病原菌的检测下限为4×103spore/g。
2.2 以常规PCR预扩增产物为模板绘制荧光定量PCR标准曲线
2.2.1 荧光定量PCR标准曲线的建立
为了提高qPCR的检测灵敏度,降低qPCR检测下限,本试验采用MoBio PowerSoil@DNA Isolation Kit提取含不同孢子浓度的土壤样品总DNA,以总DNA为模板先进行1次常规PCR预扩增,然后以预扩增产物为模板进行qPCR,以土壤含菌量的对数值(x)和对应的Ct值(y)构建标准曲线。结果表明,带菌土壤含菌量的对数值与Ct值在含菌量为4×102~4×106spore/g之间具有良好的线性关系(图3),相关系数r为0.974,扩增效率E为91.4%,斜率为-3.528,截距为36.434,从而得出土壤含菌量的对数值(x)与Ct值的线性关系式为:y=-3.5283x+36.434,有效检测下限为4×102spore/g,较未引入常规PCR方法前的qPCR检测灵敏度提高了10倍。
表1 重复性和再现性评价结果1)
Table 1 Evaluation of repeatability and reproducibility

样品浓度/spore·g-1Sampleconcentration组间变异Inter-assayvariations平均Ct值Mean标准差(n=3)SD变异系数/%CV4×10622.13e0.1680.764×10525.40d0.1800.714×10428.81c0.1860.644×10330.18b0.1190.404×10229.85b0.1270.424×10130.66a0.3511.14030.81a0.4911.59
1) 统计分析用SPSS软件,采用Duncan’s方法进行多重比较,不同处理平均Ct值后标不同字母表示处理间有显著差异(P<0.05),标相同字母表示处理间无显著差异,下同。 Statistical analysis was conducted by SPSS software, multiple comparisons were made by Duncan’s method. The different letters indicated there was significant difference between the treatments (P<0.05) and the same letters indicated that there was no significant difference between the treatments.The same as below.
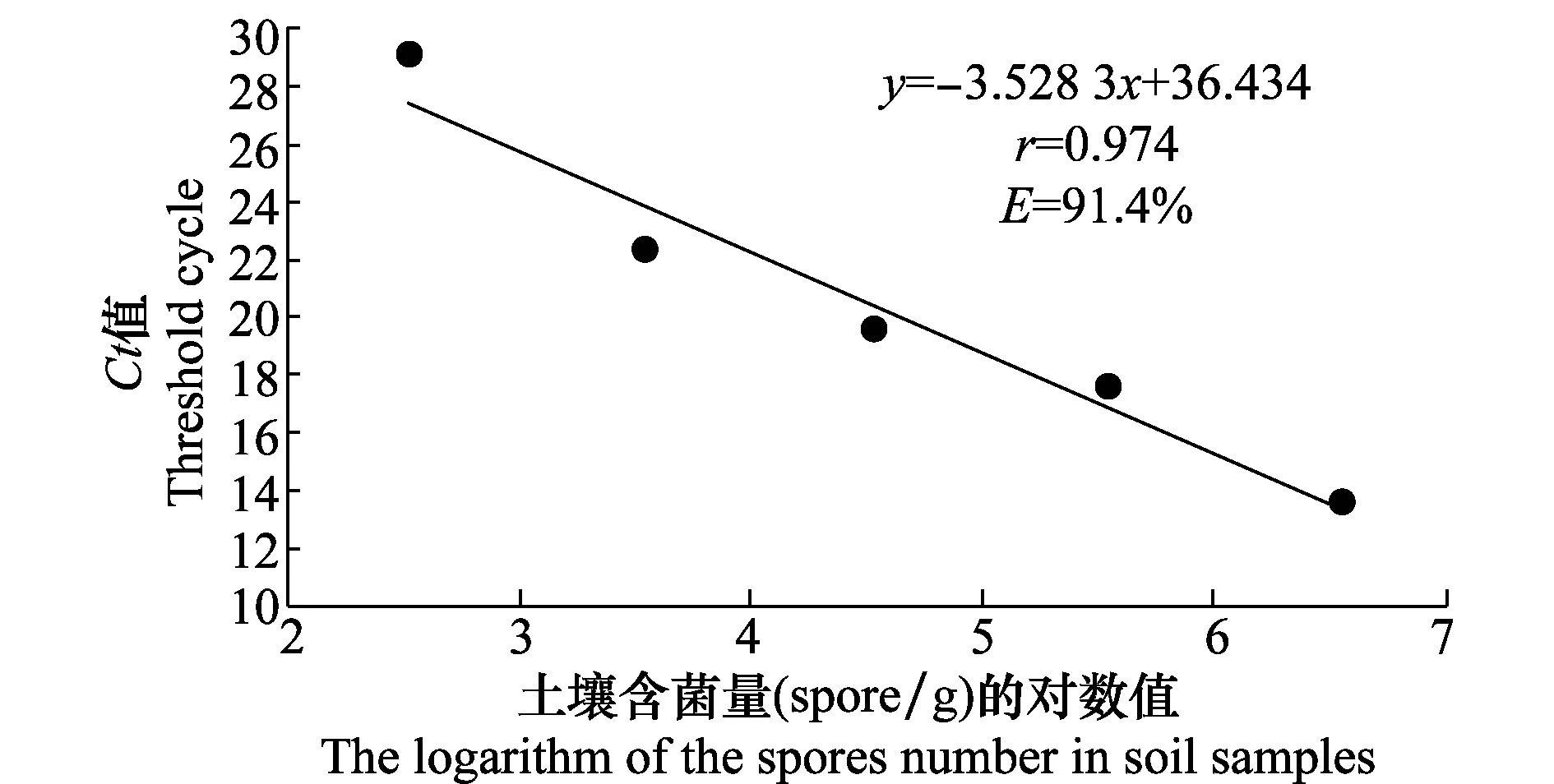
图3 荧光定量PCR标准曲线Fig.3 Fluorescence quantitative PCR standard curve
2.2.2 重复性和再现性评价
由表2可知,前后3次重复试验中各浓度梯度土壤样品的检测结果变化不大,组间变异系数0.45%~1.63%,证明建立的标准曲线具有较好的重复性。采用Duncan氏法对各浓度样品的Ct均值进行多重比较表明,4×101spore/g样品与空白对照的Ct值差异不显著,而4×102~4×106spore/g之间各浓度样品的Ct值具有显著差异,表明经过一轮预PCR扩增,然后以预扩增产物为模板绘制荧光定量PCR标准曲线可实现4×102spore/g土的病原菌检测下限。
表2 重复性和再现性评价结果
Table 2 Evaluation of repeatability and reproducibility

样品浓度/spore·g-1Sampleconcentration组间变异Inter-assayvariations平均Ct值Mean标准差(n=3)SD变异系数/%CV4×10613.61f0.1000.454×10517.69e0.1070.534×10419.49d0.1420.794×10322.24c0.1600.804×10228.98b0.1750.904×10130.43a0.3431.13030.45a0.4731.63
2.3 稀释平板法验证
本次检测试验除空白对照外共设置了1.9×101~1.9×106spore/g 6个浓度梯度的模拟带菌土样,每个样品3个重复。结果(表3)表明,采用改进的尖孢镰刀菌荧光定量PCR法检测的3个重复样品的变异系数为0.68%~1.68%,表明该方法具有较好的重复性和稳定性;而采用稀释平板法检测的变异系数为9.35%~18.90%,变异系数较大,表明稀释平板法各重复间的结果差异较大。
相比于样品初始浓度,稀释平板法的检出率为70.18%~85.96%,存在20%~30%的丢失率。改进的荧光定量PCR法对1.9×104、1.9×105、1.9×106spore/g 3个高浓度样品的检出率为94.85%~108%,准确率较高,检测结果与初始浓度差异较大的是含菌量为1.9×102spore/g的土壤样品,检出率为155.24%。总体而言,两种方法的检测结果与样品初始浓度在数量级上都呈现绝对的一致性,稀释平板法普遍存在20%~30%的丢失率,可能是样品中存在一定比例的失活孢子等原因所致,而改进的荧光定量PCR法的检测结果虽与样品初始浓度非常接近,但多有不同程度的偏高,可能与原孢子悬浮液中存在未降解的失活的病原菌有关。采用稀释平板法进行对比验证表明,经改进的尖孢镰刀菌荧光定量PCR检测方法能快速、有效地对土壤中尖孢镰刀菌进行定量检测。
表3 稀释平板法验证结果分析
Table 3 Validation analysis by dilution plate method

样品浓度/spore·g-1Sampleconcentration荧光定量PCR法 Improvedreal-timefluorescencequantitative含菌量平均值/spore·g-1Mean标准差(n=3)SD变异系数/%CV检出率/%Detectionrate稀释平板法 Dilutionplatemethod含菌量平均值/spore·g-1Mean标准差(n=3)SD变异系数/%CV检出率/%Detectionrate1.9×101----00001.9×102 294.9470.4161.50155.241.63×1021.539.3585.961.9×1032568.9930.4101.68135.211.40×1032.6518.9073.681.9×10419467.8420.2741.29102.461.33×1041.5311.4670.181.9×105180214.1580.1550.8794.851.53×1051.539.9680.701.9×1062060155.4430.0960.68108.431.46×1062.0814.1977.190----0000
3 讨论
土壤中存在的腐殖酸是土壤中固有组成成分之一,不同类型土壤中腐殖酸的含量不尽相同。荧光定量PCR测定的土壤病原菌数量是以提取的土壤总DNA为基础,土壤总DNA中的腐殖酸对PCR反应中的DNA聚合酶有抑制作用,去除腐殖酸提高DNA纯度可以避免其对PCR反应中DNA聚合酶的影响,但去除腐殖酸,纯化DNA的过程不可避免地导致DNA浓度的降低,这就是土壤DNA提取中浓度和纯度不可兼得的问题。
实时荧光定量PCR检测技术是一种非常灵敏、高效的分子检测方法,获得高纯度的土壤DNA是qPCR相关性强,重复性好的必然要求,模板DNA的浓度是影响荧光定量PCR检测下限的重要因素。本研究在进行qPCR扩增前利用耐腐殖质干扰的普通DNA扩增酶对土壤总DNA进行预扩增,此步骤不仅等梯度提高了各样品底物模板DNA的浓度,而且也降低了DNA中腐殖酸的相对含量,排除了腐殖酸对后续qPCR的干扰。预扩增获得的产物是浓度等梯度提高的各样品底物模板DNA,因而预扩增后产物与各土壤原始含菌量有着一一对应关系,这也是本研究引入常规PCR预扩增,以模拟带菌土壤含菌量的对数为横坐标,以预扩增产物为模板进行qPCR的Ct值为纵坐标构建土壤病原真菌荧光定量PCR标准曲线,实现4×102spore/g的土壤病原真菌qPCR检测下限的理论依据。
4 结论
本研究通过引入常规预PCR扩增包含qPCR目的序列的片段,提高模板DNA浓度并降低模板中腐殖酸等杂质的相对含量,成功地以带菌土壤DNA为模板构建了qPCR标准曲线,较未引入预PCR扩增前提高检测下限10倍,实现荧光定量PCR对土壤病原菌数量为4×102~4×106spore/g的有效定量检测,结合不同土壤病原真菌的特异性引物,该检测方法可为土壤病原真菌的有效定量检测提供理论支撑。
[1] 李洪连, 黄俊丽, 袁红霞.有机改良剂在防治植物土传病害中的应用[J]. 植物病理学报, 2002, 32(4):289-295.
[2] Higuchi R, Dollinger G, Walsh P S, et al. Simultaneous amplification and detection of specific DNA sequences [J]. Nature Biotechnology, 1992, 10(4): 413-417.
[3] Bustin S A, Mueller R.Real-time reverse transcription PCR (qRT-PCR) and its potential use in clinical diagnosis [J]. Clinical Science, 2005, 109(4): 365-379.
[4] 陈旭, 齐凤坤, 康立功, 等. 实时荧光定量PCR技术研究进展及其应用[J]. 东北农业大学学报, 2010, 21(8):148-155.
[5] 魏锋, 余真真, 商文静, 等. 土壤大丽轮枝菌微菌核的快速定量检测[J]. 植物病理学报, 2013, 43(5):449-457.
[6] 王淑芳,马桂珍,暴增海,等.辣椒疫霉菌(Phytophthoracapsici)实时荧光定量检测方法的研究[J].作物杂志,2012(5): 30-35.
[7] 肖蕊, 余真真, Elsharawy A A, 等. 土壤中棉花黄萎病菌SYBR Green Ⅰ荧光RT-PCR定量检测技术研究[J]. 菌物学报, 2011, 30(4):598-603.
[8] 赵裕栋, 周俊, 何璟. 土壤微生物总DNA提取方法的优化[J]. 微生物学报, 2012, 52(9):1143-1150.
[9] Yeates C, Gillings M R, Davison A D, et al. Methods for microbial DNA extraction from soil for PCR amplification [J]. Biological Procedures Online, 1998, 1(1): 40-47.
[10]李瑞琴, 刘星, 邱慧珍, 等. 发生马铃薯立枯病土壤中立枯丝核菌的荧光定量PCR快速检测[J]. 草业学报, 2013, 22(5):136-144.
[11]赵爽, 罗佳, 凌宁, 等. 基因宏阵列和荧光定量PCR方法对西瓜枯萎病害土壤中尖孢镰刀菌的快速检测和定量[J]. 土壤学报, 2010, 47(4):703-708.
[12]韩宝坤, 杜艳华. 非无菌操作下分离尖孢镰刀菌的培养基[J]. 植物病理学报, 2001, 31(4):373.
(责任编辑:杨明丽)
An improved real-time fluorescence quantitative PCR method for detectingFusarium
Huang Huaidong1,2, Xiao Jiling2, Zhang Yi2, Ruan Wanhui2, Wei Lin3, Liang Zhihuai1,2
(1.LongpingBranchofGraduateSchool,CentralSouthUniversity,Changsha410125,China; 2.HunanWatermelonandMuskmelonInstitute,Changsha410125,China; 3.HunanInstituteofPlantProtection,Changsha410125,China)
The aim of this study is to develop a more efficient and sensitive method for quantitative detection of soil pathogens by real-time PCR. The soil samples containing 4×101-4×106spore/g were prepared by mixing the cultured spore suspension and long-term cultivated paddy soil. The total DNA was extracted from the prepared soil samples using MoBio PowerSoil@DNA Isolation Kit. A 1 446 bp DNA fragment containing the qPCR target sequence was amplified from soil DNA by conventional PCR, then the PCR products were used as templates to construct the standard curve of the fluorescence quantitative PCR. The results indicated that the correlation coefficient of qPCR standard curve was 0.985, and the lower limit of detection was 4×103spore/g when the soil DNA was used as PCR templates. When the pre-amplified PCR products were used as template, the correlation coefficient of qPCR standard curve was 0.974, and the lower limit of detection was 4×102spore/g, that is the sensitivity of the method increased by 10-fold. These results showed that when combined with the specific primers of different soil pathogenic fungi, this method can provide technical support for effective quantitative detection of soil pathogens.
real-time PCR; soil pathogenic fungi;Fusarium; detection limit
2016-10-16
2017-01-07
公益性行业(农业)科研专项(201503110-03)
S 436.68, S 154.3
A
10.3969/j.issn.0529-1542.2017.04.024
* 通信作者 E-mail: liangzhihuainky@163.com

