LC-MS/MS 法测定猪肉中泰妙菌素及8-α-羟基泰妙菌素
范宏
(承德护理职业学院,河北承德067000)
LC-MS/MS 法测定猪肉中泰妙菌素及8-α-羟基泰妙菌素
范宏
(承德护理职业学院,河北承德067000)
采用磷酸缓冲液-乙酸乙酯混合提取、正己烷除脂、MCX柱净化,采用液相色谱-质谱法(LC-MS/MS)建立了同时测定猪肉中泰妙菌素及8-α-羟基泰妙菌素残留量的分析方法。结果表明:在泰妙菌素和8-α-羟基泰妙菌素加标浓度5.0 μg/kg~500.0 μg/kg范围内,相关系数分别为0.999 8和0.999 7,线性关系良好;检测限(LOD)分别为1.5 μg/kg和3.0 μg/kg,定量限(LOQ)分别为5.0 μg/kg和10.0 μg/kg;平均回收率为83.4%~97.6%,相对标准偏差(RSD)为2.4%~5.3%。
泰妙菌素;8-α-羟基泰妙菌素;液相色谱-质谱法;猪肉
泰妙菌素(pleuromulin),又称泰妙霉素、泰妙灵,分子式为C28H47NO4S,CAS号为55297-95-5,是一种双萜烯类畜禽专用抗生素[1-2],其抗菌谱与大环内酯类抗生素相近,用于畜禽呼吸道疾病及支原体关节炎等疾病的防治,目前是被全球广泛应用的主要兽用抗生素[2-4]。低剂量的泰妙霉素可提高饲料利用率,促进动物生长,但过量使用可导致泰妙霉素在体内残留或蓄积,并可通过食物链进入人体,危害人类健康。美国、欧盟、日本都明确规定了泰妙菌素最高残留限量(MRL),我国农业部235号规定了泰妙菌素及其代谢产物8-α-羟基泰妙菌素的总量,在猪体内组织最高残留限量:肌肉100 μg/kg,肝脏500 μg/kg[5]。但目前缺乏关于8-α-羟基泰妙菌素的检测方法标准。
当前关于泰妙菌素的检测方法主要有微生物法[3]、气相色谱法(GC)[2]、液相色谱法(HPLC)[6-7]、液相色谱-质谱法(LC-MS/MS)[8-11],其中微生物法前处理繁琐,准确度差;GC需要衍生化,操作复杂,精密度差;HPLC尽管仪器普及面广、定量准确,但是检出限高,无法用于低浓度兽药残留检测;LC-MS/MS具有检出限低,选择性高、灵敏度强等特点而广泛应用。本文采用磷酸缓冲液-乙酸乙酯混合提取、正己烷除脂、MCX柱净化,采用液相色谱-质谱法(LC-MS/MS)同时测定猪肉中泰妙菌素及8-α-羟基泰妙菌素残留量,该方法检出限低,精密度好,准确度高,可用于进出口猪肉中泰妙菌素及其代谢产物8-α-羟基泰妙菌素残留量检验检测的要求,并为畜禽食品中泰妙菌素残留量检测方法标准的制修订提供参考。
1 材料与方法
1.1 仪器与试剂材料
Waters Acquity UPLC XEVO TQ MS型超高效液相色谱-串联三重四极杆质谱仪:沃特世科技(上海)有限公司;Maxi Mix II型漩涡震荡器:赛默飞世尔科技(中国)有限公司;XT-NS 1型全自动氮吹浓缩仪:上海新拓分析仪器科技有限公司;Milli-Q REFERENCE型超纯水系统:密理博中国有限公司;R-300型旋转蒸发仪:瑞士步琦有限公司;BSA224S电子天平:赛多利斯科学仪器有限公司。
泰妙菌素标准物质(纯度≥99%):瑞士CARBOGEN AMCIS AG公司;8-α-羟基泰妙菌素标准物质(纯度≥99%):山德士(中国)制药有限公司;甲醇、丙酮、正己烷、甲酸(均为色谱纯):默克投资(中国)有限公司;浓盐酸、二氯甲烷、氢氧化钠(均为分析纯):国药集团化学试剂有限公司。
1.2 溶液配制
分别称取泰妙菌素、8-α-羟基泰妙菌素各100.0mg(精确至0.1 mg),用适量甲醇溶解后,置于50 mL容量瓶中,用甲醇定容至刻线,配制成各目标物浓度为2.0 mg/mL标准储备溶液,-20℃避光保存。分别吸取适量泰妙菌素和8-α-羟基泰妙菌素标准储备溶液,先用甲醇配制成各目标物浓度为100 μg/mL的混合标准溶液,然后用20%甲醇溶液逐级稀释配制浓度为5、10、50、100、200 ng/mL的系列混合标准工作液,4℃避光保存。
磷酸缓冲液(pH=8.0):称取0.52 g KH2PO4,16.73 g K2HPO4,以三蒸水定容至500 mL。磷酸缓冲液(pH= 4.5):在磷酸缓冲液(pH=8.0)中滴加磷酸使其pH值为4.5。
1.3 LC-MS/MS
色谱条件:色谱柱为ACQUITY UPLC BEH C18(2.1 mm×100mm,1.7μm);柱温为35℃;流动相A为纯甲醇;流动相B为0.1%甲酸水溶液;流速:0.2 mL/min,进样量为10 μL。梯度洗脱程序为0.0 min~0.1 min,20% A;0.1 min~3.5 min,90%A;3.5 min~4.5 min,20%A;4.5 min~5.0 min,20%A。
质谱条件:电离方式为电喷雾电离,正离子模式ESI(+);检测方式:多重反应监测(MRM);离子源温度为150℃;脱溶剂气为氮气,气速9.5L/min,温度350℃;锥孔气为氮气,气速1.0 L/min;碰撞气为氩气;其它质谱条件见表1。
1.4 样品前处理
准确称取5 g样品(精确至0.1 mg),加入5 mL磷酸缓冲液(pH=8.0),匀浆后置于50 mL离心管中,加入20 mL乙酸乙酯超声提取20 min,以6 000 r/min离心10 min,收集有机相。再用20 mL乙酸乙酯超声提取2次,合并有机相后,旋转蒸干,加入5 mL磷酸缓冲液(pH=4.5)溶解残渣,再加入5 mL正己烷涡旋振荡去脂,8 000 r/min离心5 min,取下层提取液经MCX固相萃取柱净化,5 mL甲醇洗脱,45℃氮气吹干后1 mL甲醇定容、溶解,经0.22 μm微孔滤膜过滤,供LC-MS/ MS测定。
2 结果与讨论
2.1 色谱条件优化
采用ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱,考察0.1%甲酸水-乙腈,0.1%甲酸水-甲醇,5 moL/L乙酸铵(含0.1%甲酸)-甲醇,5 moL/ L乙酸铵(含0.1%甲酸)-乙腈等不同流动相对泰妙菌素和8-α-羟基泰妙菌素的分离效果。结果显示:以0.1%甲酸水-甲醇作为流动相,经梯度洗脱后,泰妙菌素和8-α-羟基泰妙菌素与杂质峰实现很好的分离,峰形对称,无拖尾和前延现象,响应值高,在5 min内全部出峰,节省了分析时间。猪肉加标样品中泰妙菌素和8-α-羟基泰妙菌素MRM色谱图见图1所示。
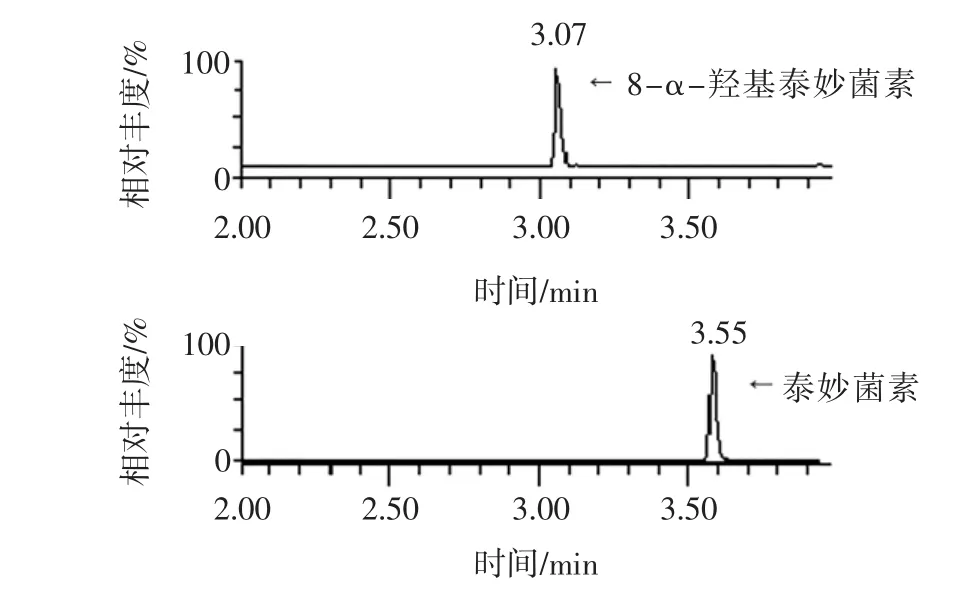
图1 猪肉加标样品中泰妙菌素和8-α-羟基泰妙菌素MRM色谱图Fig.1 Chromatogram of MRM of pleuromulin and 8-α-hydroxypleuromulin
2.2 质谱条件优化
根据目标化合物泰妙菌素和8-α-羟基泰妙菌素的结构特征,确定加合H+形成带正电荷的母离子[M+H]+,因此选用ESI+为离子化模式,配制1 μg/mL的泰妙菌素和8-α-羟基泰妙菌素标准溶液,采用流动注射泵进样,进行一级质谱扫描,确定准分子离子峰。同时对离子源温度、干燥气温度、雾化器压力等质谱参数进行优化,并以准分子离子采用MRM监测方式进行二级质谱扫描,优化碰撞能量,选择两个信噪比较高的特征子离子作为定量、定性离子对。结果显示:泰妙菌素的准分子离子[M+H]+为m/z 494.3,产生m/z 192.1、119.1的子离子;8-α-羟基泰妙菌素的准分子离子[M+H]+为m/z 337.2,产生m/z 301.0、283.1的子离子,其具体质谱参数见表1。

表1 待测物部分质谱参数Table 1 Mass spectrometric parameters of the analytes
2.3 萃取溶剂的选择
根据相似相容原理,泰妙菌素和8-α-羟基泰妙菌素偏弱极性,故考察了丙酮、乙酸乙酯、二氯甲烷、乙醚等不同萃取溶剂对泰妙菌素和8-α-羟基泰妙菌素提取效率的影响见图2。
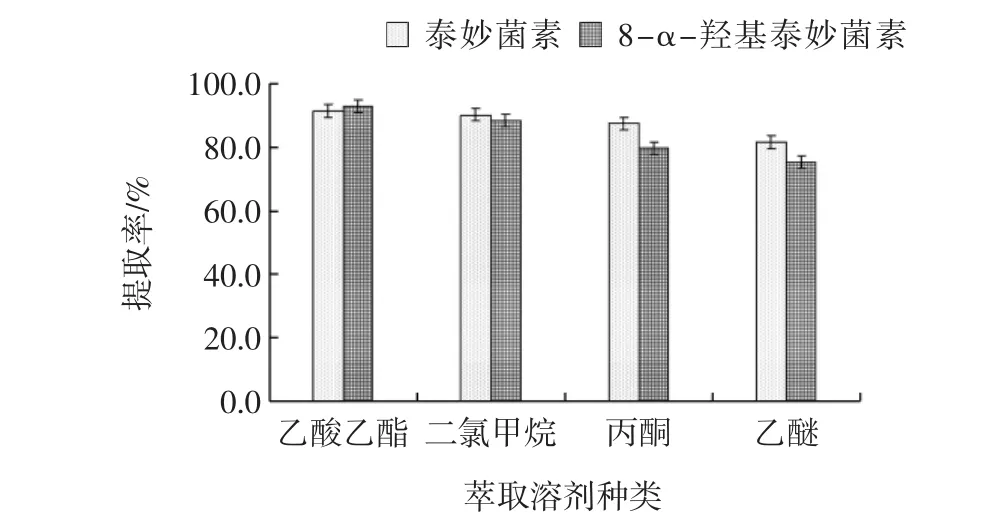
图2 不同萃取溶剂的提取率Fig.2 Extraction rate of different extraction solvents
从图2中可知:按照泰妙菌素和8-α-羟基泰妙菌素提取率高低顺序依次为:乙酸乙酯(92.3%)>二氯甲烷(89.4%)>丙酮(83.7%)>乙醚(78.6%),其中乙酸乙酯对泰妙菌素和8-α-羟基泰妙菌素提取率最高,提取率分别为91.5%和93.1%,平均值92.3%;虽然乙酸乙酯对泰妙菌素和8-α-羟基泰妙菌素的萃取效率最高,可仍有部分油脂被萃取到提取液中,可对LCMS/MS仪器响应值有明显的抑制作用,影响灵敏度,但经正己烷脱脂后,可有效提高其检测响应值,从而提高LC-MS/MS检测灵敏度。故选择乙酸乙酯作为萃取溶剂。
2.4 SPE净化柱的选择
通过样品加标试验,考察不同SPE净化柱(MCX、SCX、C18、HLB、MAX、WAX)对泰妙菌素和8-α-羟基泰妙菌素的净化效果见图3。
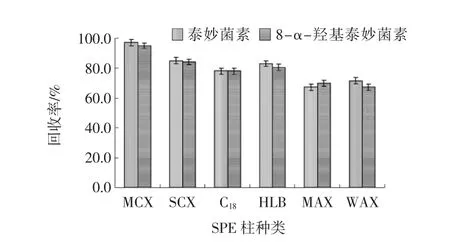
图3 不同净化柱的净化回收效果Fig.3 Purification and recovery effect of different purification column
结果表明,强阳离子交换柱(MCX和SCX)对泰妙菌素和8-α-羟基泰妙菌素的具有较好的净化和浓缩作用,特别是MCX柱净化回收率高达97.2%;弱阳离子交换柱(HLB、C18)回收率适中;而弱阴离子交换柱(MAX和WAX)净化回收率较差。因此,选择MCX固相萃取柱作为净化柱。
2.5 基质效应
基质对目标物的分析可产生显著的干扰,称之为基质效应(Matrix effect,ME),严重的基质效应可直接影响测定结果的准确性,本文研究对象猪肉组织中基质复杂,含有大量的内源性化合物,所以考察了基质效应对LC-MS/MS的影响。在纯甲醇溶液、空白猪肉基质中精确加入一定量的泰妙菌素和8-α-羟基泰妙菌素标准溶液,配制成低、中、高3种浓度溶液,按上述所建方法进行测定,比较纯甲醇溶液和猪肉基质中被测组分的峰面积,计算基质效应(ME)=Ap/As,其中Ap指猪肉基质中被测组分的峰面积;As指纯甲醇溶液中被测组分的峰面积;当ME>1表示存在基质增强效应,当ME<1表示存在基质抑制效应;M=1表示在曲线范围浓度内基质对响应强度无影响。基质效应ME值见表2。
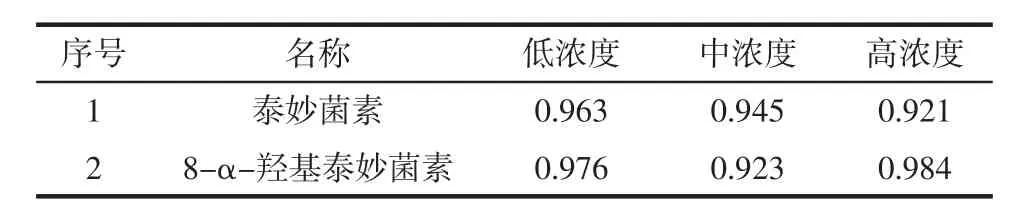
表2 基质效应ME值Table 2 ME value of matrix effect
从表2中可知:泰妙菌素的基质效应ME值在0.921~0.963,8-α-羟基泰妙菌素的基质效应ME值在0.923~0.984,即表明没有明显的基质增强或抑制效应。
2.6 线性范围与检出限
在猪肉空白样品中,分别加入适量的泰妙菌素和8-α-羟基泰妙菌素标准溶液,制备成泰妙菌素和8-α-羟基泰妙菌素标准溶液浓度依次为5.0、10.0、20.0、50.0、100.0、500 μg/kg的试样,按上述所建方法进行测定,以色谱峰面积(y)为纵坐标,被测组分的质量浓度(x)为横坐标,绘制标准曲线,求回归方程和相关系数;根据6个空白猪肉样品的基线噪音求其平均值,按信噪比(RS/N=3)计算其方法检测限(LOD),信噪比(RS/N= 10)计算其方法定量限(LOQ)(表3)。结果说明:泰妙菌素和8-α-羟基泰妙菌素在加标浓度为5.0 μg/kg~ 500.0μg/kg范围内,相关系数分别为0.9998和0.9997,线性关系良好;LOD分别为1.5 μg/kg和3.0 μg/kg,LOQ分别为5.0 μg/kg和10.0 μg/kg,这说明该方法灵敏度高,低于我国农业部公告第235号中关于动物性食品中兽药最高残留限量要求。线性方程、相关系数、检测限和定量限见表3。
2.7 回收率与精密度
在猪肉空白样品中分别加入线性范围内低、中、高3种浓度的泰妙菌素和8-α-羟基泰妙菌素标准溶液,每个浓度平行测定6次,泰妙菌素和8-α-羟基泰妙菌素标准溶液的回收率及相对标准偏差(RSD)如表4所示。
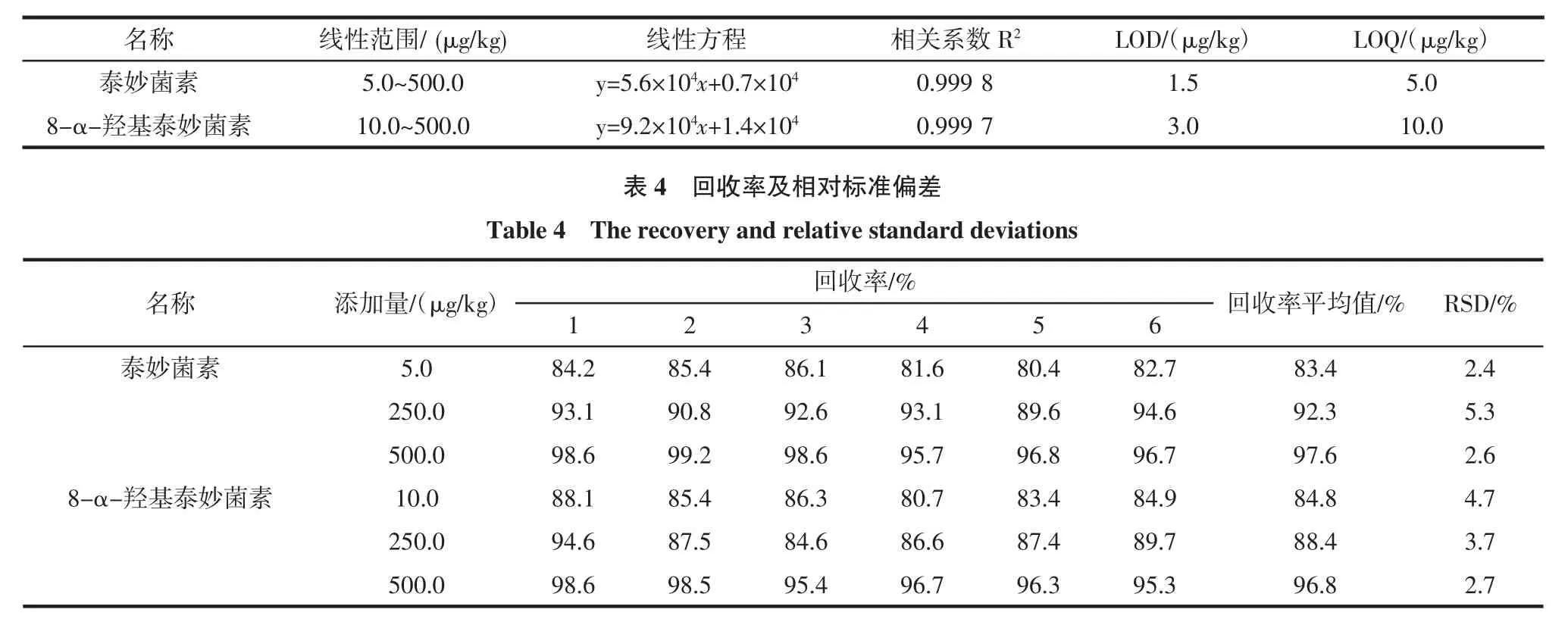
表3 线性方程、相关系数、检测限和定量限Table 3 Linear relationship,correlation coefficients,LOD and LOQ
结果表明:泰妙菌素和8-α-羟基泰妙菌素的平均回收率为83.4%~97.6%,RSD为2.4%~5.3%,符合兽药残留分析的准确度和精密度要求。
2.8 实际样品的测定
随即选取河北承德市农贸市场销售的各种新鲜猪肉30份,按上述所建方法进行测定猪肉中泰妙菌素和8-α-羟基泰妙菌素残留量的测定。结果显示:1份试样中检出含有泰妙菌素(213.8 μg/kg),阳性检出率为3.3%;4份试样中检出含有8-α-羟基泰妙菌素(56.7 μg/kg~314.2 μg/kg),阳性检出率为13.3%;8-α-羟基泰妙菌素阳性检出率高于泰妙菌素阳性检出率,这可能是由于部分猪肉中泰妙菌素经新陈代谢生成8-α-羟基泰妙菌素所导致的。检测结果表明猪肉中存在一定量的泰妙菌素和8-α-羟基泰妙菌素残留。
3 结论
本文采用磷酸缓冲液-乙酸乙酯混合提取、水饱和正己烷除脂、MCX柱净化,采用液相色谱-质谱法(LC-MS/MS)法建立了同时测定猪肉中泰妙菌素及8-α-羟基泰妙菌素残留量的分析方法。结果表明:泰妙菌素和8-α-羟基泰妙菌素在加标浓度为5.0 μg/kg~500.0μg/kg范围内,相关系数分别为0.9998和0.9997,线性关系良好;LOD分别为1.5 μg/kg和3.0 μg/kg,LOQ分别为5.0 μg/kg和10.0 μg/kg;平均回收率为83.4%~97.6%,RSD为2.4%~5.3%,该方法检出限低,精密度好,准确度高,可用于进出口猪肉中泰妙菌素及其代谢产物8-α-羟基泰妙菌素残留量检验检测的要求,并为畜禽食品中泰妙菌素残留量检测方法标准的制修订提供参考。
[1]黄贺贤,曾振灵,黄显会.截短侧耳素类抗生素一泰妙菌素的研究进展[J].中国兽药杂志,2010,44(6):42-45
[2]汤有志,远立国,刘雅红.截短侧耳素类抗生素的研究进展[J].中国兽医杂志,2012,48(5):65-68
[3]黄贺贤,曾振灵,黄显会,等.泰妙菌素混悬注射液在猪体内的药物动力学及生物利用度研究[J].中国农业科学,2010,43(10):2168-2173
[4]Rodger N,M S D.The pleuromutilin antibiotics:a new class for human use[J].Curr Opin Investig Drugs,2010,11(2):182-191
[5]叶妮,尹晖,王亦琳,等.动物性食品中泰妙菌素残留标志物检测UPLC-MS/MS法研究[J].中国兽药杂志,2016,50(11):49-53
[6]程林丽,张素霞,沈建忠,等.高效液相色谱法快速检测猪组织中泰妙菌素残留[J].分析化学,2009,37(5):718-720
[7]张骏豪,谭艾娟,吕世明,等.HPLC法同时检测猪肉中泰乐菌素和泰妙菌素[J].山地农业生物学报,2011,30(1):87-90
[8]黄雅丽.固相萃取-高效液相色谱-串联质谱法测定禽畜和水产品中沃尼妙林和泰妙菌素[J].分析试验室,2010,29(1):103-106
[9]Siegrid De Baere,Mathias Devreese,An Maes,et al.Quantification of 8-α-hydroxy-mutilin as marker residue for tiamulin in rabbit tissues by high-performance liquid chromatography-mass spectrometry[J].Analytical and Bioanalytical Chemistry,2015,407(15):4437-4445
[10]耿士伟,朱志谦,曲斌,等.高效液相-串联质谱法测定鸡肉中泰妙菌素残留的研究[J].中国家禽,2012,34(11):28-33
[11]刘晓茂,李学民,葛娜,等.超高压液相色谱-串联质谱法测定肉类中沃尼妙林和泰妙菌素的残留量[J].食品与发酵工业,2012,38 (8):182-186
Determination of the Content of Pleuromulin and 8-α-hydroxy-pleuromulin in Pork by LC-MS/MS
FAN Hong
(Chengde Nursing Career Academy,Chengde 067000,Hebei,China)
Extracting by using phosphate buffer and ethyl acetate mixed,and degreasing by n-hexane,and purifying by MCX column,the method was established for determination of the content of pleuromulin and 8-αhydroxy-pleuromulin in pork by liquid chromatography-mass spectrometry(LC-MS/MS).The results showed that the correlation coefficients of pleuromulin and 8-α-hydroxy-pleuromulin were 0.999 8 and 0.999 7 in spiked concentration from 5.0 μg/kg to 500.0 μg/kg,and they had good linear relationsh.The limit of detection(LOD)were 1.5 μg/kg and 3.0 μg/kg,and the limit of quantification(LOQ)were 5.0 μg/kg and 10.0 μg/kg;the average recovery rate were from 83.4%to 97.6%,and relative standard deviations(RSD)were from 2.4%to 5.3%.
pleuromulin;8-α-hydroxy-pleuromulin;liquid chromatography mass spectrometry;pork
2016-11-16
范宏(1976—),女(汉),副教授,硕士,主要从事化学教学及研究工作。
10.3969/j.issn.1005-6521.2017.16.031

