中国Peutz-Jeghers综合征患者STK11基因突变检测及高频突变分析
蒋宇亮,李伟聪,赵子夜,李白容,毛旭艳,宁守斌*
(1.中国人民解放军空军总医院消化科,北京 100142;2.河北北方学院研究生院,河北 张家口 075061;3.航天中心医院老年2科,北京 100040;4.中国人民解放军第二七三医院外一科,新疆 库尔勒 841007;5.北京市新华医院消化科,北京 101100)
·论 著·
中国Peutz-Jeghers综合征患者STK11基因突变检测及高频突变分析
蒋宇亮1,2,李伟聪3,赵子夜4,李白容1,毛旭艳5,宁守斌1*
(1.中国人民解放军空军总医院消化科,北京 100142;2.河北北方学院研究生院,河北 张家口 075061;3.航天中心医院老年2科,北京 100040;4.中国人民解放军第二七三医院外一科,新疆 库尔勒 841007;5.北京市新华医院消化科,北京 101100)
目的分析Peutz-Jeghers综合征(Peutz-Jeghers syndrome,PJS)患者丝/苏氨酸蛋白激酶11(serine/threonine kinase 11,STK11)基因突变情况,探讨不同STK11基因突变与临床特征的关系。方法选择完成STK11所有外显子基因测序的患者54例,分析其临床表现及突变分布规律,并比较不同突变间临床特征。结果54例患者中,33例在STK11基因编码区检测出点突变,先证者30例(检出率58.8%,30/51),家族突变检出率为55.0%(11/20),散发突变检出率为55.9%(19/34)。3个家系共5例患者在同一位点突变(c.180C>G),疑为高频突变;另1个家系的2例患者突变位点一致(c.658C>T);1例患者同时检测到2个突变位点;剩余26例患者携带突变各不相同。c.180C>G首次发病年龄和首次手术年龄≤7岁患者中所占比例明显高于其他突变,差异有统计学意义(P<0.05);c.180C>G与其他突变在性别、家族史、肿瘤史、腹部症状、手术史差异均无统计学意义(P>0.05)。结论STK11基因突变是PJS发病的主要致病原因。发现1例可疑为高频突变,该突变患者首次发生症状及接受首次手术年龄均低于其他突变患者,应在临床监测及治疗过程中多予以关注。
Peutz-Jeghers综合征;p21活化激酶类;基因;突变
Peutz-Jeghers综合征(Peutz-Jeghers syndrome,PJS)是一种罕见的以皮肤黏膜色素沉着和胃肠道多发息肉为主要表现的的常染色体显性遗传性疾病,30%~50% PJS患者有家族遗传病史[1]。分子遗传学研究表明,位于19号染色体短臂19p13.3区间的丝/苏氨酸蛋白激酶(serine/threonine kinase 11, STK11 )基因是PJS的主要致病基因[2],可发生基因的杂合性缺失、移码突变或无义突变等,从而造成STK11 基因功能丧失。STK11 基因编码区为1 302 bp,由9个外显子组成,编码相对分子质量为60 000的433个氨基酸组成的STK11,属于一种环磷酸腺苷(cyclic adenosine monophosphate,cAMP)依赖的蛋白激酶,其功能催化区域位于第44~309位氨基酸残基。PJ息肉可致急慢性腹痛、肠套叠、肠扭转、肠梗阻、胃肠道出血等严重并发症,其中以小肠套叠最常见[3],通常发生于儿童期[4]。中国人民解放军空军总医院应用PCR-DNA测序技术对54例中国PJS患者的STK11 基因编码区进行检测,其中发现1例高频突变位点,并对其临床相关因素进行了分析,现将结果报告如下。
1 资料与方法
1.1 一般资料 收集2009年1月—2015年1月在中国人民解放军空军总医院临床确诊,并同时接受PCR扩增技术、DNA测序及序列比对分析的PJS患者54例。其中男性30例,女性24例,年龄10~51岁,平均(30.12±10.98)岁。包括17个家系20例患者,34例散发患者。本研究遵守赫尔辛基宣言并由中国人民解放军空军总医院伦理委员会批准。征得所有患者及家属同意,并签署知情同意书。
1.2 纳入标准及排除标准 纳入标准:(1)入组的所有患者均符合PJS的诊断标准[4][即以下4条中的任何1条:①2个或多个息肉,经组织学诊断符合PJS特点,即起源于黏膜肌层的平滑肌像树枝样延伸至息肉的黏膜下层,称之为PJ息肉(图1);②具有PJS家族史且伴有任何数量的PJ息肉;③具有PJS家族史且典型的皮肤黏膜色素沉着;④典型的皮肤黏膜色素沉着且伴有任何数量的PJ息肉];(2)均抽取外周静脉血,提取基因组DNA,应用PCR扩增技术及DNA测序方法检测STK11基因编码区序列。排除标准:不能同时满足以上2项纳入标准者。

图1 PJ息肉光镜下表现(HE ×10)
Figure 1 Performance of PJ polyps tissue under light microscope(HE ×10)
1.3 研究方法
1.3.1 DNA提取 PJS患者均抽取外周静脉血2~4 mL,EDTA-K2抗凝。应用血液基因组DNA提取试剂盒(天根生化公司、上海南方基因科技有限公司)方法提取基因组DNA,经紫外分光光度法检测DNA的浓度及纯度。-20 ℃保存备用。
1.3.2 引物设计 应用Primer 5.0软件设计引物,引物合成由军事医学科学院合成生物学实验室、上海南方基因科技有限公司完成。
1.3.3 PCR扩增及琼脂糖凝胶电泳 对以上STK11外显子区域在PCR仪器上进行PCR扩增,并用2%琼脂糖凝胶电泳检测PCR扩增效果。
1.3.4 DNA测序 对PCR扩增产物纯化后应用DNA全自动测序仪进行测序,测序反应引物同时扩增产物,测序产物用MEGA 6.05软件进行序列分析,并将测序结果与基因库中提供的STK11基因进行对比。
1.4 统计学方法 应用SPSS 18.0统计学软件分析数据。计数资料比较采用Fisher精确检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PCR扩增产物电泳分析结果 54例PJS患者提取的DNA样本扩增后所获得的PCR产物用1%琼脂糖凝胶电泳进行检测,结果表明PCR扩增产物长度符合目的片段理论值且特异性好。
2.2 DNA测序结果及分析
2.2.1 突变总体检出情况 54例PJS患者序列比对发现33例患者存在STK11基因编码区的突变,30例为先证者,先证者点突变检出率为58.8%(30/51),其中错义突变占80.0%(24/30),删除突变占10.0%(3/30),插入突变占10.0%(3/30)。家族突变检出率为55.0%(11/20),散发突变检出率为55.9%(19/34)。3个家系共5例患者在同一位点突变(c.180C>G),疑为高频突变;另1个家系的2例患者突变位点一致(c.658C>T);1例患者(PJS12)同时检测到2个突变位点(c.250A>T,c.1 062C>G),该患者第250位密码子A>T的突变引起K84X,在第84位氨基酸形成终止密码子,考虑c.1 062C>G为多态性位点;剩余26例患者携带突变各不相同。其余21例患者STK11基因编码区未检测到点突变。有家族史患者14例,无家族史患者19例,比例为1∶1.3。男性18例,女性15例,男女比例1∶0.83。见表1。

表1 33例PJS患者STK11基因编码区突变情况Table 1 Mutation of STK11 gene coding region in 33 patients with PJS
2.2.2 c.180C>G临床特征 本组样本平均发病年龄为5.8岁(1~14岁);男性占比高(80.0%,4/5);均无肿瘤家族史;均因腹痛、呕吐发病就诊;4~7岁为高发年龄段;80.0%(4/5)患者因肠梗阻、肠套叠首次接受手术。见表2。
2.2.3 c.180C>G与其他突变相关特征比较 c.180C>G首次发病年龄和首次手术年龄≤7岁患者中所占比例明显高于其他突变,差异有统计学意义(P<0.05);c.180C>G与其他突变在性别、家族史、肿瘤史、腹部症状、手术史差异均无统计学意义(P>0.05)。见表3。
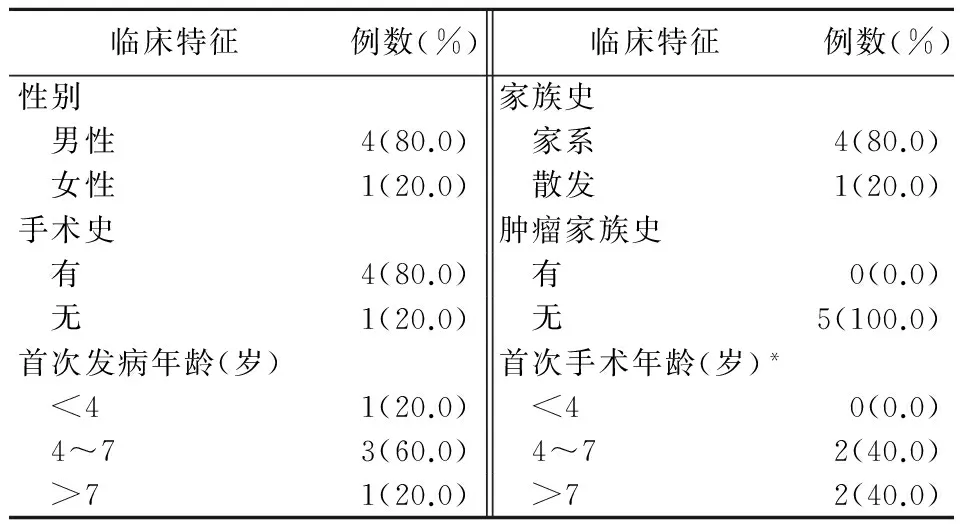
表2 c.180C>G患者临床特征Table 2 Clinical characteristics of patients with c.180C>G
*1例未行手术
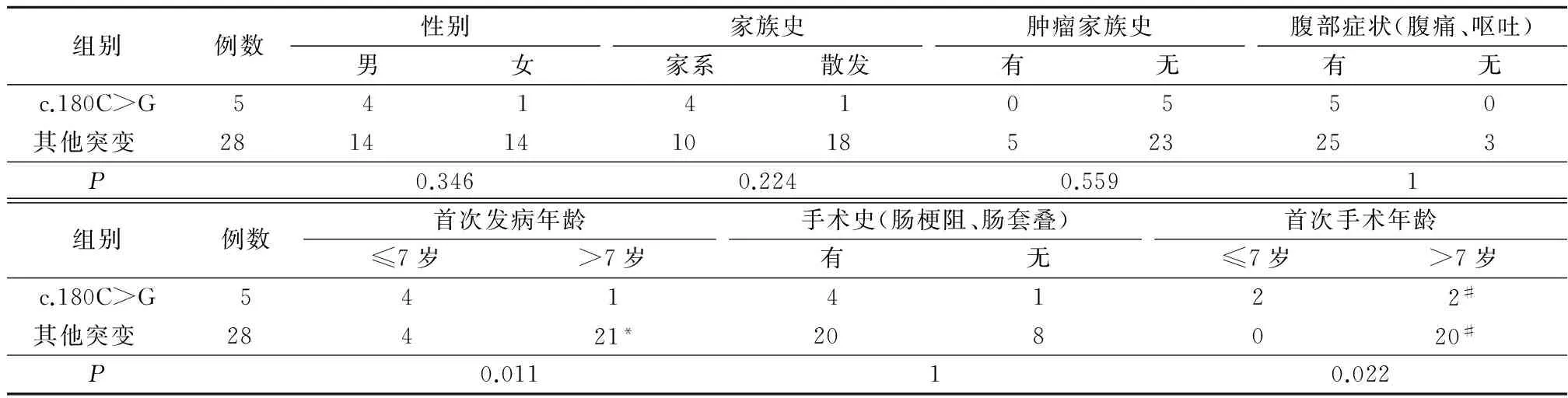
表3 c.180C>G与其他突变患者的相关特征比较Table 3 Comparison of the related characteristics of patients with c.180C>G and other mutations (例数)
注:Fisher精确检验;*3例无腹部症状;#9例未行手术
3 讨 论
PJS是一种常染色显性遗传病,主要表现为黏膜色素沉着斑、胃肠道多发息肉和随年龄增长的肿瘤风险。该病发病率为1/50 000~1/200 000。目前认为该病的主要致病基因是位于19p13.3区域的STK11基因,该基因是一种抑癌基因[5]。STK11基因的功能复杂,目前尚未完全阐述明确。欧美相关研究证实其通过调节细胞周期和细胞极化发挥作用[6-7],位于该基因编码区的突变可能导致编码蛋白的功能失活或缺失。迄今为止,在人类基因突变库(human gene mutations database,HGMD)中已鉴定出的STK11基因突变有396种。目前国外研究STK11突变检出率在66%~94%之间[8],我国学者对52个家系共116例患者使用Sanger联合MLPA进行基因检测,突变检出率达67.3%,其中点突变检出率为51.9%,大段缺失检出率为15.4%,家族性病例突变检出率为80.0%,散发病例检出率为55.6%[9]。本研究结果显示,点突变检出率为58.8%,家族点突变检出率为55.0%,散发点突变检出率为55.9%,点突变与国内数据结果相近。因本研究未对未检出突变患者进行MLPA大段缺失检测,故家族性、散发性突变检出率存在一定差异。
值得注意的是,在33例可检测到突变患者中,共有5例患者有相同突变(c.180C>G),其中1例为散发患者,4例分布于2个不同家系,疑似为高频突变位点。国内学者在研究中检测到2例患者携带该突变,且呈家族性分布,因患者分布地区各不相同,故排除同一患者可能[10-11]。国外研究也报道了2例该突变[12-13]。对5例相同突变患者的临床特征分析:①其中以家系分布为主(80.0%,4/5),国内学者报道2例突变均有PJS家族病史;②上述患者均未患肿瘤及无肿瘤家族史,国内报道也否认患者肿瘤家族史;③均有口唇及四肢末端黑斑表现,并以腹痛、呕吐为首发症状(100.0%,5/5),平均年龄为5.8岁(1~14岁),其中4例患者因肠梗阻、肠套叠接受手术(80.0%,4/5),平均年龄为11岁(4~21岁)。根据以上临床特点,考虑c.180C>G突变患者存在典型的口唇黑斑临床表现,且有家族分布倾向,首次因肠梗阻、肠套叠接受手术的平均年龄早于国内(17.29岁)[9]和国外(16岁)[14]研究数据。
STK11主要由N末端核定位信号结构域、高度保守的丝氨酸/苏氨酸激酶结构域和C末端调节结构域组成[15],其激酶催化区域位于第44~309位氨基酸残基。本研究结果显示,高频突变位于1号外显子第180位碱基处C>G的错义突变,可导致编码STK11蛋白激酶第60位氨基酸形成终止密码子(TAC→TAG),进而产生截断蛋白。国外研究表明位于激酶区的基因突变,可能干扰与STRAD和MO25结合形成复合体,从而破坏激酶活化功能[16]。此外,STK11的C端是与STRAD结合的区域,该区域的突变可能减弱AMPK的活性,进一步影响细胞极性和下游信号通路。该位点的突变导致部分激酶区域的缺失和C端调节区的完全缺失,通过影响生长周期、凋亡及细胞极化等机制,促进息肉的生长和肿瘤的发生。
在与其他突变临床特征比较时发现,c.180C>G在性别、家族史、肿瘤史、有无腹部症状、手术史等方面差异无统计学意义。因PJS患者肠梗阻及肠套叠等息肉相关并发症通常发生于儿童期[4],故将对并发症的研究年龄7岁为界,分为≤7岁(儿童组)和>7岁组。在对不同突变组与首次发病(腹痛、呕吐)年龄进行比较时发现,在年龄≤7岁构成比方面,c.180C>G突变组明显高于其他突变组。与此相似,与首次接受手术年龄的关系研究中,c.180C>G组在年龄≤7岁的构成比也高于其他突变组。所以,c.180C>G突变除有典型的PJS临床表现外,还有倾向于年龄≤7岁时首次发生症状和首次接受手术的特点。而这一表现可能与突变所导致的激酶区域的缺失和C端调节区的完全缺失有关。在对PJS患者的息肉切除过程中,发现对于大体积的息肉使用内镜黏膜切除术可有效地减少术中及术后出血量,这一发现与我国学者研究结果类似[17]。
总之,通过对54例患者突变检测的回顾,发现疑似高频突变1例,对其临床表型进行分析,是在基因-表型关联方面的一次有益尝试,并为临床早期干预及治疗PJS提供了理论基础。
[1] Shaco-Levy R,Jasperson KW,Martin K,et al. Morphologic characterization of hamartomatous gastrointestinal polyps in Cowden syndrome,Peutz-Jeghers syndrome,and juvenile polyposis syndrome[J]. Hum Pathol,2016,49:39-48.
[2] Yajima H,Isomoto H,Nishioka H,et al. Novel serine/threonine kinase 11 gene mutations in Peutz-Jeghers syndrome patients and endoscopic management[J]. World J Gastrointest Endosc,2013,5(3):102-110.
[3] Idrogo Regalado B,Frisancho Velarde O. Peutz Jeghers syndrome. Report of five cases[J]. Rev Gastroenterol Peru,2016,36(2):165-168.
[4] Beggs AD,Latchford AR,Vasen HF,et al. Peutz-Jeghers syndrome:a systematic review and recommendations for management[J]. Gut,2010,59(7):975-986.
[5] Huang Z,Miao S,Wang L,et al. Clinical characteristics and STK11 gene mutations in Chinese children with Peutz-Jeghers syndrome[J]. BMC Gastroenterol,2015,15:166.
[6] Hardie DG,Alessi DR. LKB1 and AMPK and the cancer-metabolism link-ten years after[J]. BMC Biol,2013,11:36.
[7] Zhao RX,Xu ZX. Targeting the LKB1 tumor suppressor[J]. Curr Drug Targets,2014,15(1):32-52.
[8] Szanto P,Barbieru V,Badea R,et al. Unexpected Peutz-Jeghers syndrome in an adult presenting with intermittent upper intestinal obstruction. A case report[J]. J Gastrointestin Liver Dis,2014,23(1):91-94.
[9] Wang Z,Wu B,Mosig RA,et al. STK11 domain XI mutations:candidate genetic drivers leading to the development of dysplastic polyps in Peutz-Jeghers syndrome[J]. Hum Mutat,2014,35(7):851-858.
[10] Dai L,Fu L,Liu D,et al. Novel and recurrent mutations of STK11 gene in six Chinese cases with Peutz-Jeghers syndrome[J]. Dig Dis Sci,2014,59(8):1856-1861.
[11] Zuo YG,Xu KJ,Su B,et al. Two novel STK11 mutations in three Chinese families with Peutz-Jeghers syndrome[J]. Chin Med J(Engl),2007,120(13):1183-1186.
[12] Hemminki A,Markie D,Tomlinson I,et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome[J]. Nature,1998,391(6663):184-187.
[13] Borun P,Bartkowiak A,Banasiewicz T,et al. High Resolution Melting analysis as a rapid and efficient method of screening for small mutations in the STK11 gene in patients with Peutz-Jeghers syndrome[J]. BMC Med Genet,2013,14:58.
[14] van Lier MG,Mathus-Vliegen EM,Wagner A,et al. High cumulative risk of intussusception in patients with Peutz-Jeghers syndrome:time to update surveillance guidelines?[J]. Am J Gastroenterol,2011,106(5):940-945.
[15] Korsse SE,Peppelenbosch MP,van Veelen W. Targeting LKB1 signaling in cancer[J]. Biochim Biophys Acta,2013,1835(2):194-210.
[16] Boudeau J,Baas AF,Deak M,et al. MO25 alpha/beta interact with STRAD alpha/beta enhancing their ability to bind,activate and localize LKB1 in the cytoplasm[J]. EMBO J,2003,22(19):5102-5114.
[17] 陈文婷,王锐,高会斌.内镜黏膜切除术对肠道广基大息肉样病变的治疗价值[J].河北医科大学学报,2016,37(7):828-831.
(本文编辑:赵丽洁)
Detection of STK11 gene mutation in Chinese Peutz-Jeghers syndrome patients and high frequency mutation analysis
JIANG Yu-liang1,2, LI Wei-cong3, ZHAO Zi-ye4, LI Bai-rong1, MAO Xu-yan5, NING Shou-bin1*
(1.DepartmentofGastroenterology,AirForceGeneralHospitalofPLA,Beijing100142,China; 2.HebeiNorthUniversityGraduateCollege,HebeiProvince,Zhangjiakou075061,China; 3.TheSecondDepartmentofGeriatrics,AerospaceCentralHospital,Beijing100040,China; 4.TheFirstDepartmentofSurgery,the273rdHospitalofPLA,Korla841007,China; 5.DepartmentofGastroenterology,XinhuaHospital,Beijing101100,China)
Objective To analyze serine/threonine kinase 11 (STK11) gene in patients with Peutz-Jeghers syndrome(PJS), and explore the relationship between different mutations and clinical features. Methods The sequencing of STK11 gene coding region was analyzed from 54 inpatients with PJS. Their clinical manifestations and mutations were analyzed. The clinical characteristics of different mutations were compared. Results Of the 54 patients with PJS, 33 cases were found to have mutations in the coding region of STK11 gene. Among them, 30 cases were probands (the mutation detection rate was 58.8%, 30/51), the mutation detection rate of familial patient was 55.0%(11/20), and the mutation detection rate sporadic patient was 55.9%(19/34). The 5 patients from 3 families had the same point mutation(c.180C>G), which was suspected high frequency mutation. In another family, 2 patients also had the same mutation(c.658C>T). A patient had two mutations; the other 26 patients had a single mutation site. The proportion of patients with c.180C>G in the first onset age and the first surgery age<7 years of age were significantly higher than other mutations, the difference was statistically significant(P<0.05). There were no significant differences in gender, family history, tumor history, abdominal symptoms, and surgical history. Conclusion STK11 gene mutation is the main pathogenicity of PJS. A high frequency mutations were found, patients with this mutation had symptoms and undergo surgery earlier than other patients. We should pay more attention in clinical monitoring and treatment.
Peutz-Jeghers syndrome; p21-activated kinases; genes; mutation
2017-06-14;
2017-07-07
中国人民解放军空军总医院年度计划课题(kz2015026,kz2016021)
蒋宇亮(1986-),男,内蒙古包头人,河北北方学院医学硕士研究生,从事消化疾病诊治研究。
*通讯作者。E-mail:ning-shoubin@163.com
R574;R730.269
A
1007-3205(2017)08-0878-05
10.3969/j.issn.1007-3205.2017.08.003

