孕乳期补充维生素D对仔鼠生长发育及细胞免疫功能的影响
黄利华,胡庆兰,李伟明,柳国胜,李宜花
(1.广东省清远市妇幼保健院科教科 511500;2.暨南大学附属第一医院儿科,广州 510630)
孕乳期补充维生素D对仔鼠生长发育及细胞免疫功能的影响
黄利华1,胡庆兰1,李伟明1,柳国胜2,李宜花2
(1.广东省清远市妇幼保健院科教科 511500;2.暨南大学附属第一医院儿科,广州 510630)
目的 研究孕乳期补充维生素D(VitD)对仔鼠生长发育及细胞免疫功能的影响。方法 选用120只小鼠依据VitD治疗剂量不同分为高、中、低剂量组(各30只),分别给予VitD滴剂3.44、1.72、0.86 IU,并设置对照组(30只)不给予VitD。观察幼鼠体质量、外周血25-羟维生素D3[25-(OH)D3],分别测定细胞免疫功能(迟发性变态反应实验)、体液免疫功能[包括抗体生成细胞数和半数溶血值(HC50)测定]、单核-巨噬细胞吞噬功能(包括小鼠腹腔巨噬细胞吞噬鸡红细胞实验和碳廓清实验),并进行T淋巴细胞亚群流式细胞术测定。结果 随着VitD剂量的增加,子鼠外周血中25-(OH)D3及钙离子水平逐渐升高,与对照组比较,差异均有统计学意义(P<0.05);体质量及体长逐渐增加,各剂量组间比较,差异无统计学意义(P>0.05)。与对照组比较,高剂量组、中剂量组足趾肿胀度、吞噬百分率、抗体生成细胞数、血清溶血素HC50均增加,吞噬指数均减低,差异均有统计学意义(P<0.05)。随VitD剂量的增加,CD4+、CD8+T淋巴细胞数量和CD4+/CD8+逐渐增加。结论 孕乳期补充 VitD可促进子代小鼠的生长发育,具有增强机体免疫功能的作用。
维生素D;免疫功能;小鼠
维生素D(Vitamin D,VitD)是一类具有生物活性的维生素,其生物学功能表现为维持血钙磷稳定和保持骨骼的生长。近年来大量研究证实,VitD具有神经内分泌激素功能,可以调节组织细胞的免疫功能[1]。最近学者越来越重视母体VitD状况对子代生长发育和免疫功能影响的研究。有临床研究证实,小于胎龄的胎儿其母亲孕期VitD水平显著低于正常人群,这提示母亲孕期VitD水平可能与胎儿的生长发育有关[2]。关于不同剂量母体VitD对子代生长发育及免疫功能的影响鲜见文献报道。基于此,本研究观察了母体接受不同剂量VitD干预对小鼠生长发育及细胞免疫功能的影响,从而为VitD的合理使用提供实验依据。
1 材料与方法
1.1 材料 120只清洁级ICR小鼠,8周龄,雄鼠体质量为32~34 g,雌鼠体质量为28~30 g,购于北京维通利华实验动物技术有限公司[实验动物合格证批号:SCXK(京)2012-0001]。小鼠饲养于第三军医大学实验动物饲养中心,分笼饲养,温度(20±2)℃,湿度(55±5)%,人工光照,明暗各12 h/d,24 h自由取食和饮水。
1.2 主要仪器与试剂 含小牛血清的细胞培养液、磷酸盐缓冲液(PBS)、绵羊红细胞(SRBC)、补体、鸡红细胞、瑞氏染液、文齐氏液、异硫氰酸荧光素标记的抗小鼠CD4及CD8( FITC-CD4、FITC-CD8)单克隆抗体(武汉博士德生物有限公司)、25-羟维生素D3[25-(OH)D3]测定试剂盒 (上海生工生物有限公司 )、紫外分光光度仪(美国BD公司)、FAC sort流式细胞仪(美国BD公司)、二氧化碳培养箱(上海基玛公司)、离心机 (上海基玛公司)、倒置显微镜 (日本Nikon公司)、恒温水浴锅、细胞计数板、游标卡尺、全自动生化分析仪等。
1.3 方法
1.3.1 动物分组 将雌鼠分成A、B、C、D 4组,每组30只,A、B、C组分别给予VitD滴剂,A组为高剂量组(VitD滴剂3.44 IU),B组为中剂量组(VitD滴剂1.72 IU),C组为低剂量组(VitD滴剂0.86 IU),D组为对照组不给予VitD。常规饲养3 d后,按雌雄比例2∶1将大鼠合笼,从第2天清晨开始观察,查到阴栓者单笼饲养,并记录为孕 0 d。实验期从孕19 d 至哺乳期第22天,在常规给予普通饲料的基础上,将上述实验药物灌胃。观察雌鼠的一般情况,至雌鼠分娩期及哺乳第22天,分别测定母鼠、仔鼠各实验室指标。每组取20只孕鼠于孕18周剖杀,称量活胎体质量,测量活胎鼠身长,并对胎鼠免疫功能进行评价。
1.3.2 外周血25-(OH)D3及钙离子水平检测 分娩期与哺乳第22天分别抽取母鼠、仔鼠鼠尾静脉血,于30 min内,3 500 r/min离心5 min,采用放射免疫分析(radioimmunoassay,RIA)检测外周血25-(OH)D3水平,步骤均严格按照试剂盒说明书操作。采用全自动生化分析仪测定血钙水平。
1.3.3 细胞免疫功能检测 采用足跖增厚法,每只子鼠静脉注射0.2 mL 2%(v/v)SRBC。免疫后4 d,测量左后足跖部厚度,然后在测量部位皮下注射20 μL 20%(v/v)SRBC,注射后于24 h测量左后足跖部厚度,同一部位测量3次,取平均值。
1.3.4 小鼠体液免疫功能检测 采用腹腔巨噬细胞吞噬鸡红细胞及碳廓清实验方法:给子鼠腹腔注射1%的鸡红细胞悬液1 mL,然后处死小鼠,用毛细吸管吹吸混匀腹腔内液体,制作涂片,瑞氏染液染色5 min。计数巨噬细胞吞噬鸡红细胞情况,计算吞噬百分率。吞噬百分率=吞噬有鸡红细胞的巨噬细胞数/总巨噬细胞数。按0.1 mL/10 g剂量给于小鼠墨汁,注入墨汁后2、10 min分别从内眦静脉丛取血20 μL,并立即将其加入到体积总数为3 mL的0.1%Na2CO3溶液中。用721分光光度计在600 nm波长测定的吸光度(A)值,以0.1%Na2CO3溶液作空白对照。k=(lgA1-lgA2)/(t2-t1)。
1.3.5 小鼠单核-巨噬细胞吞噬功能检测 采用半数溶血值(HC50)和抗体生成细胞数测定方法:小鼠处死后无菌条件下取出脾脏,制成细胞悬液,2 000 r/min离心15 min,加入裂解液裂解红细胞,反复离心去除血小板。用培养液调整细胞浓度为5×106/mL。取1 mL细胞悬液,加入10%SRBC 0.5 mL,补体1.00 mL,设生理盐水为空白组。37 ℃水浴30 min,冰浴终止反应。分光光度仪测定A值。将小鼠血清1.00 mL,5%SRBC 0.50 mL,补体1.00 mL混合,另设生理盐水为空白组。37 ℃水浴30 min,冰浴终止反应,2 000 r/min离心15 min,取上清液1.00 mL加文齐氏液3.00 mL,静置10 min,分光光度仪测定A值。另取5%SRBC 0.25 mL,加入文齐氏液4 mL,分光光度仪测定A值,即为实验中所用SRBC半数溶血时的A值。血清溶血素HC50=(样品的A值/SRBC半数溶血时的A值)×稀释倍数。
1.3.6 流式细胞术检测T淋巴细胞亚群变化 制备淋巴细胞悬液1×106/mL,分别加入FITC-CD4、FITC-CD8单克隆抗体20 μL。4 ℃温浴30 min。PBS溶液洗涤3次,采用流式细胞仪检测阳性率。
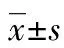
2 结 果
2.1 一般情况 各剂量组吸收胎数、平均每窝吸收胎数与对照组相比,差异均无统计学意义(P>0.05);而各剂量组死胎数和平均每窝死胎数均高于对照组,差异均有统计学意义(P<0.05)。随着VitD注射剂量的增加,子鼠外周血中25-(OH)D3及钙离子水平逐渐升高,与对照组比较,差异有统计学意义(P<0.05),见图1。
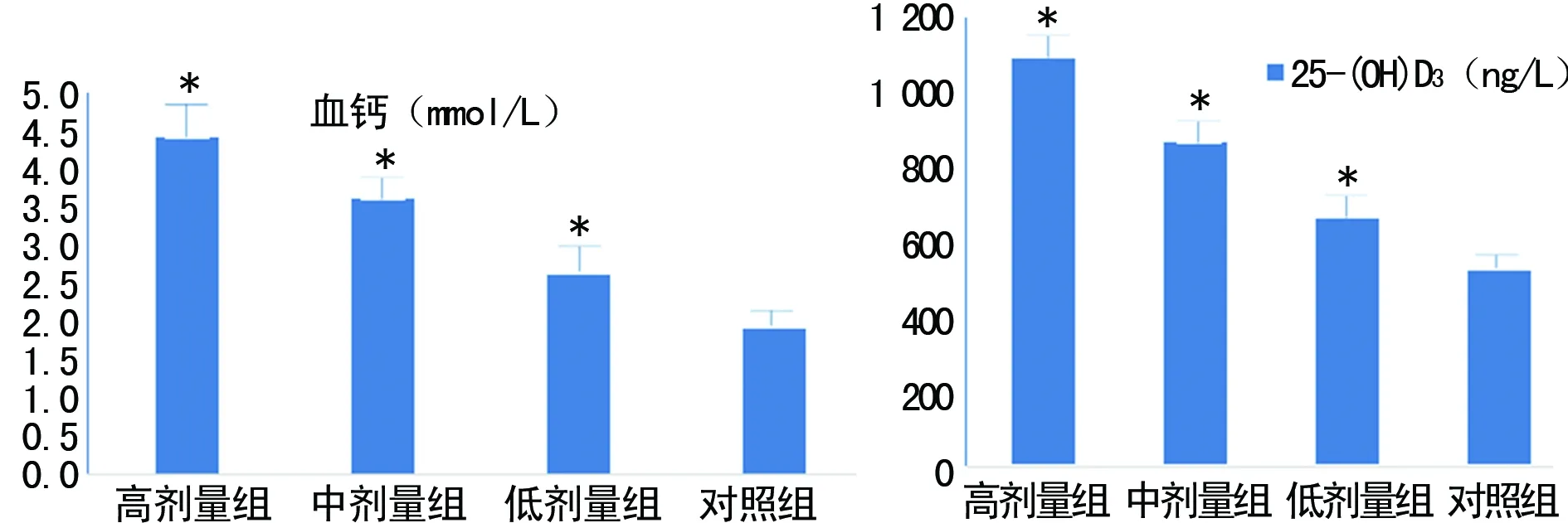
*:P<0.05,与对照组比较
图1 各组小鼠外周血25-(OH)D3及钙离子水平比较
2.2 VitD对子鼠体质量及体长的影响 与对照组比较,各剂量组子鼠的体质量及体长均不同程度的增加,差异均有统计学意义(P<0.05)。随着VitD剂量的增加,体质量及体长逐渐增加,各剂量组间比较差异无统计学意义(P>0.05),见表1。
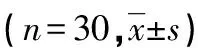
表1 VitD对子鼠体质量及体长的影响
*:P<0.05,与对照组比较
2.3 VitD对迟发型变态反应及吞噬功能的影响 与对照组比较,高剂量组、中剂量组足趾肿胀度、吞噬百分率均增加,碳廓清实验吞噬指数均降低,差异均有统计学意义(P<0.05)。随VitD剂量的增加,足趾肿胀度、吞噬百分率逐渐增加,吞噬指数逐渐减低,各计量组间比较差异无统计学意义(P>0.05),见表2。
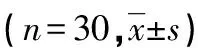
表2 VitD对小鼠迟发型变态反应及吞噬功能的影响
*:P<0.05,与对照组比较
2.4 VitD对体液免疫功能的影响 与对照组比较,高剂量组、中剂量组抗体生成细胞数、血清溶血素HC50均升高,差异均有统计学意义(P<0.05)。随VitD剂量的增加,抗体生成细胞数、血清溶血素HC50逐渐增加,各剂量组间比较差异无统计学意义(P>0.05),见表3。
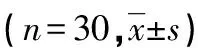
表3 VitD对小鼠抗体生成细胞数的影响
*:P<0.05,与对照组比较
2.5 VitD对T淋巴细胞亚群的影响 与对照组比较,各剂量组CD4+、CD8+T淋巴细胞数量和 CD4+/CD8+升高,差异均有统计学意义(P<0.05)。随VitD剂量的增加,CD4+、CD8+T淋巴细胞数量和CD4+/CD8+逐渐增加,且高剂量组增加较为明显,见表4。
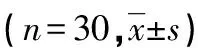
表4 VitD对小鼠T淋巴细胞亚群的影响
*:P<0.05,与对照组比较
3 讨 论
VitD作为一种微量元素,可以促进钙从肠道内吸收。活性VitD完全缺乏的小鼠具有明显的低血钙现象。除了调节钙磷平衡和骨代谢作用外,其在胚胎和胎儿发育过程中发挥着至关重要的作用,众所周知,胚胎与胎儿发育所需VitD主要通过胎盘由母体转运到胎儿循环,因此孕乳期补充VitD对子代的生长发育具有决定性作用[3]。本次实验笔者观察了孕前和孕期母体补充VitD对胎鼠生长发育的影响,同时本次实验设置了3种剂量的VitD3,分别为高剂量组(VitD滴剂3.44 IU)、中剂量组(VitD滴剂1.72 IU)、低剂量组(VitD滴剂0.86 IU),对大鼠进行为期4周的补充干预。结果显示,随着VitD注射剂量的增加,子鼠外周血中25-(OH)D3及钙离子水平逐渐升高,与对照组比较,差异均有统计学意义(P<0.05)。进一步观察发现,与对照组比较,各剂量组子鼠的体质量及体长均不同程度的增加,差异均有统计学意义(P<0.05),随着VitD剂量的增加,体质量及体长逐渐增加。这些结果提示,母体补充VitD对维持子代的正常生长发育起到至关重要的作用。对于VitD在维持胎儿生长发育中的机制,有大样本的调查提示VitD缺乏能够引起HIV-肺结核混合感染者的肿瘤坏死因子-α(TNF-α)水平显著性升高[4]。动物实验结果发现,VitD通过下调Toll样受体下游的酪氨酸蛋白激酶-1/信号转导激活转录因子-3(JAK1/STAT3)信号通路,来抑制TNF-α的产生[5]。另外研究表明,TNF-α与胎儿生长发育迟缓密切相关。故笔者认为,孕期VitD可能通过一定的通道引起子代TNF-α改变,进而影响胎儿的生长发育,导致生长发育迟缓[6]。
VitD作为一种新型的免疫调节激素,在细胞免疫调节中发挥着重要的作用,VitD对免疫系统的影响可以从以下几方面得到证实[7-8]:(1)VitD受体存在于活化炎性细胞中;(2)1,25-二羟基维生素D3[1,25-(OH)D3]可以抑制T淋巴细胞增值;(3)激活巨噬细胞,使之产生1,25-(OH)D3。在T淋巴细胞分类中,CD4具有T淋巴细胞辅助功能,而CD8则抑制、杀伤T淋巴细胞。另外,CD4能产生一些细胞因子协助B淋巴细胞抗体的产生,调节免疫反应的活性,而CD8则可以抑制免疫功能和损伤细胞。CD4/CD8是反映T淋巴细胞活性的重要指标,正常人群其比值相对稳定,比值增加提示免疫增强,反之则减弱[9]。有研究结果表明,VitD缺乏可以降低小鼠外周血白细胞数量,淋巴细胞CD4、CD8阳性率,而对体液免疫(B淋巴细胞)改变不大[10-13]。本次实验笔者观察了不同剂量的VitD对T淋巴细胞亚群分化的影响。结果提示,随VitD剂量的增加,CD4+、CD8+T淋巴细胞数量和 CD4+/CD8+逐渐增加,且高剂量组增加较为明显。随后笔者按照《保健食品检验与评价技术规范》(2003年版)关于增强免疫功能检验方法从细胞免疫、体液免疫等多角度进行了实验,结果表明,与对照组比较,不同剂量的小鼠足趾肿胀度、吞噬百分率显著增加,碳廓清实验吞噬指数显著减低,抗体生成细胞数、血清溶血素HC50显著升高。对细胞免疫、体液免疫及非特异性免疫可能具有增强作用。同时笔者发现,随着VitD补充剂量的增加,其免疫能力的增加幅度无明显差异,提示加大VitD补充剂量并不能进一步改善及促进免疫调节作用。
虽然宫内胎儿生长发育迟缓、免疫功能低下与母体微量营养素缺乏密切相关,为围产期胎儿的VitD补充、减少围产期并发症提供了依据。但由于VitD和宫内胎儿发育的相关激素与基因的多重性及生理调控关系微妙,该过程相当复杂。为进一步详细了解和掌握VitD对宫内发育迟缓的作用机制,控制胎源性成年疾病的发生,提供新思路、新方法,笔者将继续对VitD在宫内发育迟缓、免疫功能低下中的相关途径进行研究。
综上所述,孕乳期补充VitD可以促进仔鼠生长发育,提高子代的免疫功能。因此,孕期可补充足量的VitD添加剂,尤其会为冬季妊娠孕妇带来更多益处。但加倍补充VitD并不能成比例的增加其效果,尚需进一步确定更为合理的补充剂量,为VitD的合理补充提供科学依据,为临床及预防应用提供指导。
[1]吴桐,向菲,欧亚萍,等.孕妇血清维生素D水平与妊娠结局的相关性研究[J].重庆医学,2016,45(7):893-895.
[2]王强,沈影超.孕期维生素D摄入对子代远期健康的影响[J/CD].中华临床医师杂志(电子版),2013,7(11):5017-5019.
[3]Liu J,Liu L,Chen H.Antenatal taurine supplementation for improving brain ultrastructure in fetal rats with intrauterine growth restriction[J].Neuroscience,2011,18(1):265-270.
[4]Figueras F,Gardosi J.Intrauterine growth restriction:new concepts in antenatal surveillance,diagnosis,and management[J].Am J Obstet Gynecol,2011,204(4):288-300.
[5]Bucher BS,Tschumi S,Simonetti GD.Childhood′s determinants for high blood pressure in adulthood[J].Ther Umsch,2012,69(5):295-298.
[6]Stoll BJ,Hansen NI,Bell EF,et al.Neonatal outcomes of extremely preterm infants from the NICHD neonatal research network[J].Pediatrics,2010,126(3):443-456.
[7] Li Y,Qi Q,Workalemahu T,et al.Birth weight,genetic susceptibility,and adulthood risk of type 2 diabetes[J].Diabetes Care,2012,35(12):2479-2484.
[8]Grandjean P,Landrigan PJ.Neurobehavioural effects of developmental toxicity[J].Lancet Neurol,2014,13(3):330-338.
[9]Goodman J,Marsh R,Peterson BS,et al.Annual research review:the neurobehavioral development of multiple memory systems-implications for childhood and adolescent psychiatric disorders[J].J Child Psychol Psychiatry,2013,12(8):245-248.
[10]Morales E,Guxens M,Llop S,et al.Circulating 25-hydroxyvitamin D3in pregnancy and infant neuropsychological development[J].Pediatrics,2012,130(4):e913-920.
[11]Whitehouse AJ,Holt BJ,Serralha M,et al.Maternal serum vitamin D levels during pregnancy and offspring neurocognitive development[J].Pediatrics,2012,129(3):485-493.
[12]刘雪婷,任立红.补充维生素D对佝偻病大鼠Thl/Th2细胞平衡的影响[J].实用儿科临床杂志,2012,27(19):1485-1487.
[13]陈摇雪,于摇震,陈远华,等.维生素D缺乏对宫内胎鼠发育的影响[J].安徽医科大学学报,2013,48(12):1470-1471.
Effects of Vitamin D on growth and immune function in neonatal mice*
HuangLihua1,HuQingLan1,LiWeiming1,LiuGuosheng2,LiYihua2
(1.DepartmentofScienceandEducation,MaternalandChildHealthcareHospitalofQingyuanCity,Qingyuan,Guangdong511500,China;2.DepartmentofPediatrics,theFirstAffiliatedHospitalofJinanUniversity,Guangzhou,Guangdong510630,China)
Objective To study the effects of Vitamin D (VitD) supplementation on growth and immune function in neonatal mice.Methods A total of 120 mice were divided into four groups (30 mice in each group) according to dose of VitD.The high-dose group,medium-dose group and low-dose group was given 3.44,1.72,0.86 IU VitD drops,respectively.The control group was not treated with VitD drops.Rat body weight,level of peripheral blood 25-(OH)D3were observed.The cellular immune function (determined by using delayed hypersensitivity reaction experiment),humoral immune function (assessed by antibody producing cells counts and HC50determination) and mononuclear-macrophage phagocytic function (assessed by mouse peritoneal macrophage phagocytosis of chicken red blood cells test and carbon clearance test) were detected.The flow cytometry assay was carried out to differentiate T lymphocyte subsets.Results With the increase of dose of VitD,levels of peripheral blood 25-(OH)D3and calcium ion were gradually increased,there were statistically significant differences when compared with the control group(P<0.05);the body weight and body length were gradually increased,while no statistically significant difference was found among the groups treated with VitD(P>0.05).Compared to the control group,the toes swelling,phagocytic percentage,number of antibody producing cells,serum soluble HC50in the high-dose group and medium-dose group were increased significantly,while carbon clearance test phagocytic index were decreased significantly (P<0.05).With the increase of dose of VitD,the number of CD4+,CD8+T lymphocytes and the CD4+/CD8+ratio were gradually increased.Conclusion VitD could promote the growth and development of offspring mice,and enhance the immune function of the body.
Vitamin D;immune function;mice
��·基础研究
10.3969/j.issn.1671-8348.2017.19.007
清远市产业技术研究与开发资金项目(2013A014)。 作者简介:黄利华(1975-),副主任中医师,博士,主要从事血液病及其免疫机制方面的研究。
R720.5
A
1671-8348(2017)19-2615-03
2017-02-09
2017-04-14)

