频繁急性加重型慢性阻塞性肺病患者血浆血管内皮微粒水平分析
姜敏,王晶,张洪平,田戈,伊合帕尔·吐依洪,高振,李风森
(新疆医科大学附属中医医院国家中医临床研究基地,新疆呼吸病研究重点实验室,乌鲁木齐 830000)
·临床实验研究·
频繁急性加重型慢性阻塞性肺病患者血浆血管内皮微粒水平分析
姜敏,王晶,张洪平,田戈,伊合帕尔·吐依洪,高振,李风森
(新疆医科大学附属中医医院国家中医临床研究基地,新疆呼吸病研究重点实验室,乌鲁木齐 830000)
目的 探讨慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)频繁急性加重型患者血浆中血管内皮微粒(vascular endothelial microparticles, EMPs)的变化情况。方法 纳入COPD频繁急性加重型患者59例,COPD非频繁急性加重型患者56例,健康人对照46例。用流式细胞技术检测无血小板血浆中血管内皮钙黏蛋白(vascular endothelial cadherin, VE-cadherin)、血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule, PECAM)、黑素瘤细胞黏附分子(melanoma cell adhesion molecule, MCAM)、E选择素(E-selectin)的水平。用ELISA法检测各组IL-8水平,用速率散射免疫比浊法检测C反应蛋白(CRP)的含量,分析其与EMPs的相关性。结果 COPD频繁急性加重型患者和非频繁急性加重型患者血浆中VE-cadherin、PECAM、MCAM、E-selectin微粒的数目均显著高于健康人对照组(P均<0.01),COPD频繁急性加重型患者E-selectin的含量高于COPD非频繁急性加重型(P<0.05),且E-selectin与IL-8和CRP显著正相关。结论 COPD频繁急性加重型血浆中E-selectin可作为判断COPD频繁急性加重型的生物标记物。
慢性阻塞性肺病;频繁急性加重型;血管内皮微粒
慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)是一种常见的慢性炎症性呼吸系统性疾病,呈不可逆进行性发展[1-2]。COPD病程分期分为稳定期和急性加重期[3]。尽管COPD的发病机制研究尚不明确,但研究表明COPD的发生和发展与肺部炎症反应、氧化应激反应和内皮细胞凋亡有关[4]。炎症反应、氧化应激反应和内皮细胞凋亡均能导致肺部血管内皮损伤,产生内皮微粒(endothelial micropartieles,EMPs),EMPs是内皮功能紊乱的标志物[5-6],同时又能促进机体炎症反应、血管损伤和细胞凋亡[7]。EMPs根据细胞表面特异性抗原可分为血管内皮钙黏蛋白(vascular endothelial-cadherin,VE-cadherin)、血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule,PECAM)、黑素瘤细胞黏附分子(melanoma cell adhesion molecule,MCAM)、E选择素(E-selectin)[8]。研究显示VE-cadherin、PECAM和E-selectin在COPD稳定期和急性加重期较正常组升高[5]。但随着对COPD研究的不断深入,研究者发现表型识别有助于反映COPD的异质性,使得COPD的研究更趋全面和深入。COPD根据表型可分为3种表型:频繁急性加重型、COPD-哮喘重叠型和肺气肿-气道高反应型[9]。目前关于COPD频繁急性加重型患者血浆EMPs水平检测报道仍然较少,为此本研究检测COPD频繁急性加重型和COPD非急性加重型患者血浆EMPs的水平,以期评判其与COPD发展的关系。
1 资料与方法
1.1 临床资料 收集我院2015年11月至2016年8月门诊和住院的COPD稳定期患者,COPD诊断、分期参照WHO《慢性阻塞性肺疾病全球倡议》和中华医学会呼吸病学分会COPD学组《慢性阻塞性肺疾病诊治指南(2007年版)》的诊断标准[10-11]。包括COPD频繁急性加重型患者59例,年龄(67±8.9)岁,其中男性24例,女性35例;COPD非频繁急性加重型患者56例,年龄(69±9.7)岁,其中男性33例,女性23例。另收集我院体检健康人对照46例,年龄(66±6.9)岁,其中男性29例,女性17例。均填写基础信息并记录肺功能检测数值,包括第1秒用力呼气容积(forced expiratory volume in one second,FEV1)占预计值百分比及FEV1占用力肺活量(forced vital capacity, FVC)的百分比。本项目通过新疆维吾尔自治区中医医院伦理委员会批准。
1.2 纳入及排除标准 稳定期指患者咳嗽、咳痰、气短等症状稳定或轻微,且近2个月无急性加重史。COPD急性加重期指呼吸困难加重、咳脓痰、痰量增加这3个主要症状中出现2个,或者一个主要症状合并下列非主要症状之一:伤风感冒(鼻塞流涕加重)、喘息、咽喉痛、咳嗽、发热状态持续2 d以上。COPD频繁急性加重型定义为每年急性发作2次或以上,且每次发作均口服糖皮质激素和/或抗生素,或需要住院治疗的患者[9,12]。COPD非频繁急性加重型定义为上一年内出现急性加重期次数<2次。
健康人对照入组标准:无吸烟史;无慢性咳嗽、咳痰、气短史;肺功能检查,FEV1/FVC>0.70及近3个月无上、下呼吸道感染。
排除标准:合并有严重的心、肝、脾、肾、内分泌系统疾病、肿瘤和造血系统等原发性疾病及精神病患者(因肺心病本身所引起的心脑疾病不包括在内);支气管扩张症、支气管哮喘、肺结核纤维化病变、肺囊性纤维化以及弥漫性泛细支气管炎等已知病因及具有特征病理表现的气流受限疾病;COPD急性加重期时因呼吸衰竭需气管插管机械通气者。
1.3 主要试剂和仪器 4种EMPs的特异性抗体(美国BD公司):FITC标记抗CD144抗体(检测VE-cadherin用),FITC标记抗CD31抗体和PE标记抗CD41抗体(检测PECAM用),PE标记抗CD146抗体(检测MCAM用),PE标记抗CD62E抗体(检测E-selectin用);IL-8双抗体夹心ELISA检测试剂盒(武汉基因美公司);C反应蛋白(CRP)检测试剂(上海科华公司)。Guava 8HT流式细胞仪(美国密理博公司),Thermo酶标仪(赛默飞世尔公司)。
1.4 研究方法
1.4.1 标本采集及无血小板血浆(platelets-free plasma,PFP)制备 COPD稳定期的患者均由医师按照指南[13]指导用药治疗。抽取患者的外周血备检。5 mL肝素钠抗凝全血1 500×g离心10 min,小心吸取上清液,13 000×g离心2 min,得到PFP样本,分装后-80 ℃保存。
1.4.2 EMPs检测 PFP样本从-80 ℃取出,立即放入37 ℃水浴箱中,轻轻摇动至全部溶解;4 ℃、120 000×g离心30 min,弃上清,剩余约100 μL,加入500 μL Hanks平衡盐溶液(Hank′s Balanced Salt, HBSS)重悬;分别取50 μL加入4支流式管,再分别加入特异性荧光标记抗体FITC标记抗CD144抗体5 μL,FITC标记抗CD31抗体和PE标记抗CD41抗体各5 μL,PE标记抗CD146抗体5 μL,PE标记抗CD62E抗体5 μL。室温避光温育30 min后,加500 μL HBSS重悬后即上流式细胞仪进行检测。每支检测的样本流式管中加入5 μL绝对计数微球(数量大约8 000~10 000),微球大小约10 μm。当收集5 000个绝对计数微球后停止计数,依据绝对计数微球的浓度计算出EMPs浓度(个/μL)。将前向散射角和侧向散射角设置于Log通道上,以直径使用前向角设门,使0.8 μm的标准微球位于门的右上方,使0.3 μm的标准微球位于门的左下方,故门内的微粒大小均<0.8 μm。门内收集到的微颗粒进行FITC和PE光强度的分析。本实验以CD144+表示VE-cadherin,CD31+/CD41-表示PECAM,以CD146+表示MCAM,以CD62E+表示E-selectin。
1.5 IL-8和CRP检测 用双抗体夹心ELISA法检测血清中IL-8的含量,按试剂盒说明书进行检测。通过标准品吸光度值绘制标准曲线,然后计算各样本的值。用速率散射法检测CRP的含量。

2 结果
2.1 健康人、COPD频繁急性加重型和COPD非频繁急性加重型IL-8和CRP的变化 与健康人对照组比较,IL-8和CRP在COPD非频繁急性加重型和COPD频繁急性加重期型患者中均升高,差异有统计学意义(IL-8:t非频繁=15.22,P非频繁<0.01,t频繁=22.6,P频繁<0.01;CRP:t非频繁=33.05,P非频繁<0.01,t频繁=11.1,P频繁<0.01)。COPD频繁急性加重期型患者IL-8和CRP的含量均高于COPD非频繁急性加重型患者,差异有统计学意义(IL-8:t=8.83,P<0.01;CRP:t=11.51,P<0.01)。见表1。

表1 不同型别COPD与对照组血清IL-8、CRP浓度比较
注:a,与健康人对照组比较,有统计学意义(P<0.01);b,与COPD频繁急性加重型比较,有统计学意义(P<0.01)。
2.2 健康人和不同型别COPD患者血浆中EMPs的变化 流式细胞术检测健康人和不同型别COPD患者血浆中EMPs的浓度,结果显示:与对照组相比,COPD患者血浆中VE-cadherin、PECAM、MCAM、E-selectin EMPs均有增加。与COPD非频繁急性加重型患者相比,E-selectin在COPD频繁急性加重型中显著升高(t=2.36,P=0.021)。与健康对照组相比,COPD患者FEV1%和FEV1/FVC%均显著下降,但COPD频繁急性加重型和COPD非频繁急性加重型患者FEV1%和FEV1/FVC%差异无统计学意义。见表2。
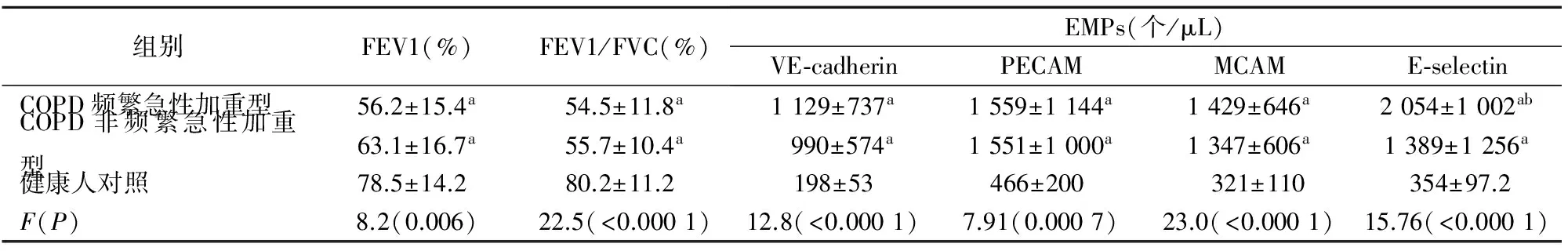
表2 COPD频繁急性加重型和COPD非频繁急性加重型肺功能及EMPs水平比较
注:a,与健康人对照组比较,P<0.01;b,与COPD非频繁急性加重型比较,P<0.01。
2.3 COPD频繁急性加重型和COPD非频繁急性加重型EMPs与IL-8、CRP的相关性分析 COPD频繁急性加重型血浆E-selectin与IL-8、CRP呈正相关关系(r=0.627、0.792) ,COPD非频繁急性加重型血浆E-selectin与IL-8、CRP呈正相关关系(r=0.293、0.436)。
3 讨论
COPD以持续性气流受限为特征,并且气流受限呈进行性发展。临床上使用FEV1表示COPD患者气流受限的程度[13]。研究发现,FEV1与COPD急性加重频次密切相关,临床上也常以FEV1作为评价急性加重期的金指标[14]。尽管急性加重频繁发作与FEV1快速下降相关,但FEV1并不能很好地区别 COPD的非频繁急性加重型和频繁急性加重型,加之COPD患者中、老年人居多,较难配合肺功能检测,因此,FEV1并不是评判COPD急性加重频次的唯一因素[15]。本研究结果也显示,COPD频繁急性加重型患者FEV1和FEV1/FVC较COPD非频繁急性加重型患者低,但差异无统计学意义。肺血管内皮连续性地衬于血管腔内面,参与许多生理和病理过程,当血管内皮细胞受到炎症因子、过氧化物和香烟烟雾等有害刺激时可引起不同表型EMPs的释放[16]。研究表明,CD31+/CD42b-EMPs水平升高提示肺血管内皮细胞的损伤和凋亡,CD31+、CD144+EMPs在COPD急性加重期升高[16],反之这种升高趋势又将进一步导致肺毛细血管内皮细胞损伤,从而使血浆EMPs水平进一步升高[17]。在急性加重期症状消失后EMPs水平还持续升高,预示着急性加重引起的内皮细胞损伤在临床症状消失后仍存在。Takahashi等[16]研究发现,COPD急性加重期患者血浆中CD144+、CD31+、CD62E+EMPs水平较稳定期显著升高,CD62E+EMPs基线水平的升高提示患者经历急性加重期的次数将增加。本研究结果显示,COPD患者血浆中VE-cadherin、PECAM、MCAM、E-selectin水平均升高,提示COPD患者肺部存在应激反应,诱导内皮细胞凋亡,刺激产生大量的内皮微粒。COPD非急性加重型和COPD急性加重型患者血浆中EMPs水平比较可知,E-selectin在COPD急性加重型患者血浆中水平升高显著,患者血浆中高水平的E-selectin提示患者较易出现COPD急性加重。IL-8和CRP是近来发现与COPD发生、发展密切相关的炎症因子,也是评判COPD急性加重的主要因子[18-19]。本研究结果表明,IL-8和CRP在COPD非频繁急性加重型和COPD频繁急性加重期型患者中均升高,COPD频繁急性加重型患者IL-8和CRP的含量始终高于COPD非频繁急性加重型,且E-selectin在COPD频繁急性加重型患者血浆中水平升高显著,并与IL-8和CRP呈正相关。结果提示,在COPD频繁急性加重型患者中炎症因子持续高水平表达,可能是其易发生急性加重的影响因素。
综上所述,COPD患者血浆中EMPs的增加预示着肺内皮细胞损伤,COPD频繁急性加重型患者血浆中持续高水平存在E-selectin,预示患者容易出现急性加重,因此,血浆E-selectin可能作为判断COPD频繁急性加重型的生物标记物。
[1]Shaykhiev R, Crystal RG. Innate immunity and chronic obstructive pulmonary disease: a mini-review[J]. Gerontology, 2013, 59(6):481-489.
[2]Li FS, Zhang YL, Li Z,etal. Randomized, double-blind, placebo-controlled superiority trial of the Yiqigubiao pill for the treatment of patients with chronic obstructive pulmonary disease at a stable stage[J]. Exp Ther Med, 2016, 12(4):2477-2488.
[3]Miravitlles M, Ribera A. Understanding the impact of symptoms on the burden of COPD[J]. Respir Res, 2017, 18(1):67.
[4]Takahashi T, Kobayashi S, Fujino N,etal. Annual FEV1 changes and numbers of circulating endothelial microparticles in patients with COPD: a prospective study[J]. Bmj Open, 2014, 4(3):e004571.
[5]Belik D, Tsang H, Wharton J,etal. Endothelium-derived microparticles from chronically thromboembolic pulmonary hypertensive patients facilitate endothelial angiogenesis[J]. J Biomed Sci, 2016, 23(1):1-11.
[6]Deng F, Wang S, Zhang L. Endothelial microparticles act as novel diagnostic and therapeutic biomarkers of diabetes and its complications: a literature review[J]. Biomed Res Int, 2016, 2016:9802026.
[7]Pirro M, Bianconi V, Paciullo F,etal. Lipoprotein(a) and inflammation: A dangerous duet leading to endothelial loss of integrity[J]. Pharmacol Res, 2017, 119:178-187.
[8]Kadota T, Fujita Y, Yoshioka Y,etal. Extracellular Vesicles in Chronic Obstructive Pulmonary Disease[J]. Int J Mol Sci, 2016, 17(12):1801.
[9]高振, 哈木拉提·吾甫尔, 李风森. “疾病-表型-证型”联合诊断模式下的慢性阻塞性肺疾病频繁急性加重表型(肺脾气虚证)研究思路探讨[J]. 中华中医药杂志, 2016, 31(8):2905-2909.
[10]中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华内科杂志, 2007, 46(3):8-17.
[11]Rabe KF, Hurd S, Anzueto A,etal. Global strategy for diagnosis,management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[S]. Am J Respir Crit Care Med, 2007,176(6): 532-555.
[12]温红侠, 马苗, 孙莉. 慢性阻塞性肺疾病不同临床表型的诊治进展[J]. 中华老年病研究电子杂志, 2015(1):9-12.
[13]Yong PJ, Koh CH, Shim WS. Endothelial microparticles: missing link in endothelial dysfunction?[J]. Eur J Prev Cardiol, 2013, 20(3):496-512.
[14]Vestbo J, Edwards LD, Scanlon PD,etal. ECLIPSE investigators. Changes in forced expiratory volume in 1 second over time in COPD[J]. N Engl J Med,2011,365(13):1184-1192.
[15]Queiroz CF, Lemos AC, Bastos ML,etal. Inflammatory and immunological profiles in patients with COPD: relationship with FEV1 reversibility[J]. J Bras Pneumol, 2016, 42(4):241-247.
[16]Takahashi T,Kobayashi S,Fujino N,etal. Differences in the released endothelial microparticle subtypes between human pulmonary microvas-cular endothelial cells and aortic endothelial cells in vitro [J]. Exp LungRes,2013,39(4/5):155-161.
[17]Lopez-Campos JL, Calero C, Arellano-Orden E,etal. Increased levels of soluble ICAM-1 in chronic obstructive pulmonary disease and resistant smokers are related to active smoking[J]. Biomark Med, 2017, 6(6):805-811.
[18]Yang X, Xu Y, Jin J,etal. Chronic rhinosinusitis is associated with higher prevalence and severity of bronchiectasis in patients with COPD[J]. Int J Chron Obstruct Pulmon Dis, 2017, 12:655-662.
[19]Leuzzi G, Galeone C, Taverna F,etal. C-reactive protein level predicts mortality in COPD: a systematic review and meta-analysis[J]. Eur Respir Rev, 2017, 26(143), pii: 160070. doi: 10.1183/16000617.
(本文编辑:刘群)
10.13602/j.cnki.jcls.2017.07.09
新疆维吾尔自治区自然科学基金青年基金(2015211C155)。
姜敏,1985年生,女,助理研究员,硕士,主要从事临床肺病基础免疫方面的研究。
李风森,教授,主任医师,博士研究生导师,E-mail:250579087@qq.com。
R563.9
A
2017-05-24)

