银屑病患者认知功能障碍分析
姚 莹 张 斌 居兴刚 郑双进 贾雪平 王俊伟
·论著·
银屑病患者认知功能障碍分析
姚 莹 张 斌 居兴刚 郑双进 贾雪平 王俊伟
目的:明确银屑病患者认知功能特点及影响因素。方法:对43例银屑病患者、30名健康对照采用蒙特利尔认知功能评估量表(MoCA)进行认知功能的评估,同时使用贝克抑郁自评量表(BDI)及贝克焦虑自评量表(BAI)进行抑郁及焦虑情绪的评估,并对可能影响银屑病患者认知功能的因素进行分析。 结果:银屑病患者的认知功能障碍发生率为30.2%。银屑病认知障碍组视空间功能及执行功能得分分别为1.69±1.25和2.46±0.87,显著低于银屑病认知正常组(3.03±0.80,3.33±0.88)及对照组(3.30±0.75,3.57±0.56),差异均有统计学意义(均P<0.05)。经多元回归分析发现,银屑病患者的年龄、病程及BDI评分是影响认知功能的消极因素(P<0.05)。结论:银屑病患者的部分认知域功能较正常人群减退,主要累及视空间功能及执行功能。影响银屑病患者认知功能的因素包括年龄、病程与抑郁情绪。
银屑病; 认知功能; 视空间功能; 执行功能
银屑病是一种常见的慢性炎症性皮肤病,其确切的发病机制尚未完全阐明,目前认为它是一种与遗传、环境等多种因素相关的多基因遗传性疾病,自然人群发病率2%左右[1]。近年来国内外的研究认为银屑病不是单一的皮肤炎症反应,而是全身系统性疾病[2]。认知是指人脑接受外界信息,经过加工处理,转换成内在的心理活动,从而获取知识或应用知识的过程,它包括记忆、语言、视空间、执行、计算和理解判断等方面[3]。认知功能障碍泛指各种原因导致的各种程度的认知功能损害(cognitive impairment),从轻度认知功能障碍到痴呆,又称为认知功能衰退、认知功能缺损或认知残疾,不同程度的影响着患者的社会功能及生活质量,给家庭和社会带来了沉重的负担[4]。认知功能障碍的危险因素最常见的是心脑血管疾病,也几乎涵盖全身各系统的疾病,比如高血压[5]、糖尿病[6]、系统性红斑狼疮[7]、炎症性肠病[8]、慢性阻塞性肺疾病[9]、贫血[10]等。但是,长期以来较少有人关注银屑病患者与认知障碍的关系。近来,陆续有国外的学者发现银屑病患者出现了早期或者轻微的认知障碍,Gisondi等[11]对41例银屑病患者的调查发现其轻度认知功能障碍(mild cognitive impairment,MCI)发生率达44%,且主要表现为长期记忆、执行功能、注意功能的减退;Colgecen等[12]对77例银屑病患者进行的横断面研究则发现银屑病患者较普通人群有更高的认知障碍发生率,且主要表现为视空间功能与执行功能的下降。而国内尚缺乏相关资料。因此,本研究拟使用蒙特利尔认知评估量表(Montreal Cognitive Assessment Scale, MoCA)对银屑病患者进行初步的认知功能评估,探索银屑病患者认知功能障碍的模式,对认知功能与相关因素进行分析,旨在增加对银屑病患者认知功能特点的认识。
1 资料与方法
1.1 研究对象 告知所有被试者研究目的及研究安全性等相关事项,并签署知情同意书,本研究受河南科技大学第二附属医院伦理委员会监督。病例组:连续选择2016年6~10月在河南科技大学第二附属医院皮肤科门诊就诊或者住院的银屑病患者,共56例,根据纳入与排除标准选择自愿参与本研究的患者共43例为研究对象,其中男19(44.2%)例,女24(55.8%)例,平均年龄(43.44±13.55)岁,病程2~15年,受教育年限(10.63±3.07)年。纳入标准:①年龄>18岁;②符合《临床皮肤病学》[13]中拟定的银屑病诊断标准并已确诊为银屑病。排除标准:①患有严重心、脑、肝、肺、肾等脏器疾病及其他内科疾病;②脑外伤史;③神经系统疾病及精神疾病史;④文盲及各种原因无法配合完成量表及调查者;⑤近期镇静药物及各种可能影响认知功能的药物使用史。同时选择到我院体检的30名健康体检者作为对照组,其中男11(36.7%)名,女19(63.3%)名,平均年龄(38.83±11.61)岁,受教育年限(11.60±2.29)年。两组一般资料比较无统计学差异(P>0.05)。
1.2 研究方法
1.2.1 调查工具 (1)使用蒙特利尔认知评估量表(Montreal Cognitive Assessment Scale, MoCA)评估患者的认知功能状况,该量表由6个认知维度构成,总共有11个测试项,总分为30分。其中视空间功能包括立方体描绘(1分)及画钟试验(3分);记忆功能包括一个复述及延迟记忆任务共5分;语言功能包括动物命名任务(3分)及句子复述任务(2分);执行功能包括交替连线测验(1分)、动物流畅性试验(1分)及词语抽象任务(2分);注意与计算功能6分(包括数字广度测试、数字警觉性测试及连续减七测试任务);定向力包括视空间定向任务共6分。得分≥26分以上为正常,得分越高,提示认知功能越好[14]。(2)采用贝克抑郁自评量表(Beck Depression Inventory-13,BDI-13)[15]评定患者的抑郁, 13个问题均有自我评价指标来反映严重程度,采用4级评分,一般BDI-13≥5分即认为被试者存在抑郁情绪,抑郁状态越严重,评分越高;采用贝克焦虑自评量表(Beck Anxiety Inventory,BAI)[16]评定患者的焦虑状况,该量表包括有21个焦虑症状,被试者对每项症状对其影响的程度以0(绝无影响)至3(严重影响)评判,若BAI总分≥45分则认为焦虑阳性。(3)银屑病疾病严重程度使用银屑病皮损面积及严重度指数(Psoriasis area and severity index,PASI)评分判定,PASI评分累计量为0~72分,评分越高提示病情越严重[17]。(4)自制表格记录下年龄、性别、受教育水平、病程、起病年龄、有无合并高血压及糖尿病、婚姻状况、家庭住址、职业特点等资料。
1.2.2 调查方法 认知功能评估在安静环境下进行,评估者为本文第一作者,评估者熟悉相关量表的操作及评分规则。
1.3 统计学方法 采用SPSS 20.0统计软件对数据进行分析,统计学方法包括t检验、χ2检验、单因素方差分析、多元线性回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般资料及认知功能评估 43例银屑病患者与30名对照组在年龄、性别、受教育年限等方面无统计学差异(P>0.05),尽管银屑病患者MoCA总分低于对照组,但是并无统计学差异(P>0.05)。见表1。以MoCA评分<26分为界,银屑病患者可分为认知障碍组共13(30.2%)例,认知正常组30(69.8%)例,而对照组中伴有认知障碍者为4(13.3%)名。单因素方差分析发现各组间视空间功能、执行功能均具有统计学差异(P<0.05),而记忆、语言、注意、定向等认知维度在三组间差异无统计学差异(P>0.05),进一步用LSD检验发现视空间功能、执行功能在组间两两比较差异有统计学意义(P<0.05),且在对照组、认知正常组、认知障碍组间呈逐渐下降趋势。见表2。

表1 研究对象的一般资料
2.2 银屑病患者认知功能障碍相关因素的单因素分析 对相关因素进行t检验及χ2检验发现,认知障碍组及认知正常组之间在性别、合并症、职业特点、婚姻状况、居住地、BAI评分等因素无统计学差异(P>0.05),而年龄、受教育程度、病程、起病程度、PASI评分、BDI评分两组间有统计学差异(P<0.05),可能与银屑病患者认知功能障碍密切相关。见表3。
2.3 银屑病患者认知功能障碍相关因素的多因素分析 以各患者的MoCA总分为因变量,将单因素分析发现的银屑病认知障碍组及认知正常组两组间差异有统计学意义的6个因素(包括年龄、受教育年限、病程、起病年龄、PASI评分、BDI评分)为自变量进行逐步多元线性回归分析,结果发现,年龄、病程、BDI评分进入回归方程对银屑病患者的MoCA评分产生负性影响(P<0.05),其余因素无显著性影响(P>0.05)。见表4。

表2 研究对象的认知功能特点
注:LSD检验,*与对照组比较,P<0.05;Δ与认知正常组比较,P<0.05
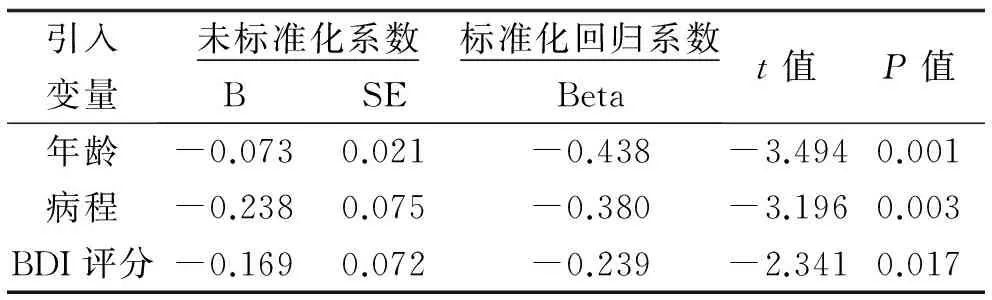
表4 银屑病患者认知功能障碍相关因素的多元线性回归分析
3 讨论
认知是机体认识和获取知识的智能加工过程,认知功能障碍通常隐袭起病,许多患者早期不伴有明显的精神神经表现,直至出现严重的认知功能损害,如痴呆时才被诊断。银屑病患者常常伴有精神心理疾病、免疫和代谢性疾病等伴发症,使得这些患者有更高的风险出现早期的认知功能下降[18]。
近年来,国外陆续有学者对银屑病患者相关认知功能特点进行了研究,本研究以MoCA为工具,在国内首次对银屑病患者的认知功能特点进行调查,发现银屑病患者认知功能障碍发生率高达30.2%,明显高于对照组的13.3%,进一步比较发现其认知功能障碍主要累及视空间功能及执行功能两个认知维度,与上述研究一致的发现银屑病患者较普通人群更容易出现认知功能障碍,而具体累及的认知维度存在一定差异,研究样本过小和认知功能评估工具的不同可能是造成这些差异的原因。视空间功能是对视觉信号包含的空间信息进行提取和阐释的认知过程;执行功能是指个体的许多认知加工过程的协同操作,在实现某一特定目标时,个体所使用的灵活而优化的认知神经机制,包括计划、工作记忆、冲动控制、抑制、定势转移或心理灵活性以及动作产生和监控等一系列功能。
我们推测有以下可能的机制导致银屑病患者的认知功能下降。首先,银屑病长期慢性炎症反应可能会导致神经元应激[19,20],加上长期存在的炎性介质,比如超敏C反应蛋白(High sensitive C reactive protein,Hs-CRP)、白介素-1β(Interleukin-1β,IL-1β)、前炎性细胞活素(proinflammatory cytokines)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)可能是引起相关脑区损伤的原因,这些介质已经被证实在阿尔茨海默病及银屑病发病机制中发挥重要作用[21,22];其次,一些研究证实两者存在一些共同的遗传背景,载脂蛋白E4(Apolipoprotein E gene,ApoE4)等位基因多态性被证明与两种疾病密切相关[23-25],所以遗传因素可能也是机制之一;再者,脑源性神经营养因子(plasma brain-derived neurotrophic factor ,BDNF)可能也参与其中,BDNF在神经可塑性中发挥着重要作用,可以促进神经元生长及增强突触强度,也影响着大脑的认知功能,有研究发现BDNF与压力、应激相关,长期的心身压力可以导致BDNF水平的下降[26,27],Brunoni等[28]发现银屑病患者脑脊液中神经营养因子水平存在下降,我们推测银屑病患者长期承受着心身压力可能引起BDNF的下降从而在认知功能障碍的发生中发挥着一定作用。然而,确切的病理生理机制仍有待进一步澄清。
此外,为了进一步了解银屑病患者认知功能障碍的相关因素,本研究通过多元线性回归分析发现,患者的年龄、病程、BDI评分对其认知功能呈显著负面影响(P<0.05)。年龄、抑郁作为认知功能下降的独立危险因素早已被证实,年龄越大、抑郁状态越严重,越可能导致痴呆发生;根据上文中提到的可能机制我们推测,病程越长,炎性介质对脑区损伤更严重,患者承受的心身压力越大,越有可能导致认知功能障碍的发生。值得一提的是,本研究并未发现银屑病严重程度(PSAI评分)与认知功能有显著相关性(P>0.05),这表明认知功能障碍可能是银屑病一个比较稳定的临床表现,其反映的是器质性的中枢神经系统损伤。
综上所述,本文在国内第一次对银屑病患者的认知功能特点进行调查,发现银屑病患者相比正常人群在部分认知域更易出现功能障碍,主要累及视空间功能和执行功能两个认知维度。因此,临床上对银屑病患者进行常规检查的同时也有必要对其进行简单的认知功能检查,必要时应该对出现的认知功能障碍进行早期干预。但是,由于本研究的局限性,以上结论还需要更多的研究来论证。
[1] Parisi R, Symmons DP, Griffiths CE, et al. Global epidemiology of psoriasis: a systematic review of incidence and prevalence[J]. J Invest Dermatol,2013,133(2):377-385.
[2] Egeberg A. Psoriasis and comorbidities. Epidemiological studies[J]. Dan Med J,2016,63(2):pii:B5201.
[3] Muller-Oehring EM, Schulte T. Cognition, emotion, and attention[J]. Handb Clin Neurol,2014,125:341-354.
[4] Ceskova E. Cognitive dysfunction and its therapy[J]. Cas Lek Cesk,2005,144(12):801-804.
[5] Iadecola C. Hypertension and dementia[J]. Hypertension,2014,64(1):3-5.
[6] 胡桂芳,黄映华,陈雪云,等. 老年2型糖尿病患者轻度认知功能障碍与血糖、血脂水平的关系及认知干预的效果[J].中国健康心理学杂志,2015,23(5):677-680.
[7] Lin YR, Chou LC, Chen HC, et al. Increased risk of dementia in patients with systemic lupus erythematosus: A nationwide population-based cohort study[J]. Arthritis Care Res (Hoboken),2016,32(8):2423-2430.
[8] Papathanasiou A, Nikakis P, Bonakis A, et al. Rapidly progressive dementia as presenting feature in inflammatory bowel disease[J]. Alzheimer Dis Assoc Disord,2014,28(3):294-295.
[9] Liao KM, Ho CH, Ko SC, et al. Increased risk of dementia in patients with chronic obstructive pulmonary disease[J]. Medicine (Baltimore),2015,94(23):930.
[10] Hong CH, Falvey C, Harris TB, et al. Anemia and risk of dementia in older adults: findings from the health ABC study[J]. Neurology,2013,81(6):528-533.
[11] Gisondi P, Sala F, Alessandrini F, et al. Mild cognitive impairment in patients with moderate to severe chronic plaque psoriasis[J]. Dermatology,2014,228(1):78-85.
[12] Colgecen E, Celikbilek A, Keskin DT. Cognitive impairment in patients with psoriasis: A cross-sectional study using the montreal cognitive assessment[J]. Am J Clin Dermatol,2016,17(4):413-419.
[13] 赵辨.临床皮肤病学[M].3版.南京:江苏科学技术出版社,2001.759-769.
[14] Chen X, Zhang R, Xiao Y, et al. Reliability and validity of the Beijing version of the montreal cognitive assessment in the evaluation of cognitive function of adult patients with OSAHS[J]. PLoS One,2015,10(7):e132361.
[15] Beck AT, Ward CH, Mendelson M, et al. An inventory for measuring depression[J]. Arch Gen Psychiatry,1961,4:561-571.
[16] 张明园.精神科评定量表手册[M].长沙:湖南科学技术出版社,1998.31-34.
[17] El MY, El GM, Youssef S, et al. Using simulation in clinical education: Psoriasis area and severity index (PASI) score assessment[J]. Curr Rheumatol Rev,2016,12(3):195-201.
[18] Owczarczyk-Saczonek A, Nowicki R. Psoriasis and comorbidity-literature review[J]. Wiad Lek,2014,67(4):512-519.
[19] Kamer AR. Systemic inflammation and disease progression in alzheimer disease[J]. Neurology,2010,74(14):1157-1158.
[20] Eikelenboom P, Hoozemans JJ, Veerhuis R, et al. Whether, when and how chronic inflammation increases the risk of developing late-onset Alzheimer's disease[J]. Alzheimers Res Ther,2012,4(3):15.
[21] Siegel D, Devaraj S, Mitra A, et al. Inflammation, atherosclerosis, and psoriasis[J]. Clin Rev Allergy Immunol,2013,44(2):194-204.
[22] Rubio-Perez JM, Morillas-Ruiz JM. A review: inflammatory process in Alzheimer's disease, role of cytokines[J]. Scientific World Journal,2012,2012:756357.
[23] Lovestone S, Anderton B, Betts J, et al. Apolipoprotein E gene and Alzheimer's disease: is tau the link?[J]. Biochem Soc Symp,2001,67:111-120.
[24] Karpouzis A, Caridha R, Tripsianis G, et al. Apolipoprotein E gene polymorphism in psoriasis[J]. Arch Dermatol Res,2009,301(6):405-410.
[25] 伍力,王燕,余发春,等.阿尔茨海默病精神症状与载脂蛋白E基因多态性相关性研究[J].中国健康心理学杂志,2008,16(10):1168-1170.
[26] Tamaji A, Iwamoto K, Kawamura Y, et al. Differential effects of diazepam, tandospirone, and paroxetine on plasma brain-derived neurotrophic factor level under mental stress[J]. Hum Psychopharmacol,2012,27(3):329-333.
[27] 孙喜蓉,瞿正万,蔡正宜,等.抑郁症患者认知功能与脑源性神经营养因子相关性研究[J].中国健康心理学杂志,2012,20(10):1446-1448.
[28] Brunoni AR, Lotufo PA, Sabbag C, et al. Decreased brain-derived neurotrophic factor plasma levels in psoriasis patients[J]. Braz J Med Biol Res,2015,48(8):711-714.
(收稿:2017-05-15 修回:2017-06-15)
Analysis of cognitive impairment in the patients with psoriasis
YAOYing,ZHANGBin,JUXinggang,ZHENGShuangjin,JIAXueping,WANGJunwei.
DepartmentofDermatology,theSecondAffiliatedHospital,HenanScienceandTechnologyUniversity,Luoyang471000,China
YAOYing,E-mail: 15537990507@163.com
Objective: To determine the characteristics of cognitive function in the patients with psoriasis and the influencing factors. Methods: The cognitive function and emotional states of 43 patients with psoriasis and 30 healthy controls were evaluated with Montreal Cognitive Assessment Scale (MoCA), Beck Depression Inventory-13 (BDI-13) and Beck Anxiety Inventory (BAI). The factors that might influence cognitive function of the patients with psoriasis were analyzed with multivariate regression. Results: The incidence of cognitive dysfunction in the patients with psoriasis was 30.2%. The visuospatial domain scores and executive function scores in the patients with cognitive impairment were 1.69±1.25 and 2.46±0.87, which were lower than those in the patients with normal cognitive (3.03±0.80, 3.33±0.88) and healthy controls (3.30±0.75, 3.57±0.56), with significant differences (P<0.05). Multiple regression analysis showed that age, duration of the disease and BDI score had significantly negative influence on cognitive function in the patients with psoriasis (P<0.05). Conclusion: The patients with psoriasis have partial cognitive decline and mainly involve the visual space and executive function. The influence factors on cognitive function of the patients with psoriasis include age, duration of the disease and depression.
psoriasis; cognitive function; visuospatial domain; executive function
河南科技大学第二附属医院皮肤科,河南洛阳,471000
姚莹,E-mail:15537990507@163.com

