西妥昔单抗联合铂类化疗对人喉鳞癌Hep-2细胞裸鼠移植瘤COX-2及MMP-7的影响*
龚永谦,程爱兰,刘洁
(1.南华大学附属第一医院 耳鼻咽喉科,湖南 衡阳 421001;2.南华大学医学院 病理学教研室,湖南 衡阳 421001)
西妥昔单抗联合铂类化疗对人喉鳞癌Hep-2细胞裸鼠移植瘤COX-2及MMP-7的影响*
龚永谦1,程爱兰2,刘洁1
(1.南华大学附属第一医院 耳鼻咽喉科,湖南 衡阳 421001;2.南华大学医学院 病理学教研室,湖南 衡阳 421001)
目的 探讨西妥昔单抗联合铂类化疗对人喉鳞癌Hep-2细胞裸鼠移植瘤环氧化酶-2(COX-2)及基质金属蛋白酶-7(MMP-7)的影响。方法 选择BALB/c裸鼠24只为研究对象,均复制人喉鳞癌Hep-2细胞裸鼠移植瘤模型,随机分为西妥昔单抗组、顺铂组、西妥昔单抗联合顺铂组及对照组,各6只。对照组腹腔注射0.9%氯化钠溶液0.2 ml,西妥昔单抗组腹腔注射1 036 μg/ml西妥昔单抗注射液,顺铂组腹腔注射3μg/ml顺铂注射液,西妥昔单抗联合顺铂组腹腔注射1 036 μg/ml西妥昔单抗注射液和3 μg/ml顺铂注射液,连续4周后,脱颈处理裸鼠。比较瘤体生长情况、COX-2与MMP-7表达及信使核糖核酸(mRNA)表达。结果 西妥昔单抗组、顺铂组、西妥昔单抗联合顺铂组瘤体体积及瘤重均低于对照组(P<0.05),西妥昔单抗联合顺铂组瘤体体积、瘤重低于西妥昔单抗组与顺铂组,抑瘤率高于西妥昔单抗组及顺铂组(P<0.05);西妥昔单抗组、顺铂组、西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7及mRNA表达均低于对照组(P<0.05),西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7表达及mRNA表达低于西妥昔单抗组、顺铂组(P<0.05)。结论西妥昔单抗联合铂类化疗有助于抑制喉鳞癌Hep-2细胞裸鼠移植瘤增殖生长,可能与抑制肿瘤组织COX-2与MMP-7表达有关。
西妥昔单抗;顺铂;喉癌;环氧化酶-2;基质金属蛋白酶-7
喉癌是头颈部恶性肿瘤之一,占全身肿瘤的2%左右[1],且有逐年增高的趋势,手术是治疗的主要方式。顺铂作为辅助治疗手段可有效保全喉结构与功能,但也存在严重胃肠道反应、骨髓抑制等毒副作用。西妥昔单抗是临床治疗头颈部肿瘤的靶向药物之一,可抑制血管内皮生长因子、基质金属蛋白酶的生成,诱导肿瘤细胞凋亡,且不增加恶心、呕吐及骨髓抑制等并发症[2-3]。两组联合应用于喉癌的文献报道较少,本文通过复制人喉鳞癌Hep-2细胞裸鼠移植瘤模型的方法,探讨西妥昔单抗联合顺铂化疗对人喉鳞癌Hep-2细胞裸鼠移植瘤环氧合酶-2(cyclooxygenase-2,COX-2)及基质金属蛋白酶 -7(matrix metalloprteinases-7,MMP-7)表达的影响,旨在分析其可能作用机制。
1 材料与方法
1.1 实验动物
BALB/c裸鼠24只。雌性;4~6周龄;体重15~30 g,平均(22.45±3.12)g;购于湖南省疾病控制中心实验动物中心(许可证号SCXK20161015)。饲养条件:室温(25.01±0.56)℃,相对湿度50%~60%,常规饲养1周后进行实验。本研究经本院动物伦理委员会批准。
1.2 细胞株与药物试剂
人喉鳞癌Hep-2细胞(中南大学湘雅医学院动物实验中心提供),西妥昔单抗(德国莫克公司,注册证号 S2011009、规格 100 mg/20 ml、批号 151210),顺铂注射液(江苏省连云港恒瑞医药股份有限公司,国药准字 H20050962、规格 100 ml),COX-2 多克隆抗体(美国Santa Cruz公司),MMP-7多克隆抗体(购自北京晶美生物工程有限公司),链霉菌抗生物素蛋白-过氧化物酶连接法(streptavidin-perosidase,SP)试剂盒(购自北京中杉金桥生物技术有限公司),二氨基联苯胺显色试剂盒(购自福建省福州迈新生物技术开发有限公司),Trizol试剂盒(购自美国Sigma公司),Taq DNA聚合酶、逆转录酶AMV(购自美国Progmega公司)。
1.3 主要仪器
超净工作台(江苏省苏州净化设备有限公司SWCJ-1F型),低温冰箱(日本 Sayyo公司MD-330),轮转式切片机(上海江文信息技术有限公司),光学相差显微镜(日本Olympus公司CKX41型),Qwin standard 2.8病理图像分析系统(德国Leica公司)。
1.4 复制模型与分组
将复苏后Hep-2细胞置于含10%小牛血清RPMI 1640培养基细胞液中,放至37℃培养箱内培养,细胞贴壁生长后取对数生长期细胞磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,配成 108/ml单细胞悬液,于裸鼠右侧背部皮下注射100 μl,2周后观察皮下肿瘤结节情况,当肿瘤直径>5 mm时提示模型复制成功。将模型复制成功的24只喉鳞癌模型裸鼠随机分为西妥昔单抗组、顺铂组、西妥昔单抗联合顺铂组及对照组,每组各6只。
1.5 药物干预
参照乔建兵等[4]的实验方法实施药物干预方案。对照组:腹腔注射0.9%氯化钠溶液0.2 ml,连续4周;西妥昔单抗组:腹腔注射1 036 μg/ml西妥昔单抗注射液,连续4周;顺铂组:腹腔注射3μg/ml顺铂注射液,连续4周;西妥昔单抗联合顺铂组:腹腔注射1 036 μg/ml西妥昔单抗注射液和3 μg/ml顺铂注射液,连续4周。
1.6 瘤体体积与瘤体重量
4周末脱颈处理裸鼠,分离移植瘤,用游标卡尺测量瘤体长径、短径,计算瘤体体积,同时称重,计算抑瘤率。将裸鼠肿瘤组织分为2部分:①用于免疫组织化学检测肿瘤组织COX-2、MMP-7蛋白表达;②用于检测瘤组织COX-2、MMP-7信使核糖核酸(messenger ribonucleic acid,mRNA)表达。抑瘤率=(对照组瘤体重量-实验组瘤体重量)/对照组瘤体重量×100%。
1.7 肿瘤组织COX-2、MMP-7蛋白表达
参照试剂盒说明书,采用SP法检测肿瘤组织COX-2、MMP-7表达,用PBS代替一抗作阴性对照,用肿瘤组织作阳性对照。判断标准:COX-2阳性细胞为细胞质可见棕黄色颗粒弥漫性分布,MMP-7阳性细胞为细胞质可见棕黄色颗粒染色。选择染色良好区域,采用图像分析软件进行定量分析。
1.8 肿瘤组织COX-2、MMP-7 mRNA表达
参照覃纲等[5]的方法检测肿瘤组织COX-2、MMP-7 mRNA表达,采用逆转录-聚合酶链反应法(reverse transcription-polymerase chain reaction,RT-PCR),用Trizol法提取肿瘤组织总RNA完成逆转录,采用PCR反应提取终产物电泳后,使用凝胶分析系统分析目的基因及β-actin积分吸光值,再用Biod-rad软件分析mRNA表达水平。
1.9 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料用均数±标准差(±s)表示,比较做方差分析,两组比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组瘤体体积与瘤体重量变化情况
4周后,4组裸鼠重量比较差异无统计学意义(P>0.05);实验组:西妥昔单抗组、顺铂组及西妥昔单抗联合顺铂组瘤体体积及瘤重低于对照组(t=6.173、6.466、8.272、2.509、3.057 和 5.347,P=0.010、0.009、0.004、0.032、0.021 和 0.013),且西妥昔单抗联合顺铂组<顺铂组<西妥昔单抗组<对照组,差异有统计学意义(F=6.324和3.456,P=0.010和0.026)实验组抑瘤率比较,差异有统计学意义(F=4.324,P=0.018),西妥昔单抗联合顺铂组抑瘤率高于西妥昔单抗组与顺铂(t=8.984和 6.109,P=0.002和0.010),顺铂组抑瘤率高于西妥昔单抗组(t=2.781,P=0.028)。见表 1。
2.2 肿瘤组织COX-2、MMP-7表达
4周后,实验组:西妥昔单抗组、顺铂组及西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7蛋白表达均低于对照组 (t=7.356、8.262、10.705、8.259 、9.450 和 12.076,P=0.006、0.004、0.000、0.004、0.000 和0.000);西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7表达低于西妥昔单抗组、顺铂组(t=7.051、7.211、5.921 和 5.579,P=0.008、0.007、0.012和0.014)。见表2。
表1 4组裸鼠重量、瘤体体积、瘤重及抑瘤率比较 (n=6,±s)

表1 4组裸鼠重量、瘤体体积、瘤重及抑瘤率比较 (n=6,±s)
注:1)与对照组比较,P <0.05;2)与西妥昔单抗组比较,P <0.05;3)与顺铂组比较,P <0.05
组别抑瘤率/%对照组 24.35±2.02 1 102.36±202.34 0.84±0.18 -西妥昔单抗组 24.12±1.65 568.12±63.211) 0.60±0.151) 28.57±3.12顺铂组 24.03±1.57 545.20±60.161) 0.57±0.121) 34.52±4.212)西妥昔单抗联合顺铂组F值P值裸鼠重量/g 瘤体体积/mm3瘤重/g23.28±1.721.1020.086 402.15±45.361)2)3)6.3240.010 0.41±0.081)2)3)3.4560.026 51.19±5.322)3)4.3210.018
2.3 肿瘤组织COX-2、MMP-7 mRNA表达
4周后,实验组:西妥昔单抗组、顺铂组及西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7 mRNA 表达低于对照组(t=2.135、3.530、3.342、4.725、5.468 和 6.715,P=0.032、0.024、0.023、0.016、0.012 和0.010);西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7 mRNA表达低于西妥昔单抗组、顺铂组(t=4.201和5.085,P=0.019和0.013);顺铂组裸鼠肿瘤组织COX-2、MMP-7 mRNA表达低于西妥昔单抗组(t=2.939和 3.424,P=0.030和 0.026)。见表 3。
表2 4组裸鼠肿瘤组织COX-2、MMP-7表达比较(n=6,±s)
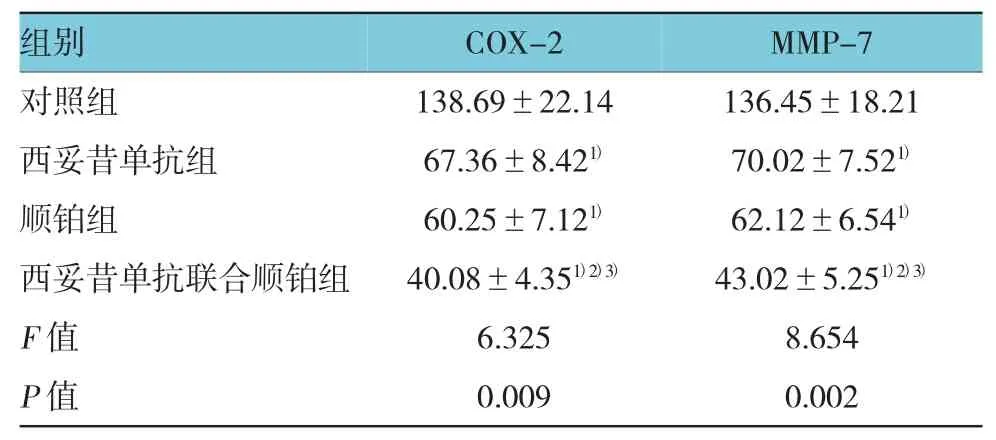
表2 4组裸鼠肿瘤组织COX-2、MMP-7表达比较(n=6,±s)
注:1)与对照组比较,P <0.05;2)与西妥昔单抗组比较,P <0.05;3)西妥昔单抗联合顺铂组与顺铂组比较,P<0.05
组别MMP-7对照组 138.69±22.14 136.45±18.21西妥昔单抗组 67.36±8.421) 70.02±7.521)顺铂组 60.25±7.121) 62.12±6.541)西妥昔单抗联合顺铂组F值P值COX-240.08±4.351)2)3)6.3250.009 43.02±5.251)2)3)8.6540.002
表3 4组裸鼠肿瘤组织COX-2、MMP-7 mRNA表达比较(n=6,±s)
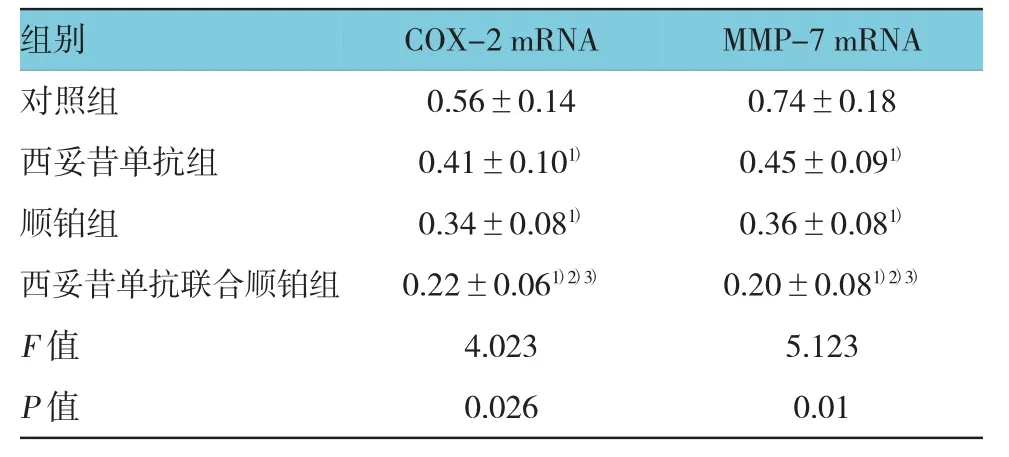
表3 4组裸鼠肿瘤组织COX-2、MMP-7 mRNA表达比较(n=6,±s)
注:1)与对照组比较,P <0.05;2)与西妥昔单抗组比较,P <0.05;3)与顺铂组比较,P <0.05
组别MMP-7 mRNA对照组 0.56±0.14 0.74±0.18西妥昔单抗组 0.41±0.101) 0.45±0.091)顺铂组 0.34±0.081) 0.36±0.081)西妥昔单抗联合顺铂组F值P值COX-2 mRNA0.22±0.061)2)3)4.0230.026 0.20±0.081)2)3)5.1230.01
3 讨论
随着现代医疗技术的不断发展以及肿瘤综合治疗手段的不断进步,在治疗喉鳞癌时,要求在不断提高生存率的前提下,通过治疗方式的改变,尽可能保留残留喉结构与功能[6],提高患者生存质量。靶向治疗以其选择性地作用于肿瘤组织细胞、减少对正常组织细胞的损害,越来越受到关注。
西妥昔单抗为抗EGFE人/鼠嵌合单克隆抗体,可竞争性结合于表皮生长因子受体,抑制癌细胞增殖[7-8];也可通过上调Bax表达与抑制Bcl-2表达诱导肿瘤细胞凋亡;通过下调基质金属蛋白表达抑制肿瘤细胞侵袭与转移[9]。也有学者研究报道,肿瘤细胞的发生、发展与肿瘤细胞增殖失控、细胞凋亡受限密切相关,西妥昔单抗可诱导Hep-2细胞株阻滞于S期,造成DNA损伤不能进行有丝分裂,从而阻止肿瘤细胞增殖失控[10-11]。本研究中,西妥昔单抗组肿瘤体积、瘤重低于对照组,且西妥昔单抗联合顺铂组肿瘤体积、瘤重均低于西妥单抗组、顺铂组,说明西妥昔单抗对肿瘤细胞的增殖、凋亡有积极的促进作用。
COX-2是花生四烯酸合成前列腺素限速酶,在组织中表达与细胞因子、炎症反应相关,可通过上调血管生长因子的表达促进肿瘤细胞局部浸润和远处转移[12];MMP-7由肿瘤细胞分泌,可通过降解细胞外基质加速肿瘤细胞侵入周围组织,为肿瘤新生血管生长提供通道[13]。相关研究表明,COX-2、MMP-7在喉鳞癌细胞组织中均呈异常高表达状态[14-15]。本实验结果发现,西妥昔单抗组COX-2、MMP-7表达及mRNA表达低于对照组,西妥昔单抗联合顺铂组裸鼠肿瘤组织COX-2、MMP-7表达及mRNA表达低于西妥昔单抗组、顺铂组,王文慧等[16]、CHUN等[17]也有类似的文献报道。
综上所述,本研究结果表明,西妥昔单抗联合铂类化疗有助于抑制人喉鳞癌Hep-2细胞裸鼠移植瘤增殖生长,可能与抑制细胞组织COX-2及MMP-7表达有关。本研究的局限性在于未对西妥昔单抗不同用药剂量进行比较,且缺乏对其可能作用机制的深入分析,有待今后作进一步的研究。
[1]李黎,高树峰,张少容,等.伊洛马司对人喉癌Hep-2细胞增殖及凋亡的影响[J].实用医学杂志,2013,29(19):3116-3119.
[2]FERNANDEZ-MATEOS J,SEIJAS-TAMAYO R,MAEIA R,et al.Epidermal growth factor receptor (EGFR)pathway polymorphisms as predictive markers of cetuximab toxicity in locally advanced head and neck squamous cell carcinoma (HNSCC)in a Spanish population[J].Oral Oncology,2016(63):38-43.
[3]BUGLIONE M,MADDALO M,CORVO R,et al.Subgroup analysis according to human papillomavirus status and tumor site of a randomized phaseⅡtrial comparing cetuximab and cisplatin combined with radiation therapy for locally advanced head and neck cancer[J].International Journal of Radiation Oncology Biology Physics,2017,97(3):462-472.
[4]乔建兵,陈文萍,王琳,等.西妥昔单抗联合顺铂对荷食管鳞癌裸鼠移植瘤的抑制作用[J].中华肿瘤防治杂志,2015,22(12):907-910.
[5]覃纲,刘文军,梁灼萍,等.尼美舒利对人喉鳞癌Hep-2细胞裸鼠移植瘤CD44MMP-7表达的影响[J].肿瘤防治杂志,2011,38(5):490.
[6]MESIA R,GARCIA-SAENZ J A,KLOZANO A,et al.Could the addition of cetuximab to conventional radiation therapy improve organ preservation in those patients with locally advanced larynx cancer who respond to induction chemotherapy? An organ preservation spanish head and neck cancercooperative group phase 2 study[J].International Journal of Radiation Oncology Biology Physics,2017,97(3):473-480.
[7]WICHMANN G,CEDRA S,SCHLEGEL D,et al.Cilengitide and cetuximab reduce cytokine production and colony formation of head and neck squamous cell carcinoma cell ex vivo[J].Anticancer Research,2017,37(2):521-527.
[8]陈永东,王远东,李晓宁.西妥昔单抗联合化疗在中晚期食管癌术后辅助治疗中的应用效果观察[J].实用医学杂志,2014,30(17):2862-2863.
[9]NOWSHEEN S,BONNER J A,LOBUGLIO A F,et al.Cetuximab augments cytotoxicity with poly(adp-ribose)polymerase inhibition in head and neck cancer[J].PloS One,2011,6(8):e24148.
[10]於子卫,董频,庞正.西妥昔单抗联合术后同步放化疗治疗晚期复发性头颈癌的初步观察[J].山东大学耳鼻喉眼学报,2010,24(6):44-46.
[11]AFTER F,HAMIDI H,FEJZO M S,et al.Dacomitinib,an irreversible pan-ErbB inhibitor significantly abrogates growth in head and neck cancer models that exhibit low response to cetuximab[J].PLoS One,2013,8(2):e56122.
[12]王智勇,成伟,梁中敏,等.声门上型喉癌中环氧化酶-2的表达及微血管和淋巴管密度的关系[J].中国肿瘤外科杂志,2015,7(1):27-29,32.
[13]梁晶,贾新凤,韩福才.肺癌患者外周血中MMP-7mRNA、sMICA、VEGF表达及其与侵袭转移的关系[J].肿瘤防治杂志,2016,43(6):508-512.
[14]姚红,尤易文,黄华.喉鳞状细胞癌组织中Beclinl、COX-2、MVC的表达及意义[J].山东医药,2014,54(23):47-50.
[15]AHMED H O A,HAGLUND C,VIRLAINEN S,et al.MMP-7,MMP-8,and MMP-9 in oral and cutaneous squamous cell carcinomas[J].Oral Surgery Oral Medicine Oral Pathology&Oral Radiology,2015,119(4):459-467.
[16]王文慧,王晓玲.西妥昔单抗联合紫杉醇对人鼻咽癌CNE-1细胞活力的影响及其可能的分子机制探讨[J].医学综述,2015,21(20):3822-3825.
[17]CHUN S G,HUGHES R,SUMER B D,et al.A phaseⅠ/Ⅱstudy of nab-paclitaxel,cisplatin,and cetuximab with concurrent radiation therapy for locally advanced squamous cell cancer of the head and neck[J].Cancer Investigation,2017,35(1):23-31.
Impact of Cox-2 and MMP-7 of cetuximab combined with cisplatin on human laryngeal neoplasms Hep 2 cells nude mice transplanted tumor*
Yong-qian Gong1,Ai-lan Cheng2,Jie Liu1
(1.Department of Otorhinolaryngology,the First Affiliated Hospital of University of South China,Hengyang,Hunan 421001,China;2.Department of Pathology,School of Medicine,University of South China,Hengyang,Hunan 421001,China)
ObjectiveTo study effects of Cox-2 and MMP-7 of cetuximab combined with cisplatin on human laryngeal neoplasms Hep 2 cells nude mice transplanted tumor and its mechanism.MethodsA total of 24 BALB/c human laryngeal neoplasms Hep 2 cells nude mice were established,and were divided into cetuximab group,cisplatin group,cetuximab combined cisplatin group,blank control group.The control group was treated with intraperitoneal injection 0.9%sodium chloride solution 0.2 ml,the cetuximab group with intraperitoneal injection 1,036 μg/ml cetuximab injection,cisplatin group with intraperitoneal injection 3 μg/ml cisplatin injection,and cetuximab combined with cisplatin group with intraperitoneal injection 1,036 μg/ml cetuximab injection and 3 μg/ml cisplatin injection.After four weeks,tumors growth,tumor tissue Cox-2 and MMP-7 protein expression and mRNA expression were compared.ResultsVolume and weight of tumors in the cetuximabgroup,cisplatin group,cetuximab combined cisplatin group were significantly lower than those in the control group(P<0.05).Volume and weight of tumors in the cetuximab combined cisplatin group were significantly lower than those in cetuximab group,cisplatin group,inhibition rate were significantly higher cetuximab group,cisplatin group(P<0.05).Expression of COX-2,MMP-7 protein and mRNA in cetuximab group,cisplatin group,cetuximab combined cisplatin group were significanlty lower than those in the control group(P<0.05).Expressions of COX-2,MMP-7 protein and mRNA in cetuximab combined cisplatin group were significanlty lower than cetuximab group,cisplatin group (P<0.05).ConclusionsCetuximab combination with cisplatin chemotherapy helps to inhibit laryngeal neoplasms Hep 2 cells nude mice transplanted tumor proliferation and growth.It may related to inhibiting tumor tissue Cox-2 and MMP-7 expression.
cetuximab;cisplatin;laryngeal neoplasms;Cox-2;MMP-7
R696.2
A
10.3969/j.issn.1005-8982.2017.11.005
1005-8982(2017)11-0026-05
2017-02-28
国家自然科学基金(No:81372894);湖南省教育厅科研项目(No:10C1136)

