基于QuEChERS净化的液相色谱-串联质谱法分析食品中的6种生物胺
蒋林蓉,徐志伟,黄杰英,曾敏
(海南出入境检验检疫局,海口 570311)
基于QuEChERS净化的液相色谱-串联质谱法分析食品中的6种生物胺
蒋林蓉,徐志伟,黄杰英,曾敏
(海南出入境检验检疫局,海口 570311)
建立了新鲜水产品(鱼、虾、蟹、鱿鱼)和动物源性腌制食品(腌制鱼、虾酱、鱿鱼干、沙丁鱼罐头)中6种生物胺组胺、尸胺、腐胺、酪胺、2-苯乙胺、色胺的液相色谱-串联质谱定量检测方法。分别对提取方法、不同食品的分类预处理方法、液相色谱条件、质谱条件进行了优化。质谱分析采用电喷雾正离子电离、多反应监测模式、外标法定量。该方法对于新鲜水产品中生物胺的定量限、线性范围和方法回收率分别为:0.10 mg/kg,10~200 ng/mL和74.18%~90.15%,对于动物源性腌制食品中生物胺的回收率为80.05%~95.58%。
生物胺;分类预处理;液相色谱-串联质谱;QuEChERS;检测
生物胺是广泛存在于生物体及多种食品中的一类低分子量含氮有机化合物,是激素、生物碱、核酸和蛋白质合成的前体物质,同时在人和动物的生物神经系统、循环系统、呼吸系统和消化系统、免疫系统及代谢过程的活性细胞中发挥着重要的生理作用[1]。但是生物胺在动物和人体内积聚达到高水平时或在其摄入量很高时会变得具有毒性[2]。除了其自身产生的毒性以外,生物胺可与亚硝酸盐反应生成致癌物亚硝胺、亚硝基吡咯烷、亚硝基哌啶等[3]。
食品中生物胺的检测一直以来都是研究者关注的焦点,原因有二:一是生物胺本身具有的潜在毒性;二是生物胺可作为食品品质的指示剂[4]。动物性食品中富含蛋白质,在加工和贮藏过程中会产生多肽和氨基酸,这些小分子物质容易进一步转化为生物胺。因此动物源性食品,特别是腌制食品中生物胺组分的检测和控制尤为重要。
生物胺分子中缺少发色基团,本身既无紫外吸收又无荧光及电化学活性,使得其分离及测定都比较困难。文献报道的测定生物胺的方法主要有薄层色谱法(TLC)[5]、高效液相色谱法(HPLC)[6]、气相色谱法(GC)[7]、离子色谱法(IC)[8]、毛细管电泳法(CE)[9]等。已报道的HPLC法需要柱前或柱后衍生,操作繁琐且衍生条件苛刻,衍生产物不稳定,阳性样品无法确证,不适用于日常批量检测。QuEChERS(quick,easy,cheap,effective,rugged and safe)方法由Anastassiades等[10]于2003年提出。该方法具有快速、简单、便宜、高效、可靠和安全等特点,广泛应用于农药和兽药残留检测中样品的净化[11]。本研究采取改良的QuEChERS前处理方法,建立了多种动物源性食品的分类预处理方法和这些食品中6种生物胺的液相色谱-串联质谱定量检测方法。并对多种食品中6 种生物胺进行了定性及定量分析,为不同动物源性食品中生物胺含量的控制提供了更多技术选择。
1 实验部分
1.1 主要仪器与试剂
API-4000QTRAP质谱仪 美国AB公司;涡旋振荡器,涡旋混合器 美国IKA公司;天平(感量为0.1 mg和0.01 g) 德国梅特勒公司;高速冷冻离心机(最大转速11000 r/min) 德国Hettich公司;氮气浓缩仪 美国 Turbovap公司;聚丙烯离心管:50 mL,具塞;移液器:1000,100 μL;液相色谱仪、乙二胺-N-丙基硅烷(primary secondary amine,PSA)吸附剂(40 μm,100 gm)、十八烷基硅烷(Octadecylsilane,C18)吸附剂(40 μm,100 gm) 美国Agilent公司。
甲醇、甲酸、乙腈(均为色谱纯);标准物质:尸胺盐酸盐(Cadaverine dihydrochloride,CAS NO.1476-39-7,C5H14N2·2HCl)、组胺盐酸盐(Histamine dihydrochloride,CAS NO. 56-92-8,C5H9N3·2HCl)、腐胺盐酸盐(Putrescine dihydrochloride,CAS NO. 333-93-7,C4H12N2·2HCl)、酪胺盐酸盐(Tyramine hydrochloride,CAS NO. 60-19-5, C8H11NO·HCl)、2-苯乙胺(2-Phenylethylamine,CAS NO. 64-04-0,C8H11N) 均购于Dr公司(纯度均>97.5%);色胺(Tryptamine,CAS NO. 61-54-1,C10H12N2) 购于TRC公司(纯度>95.0%)。其他试剂均为分析纯;实验用水为一级水。
标准储备液:6种生物胺标准储备液,分别称取6种生物胺标准品适量(精确到0.1 mg)于10 mL棕色容量瓶中,用适量水溶解并定容,得1 mg/mL标准储备液,于4 ℃避光保存,可使用6个月。
1.2 液相色谱与质谱条件
1.2.1 液相色谱条件
色谱柱:Waters 亲水作用色谱(hydrophilic interaction liquid chromatography,HILIC)柱(50 mm×2.1 mm,1.7 μm),粒度1.7 μm或相当者;柱温30 ℃;进样量20 μL;流动相:A乙腈,B 0.1%甲酸水;梯度:t=0 min,95% A,5% B;t=3.0 min 时,50% A,50% B;t=7.0 min 时,50% A,50% B;t=8.0 min 时,95% A,5% B;t=15.0 min 时,95% A,5% B;流速:0.30 mL/min。
1.2.2 质谱条件
扫描方式:电喷雾正离子(ESI+)扫描; 检测方式:多反应监测(MRM); 辅助加热气:N2。气帘气压力(CUR):30.00 psi(N2);碰撞气压力(CAD):5.0 psi(N2);电喷雾电压(IS):5500 V;离子源温度(TEM):600 ℃;雾化气压力:55.00 psi(N2);辅助气压力:55.00 psi(N2)。
1.3 样品预处理、提取与净化
本实验中,实测的样品有73种,分别为鱼、虾、蟹、鱿鱼、腌制鱼、虾酱、鱿鱼干、沙丁鱼罐头等,根据样品的性质不同分为新鲜水产品和动物源性腌制食品两大类,它们相对应的预处理、提取和净化步骤如下。
1.3.1 提取
新鲜水产品,称取2 g水产品样品(精确到0.001 g),置于离心管中,加入20.00 mL提取液[乙腈+甲醇(9+1)],涡旋混匀,加入无水硫酸钠5 g,涡旋混匀,4 ℃下以11000 r/min离心5 min,移取2 mL上清液供净化。动物源腌制食品,称取0.5 g样品(精确到0.001 g),置于离心管中,加入50.00 mL乙腈,涡旋混匀,加入无水硫酸钠5 g,涡旋混匀,4 ℃下以11000 r/min离心5 min,移取20 mL上清液,40 ℃下用旋转蒸发或氮气吹扫至小于1.8 mL,加入甲醇0.2 mL,再用乙腈定容至2 mL。
1.3.2 净化
移取2 mL上清液于加有100 mg PSA吸附剂和100 mg C18吸附剂的玻璃试管中,涡旋混匀1 min,4 ℃下以4000 r/min离心5 min,上清液过0.22 μm微孔滤膜,供液相色谱-串联质谱仪分析。
2 结果与讨论
2.1 提取溶剂的选择
提取溶剂的选择会直接影响分析方法的回收率。孙亚军等[12]选取1%三氯乙酸(TCA)提取,HPLC-MS/MS测定虾仁中8种生物胺,该方法没有样品的净化过程,在大批量日常分析时可能会导致质谱中污染物残留而使质谱响应降低。梁波[13]利用0.01%甲酸水+0.05%氨水甲醇混合溶液提取广式腊味中的生物胺。
分别选用乙腈、甲醇、水、1%甲酸乙腈、1%甲酸甲醇、乙腈+甲醇和乙腈+甲醇+甲酸进行提取。提取后的上清液经QuEChERS净化后通过HPLC-MS/MS检测。结果表明:采用纯乙腈进行提取,提取出的杂质最少,但色胺的回收率过低,必须增加乙腈的使用量以确保样品中生物胺的充分提取;使用含水溶剂或甲醇提取,强氢键作用会使提取出的杂质增多;使用含甲醇的乙腈提取,提取效率最高,但在实验基质为腌制水产品时,由于基质复杂,提取出的杂质尤其是盐分较多,后继处理难度较大,盐分进入质谱仪会明显降低其响应值;使用1%甲酸乙腈提取,组胺、腐胺、尸胺的基质效应增强,影响定量分析的准确性。
因此,在实验时对样品进行分类预处理以达到较好的提取效果。基质为腌制水产品时,选取乙腈提取溶剂,能够有效去除样品中的大部分杂质;同时,减少称样量并增加提取时乙腈的使用量,能得到满意的回收率,但需要在提取后吹干定容时加入一定比例的乙腈和甲醇以达到较好QuEChERS净化效果。基质为新鲜水产品时,采用含甲醇的乙腈为提取溶剂,回收率较好,操作步骤简单,也可减少有机溶剂的使用量。
进一步优化新鲜水产品提取时乙腈/甲醇或乙腈/水的比例,分别使用不同比例的乙腈+甲醇(5/95,1/9,1/1,8/2,9/1,95/5,99/1)进行实验。结果表明:随着提取溶剂中甲醇组分的提高,腐胺和尸胺的回收率明显增加;但甲醇或水含量过高时,杂质含量也上升,样品的基质效应不断增强,影响定量分析的准确性。在甲醇含量为5%时,腐胺的回收率约为50%,尸胺的回收率约为70%,其余生物胺的回收率均大于80%;在甲醇含量为10%时,各生物胺回收率均可达到分析要求;在甲醇含量达到20%时,色胺开始出现明显的基质效应。综合以上结果,选择含10%甲醇的乙腈为提取溶剂,同时也可保证后期的净化效果达到分析要求。
2.2 净化条件的优化
QuEChERS方法将适量的净化剂直接作用于提取液中,尽可能多地吸附杂质的同时保留目标物,和普通的SPE相比少了淋洗、洗脱等步骤,相对普通的SPE方法更为快捷和简便。PSA吸附剂能够清除许多极性干扰成分,如脂肪酸、亲脂性色素和糖类等,但去除甾醇效果一般;C18吸附剂去除胆固醇、甾醇、色素的效果较好[14]。本研究选择在提取时采用改良的QuEChERS方法,使用无水硫酸钠除去水分,同时使用PSA和C18混合吸附剂,有效去除提取液中的干扰杂质,具有良好的净化效果。
2.3 质谱条件的优化
在电喷雾正离子方式下,以组胺、尸胺、腐胺、酪胺、2-苯乙胺、色胺标准溶液泵进样进入质谱系统,对几种生物胺进行一级质谱分析(Q1扫描),得到分子离子,即母离子;对被测物的分子离子碰撞后,进行二级质谱分析,得到子离子质谱图。此外,还对离子源温度、脱溶剂气温度、脱溶剂气流量、锥孔反吹气流量等参数进行了优化。6种生物胺的定性离子对、定量离子等具体参数见表1。
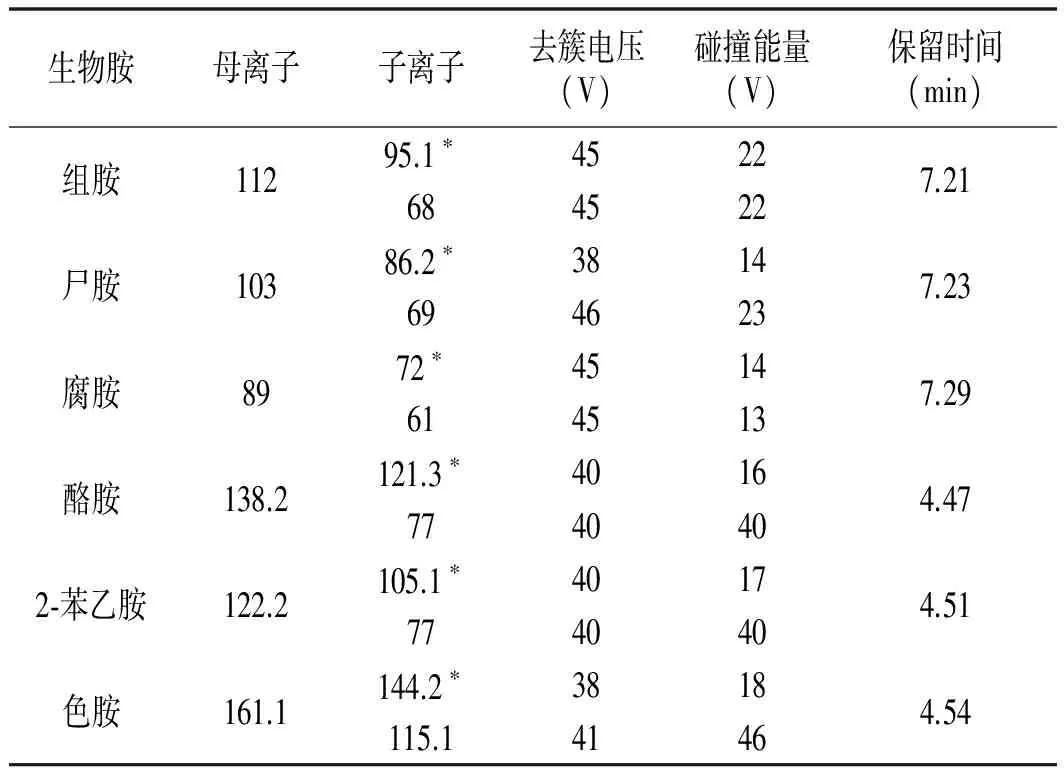
表1 多反应监测扫描模式的质谱参数Table 1 MS parameters in multiple reaction monitoring (MRM) mode
注:*为定量离子。
液相色谱-串联质谱分析结果表明:MRM模式中6种生物胺标准品的保留时间在4.47~7.29 min之间,溶剂峰干扰小,15 min内可完成对单个样品6种生物胺的定性和定量分析,适用于生物胺的日常检测。
2.4 检出限和线性范围
参照标准溶液配制成10~200 ng/mL的标准工作液,以质量浓度为横坐标,定量离子对的峰面积为纵坐标建立标准曲线,6种化合物在相应的质量浓度范围内线性关系良好,线性相关系数(r)均大于0.99。以10倍信噪比(S/N=10)所对应浓度作为方法定量限(LOQ),6种生物胺的方法定量限在0.10 mg/kg,线性实验结果和检出限见表2。

表2 6种生物胺的线性实验结果Table 2 Linear experimental results of six biogenic amines
2.5 液相色谱柱和流动相的选择
生物胺属于小分子量的极性氨基酸,在反相色谱柱中不易保留。HILIC柱通过采用强极性固定相,并且结合高比例有机相/低比例水相组成的流动相,能为强极性样品提供合适的保留时间。选择HILIC柱进行生物胺的色谱分离。结果表明:优化后的梯度洗脱条件(1.2),可较好地检测6种生物胺。
在使用HILIC柱进行色谱分离时对流动相进一步优化,用乙腈/0.1%甲酸水(7/3)等度洗脱时,腐胺、尸胺、组胺峰形较好,但酪胺、2-苯乙胺、色胺在色谱柱上基本无保留;用乙腈/水或乙腈/0.1%甲酸水梯度洗脱时,腐胺、尸胺、组胺色谱峰过宽,拖尾严重。采用乙腈/1%甲酸水梯度洗脱时,6种生物胺的峰形、保留时间和响应值均较好。因此本研究选择HILIC柱进行分离,使用乙腈/1%甲酸水流动相梯度洗脱,可兼顾几种生物胺的质谱响应及色谱保留效果。
2.6 方法的准确度和精密度
以鱼、虾、蟹、鱿鱼、腌制鱼、鱿鱼干、虾酱、沙丁鱼罐头等为代表基质进行了添加回收实验,新鲜水产品类添加水平为0.1 mg/kg,每个浓度设定6个重复实验,6种生物胺的平均回收率在74.18%~90.15%之间,相对标准偏差(RSD)在2.22%~8.04%之间。动物源性腌制食品中因有不同程度生物胺本底值的检出(0.12~1.06 mg/kg),故将其添加水平设定为1 mg/kg,并减去本底值后计算回收率。动物源性腌制食品中几种生物胺的平均回收率在80.05%~95.58%之间。相对标准偏差(RSD)在3.01%~7.84%之间。6种生物胺在8种阴性基质中的添加回收率及精密度见表3。在生物胺有检出的腌制水产品中的添加回收率及精密度见表4。鱼肉阴性样品加标的多反应监测(MRM)色谱图见图1。
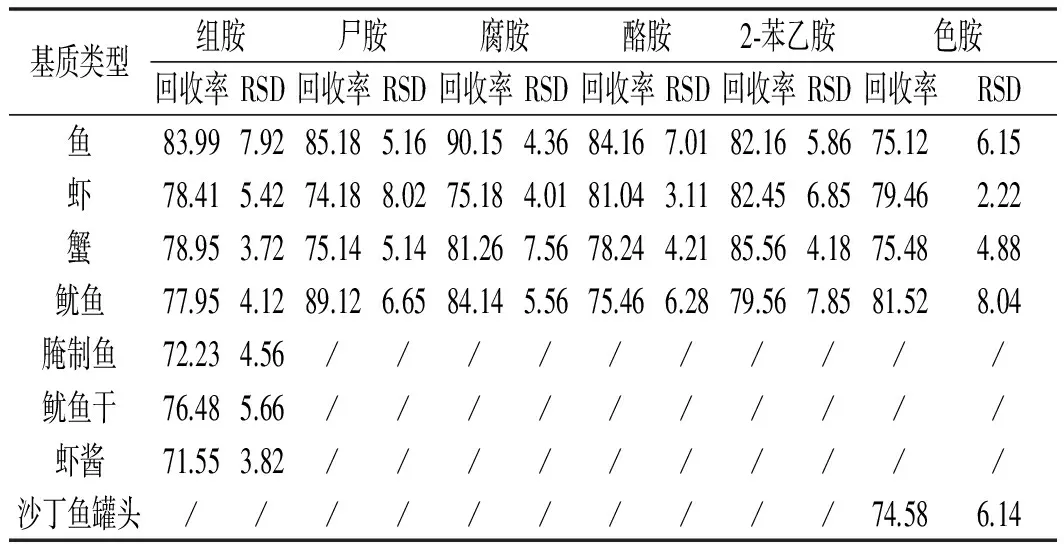
表3 不同基质中生物胺的加标平均回收率与 相对标准偏差(n=6,0.1 mg/kg)Table 3 Adding standard recoveries and relative standard deviations (RSDs) of biogenic amines in different matrix (n=6,0.1 mg/kg) %
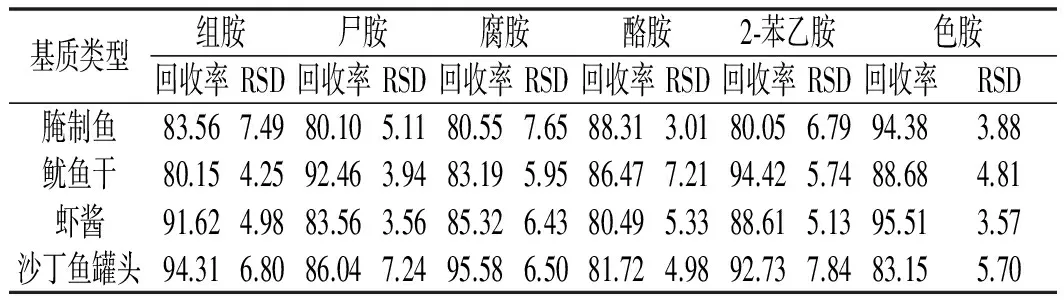
表4 腌制水产品中生物胺的加标平均回收率与 相对标准偏差(n=6,1 mg/kg)Table 4 Adding standard recoveries and relative standard deviations (RSDs) of biogenic amines in salted aquatic products(n=6,1 mg/kg) %






图1 鱼肉阴性样品加标的多反应监测 (MRM)色谱图(10 ng/mL)Fig.1 Chromatograms of biogenic amines spiked in a negative fish sample(10 ng/mL)
2.7 实际样品中生物胺含量的测定
在以上建立的实验条件下,对73种海南口岸市场购买的淡水养殖、海水养殖、海捕水产品及动物源性腌制食品进行了生物胺含量的测定,并计算了每种基质中6种生物胺的总量,测定结果见表5。

表5 实际样品中生物胺含量的检测Table 5 The detectien results of biogenic amines in actual samples mg/kg
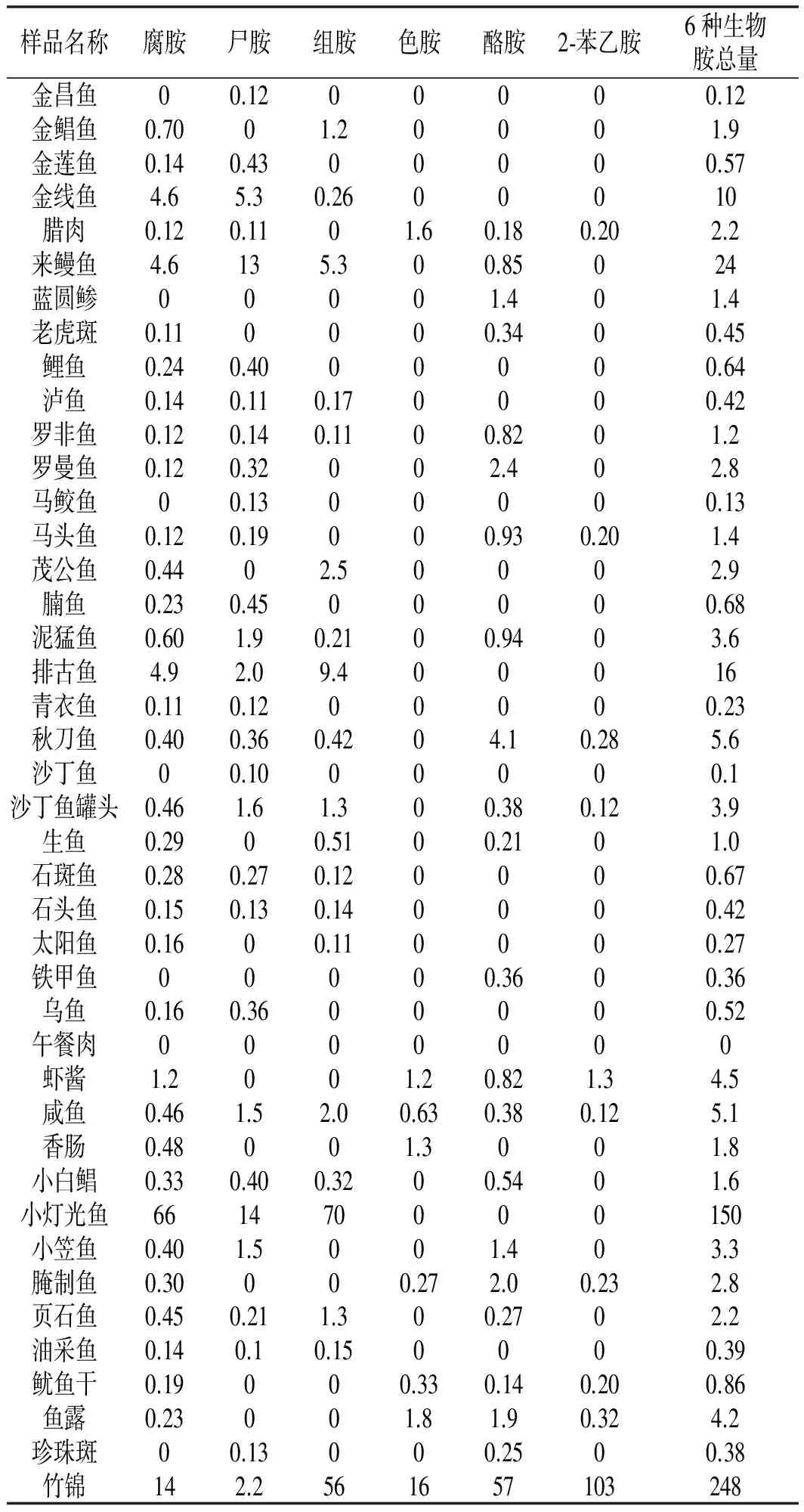
续 表
结果表明:大部分所测食品中均有不同程度的生物胺组分检出,个别样品中6种生物胺的总量高达248 mg/kg,可能是由于抽取样品新鲜程度不同对样品中生物胺含量有所影响。
3 结论
本实验建立了多种食品(新鲜水产品和动物源性腌制食品)中生物胺的分类预处理方法和这些食品中6种生物胺的液相色谱-串联质谱定量检测方法,并对73种实际样品进行了生物胺含量的检测。采用乙腈+甲醇提取,利用改进的QuEChERS方法,使用PSA和C18混合吸附剂净化除去杂质,结合RPLC-TMS分析,采用外标法定量,前处理简便、灵敏度高、准确性可靠,适用于食品中生物胺成分的定性和定量测定。
[1]赵中辉.水产品贮藏中生物胺的变化及组胺形成机制研究[D].青岛:中国海洋大学,2011.
[2]Silla Santos M H.Biogenic amines:their importance in foods[J].International Journal of Food Microbiology,1996,29:213-231.
[3]赵利,苏伟,刘建涛,等.水产品中生物胺的研究进展[J].水产学报,2006(2):272-276.
[4]Armagan Önal.A review:current analytical methods for the determination of biogenic amines in foods[J].Food Chemistry,2007,103:1475-1486.
[5]Tao Z,Sato M,Han Y,et al.A simple and rapid method for histamine analysis in fish and fishery products by TLC determination[J].Food Control,2011,22(8):1154-1157.
[6]Mazzucco E,Gosetti F,Bobba M,et al.High-performance liquid chromato graphy-ultraviolet detection method for the simultaneous determination of typical biogenic amines and precursor amino acids applications in food chemistry[J].Journal of Agricultural and Food Chemistry,2010,58(1):127-134.
[7]Hwang B S,Wang J T,Choong Y M.A rapid gas chromatographic method for the determination of histamine in fish and fish products[J].Food Chemistry,2003,82(2):329-334.
[8]Jastrzbska A,Piasta A,Szfyk E.Application of ion chromatography for the determination of biogenic amines in food samples[J].Journal of Analytical Chemistry,2015,70(9):1131-1138.
[9]An D,Chen Z Q,Zheng J C.Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J].Food Chemistry,2015,168:1-6.
[10]Anastassiades M,Lehotay S J,Stajnbaher D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[11]刘亚伟,董一威,孙宝利,等.QuEChERS 在食品中农药多残留检测的应用研究进展[J].食品科学,2009,30(9):285-289.
[12]孙亚军,廖建萌,雷晓凌,等.液相色谱-串联质谱法同时测定虾仁中八种生物胺[J].食品工业,2015,36(3):273-277.
[13]梁波.UPLC-MS/MS同时检测广式腊味制品中5种生物胺的方法研究[J].安徽农业科学,2015,43(14):249-250,258.
[14]Klinsunthorn N,Petsom A,Nhujak T.Determination of steroids adulterated in liquid herbal medicines using QuEChERS sample preparation and high-performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis,2011,55(5):1175-1178.
Determination of Biogenic Amines in Food by Modified QuEChERS Methodand Liquid Chromatography-Mass Spectrometry
JIANG Lin-rong, XU Zhi-wei, HUANG Jie-ying, ZENG Min
(Hainan Entry-Exit Inspection and Quarantine Bureau, Haikou 570311, China)
A liquid chromatography-tandem mass spectrometric (LC-MS/MS) method is established for the quantitative determination of biogenic amines in fresh aquatic products (fishes, shrimps, crabs and squids) and animal derived foods (salted fishes, shrimp sauce, dried squids and tinned sardines). The pre-processing methods of different kinds of foods, the extraction methods, the liquid chromatography and mass spectrometric conditions are optimized. Biogenic amines are analyzed by positive electrosprary ionization (ESI+) tandem mass spectrometry under multiple reaction monitoring (MRM) mode. Quantification is achieved using external standard method. The detection limits, linear ranges and recoveries of this method for fresh aquatic products are 0.1 mg/kg, 10~200 ng/mL and 74.18%~90.15% respectively. The recoveries of biogenic amines spiked in animal derived foods are between 80.05%~95.58%.
biogenic amines;classified pre-processing method;LC-MS/MS;QuEChERS;determination
2017-02-16
海南省自然科学基金项目(313105)
蒋林蓉(1981-),女,工程师,博士,研究方向:食品中有毒有害物质检测。
TS207.3
A
10.3969/j.issn.1000-9973.2017.08.028
1000-9973(2017)08-0127-06

