黑果腺肋花楸组织培养研究
程远
黑果腺肋花楸组织培养研究
程远
(五常市宝龙店种子林场,黑龙江哈尔滨150200)
以黑果腺肋花楸植株的嫩茎作为试验材料对其进行组织培养研究。结果表明,最适合黑果腺肋花楸诱导的培养基为WPM+6-BA2.0mg·L-1+IBA0.2mg·L-1+2%蔗糖,诱导率达到96%;最适宜生根的培养基为WPM+NAA0.1mg·L-1+IBA0.2mg·L-12%蔗糖,生根率为90%;移栽30d后,成活率达到90%以上。
黑果腺肋花楸;外植体;组织培养
黑果腺肋花楸(Aronia melanocarpaElliot),又名野樱莓、不老莓,为蔷薇科腺肋花楸属多年生落叶灌木[1]。原产于北美东北部,波罗的海沿岸至太平洋沿岸均有分布。我国在20世纪90年代初开始从朝鲜、俄罗斯、美国等引进,至今已有较丰富的种质资源[2]。黑果腺肋花楸果实富含丰富的黄酮、花青素、抗氧化物质和多酚类物质,对治疗心脏病、高血压、糖尿病等有特殊疗效[3]。黑果腺肋花楸花束密集,花期较长,果实宿存时间长,具有四季皆宜的观赏效果。其又可广泛用于绿化荒山、保持水土,在生态的恢复和重建中具有广阔的市场前景。所以黑果腺肋花楸是集药用、观赏与生态恢复于一体的珍贵树种[4]。组织培养能有效缩短培育周期、保持良种特性,本文对黑果腺肋花楸的组织培养条件进行了研究,为大量扩繁推广奠定基础。
1 材料与方法
1.1 试验材料
试验材料来源于黑龙江省林科所,采用黑果腺肋花楸植株的嫩茎作为外植体。
1.2 试验方法
1.2.1 外植体的消毒 在植株上剪取长度3cm的带腋芽茎段,肥皂水擦洗后流水下冲洗1h。然后在超净工作台上用75%的酒精浸泡30s,再用0.1%的HgCl2溶液处理5min。无菌水冲洗4~5次后吸干水分,将带芽茎段剪成1.5cm左右接种于培养基上。
1.2.2 诱导培养基的筛选 以WPM为基础培养基,加入不同的生长激素,培养基配方如下:
(1)WPM+6-BA0.5mg·L-1+IBA0.2mg ·L-1+2%蔗糖
(2)WPM+6-BA1.0mg·L-1+IBA0.2mg ·L-1+2%蔗糖
(3)WPM+6-BA1.5mg·L-1+IBA0.2mg ·L-1+2%蔗糖
(4)WPM+6-BA2.0mg·L-1+IBA0.2mg ·L-1+2%蔗糖
(5)WPM+6-BA2.0mg·L-1+IBA0.5mg·L-1+2%蔗糖
每个处理30瓶,每瓶接种3茎段。观察记录,30d后统计外植体的生长状况。
1.2.3 生根培养基的筛选 选取高1.5cm以上生长健壮的幼苗,接种于生根培养基上。生根培养基设4种激素组合,分别为:
(1)WPM+NAA0.1mg·L-1+IBA0.1mg· L-1+2%蔗糖
(2)WPM+NAA0.1mg·L-1+IBA0.2mg· L-1+2%蔗糖
(3)WPM+NAA0.2mg·L-1+IBA0.1mg· L-1+2%蔗糖
(4)WPM+NAA0.5mg·L-1+IBA0.2mg· L-1+2%蔗糖
每个处理20瓶,每瓶接种3茎段,观察记录生根情况,50d后统计生根率。
1.2.4 炼苗移栽 当组培苗的根生长到1.5cm左右时,将培养瓶移到温室中,挑选生根健壮的组培苗,洗净培养基,移栽入配比好的苗床基质中,浇透水后用塑料拱棚覆盖,每日浇水1次,进行透气保持湿度。7d后逐渐通风,撤走覆盖物,30d后统计移栽成活率。
2 结果与分析
2.1 不同激素水平对黑果腺肋花楸嫩茎诱导的影响
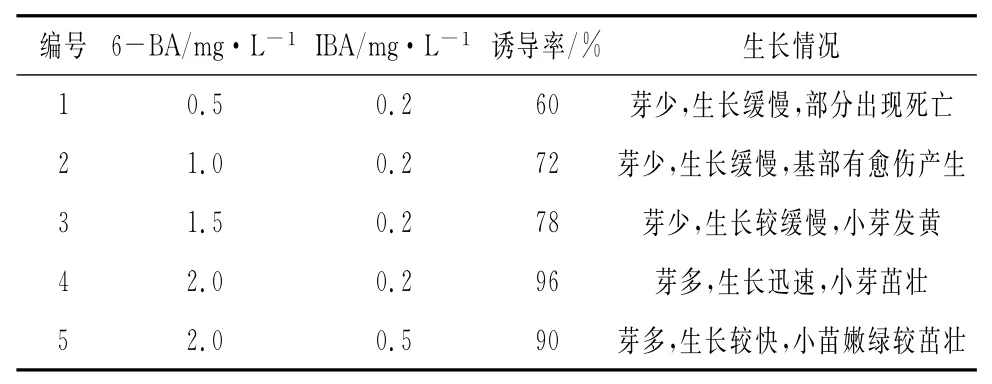
表1 不同激素水平对黑果腺肋花楸嫩茎诱导的影响
由表1可以看到,随着培养基中6-BA浓度的逐渐增加,黑果腺肋花楸苗生长的芽多,生长越迅速,小苗越茁壮。当6-BA浓度达到2.0mg·L-1时,组培苗生长的芽最多,小苗最茁壮,在搭配IBA浓度0.2mg·L-1时,诱导率最高,达到96%。所以最适宜黑果腺肋花楸诱导的培养基为WPM+6-BA2.0mg·L-1+IBA0.2mg·L-1+2%蔗糖。
2.2 不同培养基对黑果腺肋花楸的生根影响

表2 不同培养基对黑果腺肋花楸的生根影响
由表2可以看到,在6-BA0.1mg·L-1和IBA0.2mg·L-1的浓度下,黑果腺肋花楸的组培苗生根情况最理想,主根较长且粗壮,侧根生长的也多。而其他配比的培养基,小根生长的细,不够粗壮。所以在WPM+6-BA0.1mg·L-1+IBA0.2 mg·L-1+2%蔗糖的培养基中,黑果腺肋花楸生根情况最好,生根率高达90%。
2.3 炼苗移栽
炼苗移栽是组培快繁中的重要环节,黑果腺肋花楸组培苗移栽30d之后统计的成活率高达90%以上,植株生长迅速,叶片较大呈嫩绿色,茎段颜色变红明显健壮,为室外移栽的成活打下了良好的基础。
3 结论与讨论
3.1 试验表明,黑果腺肋花楸的嫩茎用HgCl2试剂消毒5min后,在诱导培养基WPM+6-BA2.0mg ·L-1+IBA0.2mg·L-1+2%蔗糖中诱导率最高,为96%。在生根培养基WPM+6-BA0.1mg ·L-1+IBA0.2mg·L-1+2%蔗糖中生根率最高,达到90%。而炼苗后移栽成活率高达90%以上。
3.2 我们在试验中发现,黑果腺肋花楸组培苗有部分的玻璃化现象,叶片呈现透明状并且较脆易破碎,影响了组培苗的生长与发育。对此,我们适当的增大了光照强度和培养瓶的透气度,发现能够控制减少玻璃化的数量。
[1]孔繁轼.黑果腺助花楸的开发与栽培[J].中国花卉园艺,2006(10):38-39
[2]韩文忠,龙忠伟.黑果腺肋花楸栽培技术要点[J].中国林副特产,2008(4):61-62
[3]Valcheva K S,Borisova P,Galunska B.Hwpatoprotective effect of the natural fruit juice fromAronia melanocaepaon carbon tetrachloride-induced acute liver damage in rats[J].Experimental and Toxicologic Pathology,2004(56):195-201
[4]张利萍.黑果腺肋花楸的组培快繁技术研究[J].价值工程,2010(18):211-222
Tissue Culture of Aronia melanocarpa
Cheng Yuan
(Baolongdian Seed Forest Farm,Wuchang City,Harbin150200,China)
Tissue culture system was established by using the tender stems of Ficus microcarpaas experimental materials.Result shows that the optimum culture medium is WPM+6-BA2.0mg·L-1+IBA0.2mg·L-1+2% sucrose,and the induction rate is96%.The optimum rooting medium is WPM+NAA0.1mg·L-1+IBA0.2mg ·L-1+2%sucrose,and the rooting rate is90%.After30days of transplanting,the survival rate reach more than 90%.
Aronia melanocarpa;explant;tissue culture
Q813.12
A
10.13601/j.issn.1005-5215.2017.07.026
2017-05-25
程远(1982-),男,黑龙江巴彦人,大学,工程师,从事小浆果及食用菌等培养研究.

