桑黄多糖对肉瘤S180细胞体内外的抑瘤作用Δ
刘燕琳,刘海燕,常 金,党和勤(1.泰山医学院附属医院药剂科,山东泰安 71000;.泰山医学院附属医院肿瘤科,山东泰安 71000)
桑黄多糖对肉瘤S180细胞体内外的抑瘤作用Δ
刘燕琳1*,刘海燕2,常 金2,党和勤1#(1.泰山医学院附属医院药剂科,山东泰安 271000;2.泰山医学院附属医院肿瘤科,山东泰安 271000)
目的:研究桑黄多糖对肉瘤S180细胞体内外的抑瘤作用。方法:选用对数生长期肉瘤S180细胞,加入0(空白对照)、2、4、8 mg/mL的桑黄多糖溶液,分别培养12、24、36、48 h,MTT法测定细胞体外增殖抑制率,荧光染色法观察细胞凋亡形态,流式细胞术检测细胞凋亡率。建立S180细胞荷瘤小鼠模型并随机分为对照组和桑黄多糖高、中、低剂量组(400、200、100 mg/kg),每组10只,每天ig相应药物1次,连续12 d;末次给药24 h后处死小鼠,称瘤质量,计算抑瘤率,免疫组化法检测肿瘤组织中抑癌基因PTEN与癌基因C-myc蛋白表达。结果:与空白对照比较,桑黄多糖能增高S180细胞的增殖抑制率,促进其凋亡率升高(P<0.05或P<0.01),且具有浓度与时间依赖性。与对照组比较,桑黄多糖各剂量组小鼠的抑瘤率明显升高(P<0.01),PTEN蛋白表达增强(P<0.05或P<0.01),C-myc蛋白表达减弱(P<0.05)。结论:桑黄多糖具有体内外抑瘤作用,并能上调抑癌基因PTEN和下调癌基因C-myc的蛋白表达。
桑黄多糖;抑瘤作用;体内;体外;肉瘤S180细胞;小鼠
桑黄是担子菌亚门层菌纲多孔菌目多孔菌科针层菌属的一种药用真菌[1]。近年来研究发现,桑黄主要成分桑黄多糖(Phellinus linteus)具有抗肿瘤、抗氧化、抗过敏、调节机体免疫功能的作用[2-5],其抗肿瘤机制的研究作为多糖研究的一大热点正受到越来越多的关注[6]。本研究通过MTT法及流式细胞术观察桑黄多糖对离体肿瘤细胞增殖的抑制作用和对肿瘤细胞凋亡的诱导作用,进而研究其抑制在体肿瘤生长的作用,同时运用免疫组化法初步探索桑黄多糖对抑癌基因PTEN与癌基因C-myc表达的影响,为进一步探究桑黄多糖的抗肿瘤机制奠定基础。
1 材料
1.1 仪器
DNM-9606型酶联免疫分析仪(北京普朗新技术有限公司);NE950型荧光显微镜(美国Nexcope公司);TX1型倒置相差显微镜(日本Olympus公司);BD FACSCantoⅡ型流式细胞仪(美国BD公司)。
1.2 药品与试剂
桑黄采自泰山山区,由泰山医学院中药学教研室鉴定为多孔菌科真菌火木层孔菌桑黄的子实体;多糖成品桑黄多糖由泰山医学院药学院提取、富集制得(醇提,得率:1.56%,纯度:>98%,批号:150401);膜联蛋白Ⅴ(AnnexinⅤ)-FLUOS细胞凋亡检测试剂盒(美国罗氏公司);抗鼠/兔通用型免疫组化检测试剂盒(上海拓然生物科技有限公司)。
1.3 动物与细胞
KM小鼠,普通级,♀♂各半,6~8周龄,体质量(20±2)g,由泰安市生物制品研究所提供,动物许可证号:鲁动质D20120011。肉瘤S180细胞株购自山东省医学科学院基础研究所。
2 方法
2.1 体外试验
2.1.1 MTT法检测细胞抑制率 复苏冻融的S180细胞,体外传代培养,接种到96孔板,加入0(空白对照)、2、4、8 mg/mL的桑黄多糖溶液,每个浓度3个复孔,分别作用12、24、36、48 h。培养结束前4 h,细胞呈圆形,悬浮生长,加入MTT终止培养前每孔中再加入二甲基亚砜(DSMO)。最后在酶联免疫分析仪上测定570 nm波长下的光密度(OD),重复试验3次,计算细胞增殖抑制率,细胞增殖抑制率=(1-加药孔OD值/空白对照孔OD值)×100%。
2.1.2 Hoechst 33258染色法检测细胞凋亡情况 取“2.1.1”项下作用48 h的各孔细胞悬液,用醋酸-乙醇或Carnoy固定液固定,0.01 mol/L磷酸盐缓冲液(PBS)漂洗5 min,加Hoechst 33258工作液染色15 min,0.01 mol/L PBS漂洗5 min×3,用甘油-PBS(1∶9)的混合液封片,荧光显微镜下观察细胞凋亡情况。
2.1.3 流式细胞仪检测细胞凋亡率 将悬浮细胞在4℃下300×g离心5 min,收集细胞,用预冷的PBS洗涤细胞2次,加入100 μL结合缓冲液(Binding Buffer)重悬细胞。加入5 μLAnnexinⅤ-异硫氰酸荧光素(FITC)和5µL碘化丙啶(PI),轻轻混匀,避光下室温反应10 min,加入400 μL结合缓冲液,混匀。1 h内用流式细胞仪分析细胞凋亡情况。试验重复6次。
2.2 体内实验
取小鼠40只,分别于左前肢腋下im S180细胞悬液(1×107mL-1)0.2 mL,建立S180细胞荷瘤小鼠模型。接种24 h后,造模小鼠随机分成4组,每组10只,分别为对照组(蒸馏水)和桑黄多糖高、中、低剂量组(400、200、100 mg/kg,分别按人临床用量的2、1、0.5倍换算而得)。对照组小鼠每日ig蒸馏水0.4 mL,其余小鼠每日ig相应剂量的桑黄多糖溶液,每日1次,连续给药12 d。末次给药后24 h处死小鼠,剥取肿瘤,称量瘤体湿质量,计算抑瘤率;取瘤组织,经常规固定、石蜡包埋、切片后,免疫组化法观察其中抑癌基因PTEN与癌基因C-myc蛋白表达,具体按试剂盒说明书操作。
2.3 统计学方法
所有数据采用Excel录入和处理,应用SPSS 19.0软件进行统计分析。数据以±s表示,检验方法采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 桑黄多糖对S180细胞体外增殖的抑制作用
与空白对照比较,2、4、8 mg/mL的桑黄多糖溶液作用后细胞的增殖抑制率均明显升高(P<0.05或P<0.01),且与浓度和时间呈正相关。这表明桑黄多糖能显著地抑制S180细胞增殖。不同浓度桑黄多糖作用不同时间后S180细胞增殖抑制率的测定结果见表1。
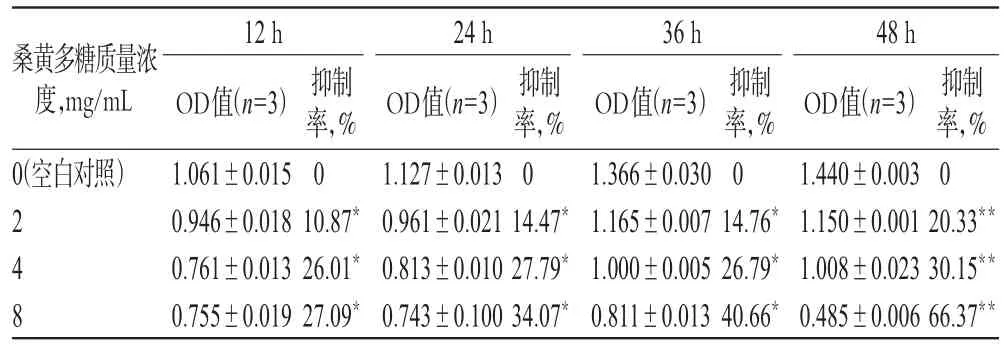
表1 不同浓度桑黄多糖作用不同时间后S180细胞增殖抑制率的测定结果Tab 1 Determination results of proliferation inhibition rate of S180 cells after phellinus linteus polysaccharide with different concentrations acting for different time
3.2 桑黄多糖对S180细胞体外凋亡的影响
空白对照的细胞呈弥散均匀荧光,色浅且淡,细胞核圆形或椭圆形、浓缩及碎裂现象。2、4、8 mg/mL的桑黄多糖溶液作用48 h后细胞核染色质固缩浓染,集聚至核膜周边。不同浓度桑黄多糖作用48 h后S180细胞的凋亡形态变化见图1。
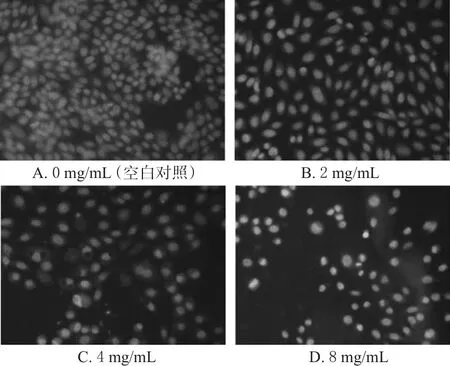
图1 不同浓度桑黄多糖作用48 h后S180细胞的凋亡形态变化(×200)Fig 1 Changes of S180 cells apoptotic morphology after phellinus linteus polysaccharide with different concentrations acting for 48 h(×200)
3.3 桑黄多糖对S180细胞体外凋亡率的影响
与空白对照比较,2、4、8 mg/mL的桑黄多糖溶液作用48 h后细胞凋亡率明显升高(P<0.05或P<0.01),且与浓度呈正相关。不同浓度桑黄多糖作用48 h后S180细胞凋亡的流式图见图2,测定结果见表2。
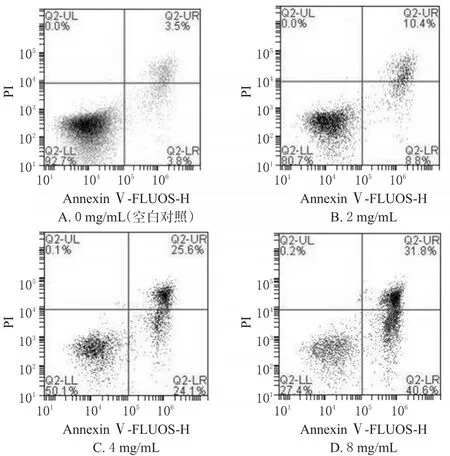
图2 不同浓度桑黄多糖作用48 h后S180细胞凋亡的流式图Fig 2 Flow cytometry of S180 cells apoptosis after phellinus linteus polysaccharide with different concentrations acting for 48 h
表2 不同浓度桑黄多糖作用48 h后S180细胞凋亡率的测定结果(±s,n=6)Tab 2 Determination results of apoptosis rate of S180 cells after phellinus linteus polysaccharide with different concentrations acting for 48 h(±s,n=6)
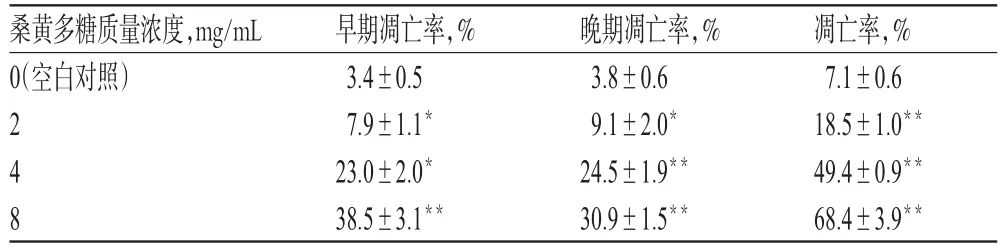
表2 不同浓度桑黄多糖作用48 h后S180细胞凋亡率的测定结果(±s,n=6)Tab 2 Determination results of apoptosis rate of S180 cells after phellinus linteus polysaccharide with different concentrations acting for 48 h(±s,n=6)
注:与空白对照比较,*P<0.05,**P<0.01Note:vs.blank control,*P<0.05,**P<0.01
桑黄多糖质量浓度,mg/mL 0(空白对照)248凋亡率,% 7.1±0.6 18.5±1.0**49.4±0.9**68.4±3.9**早期凋亡率,% 3.4±0.5 7.9±1.1*23.0±2.0*38.5±3.1**晚期凋亡率,% 3.8±0.6 9.1±2.0*24.5±1.9**30.9±1.5**
3.4 桑黄多糖对小鼠S180肉瘤的抑瘤作用
与对照组比较,桑黄多糖各剂量组小鼠的抑瘤率明显升高(P<0.01),表明桑黄多糖可明显延缓小鼠S180肉瘤肿瘤的生长。各组小鼠瘤质量与抑瘤率的测定结果见表3。
3.5 桑黄多糖对小鼠肿瘤组织中PTEN、C-myc蛋白表达的影响
结果显示,PTEN为胞核阳性,C-myc为胞浆阳性。与对照组比较,桑黄多糖各剂量组小鼠肿瘤组织中PTEN蛋白表达增强(P<0.05或P<0.01),C-myc蛋白表达减弱(P<0.05)。各组小鼠肿瘤组织中PTEN和C-myc蛋白表达的测定结果见表4,对照组和桑黄多糖高剂量组小鼠肿瘤组织中PTEN、C-myc蛋白表达的免疫组化图见图3。
表3 各组小鼠瘤质量与抑瘤率的测定结果(±s)Tab 3 Determination results of tumor weight and tumor inhibition rate of mice in each group(±s)
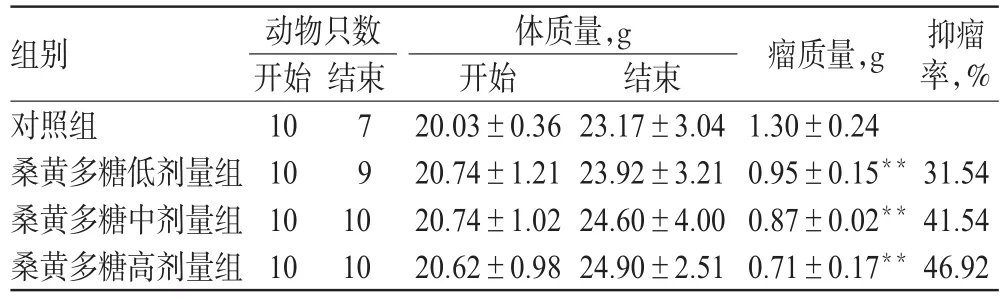
表3 各组小鼠瘤质量与抑瘤率的测定结果(±s)Tab 3 Determination results of tumor weight and tumor inhibition rate of mice in each group(±s)
注:与对照组比较,**P<0.01Note:vs.control group,**P<0.01
抑瘤率,%组别对照组桑黄多糖低剂量组桑黄多糖中剂量组桑黄多糖高剂量组结束31.54 41.54 46.92动物只数开始10 10 10 10 79 10 10体质量,g开始20.03±0.36 20.74±1.21 20.74±1.02 20.62±0.98结束23.17±3.04 23.92±3.21 24.60±4.00 24.90±2.51瘤质量,g 1.30±0.24 0.95±0.15**0.87±0.02**0.71±0.17**
表4 各组小鼠肿瘤组织中PTEN和C-myc蛋白表达的测定结果(±s)Tab 4 Determination results of PTEN,C-myc protein expressions in tumor tissue of rats in each group(±s)
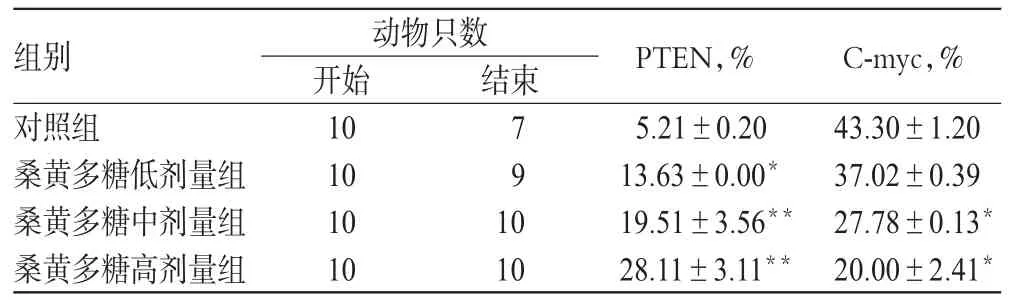
表4 各组小鼠肿瘤组织中PTEN和C-myc蛋白表达的测定结果(±s)Tab 4 Determination results of PTEN,C-myc protein expressions in tumor tissue of rats in each group(±s)
注:与对照组比较,*P<0.05,**P<0.01Note:vs.control group,*P<0.05,**P<0.01
组别对照组桑黄多糖低剂量组桑黄多糖中剂量组桑黄多糖高剂量组C-myc,% 43.30±1.20 37.02±0.39 27.78±0.13*20.00±2.41*动物只数开始10 10 10 10结束791 0 10 PTEN,% 5.21±0.20 13.63±0.00*19.51±3.56**28.11±3.11**
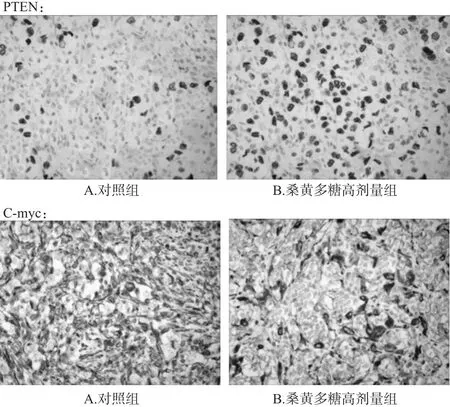
图3 对照组和桑黄多糖高剂量组小鼠肿瘤组织中PTEN、C-myc蛋白表达的免疫组化图(SP,×400)Fig 3 Immunohistochemistry diagram of PTEN,C-myc protein expressions in tumor tissue of rats in control group and phellinus linteus polysaccharide high-dose group(SP,×400)
4 讨论
桑黄作为一种药食同源的真菌在我国传统医学中应用广泛,其主要成分桑黄多糖有一定的抗肿瘤作用,相关研究发现其抗肿瘤机制主要有免疫调节、抗氧化及抗血管生成的作用等[7-8]。本研究分别通过体外试验、体内实验发现,桑黄多糖具有明显的抗肿瘤作用。
近年来研究发现,PTEN是继p53之后又一抑癌基因,越来越多的研究显示PTEN参与多种信号通路的传导,其通过抑制肿瘤生长、诱导细胞凋亡,发挥抗肿瘤作用,PTEN失表达是肿瘤发生的标志之一[9-11]。C-myc基因是较早发现的一组癌基因,C-myc的扩增与肿瘤发生和转归密切相关,亦可作为验证抗肿瘤药物发挥抗瘤作用的一个检测指标[12]。因此,探索桑黄多糖对PTEN与C-myc基因表达的影响对于从基因水平探索其抗肿瘤机制具有重要的意义。本研究发现,与对照组比较,桑黄多糖高、中、低剂量组均能明显上调PTEN基因表达(P<0.05或P<0.01),亦能明显下调C-myc基因表达(P<0.05),提示桑黄多糖通过影响PTEN与C-myc基因表达水平发挥其抗肿瘤作用。
本研究为桑黄多糖抗肿瘤机制的进一步探索奠定了基础,为促进桑黄的研发利用提供了重要参考价值。
[1] 南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2006:2784.
[2] 张敏,纪晓光,贝祝春,等.桑黄多糖抗肿瘤作用[J].中药药理与临床,2006,22(3/4):56-58.
[3] 张万国,胡晋红,蔡溱,等.桑黄对四氯化碳致大鼠肝损伤的保护作用[J].中国药房,2003,14(5):267-269.
[4] 洪海,金光日,金光玉,等.桑黄多糖对肥大细胞脱颗粒的机制[J].中国医院药学杂志,2011,31(18):1532-1534.
[5] 胡启明,梅余霞,梁运祥.桑黄多糖体外免疫活性研究[J].食品科技,2013,38(9):142-145.
[6] 吕方冰,张娜,俞淑文.桑黄多糖抗肿瘤机制研究进展[J].上海中医药杂志,2015,49(9):87-89.
[7] 赵澜.桑黄多糖的抗肿瘤及抗血管生成作用[D].上海:华东师范大学,2007.
[8] 王华林,温万芬.桑黄的药用价值研究进展[J].时珍国医国药,2015,26(11):2747-2750.
[9] Ye YT,Zhong W,Sun P,et al.Apoptosis induced by the methanol extract of Salvia miltiorrhiza Bunge in nonsmall cell lung cancer through PTEN-mediated inhibition of PI3K/Akt pathway[J].J Ethnopharmacol,2017,doi:10.1016/j.jep.2016.12.051.
[10] Egawa H,Jingushi K,Hirono T,et al.The miR-130 family promotes cell migration and invasion in bladder cancer through FAK and Akt phosphorylation by regulating PTEN[J].Sci Rep,2016,doi:10.1038/srep 20574.
[11] Ebbesen SH,Scaltriti M,Bialucha CU,et al.Pten loss promotes MAPK pathway dependency in HER2/neu breast carcinomas[J].Proc Natl Acad Sci USA,2016,113(11):3030-3035.
[12] Khaleghian M,Shakoori A,Razavi AE,et al.Relationship of amplification and expression of the C-MYC gene with survival among gastric cancer patients[J].Asian Pac J Cancer Prev,2015,16(16):7061-7069.
Antitumor Effect of Phellinus Linteus Polysaccharide on Sarcoma S180 Cells in vivo and in vitro
LIU Yanlin1,LIU Haiyan2,CHANG Jin2,DANG Heqin1(1.Dept.of Pharmacy,Affiliated Hospital of Taishan Medical University,Shangdong Tai’an 271000,China;2.Dept.of Oncology,Affiliated Hospital of Taishan Medical University,Shangdong Tai’an 271000,China)
OBJECTIVE:To study the antitumor effect of phellinus linteus polysaccharide on sarcoma S180 cells in vivo and in vitro.METHODS:Sarcoma S180 cells in logarithmic growth period were selected,adding into 0(blank control),2,4,8 mg/mL phellinus linteus polysaccharide solution and respectively culturing for 12,24,36,48 h.The in vitro proliferation inhibition rate of cells was determined by MTT method;its apoptotic morphology was observed by fluorescence staining and cell apoptosis rate was detected by flow cytometry.S180 tumor-bearing mice models were established and randomly divided into control group,phellinus linteus polysaccharide high-dose,medium-dose,low-dose groups(400,200,100 mg/kg),10 in each group.Model mice were intragastrically administrated related medicined,once a day,for 12 d.Mice were executed after 24 h of last administration,tumor weight was determined,tumor inhibition rate was calculated.Immunohistochemistry was conducted to detect the tumor suppressor gene PTEN and oncogene C-myc protein expressions in tumor tissue.RESULTS:Compared with blank control group,phellinus linteus polysaccharide can increase the proliferation inhibition rate of S180 cells and induce the increase of apoptosis rate(P<0.05 or P<0.01),showing a concentration-time manner.Compared with control group,the tumor inhibition rates in phellinus linteus polysaccharide groups were obviously increased(P<0.01),PTEN protein expressions were strengthened(P<0.05 or P<0.01)and C-myc protein expressions were weakened(P<0.05).CONCLUSIONS:Phellinus linteus polysaccharide shows antitumor effect in vivo and in vitro,which can up-regulate the PTEN,down-regulate C-myc protein expressions.
Phellinus linteus polysaccharide;Antitumor effect;in vivo;in vitro;Sarcoma S180 cells;Mice
R361+.3
A
1001-0408(2017)22-3069-04
2017-03-24
2017-05-25)(编辑:邹丽娟)
山东省中医药科技发展计划项目(No.2015-264)
*副主任药师,副教授,硕士。研究方向:临床药学、药理学。电话:0538-6236471。E-mail:tyfyypcg@163.com
#通信作者:主任药师,教授。研究方向:临床药学。电话:0538-6237545。E-mail:d75766@163.com
DOI10.6039/j.issn.1001-0408.2017.22.12
——桑黄

