辛伐他汀抑制机械牵张力和氧化低密度脂蛋白所致血管平滑肌细胞全基因组甲基化水平的降低
刘科峰,裴婷,刘树迎,李子卿,平苏宁,王晶晶,汪泓,盛璞义,李朝红*
(1湘南学院组织胚胎学教研室,郴州423000;2中山大学中山医学院人体解剖与组织胚胎学教研室,广州510080 ;3中山大学附属第一医院骨外科教研室,广州510080)
辛伐他汀抑制机械牵张力和氧化低密度脂蛋白所致血管平滑肌细胞全基因组甲基化水平的降低
刘科峰1,2,裴婷2,刘树迎2,李子卿3,平苏宁2,王晶晶2,汪泓2,盛璞义3,李朝红2*
(1湘南学院组织胚胎学教研室,郴州423000;2中山大学中山医学院人体解剖与组织胚胎学教研室,广州510080 ;3中山大学附属第一医院骨外科教研室,广州510080)
目的 探讨小鼠血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在机械牵张力(stretch stress, SS)和氧化低密度脂蛋白(oxidized low-density lipoprotein, oxLDL)作用下全基因组甲基化水平的变化,并进一步考察辛伐他汀(simvastatin, SⅠM)对此变化的影响。方法 血浆制备氧化型低密度脂蛋白,体外常规培养VSMCs,施加机械牵张力和/或氧化型低密度脂蛋白,或用辛伐他汀预处理1h后再施加刺激,用荧光探针5-甲基胞嘧啶检测VSMCs全基因组甲基化水平。以细胞免疫荧光定量阳性率和SPSS统计软件对甲基化水平进行分析。结果 机械牵张力 和氧化型低密度脂蛋白均可降低VSMCs的全基因组甲基化水平,且两者联合作用大于单一因素,辛伐他汀预处理VSMCs可部分抑制机械牵张力和/或氧化低密度脂蛋白诱导的全基因组甲基化水平降低。 结论 机械牵张力和氧化低密度脂蛋白可分别促进VSMCs全基因组甲基化水平降低,当两者共处理时呈相加作用,辛伐他汀可部分抑制上述效应。
辛伐他汀;机械牵张力;氧化低密度脂蛋白;全基因组甲基化;血管平滑肌细胞;动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)是指在动脉及其分支的动脉壁内膜及内膜下有脂质沉着,同时伴有中膜平滑肌细胞迁移至内膜并大量增殖,使内膜增厚, 形成黄色或灰黄色状如粥样物质的斑块。其斑块可发生破裂,造成血栓而导致严重的不良后果,严重威胁着人体健康。DNA甲基化是指在DNA甲基化转移酶催化作用下,以S-腺苷甲硫氨酸为甲基供体,将活化的甲基引入DNA链中,形成5-甲基胞嘧啶的过程。甲基化的DNA可导致DNA结合蛋白与DNA主螺旋沟的结合能力降低,从而在不改变DNA碱基序列的基础上调控基因的表达。目前已有研究证据表明,DNA甲基化变化在AS进程中发挥重要的作用。 Silvio Zaina[1]等采用鸟枪测序法对供体匹配的健康人和动脉粥样硬化患者的主动脉进行比较观察发现,相比于健康动脉,动脉发生粥样硬化的部分在很多位点上都表现出过度甲基化,而且用高密度DNA甲基化微阵列和一系列的供体匹配样本进行分析,发现这些DNA甲基化程度有变异的位点。对同一样本的DNA甲基化特征与相应的基因表达数据相对照,证实了DNA甲基化在该病中的重要性。这些甲基化程度存在差异的CpG与动脉粥样硬化的发生有关,而且鉴定出其中与内皮和平滑肌功能相关的基因。Ping 等[2]研究发现,ABCG1和GALNT2基因启动子高甲基化状态与冠心病危险的增加明显相关,吸烟和年龄可以影响DNA甲基化水平。这些研究结果都表明细胞DNA甲基化的变化与AS密切相关。而诱发AS的危险因素有很多,比如高血压产生的机械牵张力(SS)和高血脂氧化低密度脂蛋白(oxLDL)均可诱发AS,而且当两者并存时可协同促进AS。OxLDL对血管平滑肌细胞(VSMCs)的作用机制已有较多报道[3,4],而高血压产生的SS对VSMCs的作用前期亦有一些研究报道,有研究显示,SS伴或不伴去甲肾上腺素可通过Gαq 蛋白或ERK 信号通路诱导VSMCs增殖[5]。还有研究报道,SS伴或不伴晚期糖基化终末产物可促进VSMCs增殖和ERK信号通路激活[6]。然而,SS伴或不伴oxLDL对VSMCs全基因组甲基化的影响还未见报道。
辛伐他汀是HMG-COA还原酶抑制剂,作为降血脂药物主要通过降低血清总胆固醇来达到治疗目的。我们前期研究发现辛伐他汀可以抑制SS和/或oxLDL诱导的VSMCs ERK磷酸化增加,从而抑制血管增生[7]。后又发现其可以抑制SS和/或oxLDL诱导的巨噬细胞ROS产生增加[8]。而辛伐他汀对SS和/或oxLDL诱导的VSMCs全基因组甲基化水平的影响目前尚无报道。
本研究对体外培养的VSMCs分别给予SS、oxLDL刺激以及合并两因素同时处理,观察VSMCs在接受刺激后细胞内全基因组甲基化水平的变化及辛伐他汀对此作用的影响,旨在探讨高血脂、高血压状态下VSMCs如何参与As的发生发展,并为阐明辛伐他汀在AS血管重塑中的作用机制提供实验依据。
材料和方法
1 细胞与试剂
所用VSMCs来源于体外分离 C57BL /6J 小鼠的主动脉中膜进行原代培养获得,胰蛋白酶、H-Glucose DMEM 培养基购于Gibco公司;辛伐他汀(simvastatin,SⅠM)、核荧光染料 DAPⅠ购于Sigma-aldrich公司;胎牛血清购于浙江天杭生物科技有限公司;牛血清白蛋白( bovine serum albumin,BSA) 购于Amersco公司;5-甲基胞嘧啶(5-methylcytosine,5mc)抗体购于Eurogen公司;FⅠTC 标记驴抗小鼠荧光二抗购于Jackson Ⅰmmuno Research公司。
2 细胞培养
将VSMCs 以 5×104/ml 的密度接种于6孔硅胶牵拉板中,用含 10% 标准胎牛血清的 DMEM 高糖培养基在 37℃、5%CO2 培养箱中静置培养24h后换用无血清培养基同步化处理细胞 24h。
3 SIM工作液的配制
于瓶装SⅠM粉末中加入 95% 乙 醇 100µl,再加入15µl 0.1mol/L NaOH溶液, 于50℃ 水浴箱中静置2h,最后定容到 1ml,分装后于4℃保存,即为 10 mmol /L(5g /L) 的储存液。
4 OxLDL的制备[9]
血浆解冻后装入透析袋埋入聚乙二醇中浓缩,NaBr调整血浆密度为1.2g/ml后加入到离心管中,并加入1.063g/ml和1.020g/ml的NaCl溶液,4℃、50000r/min离心5h,收集 nLDL带。在0.01mol/L PBS透析72h, 4 ℃下 每隔 12h换液一次。加入终浓度为10μmol/L 的CuSO4溶液, 37℃水浴氧化12~16h。氧化完成后,加入终浓度为10μmol/L的EDTA终止氧化。加入1mmol/L EDTA、0.9% NaCl,4℃下透析48h,每8h换液一次。然后在0.01mol/L PBS中透析24h,4℃下每8h换液一次。透析结束后,测定蛋白浓度。用0.22μm微孔滤膜过滤,4 ℃保存备用。
5 OxLDL和SIM共同作用下对VSMCs全基因组甲基化水平的影响
采用SⅠM(2.0μmol/L)预处理静息状态的VSMCs1h后,加入oxLDL(浓度50μg/ml)作用1h,并继续培养23h,另设两组对照:SⅠM处理组,仅使用2.0μmol/L SIM处理细胞; 阴性对照组,不施加任何因素。免疫荧光检测VSMCs全基因组甲基化水平。
6 SS和SIM共同作用下对VSMCs 全基因组甲基化水平的影响
采用SⅠM(2.0μmol/L)预处理静息状态的VSMCs 1h后,通过Flexcell-2000细胞仪给予 SS[10]处理(牵拉强度10%[6],60min),并继续培养23h。另设两组对照:SⅠM处理组,仅使用2.0μmol/L SIM处理细胞;阴性对照组,不施加任何因素。免疫荧光检测VSMC全基因组甲基化水平。细胞牵拉仪装置中的真空泵可产生循环负压,牵拉VSMCs可模拟体内血压作用于血管壁的VSMCs。
7 SS、oxLDL和SIM共同作用下对VSMCs全基因组甲基化水平的影响
采用SⅠM(2.0μmol/L)预处理静息状态的VSMCs 1h后,给予SS(牵拉强度10%,60min)和/或oxLDL(浓度50μg/ml,60min),并继续培养23h。另设两组对照:SⅠM处理组,仅使用2.0μmol/L SⅠM处理细胞;阴性对照组,不施加任何因素。免疫荧光检测VSMCs 全基因组甲基化水平。
8 免疫荧光检测VSMCs全基因组甲基化水平
用3%多聚甲醛固定已处理的细胞,1%Triton-X-100/PBS破膜10min,5-甲基胞嘧啶(5mc,1:200)抗体(Eurogen)和Cy3标记的第二抗体(JacksonⅠmmunoResearch公司)孵育;用DAPⅠ复染细胞核;由5mc阳性染色(绿色)鉴定DNA甲基化细胞。DNA甲基化指数计算为5mc阳性细胞占细胞总数的百分比。使用荧光显微镜对细胞进行检测和拍照。
9 统计学方法
实验所得数据采用¯x ± s表示,采用 SPSS20.0数据包进行处理,组间比较采用方差分析,LSD法进行组间两两比较,以 P<0.05 为差异有统计学意义。
结 果
1 SIM预处理抑制OxLDL对VSMCs内全基因组甲基化水平的下调
免疫荧光检测显示,与未用SⅠM预处理的阴性对照组VSMCs比较(图1A),50μg/ml oxLDL处理的VSMCs全基因组甲基化水平明显下调(图1B);2.0μmol/L SIM处理25h不影响VSMCs全基因组甲基化水平(图1C),但用2.0μmol/L SIM预处理1h后再用50μg/ml oxLDL处理, oxLDL诱导的全基因组甲基化水平下调明显减轻(图1D,图1E)。
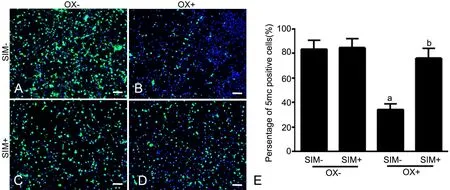
图1 SⅠM对oxLDL诱导的VSMCs内全基因组甲基化的影响。A,阴性对照组;B,oxLDL处理组;C,SⅠM处理组;D,SⅠM和oxLDL共处理组;E,细胞全基因组甲基化水平统计学分析;a,与阴性对照组相比,P<0.01;b,与oxLDL处理组比较,0.01<P<0.05;scale bar, 50μmFig. 1 Effects of SIM on genome-wide methylation induced by oxLDL. A, Negative control; B, oxLDL(OX) treatment alone; C, SIM treatment alone; D, Treatment with both of SⅠM and oxLDL; E, Statistical analysis for genome-wide methylation level. a, P<0.01, compared with negative control group; b, 0.01<P<0.05, compared with oxLDL treatment group; scale bar, 50μm.
2 SIM预处理抑制SS对VSMCs内全基因组甲基化水平的下调
与oxLDL处理相似, SS处理的VSMCs其全基因组甲基化水平明显低于未用SⅠM预处理的阴性对照组VSMCs(图2A,图2B);而用2.0μmol/L SIM预处理1h后再进行SS处理,SS诱导的全基因组甲基化水平的下调被部分抑制(图2D,图2E)。
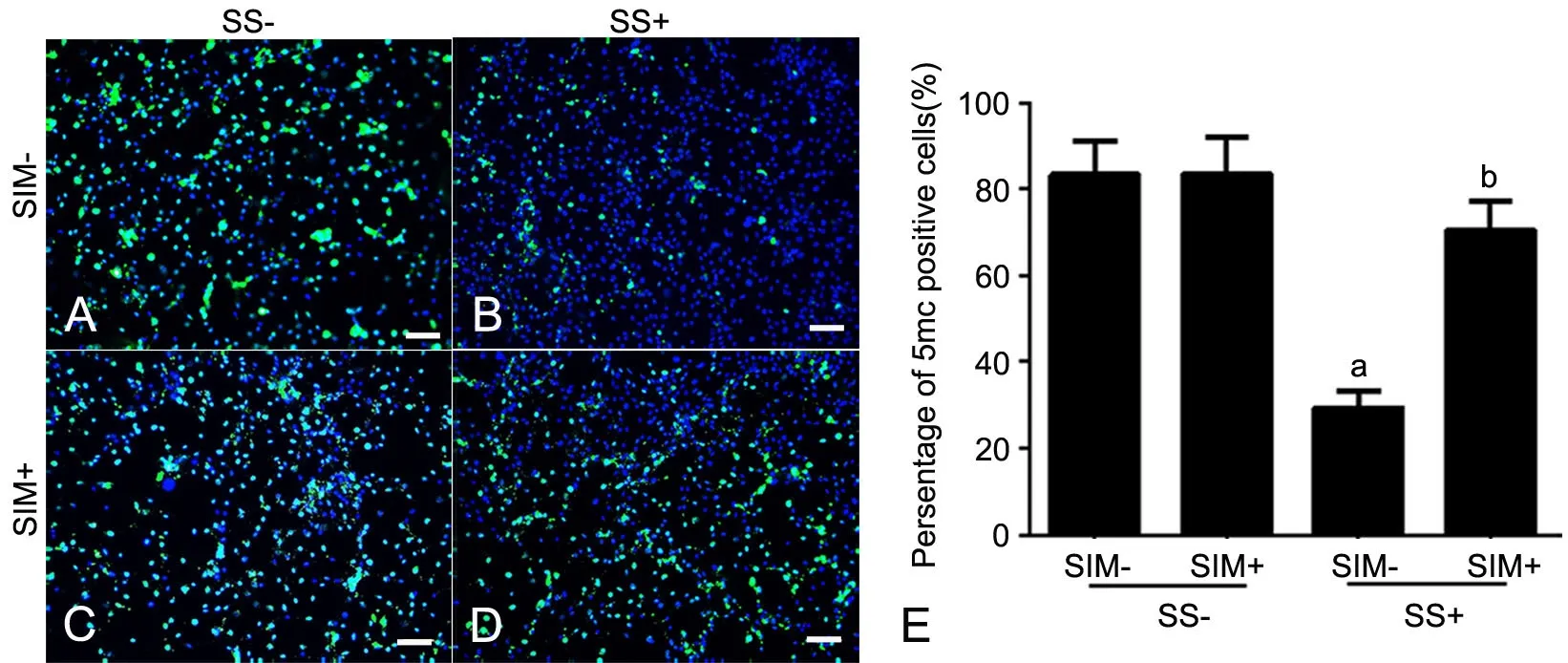
图2 SⅠM对SS诱导的VSMCs内全基因组甲基化的影响。A,阴性对照组;B,SS处理组;C,SⅠM处理组;D,SⅠM和SS共处理组;E,细胞全基因组甲基化水平统计学分析;a,与阴性对照组相比,P<0.01;b,与SS处理组比较,0.01<P<0.05;scale bar, 50μmFig. 2 Effects of SIM on genome-wide methylation induced by SS. A, Negative control; B, SS treatment alone; C, SIM treatment alone; D, Treatment with both of SⅠM and oxLDL; E, Statistical analysis for genome-wide methylation level; a, P<0.01, compared with negative control group; b, 0.01<P<0.05, compared with SS group; scale bar, 50μm.
3 SIM预处理抑制SS和oxLDL联合作用对VSMCs全基因组甲基化水平的下调
OxLDL(浓度50μg/ml)和SS(牵拉强度10%)联合处理的VSMCs其全基因组甲基化水平明显低于未用SⅠM预处理的阴性对照组VSMCs(图3A,图3D),并小于任一单因素的作用水平,呈相加效应(图3B,图3C,图3D),但用2.0μmol/L SIM预处理1h后再进行SS和 oxLDL联合处理,SS和oxLDL联合诱导的全基因组甲基化水平的下调被部分抑制(图3H,图3Ⅰ)。
讨 论
研究证实,全基因组甲基化与AS发生、发展密切相关。将Apoe-/-小鼠中主动脉早期粥样硬化组织和C57BL/6对照鼠中主动脉组织比较,发现粥样硬化组织呈现显著的全基因低甲基化状态,并且发现其发生早于动脉粥样硬化的组织学证据[11]。在人、大鼠和兔子的进展性斑块中全基因组均呈现低甲基化状态[12-14],这种基因组低甲基化是否促进动脉粥样硬化的发展,还有待研究。另外,粥样硬化斑块中不同的细胞可能各自呈现独特的甲基化方式,OxLDL可通过促进内皮细胞全基因组甲基化水平升高而减少细胞凋亡,加速AS的发生发展[15],还可通过上调巨噬细胞胱硫醚γ-裂解酶(CSE)启动子甲基化水平可促进泡沫细胞的形成,加速AS的进程[16]。由于细胞DNA甲基化变化与动脉粥样硬化密切相关,因此探讨SS和/或oxLDL对VSMCs DNA甲基化的影响具有重要的意义。本研究依照前期的实验基础,施加强度为10%的SS,可下调VSMCs内全基因组甲基化水平,当SS与oxLDL合并处理时,DNA甲基化水平降低更明显。为了研究SⅠM对SS和/或oxLDL诱导的DNA甲基化水平的影响,采用SⅠM预处理细胞1h,结束后施加SS和/或oxLDL,发现SⅠM可抑制上述作用。因此本研究具有以下几个方面的意义:首先,SS诱导VSMCs内全基因组DNA甲基化水平下降,进一步揭示了高血压在促进As发生发展过程中的重要作用;其次,SS与oxLDL共存进一步增加SS对VSMCs内全基因组DNA甲基化水平的下调效应,可部分解释临床上高血压与高血脂并发时AS加速的现象,同时还揭示了辛伐他汀除了已知的降血脂作用外,在延缓AS血管重塑病变进展中的作用机制。
在哺乳动物中,甲基化主要发生在DNA分子CpG双核苷酸序列的胞嘧啶上,CpG的甲基化通常情况下与基因沉默相关,直接调控细胞的增殖与凋亡[17],已有研究发现,oxLDL可通过促进VSMCs p21基因甲基化诱导其增殖加速AS。Hiltunen等[18]发现,发生动脉粥样硬化的人和载脂蛋白E(Apoli-po-protein E,ApoE) 基因敲除鼠,动脉斑块部位以及增殖的VSMCs中,基因组出现低甲基化。这些资料均表明VSMCs内DNA甲基化变化引起细胞增殖是导致AS的重要机制之一,本研究首次证实了高血压产生的SS可促进VSMC全基因组甲基化水平降低,SS和oxLDL联合处理时可产生相加效应,亦首次证实了辛伐他汀可抑制上述作用。但本研究也存在一些不足,我们在前期的研究中发现[7],SS和/或oxLDL可促进VSMCs增殖,那么SS和/或oxLDL诱导的VSMCs全基因组甲基化水平下降与细胞增殖有何关系?SS和oxLDL如何促进DNA甲基化水平降低?这些都将是本研究需要深入关注的问题。
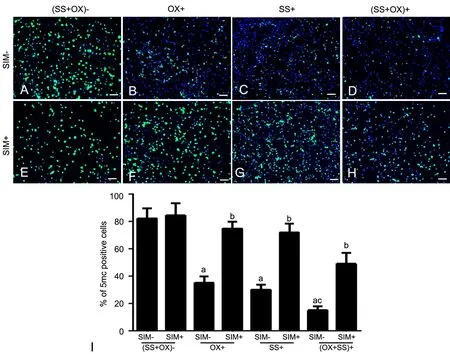
图3 SⅠM对SS和oxLDL诱导的VSMCs内全基因组甲基化水平的影响。A,阴性对照组;B,oxLDL处理组;C,SS处理组;D,SS+oxLDL共处理组;E,SⅠM处理组;F,SⅠM+oxLDL共处理组;G, SⅠM+SS共处理组;H,SⅠM+SS+oxLDL共处理组;Ⅰ,细胞全基因组甲基化水平统计学分析。a,与阴性对照组相比,P<0.01;b,与同组内未加SⅠM处理组比较,0.01<P<0.05;c,与单独ox处理组或SS处理组比较,0.01<P<0.05;scale bar, 50μmFig. 3 Effects of SIM on genome-wide methylation induced by SS and oxLDL. A, negative control; B, oxLDL treatment alone; C, SS treatment alone; D, Treatment with both of oxLDL and SS;E, SⅠM treatment alone; F, Treatment with both of SⅠM and oxLDL; G, Treatment with both of SⅠM and SS; H, Treatment with SⅠM,SS and oxLDL; Ⅰ, Statistical analysis for genome-wide methylation level; a, P<0.01, compared with negative control group; b, 0.01<P<0.05, compared with the same group without SⅠM; c, 0.01<P<0.05, compared with oxLDL treatment group or SS treatment group; scale bar, 50μm
[1] Zaina S, Heyn H, Carmona FJ, et al. DNA methylation map of human atherosclerosis. Circ Cardiovasc Genet, 2014, 7(5): 692-700.
[2] Peng P, Wang L, Yang X, et al. A preliminary study of the relationship between promoter methylation of the ABCG1, GALNT2 and HMGCR genes and coronary heart disease. PLOS One, 2014, 9(8): e102265.
[3] Sun Y, Gao W, Zhao Y, et al. Visualization and inhibition of mitochondria-Nuclear translocation of apoptosis inducing factor by a graphene Oxide-DNA nanosensor. Anal Chem, 2017, 89(8): 4642-4647
[4] Lin J, Zhou S, Zhao T, et al. TRPM7 channel regulates ox-LDL-induced proliferation and migration of vascularsmooth muscle cells via MEK-ERK pathways. FEBS Lett, 2016, 590(4): 520-532.
[5] Liu S, Li Y, Zhang Z, et al. Alpha1-Adrenergic receptors mediate combined signals initiated by mechanical stretch stress and norepinephrine leading to accelerated mouse vein graft atherosclerosis. J Vasc Surg, 2013, 57(6): 1645-1656, 1656. e1-3.
[6] Li Y, Liu S, Zhang Z, et al. RAGE mediates accelerated diabetic vein graft atherosclerosis induced by combined mechanical stress and AGEs via synergistic ERK activation. PLoS One, 2012, 7(4): e35016.
[7] Zhang Z, Zhang M, Li Y, et al. Simvastatin inhibits the additive activation of ERK1/2 and proliferation of rat vascular smooth muscle cells induced by combined mechanical stress and oxLDL through LOX-1 pathway. Cell Signal, 2013, 25(1): 332-340.
[8] 裴婷,周玉环,刘科峰,等. 辛伐他汀抑制机械牵张力介导的巨噬细胞活性氧族元素的表达. 中国动脉硬化杂志,2016(2):109-113.
[9] 林盈,陈雨,沈燕龙,等. 人血浆低密度脂蛋白(LDL)的分离纯化及鉴定. 药物生物技术,2010(1):73-75.
[10] Banes AJ, Gilbert J, Taylor D, et al. A new vacuum-operated stress-providing instrument that applies static or variable duration cyclic tension or compression to cells in vitro. J Cell Sci. 1985, 75:35-42
[11] Lund G, Andersson L, Lauria M, et al. DNA methylation polymorphisms precede any histological sign of atherosclerosis in mice lacking apolipoprotein E. J Biol Chem, 2004, 279(28): 29147-29154.
[12] Liu ZJ, Liu QM, Zhou SH. The effect of DNA Methylation on the Gene of Metal Metalloproteinases-9 and the Role of it in the Atherosclerosis. Guide of China Medicine, 2011.
[13] Richards J, Ogoe HA, Li WZ, et al. DNA methylation signature of post -injury neointimal cells during vascular remodelling in the rat balloon injury model, Mol Biol, 2016, 5 (3):163.
[14] Wang Z, Zhang J, Li H, et al. Hyperlipidemia-associated gene variations and expression patterns revealed by whole-genome and transcriptome sequencing of rabbit models. Sci Rep, 2016, 6, 26942
[15] Mitra S, Khaidakov M, Lu J, et al. Prior exposure to oxidized low-density lipoprotein limits apoptosis in subsequent generations of endothelial cells by altering promoter methylation. Am J Physiol Heart Circ Physiol, 2011, 301(2): H506-H513.
[16] Du HP, Li J, You SJ, et al. DNA methylation in cystathionine-gamma-lyase (CSE) gene promoter induced by ox-LDL in macrophages and in apoE knockout mice. Biochem Biophys Res Commun, 2016, 469(3): 776-782.
[17] Kurdyukov S, Bullock M. DNA methylation analysis: choosing the right method. Biology (Basel), 2016, 5(1): 3.
[18] Hiltunen MO, Turunen MP, Hakkinen TP, et al. DNA hypomethylation and methyltransferase expression in atherosclerotic lesions. Vasc Med, 2002, 7(1): 5-11.
Simvastatin inhibits genome-wide methylation in mouse vascular smooth muscle cells induced by stretch stress and oxidized low density lipoprotein
Liu Kefeng1,2, Pei Ting1, Liu Shuying1, Li Ziqing3, Ping Suning1, Wang Jingjing1, Wang Hong1, Sheng Puyi3, Li Chaohong2⋆
(1Department of Histology and Embryology, Xiangnan University, Chenzhou 423000, China;2Department of Histology and Embryology, Zhongshan School of Medicine,Sun Yat-sen University, Guangzhou 510080, China;3Departments of orthopedic Surgery, Sun Yat-sen University First Affiliated Hospital, Guangzhou 510080,China)
Objective To investigate genome-wide methylation in mouse vascular smooth muscle cells (VSMCs) induced by stretch stress(SS) and oxidized low-density lipoprotein (oxLDL), and the role of simvastatin in this process. Methods VSMCs were treated with SS and/or oxLDL prepared from plasma with or without pre-incubation of simvastatin for 60 min. The methylation was detected using 5-methylcytosine fluorescent probe. The level of methylation was determined by fluorescence positive rate which was quantified using SPSS analysis. Results Either SS or ox-LDL decreased the genome-wide methylation of VSMCs. The combination of both caused more significant reduction. Simvastatin partly inhibited the effect induced by SS and/or oxLDL. Conclusion Both SS and ox-LDL can reduce genome - wide methylation in VSMCs independently, and to a higher degree when applied together. Simvastatin can partly abolish this effect.
Simvastatin; stretch stress; oxidized low-density lipoprotein; genome-wide methylation; vascular smooth muscle cells; atherosclerosis
R34
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.008
2017-04-18
2017-08-02
国家自然科学基金项目(81070124、81500337);广东省科技计划项目( 2014A020212109);湖南省教育厅资助科研项目(12C0893);湖南省重点建设学科资金资助(湘教发 [2011] 76 号)
刘科峰,女(1978 年),汉族,博士
*通讯作者(To whom correspondence should be addressed):lichaoh@mail.sysu.edu.cn

