浅Ⅱ度烫伤复合机械力牵拉刺激动物模型的建立及评估
李 芬,李 巍,舒 勤
·论 著·
浅Ⅱ度烫伤复合机械力牵拉刺激动物模型的建立及评估
李 芬,李 巍,舒 勤
目的 建立浅Ⅱ度烫伤复合机械力牵拉刺激动物模型,并对模型的稳定性、可靠性进行评估。方法 选用10~12周C57BL/6小鼠60只进行实验。实验分为A组(浅Ⅱ度烫伤+机械力牵拉组)、B组(浅Ⅱ度烫伤+假手术对照组)和C组(正常对照组)。A组、B组根据不同取材时间(0、1、3、5、7、14d及21d)分为A1~A7亚组和B1~B7亚组。将小鼠编号并随机分到A1~A7亚组、B1~B7亚组和C组,每组4只小鼠。备皮后,用YLS-5Q台式恒温烫伤仪分别在A组、B组小鼠背部L1水平建立2cm2浅Ⅱ度烫伤创面,并利用组织缺损缝合的方法在A组小鼠上建立机械力牵拉刺激。分别在制创后的0、1、3、5、7、14及21d,取A组、B组小鼠的烫伤创面及C组相同部位的皮肤标本,进行病理学评估。结果 成功建立了A、B组动物模型;病理分析可见A组烫伤创面痂下愈合速度较B组快;在烫伤后第1天,A组烫伤创面显著大于B组;在烫伤后第5、7和第14天,A组残余面积显著小于B组(P<0.05),且标准差0.01~0.15,说明张力控制方法至少可持续至建模第14天,且稳定可靠、可重复性好,能再现张力对创面的作用规律。结论 本研究成功建立了一种简单、科学的小鼠背部浅Ⅱ度烫伤复合机械力牵拉刺激动物模型,为研究张力对烫伤创面愈合的影响奠定了基础。
烫伤;张力; 机械力; 动物模型
有关创面张力与愈合质量的研究历史由来已久。早在1861年,Langer就认为创面瘢痕的形成与皮肤张力线的分布有关[1]。多项研究也表明,机械力负荷能对创伤愈合的整个过程产生影响[2],显著增加增生性瘢痕的形成,影响愈合质量[3-4]。这可能与张力促进成纤维细胞向肌成纤维细胞转化,并在愈合后持续存在有关[5]。但相关机械力作用的具体机制尚未完全阐明,医学科学家及临床医生要想清晰地了解增生性瘢痕产生的机制,以便更好地减少或避免增生性瘢痕的产生,仍面临巨大的挑战[3]。
作为增生性瘢痕的重要伤因,烧烫伤创面愈合的相关研究也从未停止,但关于烧烫伤创面张力作用及其机制的研究仍刚刚开始。现有资料表明,愈合时间[6]、创面张力[7]等,是烧烫伤创面增生性瘢痕发生的重要影响因素,但机械力加载与烧烫伤创面复杂的病理生理变化之间如何重叠作用、相互影响,目前仍是空白,急需建立相应的动物模型,以开展基础实验研究。但是,目前关于张力对创面愈合影响的动物模型主要以创伤伤口为主,尚未见到针对烫伤的张力控制动物模型;且现有模型主要以猪、兔等大、中型动物为基础,实验成本相对较高。本研究利用小鼠建立张力控制浅Ⅱ度烫伤动物模型,并对其有效性进行了初步的评估,验证了其稳定性和有效性,为相关研究提供了必要的动物模型参考。
材料与方法
1 实验动物
准备10~12周的C57 BL/6小鼠60只,雄性,体重20~25g,由第三军医大学实验动物中心提供,饲养1周后进行实验[8]。将实验动物随机分为A组(浅Ⅱ度烫伤+机械力牵拉组)、B组(浅Ⅱ度烫伤+假手术对照组)和C组(正常对照组)。A组、B组根据不同取材时间(0、1、3、5、7、14及21d),分为A1~A7亚组和B1~B7亚组。将小鼠编号并随机分到A1~A7亚组、B1~B7亚组和C组,每组4只小鼠。
2 实验材料
YLS-5Q超级台式恒温烫伤仪;1%戊巴比妥钠、1mL注射器;剪毛器、脱毛膏、纱布;缝合针、缝合线、眼科剪、镊子、印泥、自制印章和尺子等。
3 模型制作
3.1 浅Ⅱ度烫伤创面制作 小鼠称重,1%戊巴比妥钠腹腔注射麻醉(0.01mL/g)。麻醉成功后,用剃毛器剃去背部毛发,脱毛膏备皮,温水擦净背部皮肤。休息24h后同法麻醉,将小鼠置于YLS-5Q台式恒温烫伤仪操作台上,充分暴露致创区皮肤(致创区的选择以小鼠L1为分界线,尾部至L1之间的区域为烫伤致创区)。使用接触面积为2cm2、自重500g的烫头致创,将烫头温度调至65℃,利用烫头自重垂直接触小鼠致创区3s,不额外加压,即制成2cm2浅Ⅱ度烫伤创面[9]。
3.2 张力控制+浅Ⅱ度烫伤模型制作 首先,按前述方法在小鼠背部L1水平建立浅Ⅱ度烫伤创面。其次,利用缺损皮肤张力缝合方法在小鼠背部建立张力控制区域。为了使所建立的张力控制区域位置恒定,对下方烫伤创面产生的张力大小相当,首先利用预先制作的“网格印章工具”在小鼠背部印制大小为0.2cm×0.2cm的网格,以精确控制皮肤缺损面积(使其张力缝合后产生的张力大小一致)。其次,在各组小鼠T1水平绘制张力线(以使各小鼠背部的张力缝合部位与下方烫伤区域的距离一致)。对A组小鼠绘制一个底边1cm、上下两边距离1.2cm的六边形(六边形中点置于小鼠T1,图1所示),并切除该六边形面积,缝合六边形上下两边,针距0.2cm,从而对烫伤创面形成一定的张力,即张力控制组;对B组小鼠则直接在这一张力线上进行假手术切开、缝合,不产生额外张力,即假手术对照组(图1)。

A.实验组 B.假手术对照组
图1 小鼠模型制作示意图。A:有六边形组织缺损并缝合的机械力牵拉刺激组;a.浅Ⅱ度烫伤部位,可见皮肤苍白,皮下组织水肿;B:仅有线性切口并缝合的无机械力增加组伤口
4 取材
同前法麻醉小鼠,拍照后,沿创缘0.1cm剪下皮肤全层组织,4%多聚甲醛固定48h,石蜡包埋切片。
5 统计学分析
采用 SPSS 18.0统计软件进行分析。应用重复测量的方差分析方法评估不同组间的差异,以P<0.05表示差异具有统计学意义。
结 果
1 一般情况
本实验术中因麻醉过深死亡1只,予以补充。其余动物建模均获得成功。
2 组织学病理学观察
为了观察浅Ⅱ度烫伤创面是否成功建立,取A组、B组的烫伤创面(制创后0d)及C组相同部位正常皮肤标本进行4%多聚甲醛固定、石蜡包埋切片(0.4μm),HE染色,光学显微镜下观察切片,结果如图2所示。
3 张力作用效果分析
为了评估施加于浅II度烫伤创面的张力是否持续、稳定且可重复,笔者利用A组、B组动物分析不同时间机械力牵拉作用下残余创面的大小。研究显示,制创当天(第0天),A组烫伤面积为(2.12±0.05)cm2;B组烫伤面积为(2.11±0.03)cm2,各组间无显著统计学意义;在伤后第1天,A组在持续机械力牵拉的作用下,其烫伤创面面积显著增大[2.28±0.02)cm2,P=0.0009];B组烫伤创面面积没有明显变化(2.11±0.05)cm2;在伤后第3天,A组、B组创面大小差异无统计学意义。在烫伤后的5、7、14d,A组创面缩小的速度显著快于B组(P<0.05);在烫伤后第21天,A组与B组残余创面均明显缩小,两组比较差异无统计学意义(P>0.05)(表1,图3、4)。
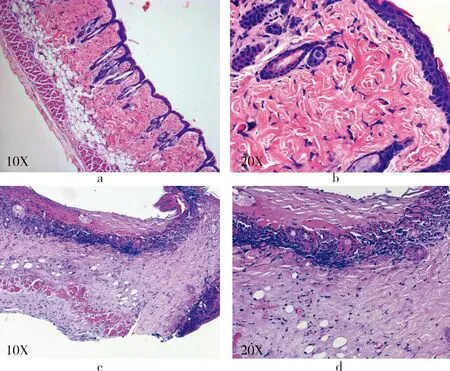
图2 浅Ⅱ度烫伤组织病理图。a~b:正常对照组背部皮肤组织的HE染色,镜下可见表皮细胞排列整齐、连续、层次清楚,上皮细胞胞核、胞浆着色良好,真皮层组织及附属结构,皮脂腺、汗腺、毛囊结构清晰、完整,细胞形态正常(a:10倍视野;b:20倍视野)。c~d:烫伤组(A组及B组)烫伤创面皮肤的HE染色,镜可见表皮破坏,真皮浅层损伤、水肿(c:10倍视野;d:20倍视野)

表1 实验组和对照组烫伤残余面积
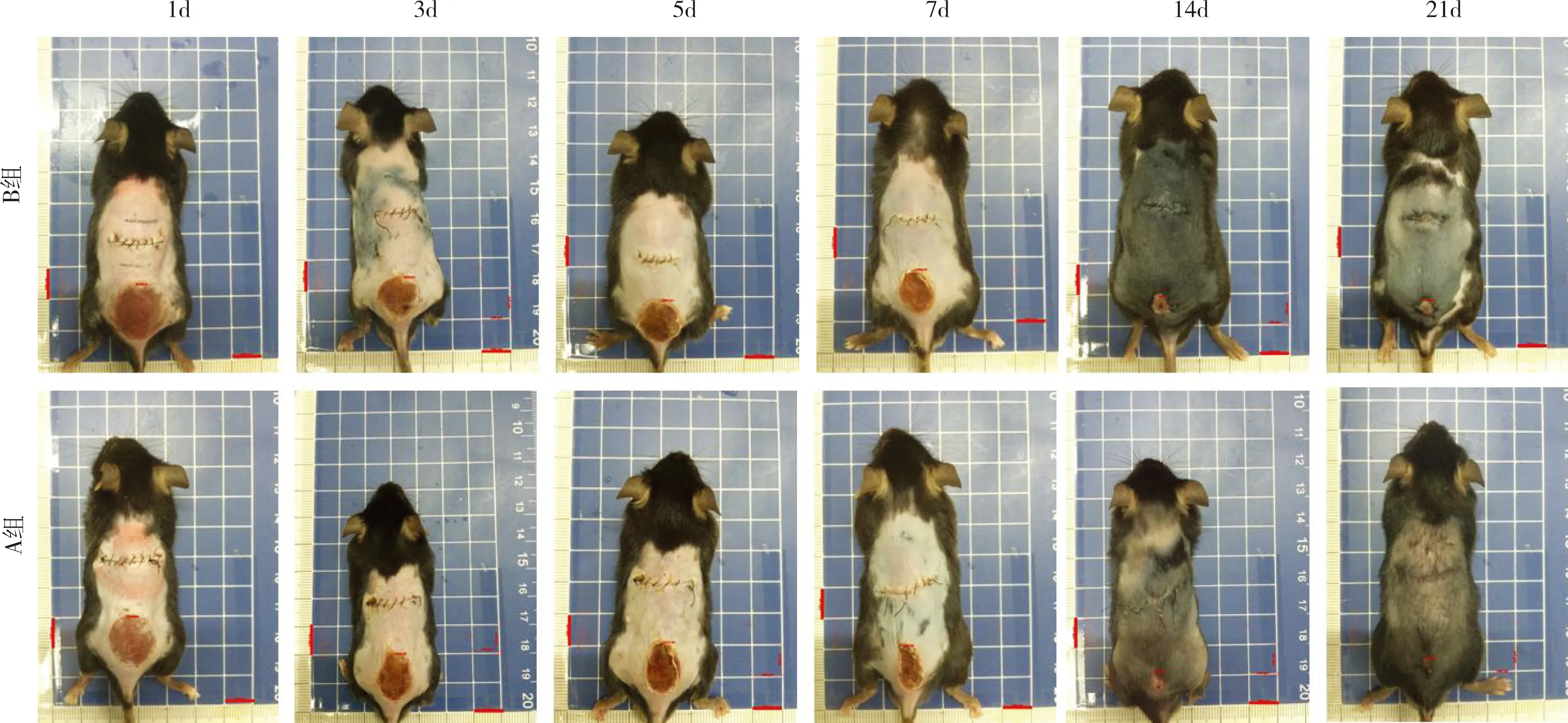
图3 各组小鼠浅Ⅱ度烫伤创面残余面积的大体观察。A组制创后1d,烫伤创面大小与B组烫伤面积无显著差异;在制创后5、7、14d,A组残余创面较B组显著减少

图4 各组小鼠烫伤创面残余面积的比较。*P<0.05,**P<0.01
讨 论
当前用于研究张力作用下创面瘢痕形成的模型分为体外模型和体内(动物)模型两种,前者主要利用2D、3D培养技术建立张力控制体系,对相关修复细胞开展研究[10],而后者主要集中于猪、兔等大中型动物[4]的创伤修复研究。目前,在小鼠皮肤上建立张力管理的动物模型尚未见报道,更没有见到在小鼠皮肤上同时建立烫伤创面+张力控制的动物模型。在尝试建模中笔者发现,主要影响小鼠张力管理动物模型建立的因素包括:(1)小鼠皮下组织较少,皮肤松弛;(2)小鼠皮肤面积小,使用牵拉器械困难;(3)小鼠活动灵活,活动范围大,不易控制张力作用的稳定性。
为了克服相关的影响因素,笔者在现有报道的基础上做了如下改进:(1)适当增加建立张力所需的皮肤缺损面积,从而对创面施加足够大的张力;(2)用对口缝合的方法使张力作用更加稳定持续;(3)将张力控制部位定位在T1水平上下,有效避免小鼠对缝合线的抓咬破坏;(4)利用网格印制工具提高对“六边形皮肤缺失+张力缝合”方法的精确控制,使张力控制组和假手术对照组在伤后1、3、5、7、14和21d共6个时相点的烫伤面积的标准差控制在0.01~0.15,说明本烫伤张力管理模型具有较高的稳定性和可重复性。
本研究发现,由于采用了连续缝合的方法建立张力加载,在伤后第7、14天,部分缝合线一端开始出现断裂脱落现象,可能对实验结果有一定的影响。
为此,在今后的实验中建议采用间断缝合方法减少或避免连续缝合法所带来的张力不稳定问题。
[1] No authors listed.On the anatomy and physiology of the skin.III.The elasticity of the cutis by professor K.Langer presented at the meeting of 27th November 1861[J].Br J Plast Surg,1978,31(3):185-199.
[2] Agha R,Ogawa R,Pietramaggiori G,et al.A review of the role of mechanical forces in cutaneous wound healing[J].J Surg Res,2011,171(2):700-708.
[3] van den Broek LJ,Limandjaja GC,Niessen FB,et al.Human hypertrophic and keloid scar models: principles,limitations and future challenges from a tissue engineering perspective[J].Exp Dermatol,2014,23(6):382-386.
[4] Gurtner GC,Dauskardt RH,Wong VW,et al.Improving cutaneous scar formation by controlling the mechanical environment[J].Ann Surg,2011,254(2):217-225.
[5] Junker JPE,Kratz C,Tollbäck A,et al.Mechanical tension stimulates the transdifferentiation of fibroblasts into myofibroblasts in human burn scars[J].Burns,2008,34(7):942-946.
[6] Park TH,Park JH,Chang CH.Challenging the dogma: relationship between time to healing and formation of hypertrophic scars after burn injuries[J].J Burn Care Res,2014,35(4):e285-286.
[7] Curran TA,Ghahary A.Evidence of a role for fibrocyte and keratinocyte-like cells in the formation of hypertrophic scars[J].J Burn Care Res,2013,34(2):227-231.
[8] Pfurtscheller K,Petnehazy T,Goessler W,et al.Innovative scald burn model and long-term dressing protector for studies in rats[J].J Trauma Acute Care,2013,74(3):932-935.
[9] 孙薇.P311促进烧伤创面表皮干细胞迁移的实验研究[D].第三军医大学,2012:67.
[10] Yang L,Witten TM,Pidaparti RM.A biomechanical model of wound contraction and scar formation[J].J Theor Biol,2013,332:228-248.
(本文编辑:黄利萍)
A novel mechanical stretch model in mice with superficial second degree burn
LIFen,LIWei,SHUQin
(Nursing School,Third Military Medical University,Chongqing 400038,China)
Objective To establish a novel mechanical stretch model in mice with superficial second degree burns,and to evaluate the stability and reliability of the model. Methods Sixty C57BL/6 mice aged 10-12 weeks were selected and randomly divided into 3 groups,including group A (mechanical stretch & superficial second degree burns),group B (sham operation & superficial second degree burns) and group C (normal). Seven sub-groups were set separately in group A and B according to different time points,with 4 mice in each group. After the skin was prepared,a 2 cm2area of superficial second degree burn wound was established on mice back in group A and B at L1level using YLS-5Q Desktop Scald Thermostatic Instrument. And the mechanical stretch was established on each mouse in group A by tissue defect suture method. The burn wound samples were taken for pathologic evaluation at 0,1,3,5,7,14d and 21d in group A and group B,as well as the skin in the same site of mice in group C.Results Superficial second degree burns were successfully built. According to pathologic evaluation results, the healing rate of wound in group A was significantly faster than that in group B. Group A had significantly larger wounds at 1d but had significantly smaller residual area at 5,7,14d than group B (P<0.05). The standard deviation was between 0.01 and 0.15,indicating that a stable and reliable mechanical stretch was sustainable until at least modeling day 14. Conclusion This study has successfully established a simple and scientific animal model of mechanical stretch stimulation with superficial second degree burn,which provides possible basis for studying the role of tension in scald wound.
burn; tension; mechanical load; animal model
1009-4237(2017)08-0603-04
2013年度全军医学科技青年培育项目资助(13QNP111)
400038 重庆,第三军医大学护理学院野战护理学教研室
舒勤,E-mail:15594115@qq.com
李巍,E-mail:weilee2020@163.com
R 644
A
10.3969/j.issn.1009-4237.2017.08.011
2016-05-04;
2016-05-31)

