骶神经电针刺激对脊髓全横断损伤后神经源性膀胱大鼠脊髓神经生长因子NGF及其受体TrkA表达的影响
元小红 叶超 江泽辉 伍绍明 于海川 李春根
·论著·
骶神经电针刺激对脊髓全横断损伤后神经源性膀胱大鼠脊髓神经生长因子NGF及其受体TrkA表达的影响
元小红 叶超 江泽辉 伍绍明 于海川 李春根
目的观察电针刺激骶2神经对脊髓全横断损伤后神经源性膀胱大鼠膀胱重量、排尿量、神经生长因子(nerve growth factor,NGF)及其酪氨酸激酶受体(TrkA) 的影响,探讨骶神经电针刺激治疗脊髓全横断损伤后神经源性膀胱的机制。方法以尖刀横断T9脊髓方式建立大鼠脊髓全横断损伤后神经源性膀胱模型,通过膀胱重量、排尿量的测量观察空白组、模型组、电针组大鼠的膀胱功能变化;通过Western blot方法观察各组大鼠脊髓内NGF及TrkA表达情况,并统计分析各组间的差异。结果治疗4周后,与空白组比较,模型组和电针组膀胱重量均明显增高(P<0.05)。与模型组比较,电针组膀胱重量降低(P>0.05)。与空白组比较,模型组手法排尿量增加(P<0.05)。与空白组比较,电针组手法排尿量增加(P>0.05)。与模型组比较,电针组手法排尿量减少(P>0.05)。空白组和电针组的NGF及TrkA的表达明显高于模型组(P<0.05)。电针组的NGF高于空白组,TrkA的表达低于空白组 (P>0.05)。结论骶神经电针刺激治疗可以通过提高损伤脊髓局部神经生长因子NGF及其高亲和力受体TrkA的表达,抑制脊髓损伤局部神经细胞凋亡,保护神经细胞并促进损伤神经的恢复。同时电针刺激促进排尿反射的协调进行,改善SCI后NB的膀胱功能。
神经源性膀胱; 脊髓损伤; 电刺激疗法; 神经生长因子; 神经生长因子氨酸激酶受体
神经源性膀胱(neurogenic bladder,NB)指控制排尿的中枢神经(脑或脊髓)或周围神经受到损害后引起的排尿功能障碍,是脊髓损伤(spinal cord injury,SCI)后的常见并发症,也是SCI患者最常见的临床问题[1],严重影响SCI患者的生活质量。研究显示,电针刺激治疗能够一定程度上恢复SCI后NB患者的神经功能[2-4],然而作用机制尚未明确。本文通过观察电针刺激骶神经对SCI后NB大鼠脊髓组织内神经营养因子(nerve growth factor,NGF)及其受体原肌球蛋白相关激酶A(TrkA)表达的影响,探讨骶神经电针刺激治疗SCI后NB的机制。
1 材料与方法
1.1 动物和分组
SPF级雌性SD大鼠40只,体重(200±20)g。随机挑选10只作为空白组,其余30只大鼠进行脊髓全横断损伤造模,2周后对确定神经源性膀胱成模的存活大鼠26只采用随机数字表法分为:模型组、电针刺激组,每组13只。
1.2 仪器及试剂
英迪牌KWD-808Ⅰ型脉冲针灸治疗仪(常州英迪电子医疗器械有限公司);NGF抗体(生产厂家:美国santa cruz公司,编号:SC-548);TrkA抗体(生产厂家:美国santa cruz公司,编号:SC-118)。
1.3 模型制备
脊髓全横断损伤造模:参照Hassan Shaker脊髓横断法[5]并加以改良。具体操作:制备T9脊髓全横断损伤大鼠模型:大鼠以乌拉坦0.9 g/Kg腹腔内注射麻醉后俯卧位固定于平板上,常规备皮,75%酒精消毒背部手术区域,根据解剖学标志定位T10椎体。以T10棘突为中心沿背侧正中线做长约2 cm的纵行切口,依次切开皮肤及皮下组织,紧贴椎板切开竖脊肌并向两边钝性剥离,用撑开器撑开肌肉组织,显露相邻上下胸椎的棘突和椎板。用手术刀切开T9~T10棘间韧带,用微型咬骨钳从T9~T10椎板间隙紧贴椎板与脊髓平行进钳,轻轻向上小心咬除椎板,逐渐咬除整个T9椎板及两侧关节突,避免损伤脊髓硬脊膜、血管和神经根。尖刀片在显露的脊髓一端横向切断脊髓,刀尖要触及椎管前壁和侧壁骨面,反复切割脊髓,即刻见大鼠双下肢抽搐,尾巴甩动,随后松驰,后以弯头显微镊轻轻抬起脊髓断端用显微剪剪断取出约1~2 mm长的脊髓组织,脊髓内缩形成一个空洞,充分止血后以明胶海绵填充并清理切口,逐层缝合肌肉、皮下组织及皮肤。以双下肢瘫痪作为SCI成模的标志,术后大鼠在加热毯上至苏醒后放回单笼饲养,每2日更换垫料。术后一周内每日腹腔注射青霉素钠8万单位预防感染,每日2次以手法对大鼠进行人工辅助排尿、排便,并记录尿量及观察排尿习惯。辅助排尿量在术后第14天左右降低并稳定,结合尿动力学检查判定SCI后NB大鼠造模成功。
1.4 干预方式
造模14天后开始干预,空白组和模型组只固定不电针,电针刺激组:俯卧位固定大鼠,以直径0.25 mm×40 mm的中研太和牌无菌针灸针进行双侧骶2神经针刺,定位于第2骶后孔处,直刺4~5 mm。针刺后分别接英迪牌KWD-808Ⅰ型脉冲针灸治疗仪正负极。电针刺激参数:疏密波,2 Hz,强度以肢体轻颤并耐受为度。每日1次,每次20分钟,5次/周,共4周。
1.5 检测
3组大鼠治疗4周后,进行一次人工辅助手法排尿量测定,然后以乌拉坦0.9 g/kg腹腔注射麻醉。在全麻状态下迅速剥离大鼠背部皮肤、筋膜、肌肉等充分暴露T7~T11脊髓,迅速平整切除T8~T10 脊髓,用冰生理盐水冲洗后放入冻存管中,存放于-80℃低温冰箱,以备用于Western blot检测。完整取出膀胱,滤纸吸干后称重。
1.6 统计学处理
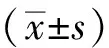
2 结果
2.1 膀胱重量及手法排尿量
见下表1,各组大鼠治疗4周后,模型组和电针组与空白组比较,膀胱重量均明显增高(P<0.05)。电针组与模型组比较,膀胱重量降低,差异不具有统计学意义(P>0.05)。模型组与空白组比较,手法排尿量增加(P<0.05)。电针组与空白组比较,手法排尿量增加,差异不具有统计学意义(P>0.05)。电针组与模型组比较,手法排尿量减少,差异不具有统计学意义(P>0.05)。

表1 各组大鼠膀胱重量和手法排尿量比较
注: 与空白组比较,aP<0.05。
2.2 脊髓组织和神经根中NGF及其受体TrkA表达量的观察
见表2,各组大鼠治疗4周结束后,空白组和电针组的神经生长因子及受体TrkA的表达明显高于模型组(P<0.05)。电针组的NGF高于空白组,受体TrkA的表达低于空白组,差异均不具有统计学意义(P>0.05)。

表2 各组大鼠脊髓中NGF、TrkA灰度值比较
注: 与空白组比较,aP<0.05;与模型组比较,bP<0.05。
3 讨论
本实验采取胸段脊髓全横断损伤切断了骶髓排尿中枢与脑干及其以上的排尿中枢间的上行和下行神经通路,骶髓排尿中枢失去了上位排尿中枢的调控,从而先后产生逼尿肌机能低下、逼尿肌亢进、逼尿肌-括约肌协同失调[6]等病理生理改变,最终造成膀胱功能性出口梗阻而致不充分排尿、残余尿量增加,膀胱有效排尿率下降。久之膀胱壁逐渐增厚,因此本实验中SCI造模后的模型组和电针组的膀胱重量均明显高于空白对照组,而人工排尿量均高于空白对照组。经过4周电针刺激治疗后,电针组大鼠膀胱重量及人工排尿量较模型组均有降低趋势,说明电针刺激骶神经根对SCI后NB有一定治疗作用,能够减缓膀胱增生程度,改善膀胱梗阻情况,提高膀胱有效排尿率,一定程度上改善SCI后NB的膀胱功能。
NGF是神经营养因子家族中首先被发现的关键成员[7-8],能够影响神经生长、成熟及损伤等过程,并可影响中枢神经的可塑性[9-10]。此外,NGF还可以保护细胞免受氧化应激及细胞毒素介导的细胞凋亡[11-13]。NGF通过与两个已知的受体结合发挥信号分子的作用:能够结合所有神经营养因子的普通低亲合力受体P75和只与特定的酪氨酸激酶受体结合的高亲合力受体TrkA[14-15]。当运动神经元损伤后,NGF选择性地与高亲合力受体TrkA结合才能启动NGF的对中枢神经系统的发育、修复及再生等生物效应[16-18]。TrkA受体和细胞内激酶通路的激活,包括PI3K/Akt和增殖蛋白激酶通路参与神经发生和神经生长因子的保护作用[19-20]。
大量研究表明,NGF对SCI后神经损伤的修复具有促进作用[21-22]。本实验结果表明大鼠脊髓损伤后脊髓中NGF及其受体TrkA水平均降低,而经过电针治疗4周后,SCI大鼠脊髓中NGF及其TrkA均恢复至稍低于正常水平,且差异不明显。因此,电针刺激骶神经能够诱导脊髓运动神经元重新表达NGF及其受体TrkA,最终改善SCI后NB的膀胱功能。这一作用机制可能是NGF与其受体TrkA结合后,激活PI3K/Akt和增殖蛋白激酶通路,从而抑制脊髓损伤局部神经细胞凋亡,保护脊髓损伤局部神经细胞,促进损伤神经的恢复。
目前,针灸对SCI后NB的疗效在临床与实验研究中均得到证实[23-26]。本研究采用电针刺激骶2神经治疗SCI后NB,提高了损伤脊髓周围NGF及其受体TrkA的水平,并改善了SCI后NB的膀胱功能。电针既有针刺效应又有低频电刺激作用。它通过刺激S2神经,可以刺激到骶副交感神经,从而调节膀胱、尿道的功能状态,改善储尿或排尿功能。其刺激经传入神经纤维可反射性兴奋脊髓及高级排尿中枢,从而发放冲动下行至膀胱,支配逼尿肌及括约肌,促进二者协调运动完成排尿反射[25]。
综上所述,电针刺激S2神经能够诱导脊髓中NGF及其受体TrkA的表达升高,抑制脊髓损伤局部神经细胞凋亡,保护脊髓损伤局部神经细胞并促进损伤神经的恢复。同时电针刺激促进排尿反射的协调进行,改善SCI后NB的膀胱功能。
[1] D’Hondt F,Everaert K. Urinary tract infections in patients with spinal cord injuries[J]. Curr Infect Dis Rep 2011,13:544-551.
[2] 宋良玉,吕威,景泉凯,等.两种电针对脊髓损伤14天后大鼠运动功能、神经元及MEK2、p-ERK1表达的影响[J].环球中医药,2016,(5):557-562.
[3] 李晓宁,张良,杨庆红,等.夹脊电针对脊髓损伤后大鼠c-fosmRNA及BNIP3 mRNA表达影响的实验研究[J].针灸临床杂志,2015,(7):83-86.
[4] 钱宝延,蔡西国,马玉娟,等.电针俞募穴治疗脊髓损伤后神经源性膀胱的临床观察[J]. 中国康复医学杂志,2016,31(1):50-53.
[5] Hassan S,Sherif M M,Hatem E M,et al. Urinary bladder hyperreflexia: a rat animal model[J]. Neurourology & Urodynamics,2003,22(7):693-698.
[6] Craggs MD.Pelvic somato-visceral reflexes after spinal cord injury: Measuresof functional loss and partial preservation[J].Prog Brain Res,2006,152:205-219.
[7] Geldof A A,Kleijn M A T D,Rao B R,et al. Nerve growth factor stimulates in vitro invasive capacity of DU145 human prostatic cancer cells[J]. Journal of Cancer Research & Clinical Oncology,1997,123(2):107-112.
[8] Huang E J,Reichardt L F. Neurotrophins: roles in neuronal development and function[J]. Scientometrics,2000,13(5-6):181-188.
[9] Manni L,Rocco M L,Bianchi P,et al. Nerve growth factor: basic studies and possible therapeutic applications[J].Growth Factors, 2013,31(4):115-122.
[10] Aloe L,Rocco M L,Bianchi P,et al. Nerve growth factor: from the early discoveries to the potential clinical use[J]. Journal of Translational Medicine,2012,10(27):3419-3432.
[11] Salinas M, Diaz R, Abraham N G, et al. Nerve growth factor protects against 6-hydroxydopamine-induced oxidative stress by increasing expression of heme oxygenase-1 in a phosphatidylinositol 3-kinase-dependent manner[J]. Journal of Biological Chemistry,2003,278(16):13898-13904.
[12] Tang L L,Wang R,Tang X C. Huperzine A protects SHSY5Y neuroblastoma cells against oxidative stress damage via nerve growth factor production[J]. European Journal of Pharmacology,2005,519(1-2):9-15.
[13] Lu XM,Shu YH,Qiu CH,et al. Protective effects and anti-apoptotic role of nerve growth factor on spinal cord neurons in sciatic nerve-injured rats[J]. Neurological Research,2014,36(9):814-823.
[14] Roux P P,Barker P A. Neurotrophin signaling through the p75 neurotrophin receptor[J]. Progress in Neurobiology,2002,67(3):203-233.
[15] Schecterson L C,Bothwell M. Neurotrophin receptors:Old friends with new partners[J]. Developmental Neurobiology,2010,70(5):332-338.
[16] Michael G J,Kaya E,Averill S,et al. TrkA immunoreactive neurones in the rat spinal cord[J]. Journal of Comparative Neurology,1997,385(3):441-455.
[17] Josephson A,Widenfalk J,Trifunovski A,et al. GDNF and NGF family members and receptors in human fetal and adult spinal cord and dorsal root ganglia[J]. Journal of Comparative Neurology,2001,440(2):204-217.
[18] Oderfeldnowak B,Zaremba M,Lipkowski A W,et al. High-affinity NGF receptor in the rat spinal cord during acute and chronic phases of experimental autoimmune encephalomyelitis: a possible functional significance[J]. Archives Italiennes De Biologie,2003,141(2-3):103-116.
[19] Diering G H,Numata Y,Fan S,et al. Endosomal acidification by Na+/H+exchanger NHE5 regulates TrkA cell-surface targeting and NGF-induced PI3K signaling[J]. Molecular Biology of the Cell,2013,24(21):3435-3448.
[20] Yu W,Sheng M,Xu R,et al. Berberine protects human renal proximal tubular cells from hypoxia/reoxygenation injury via inhibiting endoplasmic reticulum and mitochondrial stress pathways[J]. Journal of Translational Medicine,2013,11(1):24.
[21] Kishi S,Shimoke K,Nakatani Y,et al. Nerve growth factor attenuates 2-deoxy-d-glucose-triggered endoplasmic reticulum stress-mediated apoptosis via enhanced expression of GRP78[J]. Neuroscience Research,2010,66(1):14-21.
[22] Oliveira M R D,Rocha R F D,Stertz L,et al. Total and Mitochondrial Nitrosative Stress,Decreased Brain-Derived Neurotrophic Factor (BDNF) Levels and Glutamate Uptake,and Evidence of Endoplasmic Reticulum Stress in the Hippocampus of Vitamin A-Treated Rats[J]. Neurochemical Research,2011,36(3):506-517.
[23] 艾坤,张泓,张雨辰,等.电针对骶髓损伤后神经源性膀胱大鼠尿流动力学及膀胱组织中Caspase-3表达的影响[J].中国康复理论与实践,2013,(12):1104-1107.
[24] 王晓红,周宁,王琴,等.针灸治疗脊髓损伤后不同类型神经源性膀胱疗效观察[J].中国康复,2014,(5):362-364.
[25] 朱毅,李凝,励建安,等.脊髓损伤后神经源性膀胱尿潴留的针刺康复临床研究[J].中华全科医学,2010,8(12):1495-1497.
[26] 高连军,孙迎春,李建军,等.不同时间电针刺激对大鼠脊髓损伤后磁共振弥散张量纤维束成像部分各向异性值均值的影响[J].中国康复理论与实践,2014,(8):728-733.
(本文编辑: 董历华)
EffectsofsacralelectroacupunctureontheexpressionofNGFandTrkAinspinalcordofratswithspinalcordtransectioninjury
YUANXiaohong,YEChao,JIANGZehui,etal.
SecondDepartmentofOrthopaedics,DongzhimenHospitalAffiliatetoBeijingUniversityofChineseMedicine,Beijing100700,China
Correspondingauthor:LIChungen,E-mail:leechungen@126.com
ObjectiveTo observe the influence of electroacupuncture stimulation on S2 nerve of the bladder weight, urine output and the expression of NGF and TrkA of rats with neurogenic bladder after spinal cord transection injury and it’s mechanism.MethodsTo build a model of neurogenic bladder after spinal cord transection injury by remove the T9 spinal cord with a sharp scalpel blade, the bladder function were detected by bladder weight, urine output. The expression of NGF and TrkA were detected by Western blot method, and the differences between the groups were statistically analyzed.Results4 weeks after treatment, compared with blank group, the bladder weight of model group and the electroacupuncture group were significantly increased (P<0.05). Compared with model group,the bladder weight of electroacupuncture group was decreased (P>0.05). Compared with blank group, the urine output of model group was increased (P<0.05). Compared with blank group, the urine output of the electroacupuncture group was increased (P>0.05). Compared with model group, the urine output of the electroacupuncture group was decreased (P>0.05). The expression of NGF and TrkA in blank group and electroacupuncture group was obviously higher than that in model group (P<0.05). The expression of NGF in electroacupuncture group was higher than that in blank group, the expression of TrkA was lower than that in blank group (P>0.05).ConclusionSacral electroacupuncture therapy can improve the expression of both NGF and TrkA in the local nerve of damaged spinal cord, inhibite apoptosis of the damaged spinal cord, protect nerve cells and promote the recovery of damaged nerve. At the same time, electroacupuncture can promote the coordination of micturition reflex and improve NB bladder function after SCI.
Neurogenic bladder; Spinal cord injury; Electrical stimulation therapy; Nerve growth factor; TrkA receptor
100700 北京中医药大学东直门医院骨二科[元小红(博士研究生)、叶超、江泽辉、伍绍明、于海川、李春根]
元小红(1987-),女,2014级在读博士研究生。研究方向:脊髓损伤与关节软骨再生。E-mail: zhenjiuyuan@126.com
李春根(1965-),博士,主任医师,教授,博士生导师。研究方向:脊髓损伤与关节软骨再生。E-mail:leechungen@126.com
R245
A
10.3969/j.issn.1674-1749.2017.08.003
2016-11-05)

