基于过氧化氢预处理的巨龙竹木质素提取及结构解析
何鸣宇,杨海艳,邓 佳,郑志锋,杨 静,史正军,石 纯
(1.西南林业大学云南省高校生物质化学炼制与合成重点实验室,云南 昆明 650224;2. 西南林业大学教育部省部共建西南山地森林资源保育与利用重点实验室,云南 昆明 650224)
基于过氧化氢预处理的巨龙竹木质素提取及结构解析
何鸣宇1,杨海艳1,邓 佳2,郑志锋1,杨 静1,史正军1,石 纯1
(1.西南林业大学云南省高校生物质化学炼制与合成重点实验室,云南 昆明 650224;2. 西南林业大学教育部省部共建西南山地森林资源保育与利用重点实验室,云南 昆明 650224)
巨龙竹属禾本科竹亚科牡竹属竹种,是世界上已知最粗大的巨型丛生竹种,具有极高的开发利用价值。本研究采用碱性过氧化氢预处理结合碱抽提的方法提取巨龙竹秆材中的木质素,通过核磁共振、红外光谱以及热稳定性分析等方法,对所得的木质素样品进行了结构表征与解析。结果表明:巨龙竹木质素是典型的禾草类(HGS型)木质素,其大分子结构由对羟基苯丙烷单元、愈创木基单元和紫丁香基单元构成;木质素的结构中的联接结构以β-O-4′联接键居多,β-β′和β-5′联接键较少;巨龙竹木质素有部分在侧链的γ位上与对香豆酸发生酯化反应,形成稳定的对香豆酸酯结构;本研究分离得到的3个巨龙竹木质素样品起始分解温度分别为194.8、195.4、197.9 ℃,热稳定性良好。
巨龙竹;木质素;碱性过氧化氢;提取分离;结构解析
随着石油等化石资源储量的逐渐减少,从农林生物质等可再生资源中转化利用获得新材料、化工原料、能源和功能食品及药物,补充化石等不可再生资源的缺口,正成为一种新的发展趋势[1]。木质素是农林生物质中总量仅次于纤维素的重要可再生天然高分子资源。但是,由于木质素的化学结构及在细胞壁中与其他组分的构效关系特别复杂,工业生产中每年都有大量的木质素被任意排放或者随意焚烧,资源浪费和环境污染十分严重[2]。因此,合理开发和利用木质素资源,不仅可以缓解当前化石资源不足的问题,还能在一定程度上缓解生态环境的恶化。
木质素的分离是实现其有效地利用的关键。有效的预处理能够提高木质素的提取效率,对预处理原料木质素的结构进行研究能在揭示预处理机制的同时促进预处理技术的改进。因此,阐述预处理后木质素的结构成为国内外木质素基础化学研究的热点[3]。预处理方法中以化学法应用最为广泛,其中,碱性过氧化氢法作为一种优良的预处理方法,常常用于分离植物原料中的木质素。高浓度条件下,过氧化氢脱木质素主要依靠其在碱性条件下分解生成的过氧氢根离子(HOO-)对木质素的氧化降解作用[4]。Kerley等[5]用pH值为11.5,浓度为1%的过氧化氢溶液处理水稻秸秆,常温搅拌16 h后样品中的木质素含量显著减少。张勇等[6]用碱性过氧化氢处理玉米秸秆,发现当过氧化氢浓度在8%~12.5%范围时,样品中残留的木质素含量会随着过氧化氢浓度的增加呈下降趋势。白杨木经pH 11的过氧化氢处理后,再用碱液提取,可以溶出36%的原本木质素[7]。Sun等[7]研究证明,碱性条件下的低浓度过氧化氢预处理,不仅能提高麦草木质素的溶出率,而且所得木质素的化学结构不会发生明显变化。因此,基于碱性过氧化氢预处理的木质生物质组分拆分方法的机理机制仍然具有深入研究的必要。
竹林在我国被誉为“第二森林”,其因具有生长速度快、培育周期短、单株产量高、一次栽培管理得当便可永续经营利用等优点,被视为极具培育和开发利用价值的木质生物质资源[8]。在竹材细胞壁结构中,木质素的化学结构是最复杂的,其结构规律至今仍未完全探究清楚。早在1952年Leopold等[9]就发现竹子木质素与木材不同,它由3种基本单元构成,即紫丁香基(S)、愈创木基(G)和对-羟基苯基(H)。Yang等[10]发现金竹(Phyllostachyssulphurea)离子液体可溶性木质素的G/S/H比例为100∶85∶1,测出木质素大分子基本单元间化学连接键中β-O-4′、β-β′和β-5′链接分别占43.2%、4.3%和5.1%,同时发现金竹木质素大分子苯丙烷基本结构单元侧链的γ位碳与对香豆酸和阿魏酸形成酯化物。最近,郭思勤等[3]从经酸催化离子液体预处理的芦竹中提取酶木质素,结构解析表明证明芦竹木质素大分子中S /G比例为1.08,有较高的S 单元比例,其木质素主要的连接键型为β-O-4′单元,其次是β-5′单元,而β-β′单元的相对含量最低。
巨龙竹(Dendrocalamussinicus)系禾本科竹亚科牡竹属的丛生竹种,是世界上已知最粗大的巨型丛生竹种,研究和开发利用价值高。本实验以巨龙竹为研究对象,采用碱性过氧化氢预处理结合碱提取的方法,从巨龙竹竹粉中提取分离木质素,并对其化学结构和热稳定性能进行研究,旨在为实现巨龙竹资源的高值化转化利用提供理论参考。
1 材料与方法
1.1 实验材料
本试验以采自云南省普洱市孟连县景信乡3年生健康成材的巨龙竹为原料。竹材风干后,取基部竹材切碎,再用粉碎机将原料粉碎并筛选出0.25~0.42 mm的竹粉。合格竹粉用V(甲苯)∶V(乙醇)=2∶1溶液在索氏提取器中连续抽提10 h后,于60 ℃条件下烘干10 h,备分析测试用。本研究所用巨龙竹木质素含量为26.12%,按中华人民共和国国家标准[11-13]进行测定。
1.2 实验设备
粉碎机、索氏抽提器、电热恒温鼓风干燥箱、恒温水浴锅、旋转蒸发仪、磁力搅拌器、离心机、冷冻干燥仪、BRUKER AVANCE III 500MHz核磁共振波谱仪、BRUKER Tensor-27 傅立叶变换红外光谱仪、热重分析仪。
1.3 实验方法
巨龙竹预处理及木质素提取分离流程如图1所示。首先,稀释过氧化氢溶液浓度(H2O2,30%)至5.0%,并用4.0 mol·L-1氢氧化钠调节pH 11[14-15]。然后,取脱蜡竹粉30 g,在60 ℃、固液比1∶20(g·mL-1)条件下,依次用碱性过氧化氢溶液、5.0%和8.0%氢氧化钠溶液连续抽提巨龙竹竹粉,每阶段抽提4 h。将每一步抽提得到的残渣和滤液过滤分离,滤液酸碱度用6 mol·L-1氯化氢调至pH 5.5,并减压浓缩到约30 mL,搅拌状态下缓慢倒至3倍体积95%乙醇中,静置半小时,析出半纤维素沉淀。接着,用离心机固液分离去除半纤维素组分,将含木质素的滤液继续减压浓缩到约15 mL,调节pH 2.0,析出木质素,离心分离、冷冻干燥后得到巨龙竹木质素样品(L1、L2、L3)(图1)。
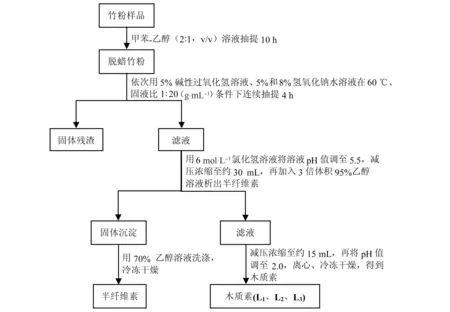
图1 巨龙竹木质素提取流程图Fig.1 Scheme for extraction of lignin fractions from D. sinicus
1.4 红外光谱分析条件
木质素样品的红外光谱分析在傅立叶变换红外光谱仪上进行。采用溴化钾压片方法,将样品均匀地分散在溴化钾中,试样与溴化钾的质量比约为1∶100~200。扫描波数范围为4 000~400 cm-1,扫描次数为16次,分辨率4 cm-1,在透视模式下采集红外光谱数据。
1.5 核磁共振分析条件
核磁共振图谱分析采用布鲁克AVANCE III 500 MHz核磁共振波谱仪进行测定。碳谱测样时,采集时间1.1 s,弛豫时间3 s,扫描2 048次;HSQC测样时,采样时间0.07 s,弛豫时间1.2 s,采样24次。
1.6 热稳定性分析条件
热稳定性分析采用日本Shimadzu公司DTG-60热重分析仪进行。木质素样品先在105 ℃烘箱中烘干2 h,取10 mg样品置于坩埚中,氮气流速30 mL·min-1,加热速率10 ℃·min-1,测试从室温加热至600 ℃。
2 结果与讨论
2.1 木质素得率分析
碱处理机制在于氢氧根离子能够削弱纤维素和半纤维素之间的氢键及皂化半纤维素和木质素分子之间的酯键[16]。而过氧化氢作为一种弱氧化剂,它与木质素反应主要是与木质素侧链上的羰基和双键反应进而氧化降解木质素[17],氧化反应发生过程中会发生一系列的侧链取代、亲电取代以及烷基芳醚键的断裂等[4]。本实验采用碱性过氧化氢对巨龙竹竹粉进行预处理的方法,从原料中提取得到木质素样品L1、L2和L3。按照所得木质素占总木质素百分比得出木质素得率,见表1。由表1可知,碱性过氧化氢预处理结合碱液提取木质素的得率为65.64%。本课题组前期研究表明:采用2%氢氧化钠溶液结合超声处理抽提巨龙竹竹粉,木质素单步抽提最高得率为22.9%[18];在温和条件下连续采用二氧六环和二甲基亚砜抽提巨龙竹原料,木质素总得率为52.1%[19];用96% 二氧六环溶液和含有0.05 mol·L-1盐酸的85% 二氧六环溶液连续抽提巨龙竹竹粉,木质素总得率为54.2%[20]。对比分析可以看出,基于碱性过氧化氢预处理的碱抽提是一种竹材木质素的有效分离方法。

表1 巨龙竹木质素样品的得率
注:a基于样品的Klason木质素含量计算abase on sample′s content calculation of Klason lignin
2.2 木质素红外光谱分析
本实验中得到的3个巨龙竹木质素样品的红外光谱见图2,红外光谱中特征吸收峰位的归属参照文献进行标识[21-23]。

图2 巨龙竹中木质素的红外光谱Fig.2 FT-IR spectra of lignin fractions isolated from D. sinicus
由图2可知,巨龙竹木质素L1、L2和L3的红外光谱图相似性很高,仅在吸收强度上稍有不同。表明了巨龙竹木质素结构的一致性,也表明碱性过氧化氢预处理并不会对木质素结构造成很大的破坏。其中3 433 cm-1处的吸收峰源自羟基的O-H伸缩振动峰;2 938 cm-1和2 843 cm-1处的吸收峰分别是来自甲基和亚甲基的C-H伸缩振动峰;1 708 cm-1处的吸收峰是源自非共轭酮基、羰基和酯键的C=O振动吸收峰,这个信号峰在L1和L2中较为明显,在L3中较为微弱,可能是因为经多步碱处理后使C=O键被破坏;1 599 cm-1、1 503 cm-1和1 418 cm-1处的吸收峰是木质素芳环的主要特征峰,这3个峰较为明显,说明所提木质素特征结构明显、完整。除此之外,1 458 cm-1处的吸收峰是苯环C-H的变形振动;1 326 cm-1处的吸收峰是紫丁香基(S)和缩合愈创木基(G)的振动吸收峰;1 263 cm-1处的吸收峰是愈创木基环(G)加C=O的伸缩振动峰;1 222 cm-1处的吸收峰是C-C、C-O、C=O的振动吸收峰;1 127 cm-1处的强吸收峰是C-H面内变形振动(主要是S型单元)。最后,1 032 cm-1和836 cm-1处的吸收峰是木质素的C-H面内振动和C-H面内变形振动。综上所述,基本可以判断所得3个巨龙竹木质素样品均为HGS型木质素。
2.3 木质素核磁共振分析
木质素是一种天然无定形的、分子结构十分复杂的芳香性高分子化合物。在核磁共振分析中,氢谱的谱宽只有10 ppm,而碳谱的谱宽有200 ppm,为避免信号峰重叠导致不易分析的情况,本研究选择利用碳谱和二维HSQC对巨龙竹木质素的结构进行表征。
2.3.1 核磁共振碳谱分析 本研究对3个木质素样品进行了核磁共振碳谱分析,并参照文献对核磁共振中的信号峰进行标识[21,24-25],见图3。具体信号归属见表2。由图3可知,104~168 ppm为木质素特征峰区域,在这一区域中,信号168.0 ppm、159.8 ppm、144.2 ppm、130.1 ppm、125.1 ppm、115.8 ppm和115.3 ppm分别代表对香豆酸酯(pCA)的C-γ、C-4、C-α、C-2/C-6、C-1、C-3/C-5和C-β,这是由于大量对香豆酸都酯化在木质素侧链的γ位置,这些对香豆酸酯的信号都非常强,表明了巨龙竹木质素中含有大量的对香豆酸酯,同时也说明了碱性过氧化氢预处理结合碱抽提的方法对对香豆酸酯的结构没有较大破坏。
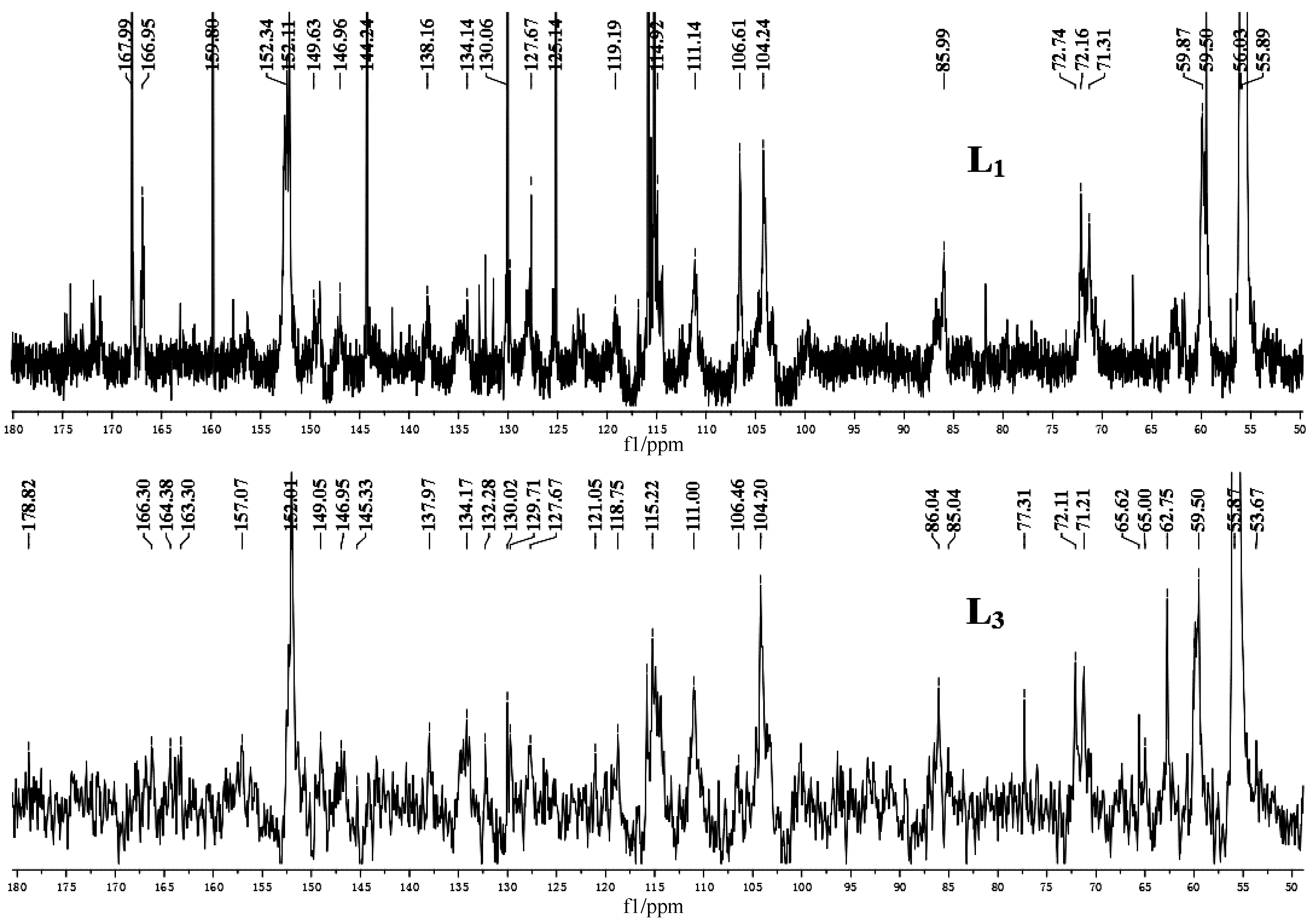
图3 巨龙竹木质素组分(L1和L3)的核磁共振碳谱图Fig.3 13C-NMR spectra of lignin fractions (L1 and L3) isolated from D.sinicus
除此之外,图3中巨龙竹木质素HGS 3大基本单元的信号也比较明显,其中H单元信号为:129.7 ppm(C-2/C-6)和114.4 ppm(C-3/C-5,醚化);G单元信号为:149.6 ppm(C-3,醚化)、147.0 ppm(C-4,醚化)、145.3 ppm(C-4,非醚化)、134.1 ppm(C-1,醚化)、119.2 ppm(C-6)、114.9 ppm(C-5)和111.1 ppm(C-2);S单元信号为:152.3 ppm(C-3/C-5,醚化)、138.2 ppm(C-4,醚化)、134.2 ppm(C-1,醚化)、106.6 ppm、104.2 ppm(C-2/C-6)。同时,在核磁共振碳谱中能检测到几种常见的木质素单元的连接键信号。β-O-4′的联接信号出现在86.0 ppm (C-β)、72.2 ppm (C-α) 和59.9 ppm (C-γ); β-β′的联接信号出现在71.3 ppm (C-γ);β-5′的联接信号出现在62.8 ppm (C-γ)。愈创木基或紫丁香基的-OCH3信号在56.0 ppm。另外,在90.0 ppm-102.0 ppm中出现了少量糖信号,可能是木质素样品中夹杂着少量半纤维素。
2.3.2 二维HSQC核磁共振谱图分析 为得到更多关于巨龙竹木质素的化学结构信息,本研究对3个木质素样品又进行了二维HSQC核磁共振分析,见图4,图4中各信号峰参照现有文献进行归属[25-27],归属结果见表3。

表2 巨龙竹木质素组分(L1和L3)核磁共振碳谱图信号归属
注:G,,愈创木基单元;S,紫丁香基单元;H,对羟基苯丙烷单元;pCA,酯化的对香豆酸。
G,guaiacyl units; S,syringyl units; H,p-hydroxylphenyl units; pCA,esterfiedp-coumaric acid.

图4 巨龙竹木质素组分(L1、L3)的二维HSQC核磁共振图谱Fig.4 HSQC-NMR spectra of lignin fractions (L1 and L3) isolated from D.sinicus
由图4可知,侧链区(δC/δH 50-90/2.5-6.0 ppm)Aα、Aβ和Aγ的信号比较明显,其信号分别在δC/δH 72.3/4.83 ppm (Aα)、83.9/4.32 ppm (Aβ(G))、86.0/4.11 ppm (Aβ(S))和60.1/3.73 ppm (Aγ),表明β-O-4′结构在巨龙竹木质素中存在较多;树脂醇β-β′结构的Bα、Bβ和Bγ的信号分别在δC/δH 85.2/4.64 ppm、53.9/3.04 ppm和71.4/3.83,4.16 ppm;β-5′结构(C)的α、β和γ位信号分别在δC/δH 86.9/5.59 ppm、53.5/3.46 ppm和62.9/3.78 ppm;螺旋二烯酮结构(D)的α位信号在δC/δH 79.2/5.59 ppm,此结构的信号比较弱,说明其在巨龙竹木质素中的含量较少。
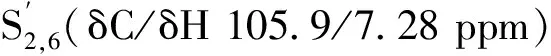
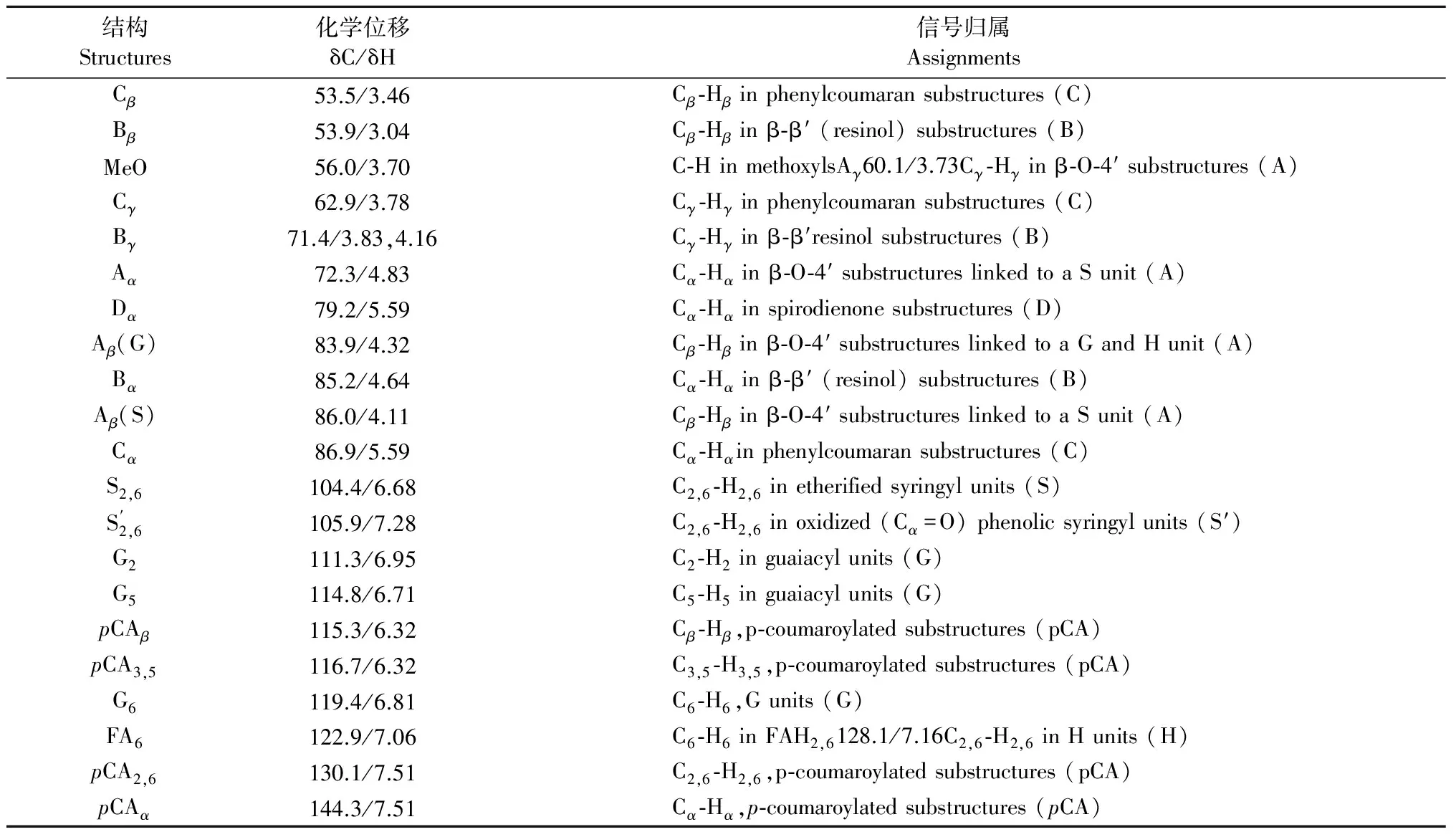
表3 巨龙竹木质素二维HSQC谱图信号归属
注:G,,愈创木基单元;S,紫丁香基单元;H,对羟基苯单元;pCA,酯化的对香豆酸;FA,酯化的对阿魏酸。G,guaiacyl units; S,syringyl units; H,p-hydroxylphenyl units;pCA,esterfiedp-coumaric acid; FA,esterfied ferulic acid
巨龙竹木质素大分子可能存在的结构单元如图5所示。
2.4 木质素热稳定性分析
为了研究所得木质素样品的热稳定性,对3个木质素样品进行了热重分析,TGA/DTG曲线见图6。结合相关文献[28],对图像进行了分析。L1、L2和L3在100 ℃附近分别失重2%、1.5%和1%,这个阶段主要是脱除样品中的自由水;在100~200℃范围中,木质素开始缓慢分解,到达初始热解温度时开始剧烈分解,L1、L2和L3的初始热解温度分别为194.8、195.4和197.9 ℃;在200~300 ℃范围中,木质素失重速率逐渐增大,生成大量分解产物。在木质素样品L2的DTG曲线(图6 b)中,150~250 ℃范围出现较明显的峰,峰顶点值为209℃,这主要是由于木质素苯环周围的官能团发生断裂,产生二氧化碳和少量的水形成的峰[29-30],此反应在在L1和L3中也存在,但是不够明显。3个样品分别在302.3、308.7和337.4 ℃达到热裂解速率最大值,3个样品剧烈分解的终止温度分别为339.3、338.6和395.7 ℃。最后阶段,样品失重速率缓慢,此时大部分木质素已经降解,因此失重不再明显。结果表明巨龙竹木质素样品具有良好的热稳定性,而木质素样品L3的热稳定性比L1和L2更高,可能是由于L1和L2的分子量较小,可以通过预处理和较低浓度碱液提取得到,而L3的分子量较大,通过较高浓度碱液才能提取出来。
3 结论
(1)本实验选用极具开发和研究潜力的大型丛生竹材巨龙竹为原料,在60 ℃条件下经5%碱性过氧化氢溶液(pH 11)、碱性水溶液(5.0%、8.0%氢氧化钠)连续抽提竹粉,最终得到3个木质素样品。该方法对竹材木质素组分具有较高的溶出效率,木质素总得率为65.64%。

图5 巨龙竹木质素组分(L1和L3)HSQC-NMR图谱中主要联接结构及结构单元(A)β-O-4′醚键结构,γ位为羟基;(A′)β-O-4′醚键结构,γ位为乙酰基;(A′′)β-O-4′醚键结构,γ位为酯化对羟基苯甲酸酯;(pCA)酯化的对香豆酸单元;(B)树脂醇结构,由β-β′、α-O-γ′和γ-O-α′联接而成;(C)苯基香豆满结构,由β-5′和α-O-4′联接而成;(D)螺旋二烯酮结构,由β-1′和α-O-α′联接而成;(FA)酯化的阿魏酸单元;(G)愈创木基结构;(S)紫丁香基结构;(S′)氧化的紫丁香基结构,α位为酮基;(H)对羟基苯基结构Fig.5 Main substructures presented in the lignin fractions (L1 and L3) isolated from D. sinicus (A) β-O-4′ linkages; (A′) γ-acetylated β-O-4′ substructures; (A′′) γ-p-courmaroylated β-O-4′ linkages; (pCA) p-coumarate ester structures; (B) resinol substructures formed by β-β′,α-O-γ′ and γ-O-α′ linkages; (C) phenylcoumarane substructures formed by β-5′ and α-O-4′ linkages; (D) spirodienone structures formed by β-1′ and α-O-α′ linkages; (FA) ferulate ester structures; (G) guaiacyl units; (S) syringyl units; (S′) oxidized syringyl units with a carbonyl group at Cα (phenolic); (H) p-hydroxyphenyl units
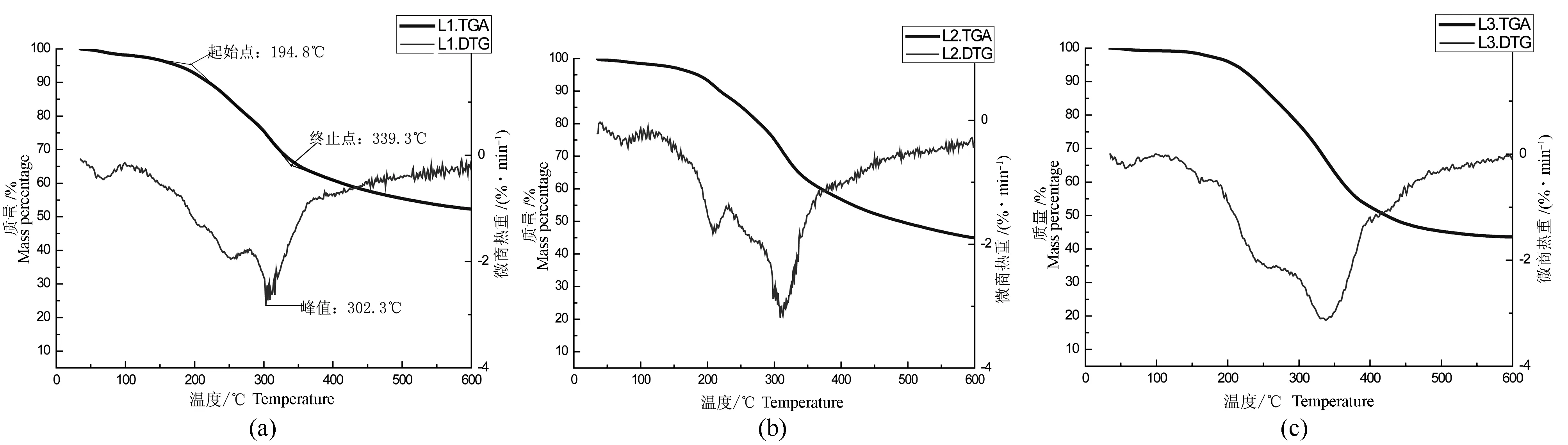
图6 巨龙竹木质素样品L1(a)、L2(b)和L3(c)的TG/DTG曲线Fig.6 TGA/DTA curves of lignin fractions L1 (a),L2 (b) and L3 (c) isolated from D. sinicus
(2)红外光谱和核磁共振波谱分析表明,巨龙竹木质素是典型的禾草类(HGS型)木质素,其大分子结构由对羟基苯基单元、愈创木基单元和紫丁香基单元构成。木质素的结构中,以β-O-4′联接键居多,β-β′和β-5′联接键较少。此外,巨龙竹木质素侧链的γ位与对香豆酸存在酯化连接,形成对香豆酸酯。
(3)本研究所抽提得到的巨龙竹木质素具有良好的热稳定性,其热分解起始温度分别为194.8、195.4和197.9 ℃,分别在302.3、308.7和337.4 ℃达到热裂解速率最大值。
[1] 彭锋. 农林生物质半纤维素分离纯化、结构表征及化学改性的研究[D]. 广州:华南理工大学,2010.
[2] Hatakeyama H,Hatakeyama T. Lignin structure,properties and applications [J]. Advances in Polymer Science,2010,232:1-63.
[3] 郭思勤,游婷婷,周天,等. 酸催化离子液体预处理芦竹酶木质素结构研究[J]. 林业工程学报,2016,1 (2):82-87.
[4] 詹怀宇. 纤维化学与物理[M] .北京:科学出版社,2005.
[5] Kerley M S,Fahey G C,Berger L L,etal. Effects of alkaline hydrogen peroxide treatment of wheat straw on site and extent of digestion in sheep [J]. Journal of Animal Science,1986,63:868-878.
[6] 张勇,朱宇旌,李笑丹,等. 碱性双氧水处理对玉米秸秆营养价值的影响[J]. 中国农学通报,2003,19 (6):7-9.
[7] Sun Run-cang,Tomkinson J,Wang Shi-qing,etal. Characterization of lignins from wheat straw by alkaline peroxide treatment [J]. Polymer Degradation and Stability,2000,67:101-109.
[8] 崔宇,吴良如. 我国竹醋液发展现状和展望[J]. 竹子研究汇刊,2010,29(1):11-16.
[9] Leopold B,Malmstrom I L. Studies on lignin. IV. Investigation on the nitrobenzene oxidation products of lignin from different woods by paper partition chromatography [J]. Acta Chemica Scandinavica,1952,6 (1):49-54.
[10] Yang Dong,Zhong Lin-xin,Yuan Tong-qi,etal. Studies on the structural characterization of lignin,hemicelluloses and cellulose fractionated by ionic liquid followed by alkaline extraction from bamboo [J]. Industrial Crops and Products,2013,43:141-149.
[11] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 742-2008,造纸原料、纸浆、纸和纸板灰分的测定[S].北京:中国标准出版社,2008.
[12] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 2677.8-1994,造纸原料酸不溶木素含量的测定[S]..北京:中国标准出版社,1994.
[13] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 10337-2008,造纸原料和纸浆酸溶木素的测定[S]..北京:中国标准出版社,2008.
[14] 王文侠,宋春丽,张晓静,等. 碱性过氧化氢法提取豆渣半纤维素的研究[J]. 中国粮油学报,2010,25 (12):117-121.
[15] 胡彪,刘芳,全亮. 碱性过氧化氢提取苹果木聚糖的研究[J]. 农产品加工学刊,2010(5):34-37.
[16] 岳建芝,李刚,张全国. 促进木质纤维素类生物质酶解的预处理技术综述[J] .江苏农业科学,2011,39 (3):340-343.
[17] 邢杨,卜令习,朱莉伟,等. 碱性过氧化氢预处理糠醛渣超声波辅助酶解研究[J]. 林产化学与工业,2012,32 (4):47-52.
[18] 邓嘉雯,杨海艳,史正军,等. 超声-弱碱协同作用下巨龙竹木质素的分离及表征[J]. 林业工程学报,2017,2 (2):64-69.
[19] 邓佳,史正军,成聃睿,等. 巨龙竹有机溶剂木质素提取及结构表征[J]. 广州化工,2015,43 (12):47-49.
[20] 成聃睿,史正军,杨海艳,等. 巨龙竹木质素化学结构研究[J].世界竹藤通讯,2015,13 (2):1-6.
[21] 文甲龙. 生物质木质素结构解析及其预处理解离机制研究[D]. 北京:北京林业大学,2014.
[22] Faix O. Classification of lignins from different botanical origins by FT-IR spectroscopy [J]. Holzforschung-International Journal of the Biology,Chemistry,Physics and Technology of Wood,1991,45 (s1):21-28.
[23] Xu Feng,Sun Run-cang,Sun Jin-xia,etal. Determination of cell wall ferulic andρ-coumaric acids in surgarcane bagasse [J]. Analytia Chimica Acta,2005,552 (2):207-217.
[24] Capanema E A,Balakshin M Y,Kadla J F. Quantitative characterization of a hardwood milled wood lignin by nuclear magnetic resonance spectroscopy [J]. Journal of Agricultural and Food Chemistry,2005,53 (25):9639-9649.
[25] 史正军. 甜龙竹及巨龙竹半纤维素、木质素结构诠释及相互间化学键合机制解析[D]. 北京:北京林业大学,2013.
[26] Martinez A T,Rencoret J,Marques G,etal. Monolignol acylation and lignin structure in some nonwoody plants:a 2D NMR study [J]. Phytochemistry,2008,69(16):2831-2843.
[27] Xiao Ling-ping,Shi Zheng-jun,Xu Feng,etal. Structural characterization of lignins isolated from Caragana sinica using FT-IR and NMR spectroscopy [J]. Spectroscopy and Spectral Analysis,2011,31(9):2369-2376.
[28] 车德勇,孙亚萍,孙艳雪. 木质素热解的热重红外分析仪实验研究[J]. 科学技术与工程,2016,16 (3):225-228.
[29] 刘成. 木质素热重红外动力学分析与乙酰化改性研究[D]. 南京:南京林业大学,2015.
[30] 车德勇,孙艳雪,孙佰仲,等. 木质素热解气相产物释放特性实验研究[J]. 中国电机工程学报,2015,35 (24):6439-6444.
Isolation and Structural Characterization of Lignin fromDendrocalamussinicusPretreated with Alkaline Hydrogen Peroxide
HE Ming-yu1,YANG Hai-yan1,DENG Jia2, ZHENG Zhi-feng1,YANG Jing1,SHI Zheng-jun1,SHI Chun1
(1.University Key Laboratory of Biomass Chemical Refinery & Synthesis, Southwest Forestry University,Kunming 650224,Yunnan,China; 2.Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China,Southwest Forestry University,Kunming 650224,Yunnan,China)
Dendrocalamussinicus,belonging toDendrocalamusin Bambusoideae of Gramineae,has great development potential and research value,is known as the largest bamboo species of the world. In order to effectively separate lignin formD.sinicusand analyze the chemical structure more systematically,three lignin fractions (L1,L2,L3) were isolated with alkaline H2O2solution and alkaline aqueous solution. The structure and properties of the lignin fractions were characterized by nuclear magnetic resonance (NMR),Fourier transform infrared spectroscopy (FT-IR),and thermogravimetry (TG). The results indicated that the lignin isolated fromD.sinicusis representative HGS lignin,and the macromolecular structure consists ofp-hydroxylphenyl units,guaiacyl units and syringyl units. In the structure of the lignin,β-O-4′ linkages are in the majority,β-β′ linkages andβ-5′ linkages are less. Besides,the lignin side-chain was found to be esterfied byp-coumaric acid at theγ-carbon,and form stablep-coumarate structures. In addition,the isolated bamboo lignin fractions have good thermal stability,and the temperatures of initial decomposition are 194.8,195.4 and 197.9 ℃,respectively.
Dendrocalamussinicus; Lignin; Hydrogen peroxide; Isolation; Structural characterization
2016-11-22
国家自然科学基金资助项目(31260165、31560195);云南省科技计划项目(2015FD023)
何鸣宇,硕士研究生,从事生物质转化、竹类研究等研究。通信作者:史正军,博士,副教授,硕士生导师,从事生物质资源转化研究。E-mail: shizhengjun1979@163.com

