不同价态五氧化二钒吸附水和氨的机理研究
高正阳, 梁冉冉, 范军辉
(华北电力大学 能源动力与机械工程学院,河北保定 071003)
不同价态五氧化二钒吸附水和氨的机理研究
高正阳, 梁冉冉, 范军辉
(华北电力大学 能源动力与机械工程学院,河北保定 071003)
为研究不同价态的V2O5(V6O15及V6O15+)吸附H2O和NH3的反应机理,应用量子化学得到反应物、中间体、过渡态和产物的几何构型,对比分析反应过程中优化结构的势能、反应能垒、键长和吸附能等数据.结果表明:V6O15和V6O15+均可吸附H2O生成V—OH,但是对于后者整个反应表现为放热,而且反应能垒更低,说明V6O15+更容易与H2O反应生成Brønsted酸位;NH3在V6O15+上的吸附能更大,更容易形成可与NO反应的—NH4+;在SCR脱硝反应中阳离子团簇V6O15+比中性团簇V6O15活性更大.
五氧化二钒; 吸附; 量子化学; 反应机理
氮氧化物(NOx)是造成酸雨和城市大气污染的主要原因.近年来,中国燃煤电厂产生的NOx约占排放总量的60%,随着燃煤电厂数量的不断增加,NOx排放量及其所占比例还将继续增加[1].为响应世界各国保护环境及人类生命财产安全的号召,我国制定了严格的排放标准来控制火电厂NOx的排放量[2].目前,选择性催化还原(SCR)被认为是一种最有效的烟气脱硝方法[3].SCR的工作原理是向锅炉排放的携带有大量NOx的烟气中喷入NH3等还原剂,在脱硝催化剂的作用下NH3等还原剂与烟气中的NOx反应,生成对大气无污染的N2和H2O.
烟气SCR脱硝工艺的技术核心是催化剂.脱硝催化剂一般由活性组分和载体组成,以V2O5为主要活性组分、TiO2为载体的催化剂是当前工业脱硝催化剂的主流剂种.国内外学者对钒系催化剂脱硝反应机理的描述不尽相同,归纳起来认为NH3-SCR脱硝反应主要有2种机理[4]:Eley-Rideal机理(E-R机理)和Langmuir-Hinshelwood机理(L-H机理).Topsoe等[5-6]提出SCR脱硝反应的E-R和L-H结合机理,被广泛认可,该机理涉及2种V活性位,即Brønsted位(吸附位V—OH)和Lewis位(氧化位V=O).NH3吸附在Brønsted酸位(B酸位)上形成的—NH4+在SCR脱硝反应机理中起关键作用,气相中的NO与活化的—NH4+发生反应并生成中间体,分解成N2和H2O[7].V2O5结构本身只有Lewis位,—NH4+在V—OH基上形成,B酸位由V=O吸附水转化形成[8].因此,B酸位的形成以及NH3在B酸位的吸附对于研究SCR脱硝反应至关重要.
为了在分子层次上揭示催化反应的相关机理,众多学者对过渡金属氧化物团簇和H2O、NH3分子反应进行了研究[9-10].相比于V2O5中性团簇,针对V2O5阳离子团簇对B酸位形成的影响以及NH3吸附的研究还很少.Ma等[11]研究了H2O分子吸附在V4O10阳离子团簇并生成V—OH的过程,但是没有探讨V4O10中性团簇吸附H2O分子并生成V—OH的过程.关于V2O5中性团簇和阳离子团簇吸附水形成羟基及吸附氨过程的研究也很少.笔者利用密度泛函理论(DFT)结合精度更高的V6O15、V6O15+簇模型,模拟Lewis位吸附H2O分子形成吸附位V—OH的微观机理,得到了反应过程中形成的中间体和过渡态的结构,进一步探讨NH3在B酸位的吸附,对比分析不同价态的团簇模型在脱硝过程中的优劣性,对提升催化剂的脱硝效率有一定参考意义.
1 计算方法
1.1理论方法和反应机理
随着计算机的发展,量子化学逐渐成为探讨微观反应机理的重要手段[12].密度泛函理论具有良好的计算速度和精确度,因此被广泛地应用于量子化学计算[13].笔者采用密度泛函理论B3LYP,体系中的金属原素V选择lanl2dz基组,除V以外的H、O和N等元素处于多电荷体系,采用单纯的标准基组不能满足计算精度,因此选择6-311g(d,p)基组.在指定的基组水平上采用双杂化泛函方法得到反应中所有物质的能量.计算采用Gaussian09软件包.
由于吸附水形成羟基过程的反应物不同,研究反应过程也会有差异.
反应Ⅰ,V6O15吸附水分子:
V6O14(OH)2
(1)
反应Ⅱ,V6O15+吸附水分子:
(2)
应用量子化学计算V6O15和V6O15+团簇吸附水反应过程中涉及到的反应物、中间体、过渡态和产物的几何构型,并对其进行振动频率分析,确保优化后都是能量最低的结构.在相关几何参数的基础上进行热能和零点能校正,从而得到反应活化能.构造B酸位后模拟计算NH3在V6O15和V6O15+团簇羟基上的吸附,对比分析优化后原子间键长的变化和吸附能的大小,获得不同价态钒基催化剂吸附氨形成—NH4+的能力.
1.2吸附能的计算方法
通过吸附能来衡量催化剂表面对吸附质的作用,吸附能(Eads)为吸附前后体系的能量变化:
(3)
式中:E(A)和E(B)分别为吸附前原子簇模型和吸附质的能量;E(AB)为吸附后体系的能量.
吸附能为负值表示可能发生吸附,否则吸附不会发生.Eads负值越大,吸附能力越强,反应越容易发生.
2 结果与分析
2.1V2O5吸附H2O形成B酸位
2.1.1 H2O吸附生成—OH的过程
采用密度泛函理论B3LYP,调整指定键长后扫描势能面,将势能面上的鞍点作为初始结构,在6-311g(d,p)/lanl2dz基组水平上进行结构优化,得到整个反应过程,如图1和图2所示.
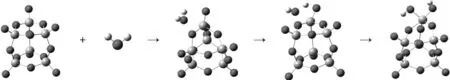
+→→→
R IM1 TS1 P1
图1 V6O15吸附H2O的过程
Fig.1 Reaction process of H2O adsorption by V6O15

R IM2 TS2 IM3

P
图2 V6O15+吸附H2O的过程
图1给出了中性团簇V6O15吸附H2O生成B酸位的过程,H2O分子中的一个H原子和V=O(1)的O(1)原子结合,该反应存在中间体和过渡态.在整个反应过程中,H—O(1)两原子间的距离逐渐缩小(∞→0.283 nm→0.116 nm→0.098 nm,∞表示原子间的距离不足以成键),反映了H—O(1)键的形成过程.钒基上V=O(1)双键距离逐渐拉长(0.157 nm→0.157 nm→0.169 nm→0.174 nm),V原子与O(1)原子间的作用力变弱,有利于脱离H2O分子后的H原子靠近O(1)形成B酸位.过渡态频率分别为-1 553.90 cm-1、33.21 cm-1和35.97 cm-1等,有且仅有一个虚频.在虚频振动形式下,H原子向O(1)原子方向有明显的振动,有利于发生反应,说明存在该过渡态,笔者研究的机理是可信的.
阳离子团簇V6O15+吸附H2O生成B酸位的过程如图2所示.H2O分子吸附在V6O15+上生成稳定的中间体IM2,经过渡态TS2得到中间体IM3,优化后H2O分子分解,其中一个H原子逐渐远离并靠近O(1)原子,生成V6O15H+和OH.在反应过程中,H—O(1)键的距离逐渐缩小(∞→0.243 nm→0.129 nm→0.103 nm→0.098 nm),反映了H—O(1)键的形成过程.在整个过程中,所有经过优化的中间体振动频率均为正,过渡态有且仅有一个虚频,频率为-1 159.98 cm-1.在虚频振动形式下,H原子沿反应途径远离H2O分子并向钒基O(1)原子方向有明显的振动,说明该过渡态的存在是合理的.
2.1.2 沿反应途径(IRC)体系的势能变化
分别以反应状态的反应途径和总能量为x轴和y轴作图,得到沿反应途径(IRC)体系的势能变化曲线,如图3和图4所示.
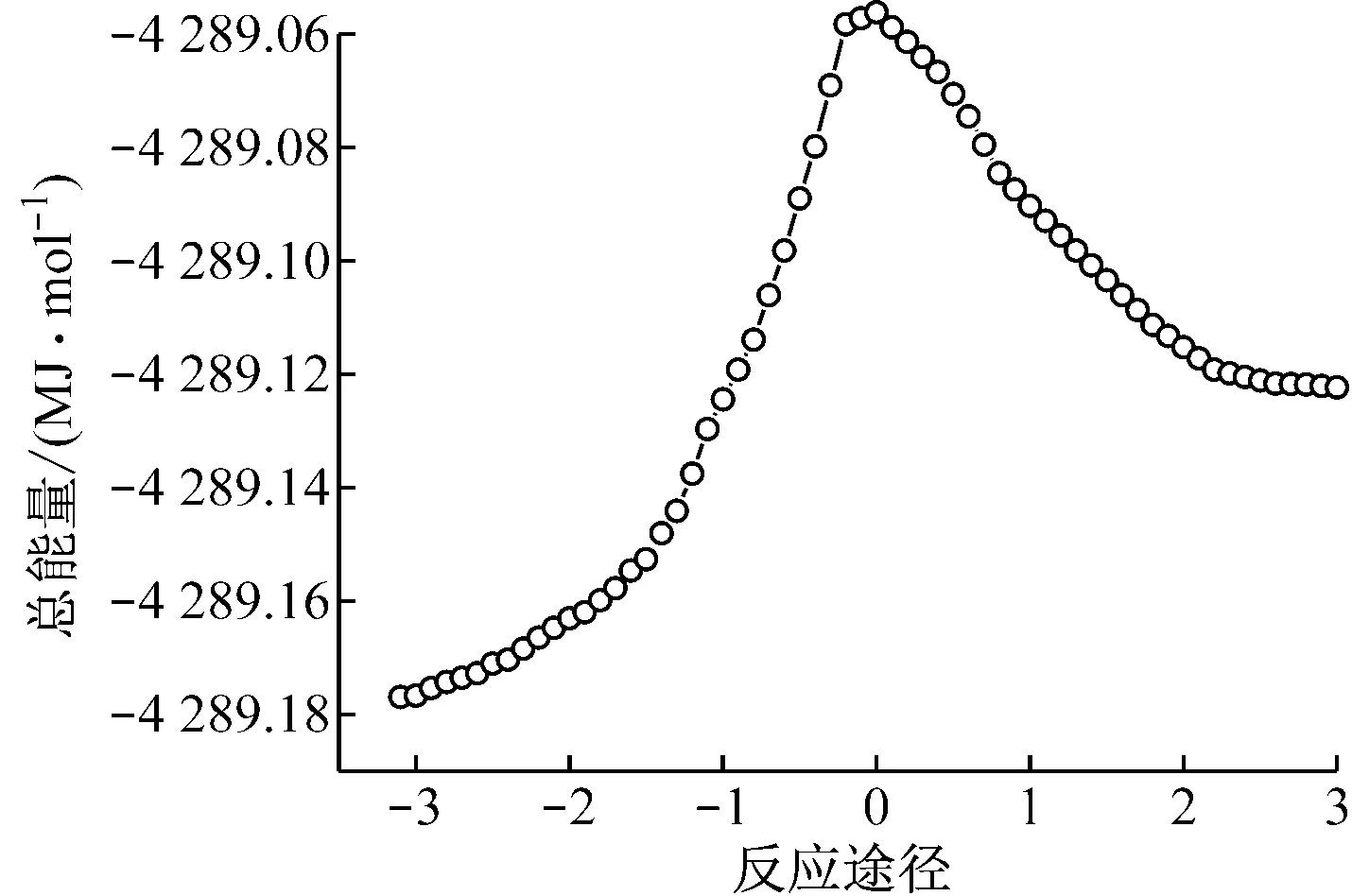
图3 V6O15吸附H2O沿反应途径(IRC)的能量变化
Fig.3 Energy changes of adsorption of H2O on V6O15neutral clusters along intrinsic reaction coordinate (IRC)
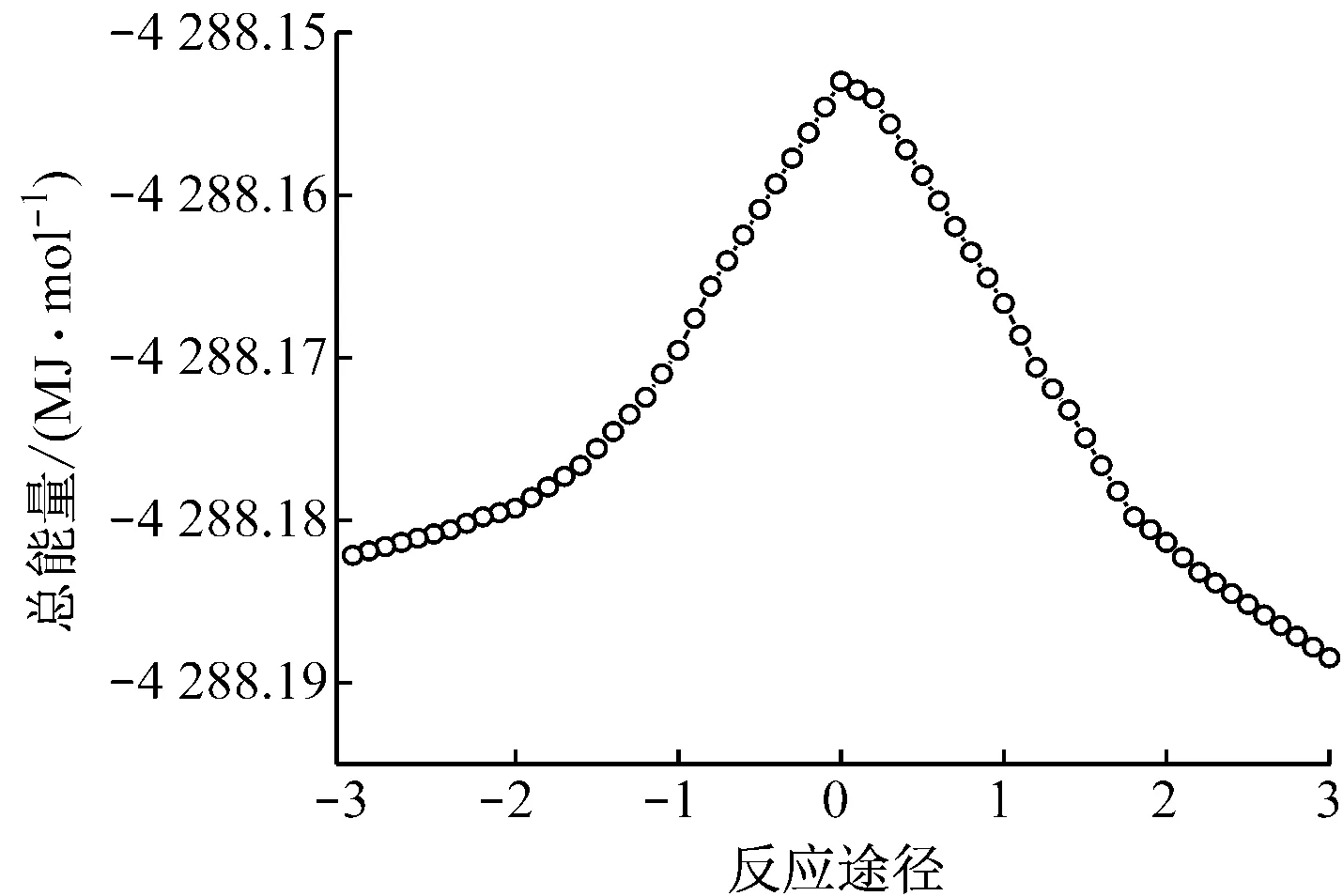
图吸附H2O沿反应途径(IRC)的能量变化
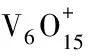
由图3可知,反应物的能量低于产物能量,说明是吸热反应.在H2O分子靠近钒基并形成V—OH的过程中,当H2O分子中O—H键逐渐断裂,H原子远离羟基并将要与V6O15中的V=O(1)成键时,形成过渡态TS1,反应体系吸收热量;当H原子与O(1)成键形成V—OH时,反应体系放出热量.
由图4可知,反应物的能量高于产物能量,说明是放热反应.当H2O分子中的一个H原子逐渐远离并将要与V6O15+中的V=O(1)成键时,形成过渡态TS2,过程吸收热量;当H原子与O(1)成键形成V—OH时,反应体系放出热量.
2.1.3 反应过程中的能量
V2O5吸附H2O生成B酸位的反应涉及到各驻点(反应物R、过渡态TS、中间体IM以及产物P)的总能量、相对能量和过渡态结构的虚频,如表1和表2所示.根据表1和表2中数据绘制各驻点相对能量的变化,如图5所示.
由表1、表2和图5可知,中性团簇V6O15吸附H2O生成B酸位的反应能垒为157.7 kJ/mol.阳离子团簇V6O15+吸附H2O生成羟基的反应能垒为40.0 kJ/mol.
表1V6O15吸附H2O的过程中各驻点结构的单点能E0、零点校正能EZPE、总能量Etot、相对能Erel和虚频ν
Tab.1E0,EZPE,Etot,Erelofvariouscompoundsandtheimaginaryfrequencyoftransitionstates(ν)inreactionprocessofH2OadsorptionbyV6O15
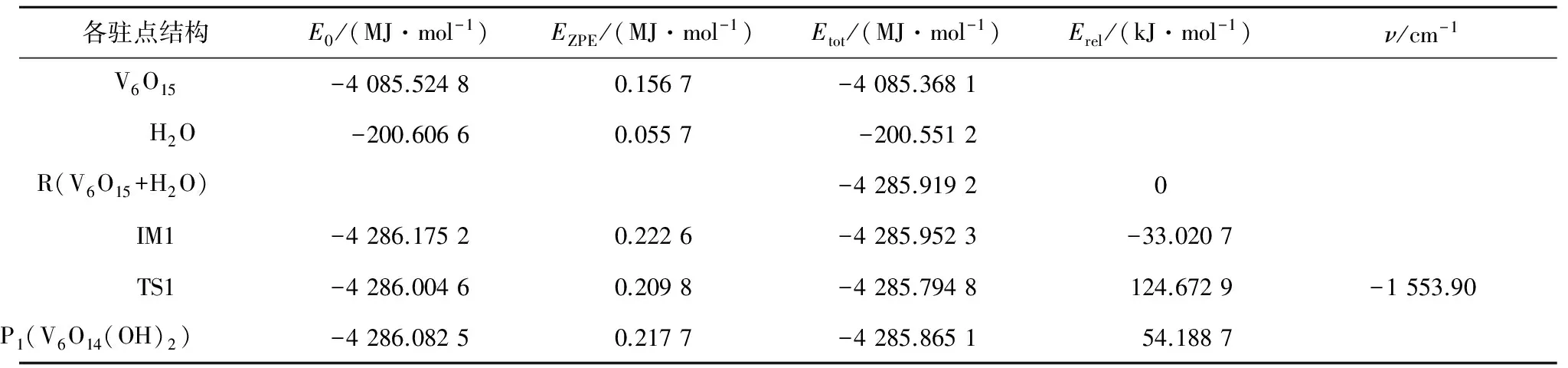
各驻点结构E0/(MJ·mol-1)EZPE/(MJ·mol-1)Etot/(MJ·mol-1)Erel/(kJ·mol-1)ν/cm-1V6O15-4085.52480.1567-4085.3681H2O-200.60660.0557-200.5512R(V6O15+H2O)-4285.91920IM1-4286.17520.2226-4285.9523-33.0207TS1-4286.00460.2098-4285.7948124.6729-1553.90P1(V6O14(OH)2)-4286.08250.2177-4285.865154.1887
表2V6O15+吸附H2O的过程中各驻点结构的单点能E0、零点校正能EZPE、总能量Etot、相对能Erel和虚频ν

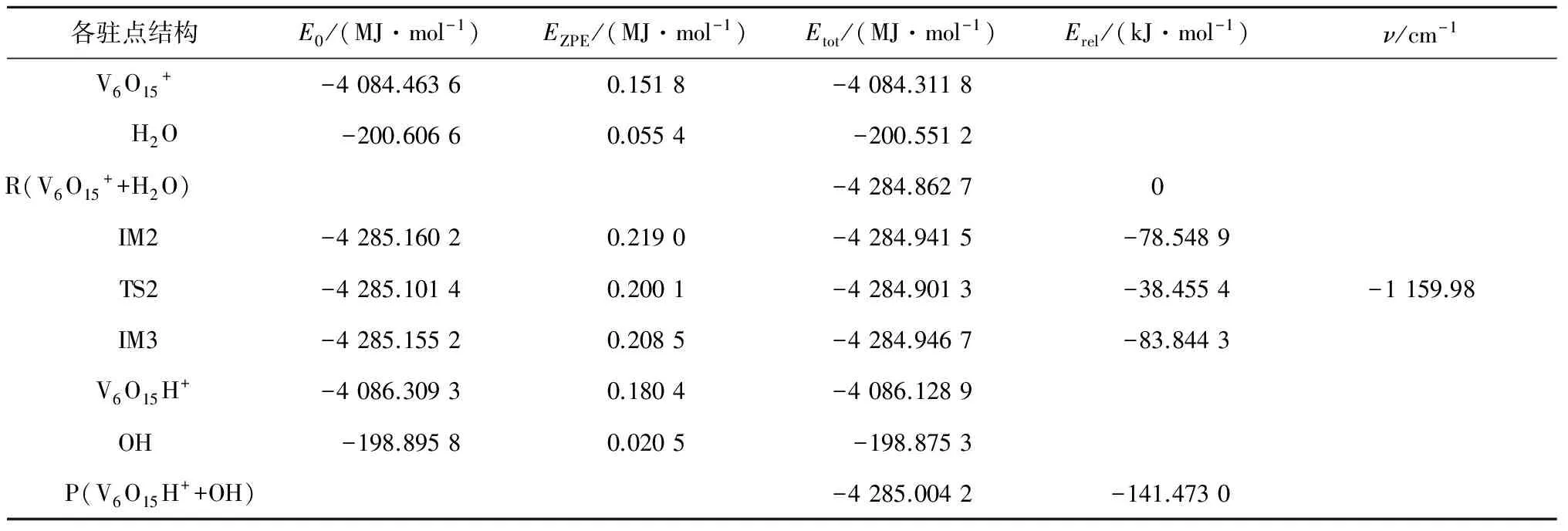
各驻点结构E0/(MJ·mol-1)EZPE/(MJ·mol-1)Etot/(MJ·mol-1)Erel/(kJ·mol-1)ν/cm-1V6O15+-4084.46360.1518-4084.3118H2O-200.60660.0554-200.5512R(V6O15++H2O)-4284.86270IM2-4285.16020.2190-4284.9415-78.5489TS2-4285.10140.2001-4284.9013-38.4554-1159.98IM3-4285.15520.2085-4284.9467-83.8443V6O15H+-4086.30930.1804-4086.1289OH-198.89580.0205-198.8753P(V6O15H++OH)-4285.0042-141.4730
根据对IRC势能变化和反应能垒大小的分析,H2O分子在阳离子团簇吸附形成B酸位时为放热反应,反应能垒较低.因此,相比于中性团簇V6O15,V6O15+更容易吸附H2O生成—OH,反应活性更大.
2.2NH3在V2O5羟基上的吸附

(a) V6O15吸附H2O的反应过程
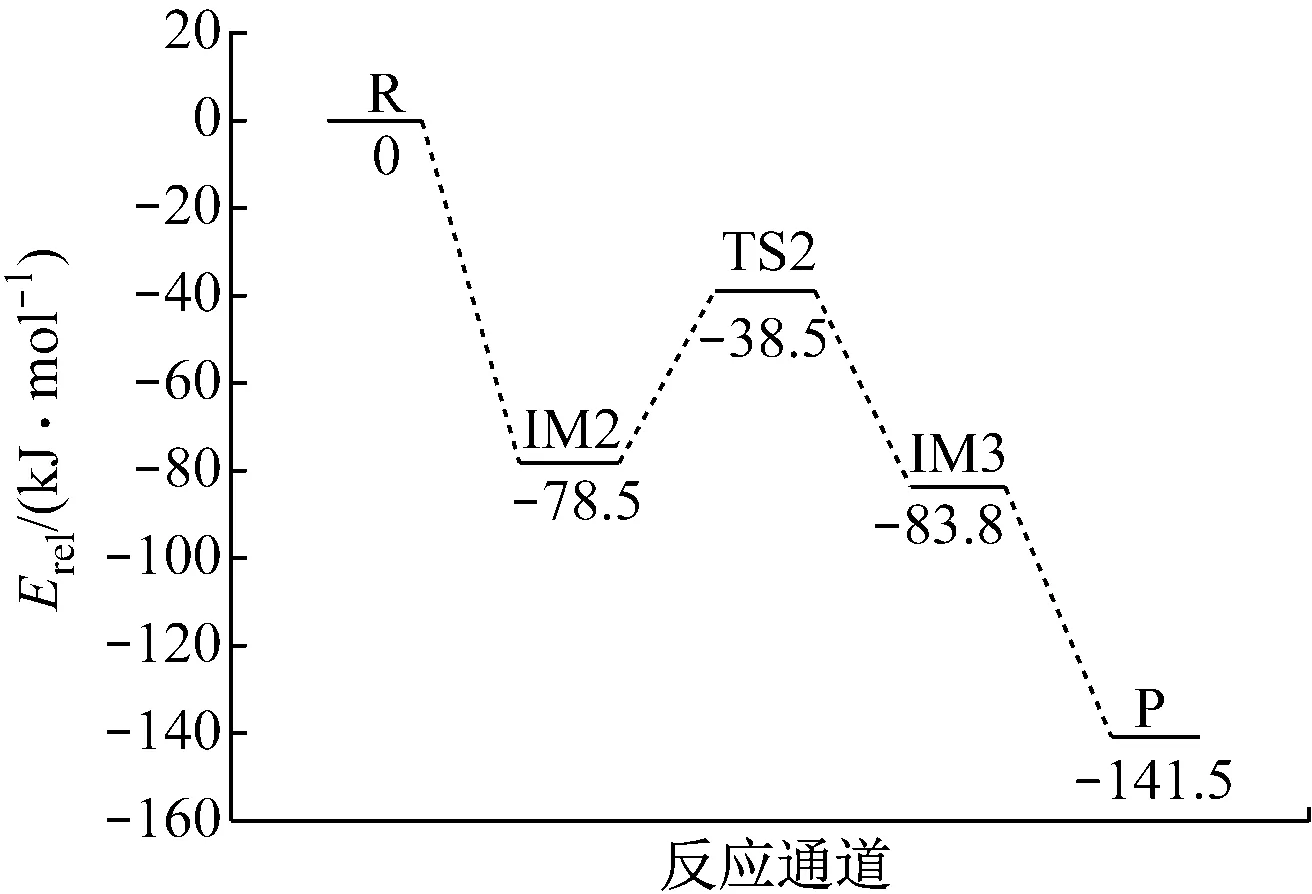
(b) V6O15+吸附H2O的反应过程
NH3在V2O5表面的吸附位主要有Lewis位和B酸位,在SCR脱硝反应过程中E-R机理和L-H机理均可能发生,NO以弱吸附物种形式参与反应的可能性更大.NH3吸附在催化剂酸性位V—OH形成—NH4+,—NH4+与气相中的NO结合生成中间体,分解成N2和H2O.因此,探讨NH3吸附在催化剂表面V—OH形成—NH4+的过程对于研究SCR脱硝反应机理具有重要意义.笔者研究了NH3在不同价态V2O5(V6O15和V6O15+)表面B酸位的吸附情况,如图6所示.表3给出了NH3在V6O15和V6O15+表面B酸位吸附前后原子间键长的变化及吸附能的大小.其中d为键长,Eads为吸附能.
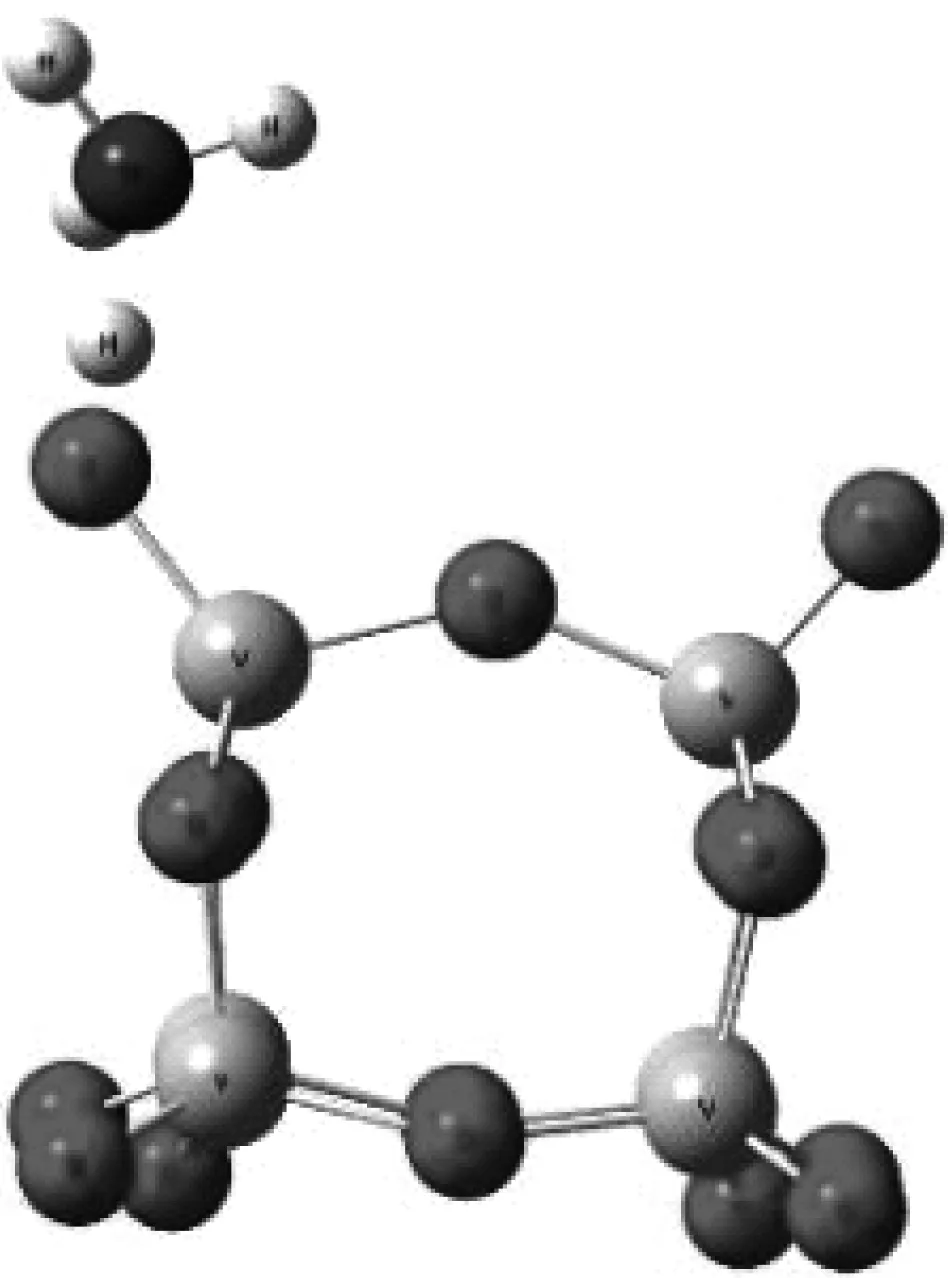
(a) NH3吸附在V6O15表面B酸位的模型
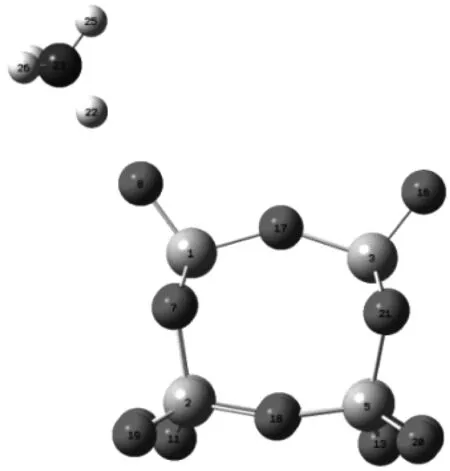
(b) NH3吸附在V6O15+表面B酸位的模型
表3NH3在V2O5团簇B酸位吸附后的键长和吸附能(括号内为吸附前数值)
Tab.3AdsorptionparametersforNH3adsorbedatBrønstedsiteforV2O5cluster(valuesinbracketarethatbeforeadsorption)

吸附构型dH—N/nmdO—H/nmEads/(kJ·mol-1)V6O15—NH30.1470.109(0.097)-89.396V6O15+—NH30.1070.163(0.098)-158.408
由表3可知,NH3在V6O15和V6O15+表面B酸位的吸附能Eads分别为-89.396 kJ/mol和-158.408 kJ/mol,吸附能绝对值均大于发生化学吸附时的能量(30 kJ/mol),即发生了化学吸附,阳离子团簇对氨的吸附能远大于中性模型.从吸附能大小可以看出,SCR脱硝反应中V6O15+比V6O15更容易吸附NH3.V6O15吸附NH3时O(1)—H键长为0.109 nm,O(1)—H与氮原子的距离为0.147 nm.阳离子构型上O(1)—H键被拉长0.066 nm,H与N原子的距离为0.107 nm,与NH3中N—H键长计算值0.102 nm十分接近,说明V6O15+表面B酸位上NH3与羟基更容易作用生成—NH4+.
综上表明,NH3既能吸附在V6O15表面B酸位上生成—NH4+,也能在V6O15+的B酸位上生成—NH4+,后者吸附能更大、更稳定,O(1)H与N原子的距离与NH3中N—H键长更接近.对于多聚合态的V2O5,在SCR脱硝反应中NH3与羟基作用生成的—NH4+有重要作用,因此阳离子团簇V6O15+更容易吸附氨生成—NH4+,活性更大.
3 结 论
(1)V6O15和V6O15+均可吸附H2O生成V—OH,后者整个反应表现为放热,反应能垒更低,说明V6O15+更易与H2O反应生成B酸位.
(2)NH3在V6O15和V6O15+表面B酸位上的吸附均为化学吸附,但是在V6O15+上的吸附能更大,O(1)H与N原子的距离更小,更容易形成可与NO反应的—NH4+.
(3)在SCR脱硝反应中阳离子团簇V6O15+比中性团簇V6O15的活性更大.
[1] 朱礼想. 燃煤电厂氮氧化物(NOx)脱除技术方法探讨和应用[J].价值工程, 2015(12): 64-66.
ZHU Lixiang. Discussion and application of NOxremoval technology in coal-fired power plant[J].ValueEngineering, 2015(12): 64-66.
[2] 高婕, 王禹, 张蓓. 我国大气氮氧化物污染控制对策[J].环境保护科学, 2004, 30(5): 1-3.
GAO Jie, WANG Yu, ZHANG Bei. Countermeasure of atmospheric nitrogen oxide pollution in China[J].EnvironmentalProtectionScience, 2004, 30(5): 1-3.
[3] 谭青, 冯雅晨. 我国烟气脱硝行业现状与前景及SCR脱硝催化剂的研究进展[J].化工进展, 2011, 30(增刊1): 709-713.
TAN Qing, FENG Yachen. Present status and perspective of China's flue gas denitration industry and research progress of SCR catalysts[J].ChemicalIndustryandEngineeringProgress, 2011, 30(S1): 709-713.
[4] 高慧聪. V4+/V5+比值调变与SCR脱硝活性及催化剂性能[D]. 哈尔滨: 哈尔滨工程大学, 2013.
[5] TOPSOE N Y, DUMESIC J A, TOPSOE H. Vanadia-titania catalysts for selective catalytic reduction of nitric-oxide by ammonia: I.I. Studies of active sites and formulation of catalytic cycles[J].JournalofCatalysis, 1995, 151(1): 241-252.
[6] TOPSOE N Y, TOPSOE H, DUMESIC J A. Vanadia/titania catalysts for selective catalytic reduction (SCR) of nitric-oxide by ammonia: I. combined temperature-programmed in-situ FTIR and on-line mass-spectroscopy studies[J].JournalofCatalysis, 1995, 151(1): 226-240.
[7] 杜学森. 钛基SCR脱硝催化剂中毒失活及抗中毒机理的实验和分子模拟研究[D]. 杭州: 浙江大学, 2014.
[8] 姜烨. 钛基SCR催化剂及其钾、铅中毒机理研究[D]. 杭州: 浙江大学, 2010.
[9] 彭吉伟. 选择性催化还原脱硝催化剂反应机理与失活分析[D]. 济南: 山东大学, 2014.
[10] 孙克勤. 选择性催化还原脱硝的理论及实验研究[D]. 南京: 南京理工大学, 2007.
[11] MA Jiabi, ZHAO Yanxia, HE Shenggui, et al. Experimental and theoretical study of the reactions between vanadium oxide cluster cations and water[J].TheJournalofPhysicalChemistryA, 2012, 116(9): 2049-2054.
[12] TYRRELL J, KAR T, BARTOLOTTI L J. A study of the mechanism of the reaction between ozone and the chlorine atom using density functional theory[J].TheJournalofPhysicalChemistryA, 2001, 105(16): 4065-4070.
[13] 高正阳, 吕少昆, 李晋达, 等. 褐煤表面吸附水分子的微观机理[J].动力工程学报, 2016, 36(4): 258-264, 293.
GAO Zhengyang, LÜ Shaokun, LI Jinda, et al. Micro-mechanism of water molecule adsorption on lignite surfaces[J].JournalofChineseSocietyofPowerEngineering, 2016, 36(4): 258-264, 293.
Mechanism Study of H2O and NH3Adsorption by V2O5with Different Valences
GAOZhengyang,LIANGRanran,FANJunhui
(School of Energy, Power and Mechanical Engineering, North China Electric Power University,Baoding 071003, Hebei Province, China)

V2O5; adsorption; quantum chemistry calculation; reaction mechanism
2016-09-18
:2017-01-04
中央高校基本科研业务费专项资金资助项目(10MG19)
高正阳(1972-),男,河北保定人,副教授,博士,主要从事煤中有害痕量元素迁移规律与控制方法方面的研究. 电话(Tel.):18331125675;E-mail:liangran0128@163.com.
1674-7607(2017)09-0738-06
:TK122
:A
:470.10

