血液制品车间的工程设计及案例分析
陈晴
(中石化上海工程有限公司,上海 200120)
血液制品车间的工程设计及案例分析
陈晴
(中石化上海工程有限公司,上海 200120)
针对血液制品生产的工艺特性,根据GMP及其附录(4)血液制品,对血液制品的生产工艺流程、车间布置、相关公用工程及辅助设施的要求进行阐述,并通过设计案例对上述内容加以说明。
GMP;工程设计;血液制品
血液制品属于生物制品,是以健康人血为原料,通过采用生物工程技术或分离纯化技术制备的具有生物活性的一类特殊制品,是宝贵的人源性生物类药品。其产品主要分为三大类人血白蛋白、免疫球蛋白、凝血因子。随着国家于2015年6月放开血制品最高零售价,血制品在2016年进入量价齐升的阶段。在量的方面,血浆供需失衡的现象仍然没有缓解,卫计委数据我国血制品需求12 000t左右,2015年我国采浆量为5 846t,同比增长12 %,2016年有望达到6 600t,增速依然维持在10 %以上,但相比于万吨级的需求,仍显捉襟见肘。
由于单采血浆站由血液制品生产单位设置或者由县级人民政府卫生行政部门设置[1],且单采血浆站只能向一个与其签订质量责任书的血液制品生产单位供应原料血浆,严禁向其他任何单位供应原料血浆[2]。因此一个血液制品厂如果要提升其生产规模,除了需要拥有更多的血浆来源(提升有限),另一个方向就是血液制品品种要多。投浆量越大、开工要越足,单品成本就越低;品种越丰富,血浆综合利用效率就高,单品分摊的成本也越低。根据国外经验,1 000~1 500t的投浆量最具规模效应。
本文针对上述血液制品行业的发展趋势、血液制品生产的工艺特性以及根据GMP及其附录(4)血液制品,对血液制品的生产工艺流程、车间布置、相关公用工程及辅助设施的要求进行阐述。并通过设计案例对上述内容加以说明。
1 工艺流程
血液制品的原料是血浆,血液制品就是从原料血浆中分离纯化出来的多种特殊功能性蛋白。其中含量较多的是人血白蛋白(HA)、球蛋白(IgG),其余为微量蛋白。血液制品的生产工艺流程就是通过各种分离纯化方法将上述蛋白从血浆中提取出来。从上文中我们了解到血液制品车间今后的一个发展趋势就是规模更大,产品种类更丰富,为了更好的规划一个血液制品车间的布置,我们需要了解血液制品各个生产步骤及其特点。
1.1 融浆
血浆在各个血浆站采集并检测合格并放置90 d后,再次对献浆者和其血浆样本进行血清学和病毒学检测后,方可将90 d前采集的原料血浆投入生产[3]。在融浆区内,冷冻的血浆袋经清洗及外表面消毒后,通过破袋机取出血浆袋中冰冻的血浆并将血浆自动投入到融浆罐中融化。投入融浆罐中的血浆溶化后在4±2℃下形成冷沉淀,此时融浆罐中的血浆输送至凝血因子灭活前生产区。
1.2 冷沉淀分离
来自融浆罐的血浆经离心分离后,所得冷沉淀蛋白富含Ⅷ因子、VW因子、XIII因子、纤维连接蛋白和纤维蛋白原,而冷上清中含有的凝血因子经凝胶吸附后去至科恩分离区。 冷沉淀及凝胶洗脱液作为凝血因子类产品的原料去至生产或冷冻保存。
1.3 Cohn分离
多数的血液制品厂在血浆的粗组分(含有纤维蛋白原、白蛋白、球蛋白的糊剂)分离时采用的方法都是Cohn分离法,即低温乙醇沉淀分离法。血浆经冷沉淀分离后得到的冷上清,通过Cohn分离法,不同的粗组分在不同的酒精浓度的溶解不同,使得粗组分能够分步从血浆中析出,并通过离心或压滤的方式将至分离出来。工艺流程见图1。
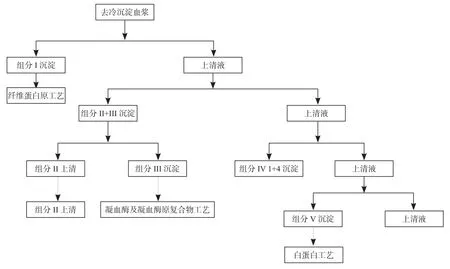
图1 Cohn分离工艺流程Fig.1 Cohn fraction process fl ow
从图1我们可以看出组分I、组分II及组分V分别是纤维蛋白原、球蛋白、白蛋白这3种血液制品的原料。
1.4 凝血因子类产品生产工艺
从上述工艺流程我们可以看出,从冷沉淀分离得到的凝血因子VIII粗组分在进一步分离去除颗粒较大的杂质后进入了S/D灭活处理。根据《药品生产质量管理规范(2010年修订)》[1]附录(4)血液制品第十五条要求:血浆融浆区域、组分分离区域以及病毒灭活后生产区域应当彼此分开,生产设备应当专用,各区域应当有独立的空气净化。凝血因子VIII在病毒灭活前区内完成S/D灭活的第一步(S/D溶剂的添加并恒温搅拌一定时间)后经管道输送至病毒灭活后区S/D罐。灭活后的凝血因子VIII中间品在病毒灭活后区内经纯化、配制、检测合格后,经过除菌过滤,凝血因子VIII原液即可输送至分装区域进行分装。
1.5 免疫球蛋白类产品生产工艺
免疫球蛋白类产品其主要原料为来自Cohn分离组分II沉淀工段获得的球蛋白粗品糊剂,工艺流程见图3。

图2 凝血因子VIII工艺流程Fig.2 Factor VIII process fl ow
在工艺流程(图1、图2)中我们可以看出,从组分II沉淀分离获得的球蛋白粗品糊剂在病毒灭活前区进行了辛酸灭活的第一步(辛酸的添加并恒温搅拌一定时间)后输送至病毒灭活后区辛酸罐。灭活后的免疫球蛋白中间品进一步纯化后经纳滤除病毒后进入最后灭活后区,在最终灭活后的区域内,经配制、检测合格后,经除菌过滤,免疫球蛋白原液即可输送至分装区域进行分装。
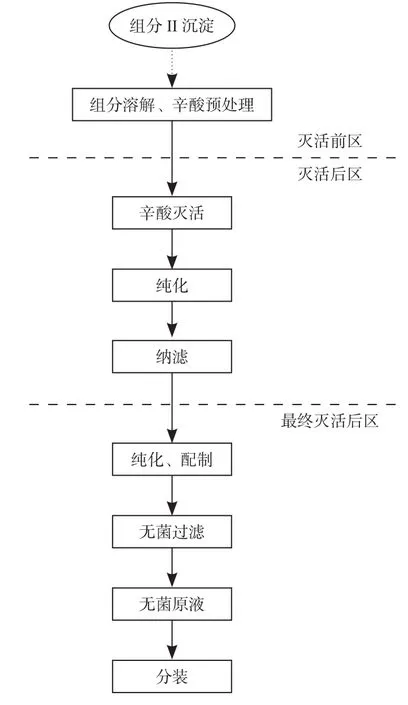
图3 免疫球蛋白工艺流程Fig.3 Immunoglobulin process fl ow
1.6 白蛋白生产工艺
白蛋白类产品其主要原料为来自Cohn分离组分V沉淀工段获得的白蛋白粗品糊剂,工艺流程见图4。
从上述工艺流程我们可以看出,从组分V沉淀分离获得的白蛋白粗品糊剂在病毒灭活前区进行巴氏灭活,灭活后去至灭活后区中间罐暂存。储罐内中间品检测合格后,经除菌过滤,白蛋白原液即可输送至分装区域进行分装。
从上述4个工艺流程来看,血液制品分为各个产品的粗组分分离,病毒灭活前精制和病毒灭活后精制这3个部分。
2 辅助区域
由于血液制品生产的特殊性,为血液制品车间服务的公用工程系统与其他相关辅助设施也与常规制剂有些许不同。下面对血液制品车间所需的一些公用工程和辅助区域的特殊要求及设计要点进行阐述。
王实甫才情富丽,真辞家之雄;但《西厢》首尾五卷,曲二十一套,终始不出一“情”字,亦何怪其意之重复,语之芜类耶!今乃知元人杂剧止是四折,未为无见。

图4 白蛋白工艺流程Fig.4 Albumin process fl ow
2.1 缓冲液配制
无论是Cohn分离工艺,还是各产品的灭活前区工艺和灭活后区工艺中都会使用到不同种类的缓冲液,并且这些缓冲液的使用量也不小。从本文开头写到的血液制品市场的需求量数据中,我们可以看出,将来的血液制品车间的规模都不会太小,且与国外一些血液制品企业年投浆量在1 000t以上的规模相比,国内厂家的年投浆量在300~600t的生产规模还是有很大差距的。针对将来血液制品车间产能增大的一个趋势,一个集中的缓冲液配制区也需在设计中考虑到。根据不同缓冲液的特性、使用量及存放周期,可将生产1天甚至生产1周所需的缓冲液一次性配制后放置在缓冲液储罐内存储待用。
2.2 低温空调系统
在血液制品的生产过程中,为了保证血浆、中间品及半成品中的有效成分的活性,部分中间品需在低温环境中(-30℃)保存,并且部分生产工序需在2~8℃的低温洁净环境下进行。针对部分中间品需在-30℃的冷库中保存,由于-30℃的冷库做成洁净冷库不是很合理,因此需要考虑中间品在进出冷库时需要采取必要的措施来保证中间品不会因进出交接时间过长产生温度回升对产品造成影响。可将进出交接的传递柜设置成对开门的冰柜或者保温性能良好的传递柜,保证中间品在传递交接的过程中仍旧保持原有的温度。而针对有工艺操作的洁净空调系统也需考虑特殊设计,空调系统距离其所服务洁净区距离尽可能的短,避免冷量在过长的风管上流失造成损失,甚至对洁净区的温度控制造成影响。并且空调机组应考虑双风机,避免因机械故障导致对洁净区的低温环境造成影响。
2.3 低温酒精系统及酒精回收
在Cohn分离及部分缓冲液配制中会使用到酒精,在不影响到工艺低温操作的情况下,使用到的酒精的温度需<-10℃。因此需专门为工艺考虑设置一套低温酒精循环分配系统,如图5所示。

图5 低温酒精分配系统Fig.5 Cold ethanol distribution system
2.4 低温冷媒系统
无论是血液制品的生产工艺,还是低温洁净系统,都会用到低温冷媒。常规制剂一般最多仅会用到7~12℃的冷媒。但是在血液制品生产中除常规的 7~12℃系统外,一般会用到 -30~-25℃乙二醇系统,-10~-5℃乙二醇系统和 0~5℃乙二醇系统。不同的冷媒温度满足合适的降温要求。其中需要注意的是,50 %的乙二醇溶液在-30℃下,其黏度43.98 mPa·s,为常温水黏度的40多倍,流动性较差。在工程设计中其他冷媒系统可在其他建筑物如公用工程楼中集中设置,而 -30~-25℃乙二醇系统在条件允许的情况下就近靠近使用点设置,使得乙二醇的输送距离尽可能短。
2.5 注射用水系统
在血液制品生产工艺中,会用到75℃和5℃两种温度的注射用水用于缓冲液的配制、器具清洗、工艺设备的CIP等。对于低温注射用水使用点不多,使用量不大的情况,通常仅考虑设置一套循环温度70℃以上的注射用水循环分配系统,在使用到低温注射用水的用点设计一台换热器用于注射用水的降温,并且该换热器可考虑设置相应的SIP功能以保证注射用水的质量。
针对血液制品车间,由于其低温注射用水点较多,且使用量也较大,上述的注射用水循环分配方案就不大合适了。应针对低温用水点集中设置一套低温注射用水循环分配系统。
2.6 在线清洗
由于生产规模的扩大以及生产品种的增多,血液制品车间内会有许多的工艺设备需要考虑在线清洗,那么在车间中就需要考虑设置多个在线清洗站来满足设备的清洗要求,并且在线清洗站最好能够设置在所需清洗设备的下方,以便工艺设备及管线内的液体排尽。
3 血液制品工艺布置
以下述血液制品车间为例,阐述如何根据上述说到的血液制品的生产工艺以及相关辅助区域的需求,结合市场需求以及GMP要求,合理地进行工艺布局。
3.1 整体布局方案
为顺应市场需求,某大型血液制品车间其年投浆量为1 000t以上,产品包含凝血因子产品、免疫球蛋白类产品以及白蛋白产品,种类比较齐全。根据该血液制品车间的工艺流程及GMP要求,考虑车间为三层设计外加局部地下室。其中,三层包含病毒灭活前生产区域人员总更区、融浆区、Cohn分离区、凝血因子病毒灭活前工艺区、球蛋白/白蛋白病毒灭活前工艺区、集中缓冲配制存储区以及相应的空调机房。二层包含凝血因子病毒灭活后工艺区、球蛋白病毒灭活后工艺区、球蛋白/白蛋白最终病毒灭活后工艺区、洁净公用工程区相应的空调机房及三层工艺用辅机房。一层包含病毒灭活后生产区域人员总更区、凝血因子类非完全灭活产品分装线、球蛋白/白蛋白产品分装线、产品待检暂存区、外包区、相应的空调机房以及二层工艺用辅助机房。地下室包含非洁净公用工程分配站、物料运输通道以及相应的空调机房。各层核心工艺区域的大致布置如图6、图7、图8所示。
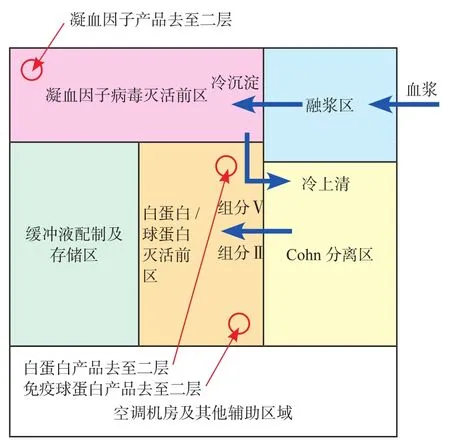
图6 血液制品车间三层布置Fig.6 The 3rd fl oor layout of the plasma plant

图7 血液制品车间二层布置Fig.7 The 2nd fl oor layout of the plasma plant
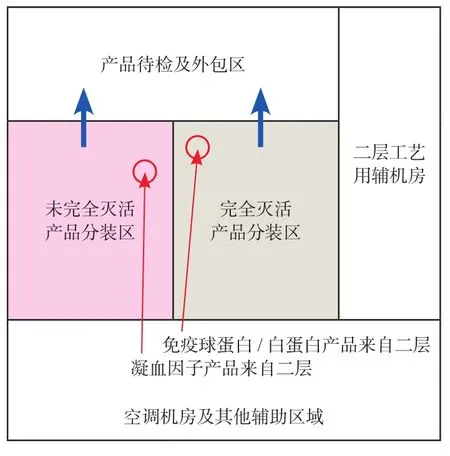
图8 血液制品车间一层布置Fig.8 The 1st fl oor layout of the plasma plant
布置中,不仅将血液制品的病毒灭活前后工艺生产区单独设置,并且将病毒灭活工艺前工艺区与病毒灭活后工艺区分别整合在上下两个楼层里面。首先从区域管理上,2个区域更加地相互独立,人员与物流管理上更加简单。其次,每个产品的病毒灭活前后工艺生产区域上下基本一一对应,未完全病毒灭活后产品分装区与凝血因子病毒灭活后区上下对应,完全病毒灭活后产品分装区与完全病毒灭活后产品原液区上下对应。那么各个前后对应区域互相传输物料的工艺管道可以实现由上往下的重力流输送,且距离可以保障尽可能的短。避免了以往病毒灭活前后区域同一平面布置时需要用泵来传输的情况,导致产品残留在物料管道最低段无法全部进入下段工艺设备,需用缓冲液将管道中残余产品冲洗至下段工艺,导致中间品的有效成分含量较低,不利于后续的续纯工艺,且管道距离过长也会导致管道内会有产品残留过多。这些对于血液制品这类高附加值的产品来说都会造成一定的损失的。另外将一些工艺设备的辅助设置,如夹套循环泵,CIP装置均考虑设置在工艺使用点楼下相对靠近的位置,这也是考虑避免传统平面布置时CIP管道及夹套循环管道最低段需考虑排尽措施。
3.2 病毒灭活前工艺区的布置原则
根据《药品生产质量管理规范(2010年修订)》附录(4)血液制品[4]第十四条要求:原料血浆破袋、合并、分离、提取、分装前的巴氏灭活等工序至少在D 级洁净区内进行。本车间三层病毒灭活前工艺区的洁净区域划分原则见表1。
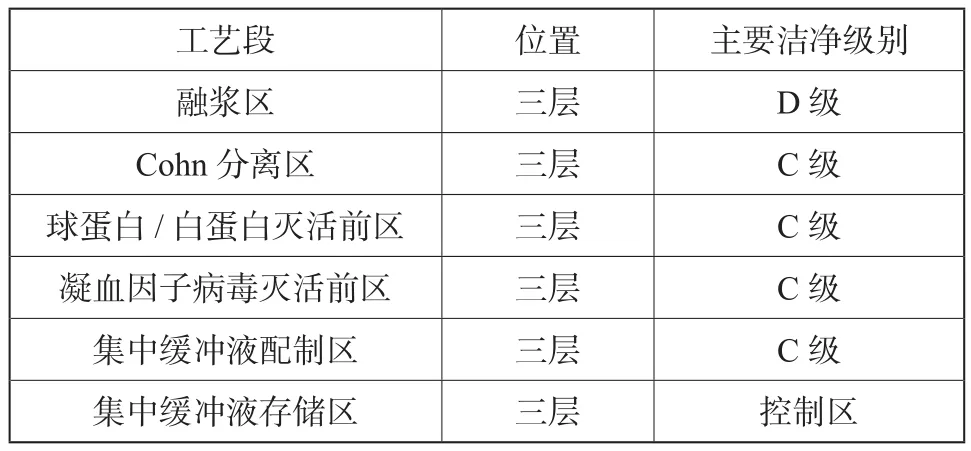
表1 病毒灭活前工艺区洁净级别Tab.1 The grade of the clean room in pre-virus area
病毒灭活前工艺区内考虑到部分工艺操作如压滤机去沉淀,离心机开盖去沉淀等操作为产品暴露操作,在暴露操作时可能会对操作人员或周围环境造成污染,为避免受到污染的人员或器具在退出操作间时对操作间外的洁净区造成污染从而导致交叉污染的风险,考虑这些区域采用人物流单向通道的设计原则,人员、待清洗器具及废弃物经气锁退出工艺操作间进入洁净级别为D级的污物走廊。操作人员经退更出洁净区。待洗器具在D级环境下清洗、灭菌后进入C级器具存放间待用。废弃物及退更换下的洁净服经打包并灭菌柜消毒后退出洁净区。
3.3 病毒灭活后工艺区的布置原则
本车间三层病毒灭活前工艺区的洁净区域划分原则见表2。
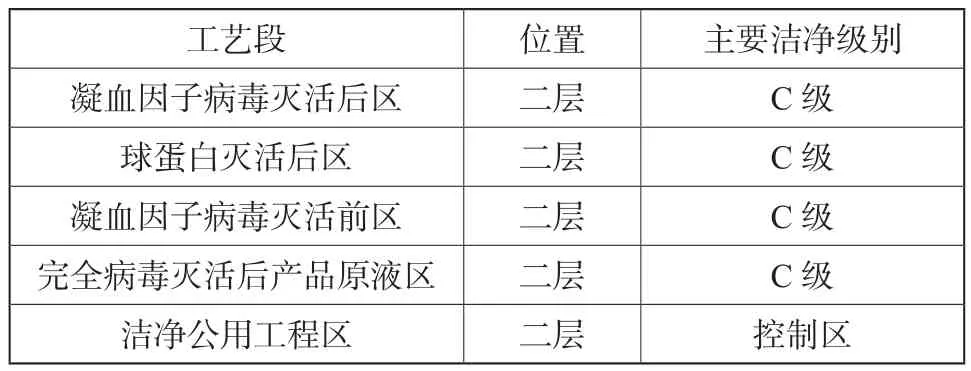
表2 病毒灭活后工艺区洁净级别Tab.2 The grade of the clean room in post-virus area
从工艺流程上来看,血液制品在进入病毒灭活后工艺区域内,所进行的一些工艺操作基本为对蛋白原液的进一步层析纯化、超滤、配制、除菌过滤等。进行该些工艺操作的设备基本都已经模块化了,且都可以有设备厂家成套提供。因此该些区域的工艺布置也可单元化、模块化设计,保证各个区块的衔接流畅,人物流路线的合理即可。对于附加值高的产品,甚至可以采用如今在单抗药物工艺中普遍采用的一次性生物反应器设备,这样也避免了设备清洗所带了的一些繁复操作以及清洗验证所附带的一些成本。
4 结束语
在血液制品车间的设计过程中,首先我们要了解血液制品的生产工艺。知道生产工艺中有哪些特殊地方需要特别考虑。了解一个产品的生产工艺,不仅仅是这个工艺的工艺流程图,产品的产量、所使用到的原辅料的特殊性、所使用到设备的操作方式、血液制品厂家自身的操作习惯都会对设计或多或少有着影响。一个设计合理的血液制品车间并不一定要按照上述所举的例子完全一样,并且上述的例子或许还有更优化的设计方案。我们所要做到的是设计一个符合国家规范要求,满足业主需求,并且安全、经济、合理的血液制品车间。
[1]血液制品管理条例(2016年修订). 中华人民共和国国务院令第208号:第五条[S].
[2]血液制品管理条例(2016年修订). 中华人民共和国国务院令第208号:第十三条[S].
[3]国家食品药品监督管理局办公厅. 实施原料血浆检疫期管理技术指导原则,食药监办[2008]144号[S].
[4]药品生产质量管理规范(2010年修订). 附录(4)血液制品[S].
Engineering Design of Plasma Plant and Case Analysis
Chen Qing
(SINOPEC Shanghai Engineering Co., Ltd, Shanghai 200120)
In this article, with respect to the features in the process of plasma production, and based on GMP and its annex 4 “Plasma products”, the requirements in the process, the layout of facilities in workshop, related utilities and auxiliary facilities for plasma production were stated. And then above mentioned was explained with practical design examples.
GMP; engineering design; plasma products
TQ 460.8
:A
:2095-817X(2017)04-0026-006
2017-05-31
陈晴(1985—),男,工程师,主要从事医药工程设计。

