肾动脉狭窄的诊断和处理中国专家共识
中国医疗保健国际交流促进会血管疾病高血压分会专家共识起草组
指南与共识
肾动脉狭窄的诊断和处理中国专家共识
中国医疗保健国际交流促进会血管疾病高血压分会专家共识起草组
1 前言
随着人口老龄化的来临和血管影像技术的普及,在心血管病临床实践中发现肾动脉狭窄(renal artery stenosis, RAS)越来越多。RAS是引起高血压和(或)肾功能不全的重要原因之一[1],如果未予适当治疗,病情往往进行性加重, 部分肾动脉从狭窄变为闭塞, 肾功能逐渐恶化, 部分患者因此进入终末期肾病[2]。由于RAS病因多样,临床表现缺乏特异性,治疗策略上仍有较大争议,已有的相关指南和共识对RAS的处理意见也不一致[3-7]。因此,迫切需要总结国际上已有的研究结果,结合我国的临床实际,建立新的共识,避免混淆和分歧,推动临床问题的合理解决。
2 流行病学和筛查人群
据估计,RAS的患病率在高血压人群约占1%~3%,而在继发性高血压人群可达20%[8-10]。在老年人群中,RAS相当常见,有一项国外的研究表明,年龄>65岁高血压患者中6.8%合并RAS[11]。Hansen等[12]对77岁以上老年人群心血管健康研究发现,RAS患病率在男性为9.1%,女性为5.5%。基于我国‘十二·五’全国高血压患病率流行病学调查结果,18岁以上人群高血压患病率约为26.6%[13],因此推测我国RAS的患病总数巨大。随着我国人口老龄化的来临,老年高血压人群成为RAS的高发区。但由于RAS的主要临床表现是高血压,部分患者可伴有肾功能损害和高血压并发症,并无特异性,这可能导致有大量RAS患者被漏诊误诊。因此,如何在高血压人群中准确地鉴别出RAS患者并予以适当的治疗十分重要。
虽然我国RAS的患病人数巨大,但仅占高血压人群的小部分,为了提高筛查的费用效益比,首先要确定合适筛查的人群。基于已有的指南和共识推荐[3-7],结合实践经验,本共识建议在高血压人群中筛查RAS的人群如下: (1) 持续高血压达Ⅱ级或以上,伴有明确的冠心病、四肢动脉狭窄、颈动脉狭窄等。(2) 高血压合并持续的轻度低血钾。(3)脐周血管杂音伴有高血压。(4)既往高血压可控制,降压药未变情况下突然血压难以控制。(5)顽固性或恶性高血压。(6)重度高血压患者左心室射血分数正常,但反复出现一过性肺水肿。(7)难以用其他原因解释的肾功能不全或非对称性肾萎缩。(8)服用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)后出现血肌酐明显升高或伴有血压显著下降。当高血压患者具备以上一项或多项临床特点时需要高度警惕RAS,进行专业检查,以明确诊断。
3 诊断
全面准确的诊断是合理治疗的前提和关键。RAS的诊断应该包括:(1)病因诊断。(2)解剖诊断。(3)病理生理诊断。
3.1 RAS病因诊断
RAS的病因诊断往往是选择合理治疗策略的开始,一般分为两类: 动脉粥样硬化性和非动脉粥样硬化性。大多数RAS由动脉粥样硬化所致,多见于有多种心血管危险因素的老年人。非动脉粥样硬化性RAS包括:大动脉炎、纤维肌性发育不良(fibromuscular dysplasia,FMD)、血栓、栓塞、主动脉夹层累及、外伤、先天性肾动脉发育异常、结节性多动脉炎、白塞氏病、放射治疗后疤痕、周围组织肿瘤以及束带压迫等,以大动脉炎和FMD最为常见[14-16]。在西方发达国家病因以动脉粥样硬化为主(约90%),其次为FMD(约10%)[1,17]。我国20世纪80年代的流行病学资料显示病因以大动脉炎为主,其次为FMD及动脉粥样硬化[18],至90年代后期开始,由于血管影像技术的逐步推广普及,接受血管影像检查的老年人数量明显增加,动脉粥样硬化开始上升为首位。阜外医院总结分析了该院1999~2014年连续2 047例住院患者RAS病因[19]:1 668例(81.5%)为粥样硬化性,259例(12.7%)为大动脉炎,86例(4.2%)为FMD,其他34例(1.6%)。年龄≤40岁的患者中大动脉炎占60.5%(319例),其次是FMD(24.8%)。在年龄>40岁的1 728例患者中,首位病因是动脉粥样硬化(94.7%),其次是大动脉炎(3.8%)。大动脉炎和FMD中,女性明显多于男性患者。该研究结果基本反映了我国当前RAS病因构成的特点。因此,在病因诊断中发病年龄和性别应作为重要的诊断要素。
基于国内外对RAS病因的研究和临床实践认识,本共识推荐RAS的三个主要病因诊断标准:
动脉粥样硬化性RAS诊断标准[20-22]:(1)至少具有1 个动脉粥样硬化的危险因素(肥胖、糖尿病、高脂血症、年龄>40 岁、长期吸烟)。(2)至少具有2 项动脉粥样硬化的影像学表现(肾动脉锥形狭窄或闭塞,偏心性狭窄,不规则斑块,钙化,主要累及肾动脉近段及开口;腹部其他血管动脉粥样硬化的表现)。
大动脉炎性RAS诊断标准:2011年中华医学会风湿病学分会曾制定了中国的“大动脉炎诊断及治疗指南”[23],采用1990年美国风湿病学会的诊断标准,日本、印度、加拿大、欧盟等也有各自的大动脉炎诊断标准,但我们在临床实践中发现,照搬这些标准,尤其是1990年的美国标准用于中国患者有一定局限性。我们回顾了近半个世纪上千例的临床病例,建议大动脉炎的诊断采用阜外诊断标准[24]:(1)发病年龄<40岁,女性多见。(2)具有血管受累部位的症状和(或)体征(受累器官供血不足、病变血管狭窄相关体征、急性期可出现受累血管疼痛和炎症指标明显升高)。(3)双功能超声检查(duplex ultrasonogrphy,DUS)、计算机断层血管成像(computed tomography angiography,CTA)、磁共振血管成像(magnetic resonance angiography,MRA)或者肾动脉造影发现特征性的病变影像,这种病变影像综合分型(表1)包括病变部位和病变性质的组合,即任何一型或多型的病变部位加任何一型或多型的病变性质组合,排除动脉粥样硬化、FMD、先天性动脉血管畸形、结缔组织病或其他血管炎等。该标准需要满足以上三项,每项须符合其中至少一条。其诊断敏感性很高,几乎可以包括所有形式的大动脉炎病损,甚至对超急性期无血管腔影像改变的大动脉炎也可作出诊断。如果大动脉炎诊断成立,RAS程度超过50%以上,可诊断为大动脉炎性RAS。

表1 大动脉炎病变综合分型
FMD性RAS诊断标准[25]:FMD系原发性、节段性、非动脉粥样硬化性、非炎症性的动脉壁肌性病变所导致的体循环中动脉狭窄,好发于肾动脉,也可累及颈内动脉、椎动脉、锁骨下动脉、肠系膜动脉、髂动脉等,一般青少年开始出现症状,多见于育龄女性。肾动脉FMD病理上按动脉壁受累的范围分为中膜型、内膜型和全层型。影像上分为多灶型(串珠样)、单灶型(长度<1 cm)和管型(长度>1 cm)。病变大多位于肾动脉主干中远段,可累及一级分支。严重狭窄远端往往可见侧支血管来自肾动脉主干近端或邻近的腰动脉。单灶型往往可见远端连接单发的动脉瘤或瘤样扩张。单纯的肾动脉瘤不属FMD范畴。因此,青少患者(多数<40岁)发现上述肾动脉受累的影像学改变,排除动脉粥样硬化、肾动脉痉挛、大动脉炎或者其他血管炎等,可诊断为肾动脉FMD。
3.2 RAS解剖诊断
RAS解剖诊断在于阐明狭窄的解剖特征,有助于血管重建方法的选择。如果一个肾有2支或以上肾动脉供血,一般称粗大、进入肾门的一支为主肾动脉,其他的为副肾动脉,副肾动脉发生率约为30%。RAS的解剖诊断方法主要有双功能超声、CTA、 MRA和肾动脉造影[3-7,26-28]。
DUS:灰阶超声用于显示肾实质、肾盂及肾血管二维切面,可观察肾脏大小、形状、皮质厚度等,有助于发现肾动脉起始部和主干狭窄,对肾动脉分支及副肾动脉狭窄的诊断价值有限。彩色多普勒超声可检测肾动脉及分支血流信号。一般推荐超声诊断RAS的标准[28,29]:狭窄处收缩期峰值流速>180 cm/s,肾动脉与肾动脉水平处腹主动脉收缩期峰值流速比值≥ 3.5;狭窄后加速时间>0.07s和收缩早期加速度<300 cm/s,肾动脉主干与段动脉阻力指数之差>0.15 。肾段动脉阻力指数可能有预测疗效的价值,介入术前阻力指数大于0.80时,术后肾功能改善及高血压控制可能性低[30]。超声的准确性明显受操作水平、肥胖及腹胀等干扰因素影响。
CTA:高分辨率的CTA(64排或以上)可清晰显示肾动脉主干及一、二级分支管腔、管壁、肾实质及肾动脉支架,也可显示动脉管壁钙化、夹层、斑块及出血,并根据肾实质显影时间及程度对肾功能进行大致评估[31,32]。CTA检查范围应包括膈肌以下、腹股沟以上的腹主动脉及分支,以便于了解连接动脉的解剖特征和是否存在副肾动脉。肾动脉CTA可作为无创评价RAS的金标准,其敏感性、特异性和准确性极高。在以下两方面CTA较有创肾动脉造影或数字血管减影(digital subtraction angiography,DSA)有优势:(1)对偏心性狭窄、开口起源于腹主动脉前后,前后位投照时病变部位难以充分暴露,有创肾动脉造影或DSA可能低估狭窄程度或难以发现狭窄病变。(2)DSA如果采像速度过慢,有可能夸大病变的狭窄程度。CTA尚存不足:(1) X线辐射剂量较大。(2)对钙化和支架内狭窄细节评价有限。(3)对比剂可能产生过敏反应和肾毒性,有对比剂过敏史或肾功异常者慎用,肌酐>3.0 mg/dl时不建议使用。(4)严重心功能不全或主动脉瓣返流患者,流经肾动脉的对比剂很慢或不均匀,可导致CTA结果假阳性。
MRA:MRA包括应用对比剂增强MRA(contrast-enhanced MRA,CE-MRA)及非对比剂增强MRA。MRA无电离辐射,可测量肾动脉血流、肾脏灌注,大致评估肾功能,是较好的RAS无创检查方法[33]。三维CE-MRA的血管成像效果更好,可与DSA相似。但MRA也尚存不足:(1)CE-MRA空间分辨率低,其段动脉及其以下动脉显示不够清楚。(2)严重心功能不全、患肾功能减退或主动脉瓣返流患者,流经肾动脉的血流排空效应差,可导致MRA结果假阳性或夸大狭窄程度。(3)无法观察严重钙化和肾动脉支架再狭窄病变。(4) CE-MRA应用的含钆对比剂有可能导致肾功能不全者肾源性系统性纤维化。近年来有研究报道流入反转恢复序列非对比增强MRA用于临床[34,35],可对肾动脉选择性成像,与CE-MRA相比,无需对比剂,检查过程无需屏气,适用于老年及体弱患者。其不足之处是该成像技术受血流量影响大,成像过程受肠道干扰大,往往夸大RAS程度。
经皮肾动脉造影:经皮肾动脉造影术或DSA是传统诊断肾动脉解剖狭窄的金标准,可多部位投照,能提供病变的分布、狭窄程度、解剖特征等直观的影像,对钙化病变、支架再狭窄、肾内分支动脉狭窄等均有较好的分辨率。该检查有创、放射线剂量较大、对比剂有肾脏毒性,如果仅用于诊断,与CTA比较基本上无优势。因此该方法主要用于计划同期行肾动脉介入的患者。
表2列出了目前临床工作中用于RAS解剖诊断的各种检查方法,并对其优点及不足作了扼要说明,主诊医师可根据患者病情和医院的条件选择合适的检查。

表2 肾动脉狭窄的解剖评估
3.3 RAS病理生理诊断
RAS的病理生理诊断是决定能否进行血管重建的主要依据。RAS一般定义为肾动脉主干及(或)其分支直径减少≥50%,狭窄两端收缩压差≥20 mmHg(1 mmHg=0.133 kPa)或平均压差≥10 mmHg。这种程度的狭窄才可能引起显著的肾血流量下降,并影响肾灌注压和肾小球滤过率(glomerular filtration rate,GFR),激活病理生理进程,临床上主要表现为肾血管性高血压和缺血性肾病[1,36]。评估RAS是否有功能意义是临床关注的重要问题[37],但也是目前临床实践中被常忽视的问题。表3列出了目前临床工作中用于RAS病理生理诊断的各种检查方法,并对其原理、优点及不足作了扼要说明[30,37-40],主诊医师可根据患者病情和医院的条件选择合适的检查。临床上关于缺血性肾病的诊断尚有争议。单侧RAS仅导致患侧缺血性肾病,由于健侧代偿,往往不伴有血肌酐异常升高。双侧RAS或单功能肾RAS伴肾功能下降系传统的缺血性肾病定义。如果血肌酐升高,估测GFR(eGFR)明显下降,但肾功能下降程度与狭窄程度不平衡或不匹配,反映了肾缺血不是肾功能损伤的主要原因,这种情况下缺血性肾病的诊断难以确定。
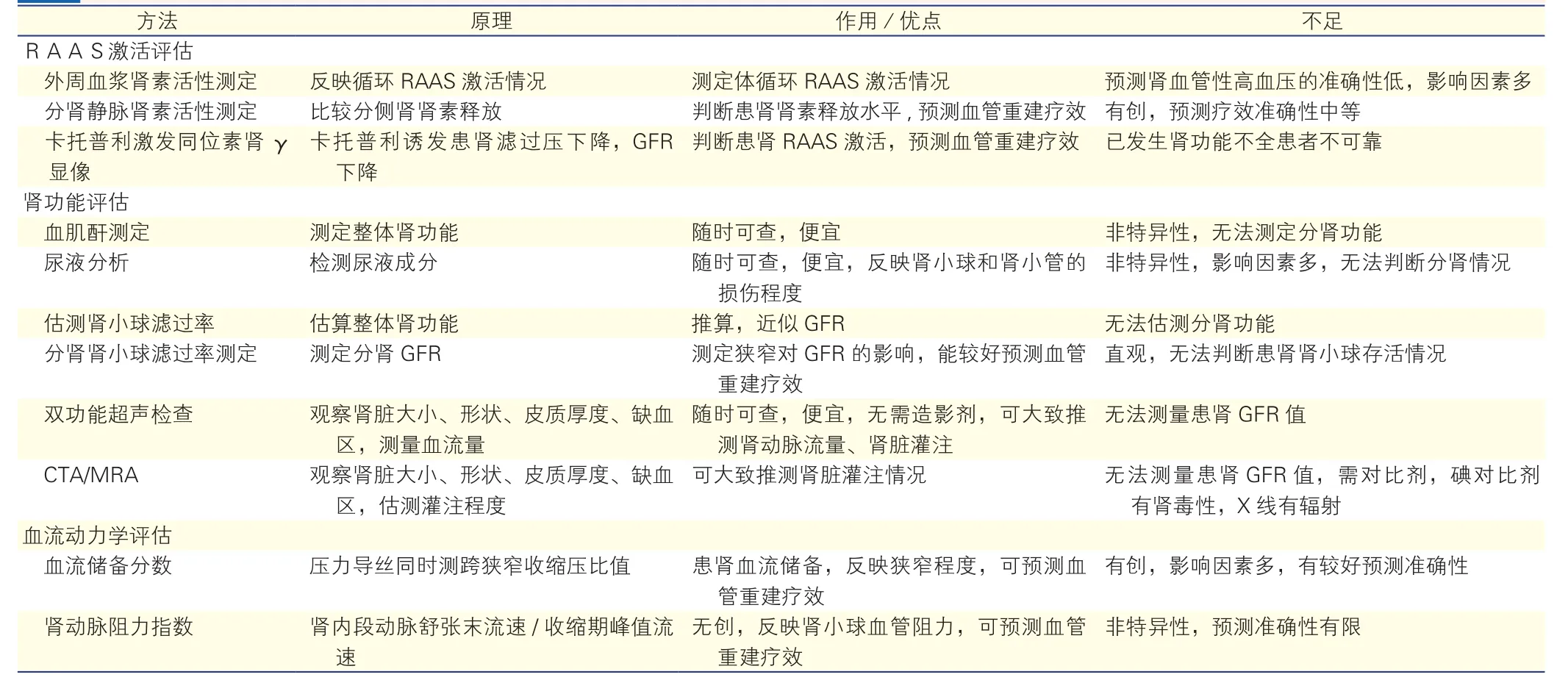
表3 肾动脉狭窄的功能评估
4 治疗
RAS的合理治疗应基于完善的诊断,就其病因、解剖和病理生理进行针对性的治疗,目标是中断病因的作用,显著降低高血压程度及其并发症,防止或延缓进入缺血性肾病,避免演变为终末期肾病。基于国际上已有的推荐和我国的临床实践经验,本共识推荐RAS处理流程如下(图1)。
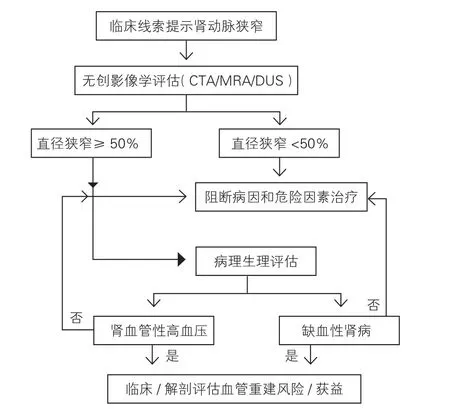
图1 肾动脉狭窄的处理流程
4.1 RAS的药物治疗
4.1.1 不同病因的药物治疗
动脉粥样硬化的病因治疗主要针对危险因素,包括戒烟、降脂、控制血压,抗血小板和降糖治疗等,重点是降脂治疗。依据《中国成人血脂异常防治指南(2016年修订版)》指导降脂治疗[41]。需要指出的是,如果RAS已导致肾血管性高血压和(或)缺血性肾病,应归属为极高危人群,建议强化降脂,目标为低密度脂蛋白胆固醇≤1.80 mmol/L。有研究表明,粥样硬化性RAS支架术后强化降脂较常规降脂对肾功能更有益[42]。其他危险因素的防治应遵循相应的最新国内外指南。
大动脉炎的初始病因至今尚不清楚,治疗主要针对血管壁非特异性炎症。本病在就诊时炎症可处于活动期或非活动期[43]。如果临床上处于非活动期,是否需要予以抗炎治疗有较大争议,因为基于美国国立卫生研究院对大动脉炎非活动期的定义,研究发现部分非活动期患者的病变部位仍有炎症活动,提示症状仍在进展[44],这部分患者抗炎治疗可能有益,但如何确定这部分患者临床上尚无有效办法。如果临床上处于活动期,尤其是在急性期,一般主张积极抗炎治疗[45]。多数指南推荐初始治疗为糖皮质激素[23]。长期泼尼松治疗可能稳定甚至逆转RAS,阻止炎症对肾血管的进一步损伤,有助于改善肾功能,减轻肾血管性高血压[46,47]。泼尼松的剂量及疗程文献推荐并不一致,强烈需要有说服力的循证医学证据。基于阜外医院数十年的观察研究,我们总结以下经验供大家参考:泼尼松初始治疗推荐剂量为0.5 mg/(kg·d),或30 mg/d,若一周内C反应蛋白和血沉降至正常,炎症症状缓解,则继续维持;如果不达标,剂量可增至1 mg/(kg·d)。维持治疗2个月以上,随后每月查C反应蛋白和血沉,如果在正常范围,可以每月减量5 mg,至10~15 mg/d时,维持观察3~6个月。如果C反应蛋白和血沉仍在正常范围,可以考虑每月减量2.5 mg至5~10 mg/d低剂量维持,小部分患者甚至可以停药,但仍有复发可能[24]。研究表明,部分大动脉炎患者需要联合应用免疫抑制剂和糖皮质激素来诱导和维持炎症缓解,常用的免疫抑制剂有甲氨蝶呤、硫唑嘌呤、环磷酰胺等。另外也可以考虑给予新一代免疫抑制麦考酚酯等以缓解病情。近年来,一些新开发的生物制剂也被尝试应用于大动脉炎的抗炎治疗,如肿瘤坏死因子拮抗药英夫利昔单抗、白细胞介素6受体拮抗剂托珠单抗等,其疗效有待证实[48,49]。
4.1.2 肾血管性高血压的药物降压治疗
药物降压是肾高血压性高血压的基础治疗,首先应遵循《2010年中国高血压防治指南》的基本原则[50]。可选用的药物有ACEI/ARB、钙拮抗剂、β受体阻滞剂等。已往的研究表明,钙拮抗剂是治疗肾血管性高血压的安全有效药物。ACEI/ARB是最有针对性的降压药物,对大部分患者推荐使用[51-53],但这类药物有可能使单功能肾或双侧RAS患者的肾功能恶化,因此ACEI/ARB可用于单侧RAS,而单功能肾或双侧RAS慎用,开始使用时需要密切监测尿量和肾功能,如服药后尿量锐减或血清肌酐快速上升超过0.5 mg/dl,表明已发生急性肾功能不全,应立刻减量或停药,一般肾功能均能恢复;β受体阻滞剂能抑制肾素释放,有一定的降压作用,可以选用;利尿剂激活肾素释放,一般不主张用于肾血管性高血压,但患者如合并原发性高血压、肺水肿或心力衰竭,仍可选用。
4.2 RAS的血管重建治疗
RAS血管重建的主要目标:改善高血压,预防高血压所致并发症,改善肾功能及治疗RAS严重的病理生理效应,包括慢性心力衰竭、反复发作的急性肺水肿和心绞痛,甚至有可能免于透析。次要目标:减少降压药,慢性心力衰竭或心肌病患者可更安全使用血管紧张素转换酶抑制剂[1,36,54]。目前尚无一致意见RAS到何种程度必须进行血管重建,推荐血管重建最小阈值为直径狭窄50%。但对于肾动脉直径狭窄50%~70%的患者,要有明确的血流动力学依据,一般以跨病变收缩压差>20 mmHg或平均压差>10 mmHg为准。直径狭窄>70%是比较有力的解剖学指征。高血压持续Ⅱ~Ⅲ级(未服降压药)系必须具备的临床基本指征,除非患者合并严重左心功能不全。如能获得进一步证据表明狭窄与高血压和肾功能损害有因果关系(表3),患侧具备:(1)患肾GFR或血流量较健侧下降25%以上。(2)患侧肾静脉肾素较健侧升高2倍以上。(3)卡托普利激发的同位素肾图阳性。(4)肾萎缩等其中1个或以上证据,则适应证更明确。血管重建临床指征包括: 严重高血压(持续高血压Ⅱ~Ⅲ级)、恶性高血压、难治性高血压、高血压恶化或药物治疗不耐受;单功能肾或双侧RAS合并肾功能不全;单功能肾或双侧RAS肾功能恶化;一过性肺水肿;不稳定性心绞痛。以下情况如果具备1项或以上,提示肾脏功能严重受损,往往不可逆,肾动脉血管重建难以改善患肾功能[36-40],应视为相对禁忌证:(1)患肾长径≤7 cm。(2)尿液分析发现大量蛋白(≥2+)。(3)血肌酐≥3.0 mg/dl。(4)患肾GFR≤10 ml/(min·1.73m2)。(5)肾内动脉阻力指数≥0.8。(6)超声、CTA或MRA显示肾实质有大片无灌注区。目前尚无特异的检查能确定缺血的肾小球处于休眠或坏死状态,也不能把患肾功能严重受损等同于肾素-血管紧张素-醛固酮系统激活停止。因此,即使有肾功能受损的明确依据,如果有充分的证据表明患肾动脉严重狭窄导致肾素-血管紧张素-醛固酮系统激活,对于解剖条件适合的病变,腔内治疗并非禁忌,仍能改善肾血管性高血压[1,2]。总之,肾动脉血管重建策略的制定应基于患者的个体特征,系统评估病因、解剖和病理生理,包括预期寿命、合并症、血压控制难易及患肾功能是否可逆等,预估风险/获益,从而选择相应的治疗策略。
目前一般推荐经皮介入治疗作为肾动脉血管重建的首选方法,血管外科直视手术仅适用于某些特殊情况[3-7]:病变不适合行介入治疗,病变肾动脉附近腹主动脉需要外科重建,介入治疗失败的补救措施,对比剂严重过敏,服用抗血小板药物有禁忌等。外科肾血管重建直视手术的方法很多,在治疗时应结合具体病情选用最适宜的手术方法,包括:(1)动脉内膜剥脱术。(2)腹主动脉-肾动脉旁路移植术。(3)脾-肾动脉或肝-肾动脉吻合术。(4)RAS段切除术加移植物置换术。(5)自体肾移植术。RAS患肾切除术目前已很少实施,其指征一般要满足以下四点:(1)患肾动脉病变广泛而严重,尤其远段分支受累,无法实施血管重建。(2)对侧肾无明显病变,肾功能良好或基本可代偿。(3)患肾无滤过功能[GFR≤10 ml/(min·1.73m2)],但分泌大量肾素,导致严重高血压。(4)患者无法耐受降压药物、降压疗效不佳或准备妊娠不宜服用降压药。
4.3 RAS血管重建需要根据不同病因选择不同的策略
4.3.1 粥样硬化性RAS的介入治疗
对于粥样硬化性RAS患者,尽管已有ASTRAL[55]和CORAL[51]等较大样本的随机临床研究比较了介入治疗与单纯药物治疗的结果差异并无统计学意义,但目前对于肾动脉介入治疗能否保护肾功能、有效降低血压和减少心血管事件等方面仍存较大争议。最新的系统性回顾分析结果显示,这些研究结果的证据强度低,主要研究对象集中在RAS并不严重的人群,这些随机临床研究存在诸多缺陷,如较大比例患者的RAS没有达到显著血流动力学意义,也无适当的功能意义评估,研究者还有意剔除那些明确能从肾动脉介入中获益的患者,部分术者操作经验不足等,这些混杂因素对研究结果影响较大,需要更有说服力的研究予以澄清[56]。
由于粥样硬化性RAS者往往在长期原发性高血压基础上合并动脉粥样硬化, 随后逐步发展为RAS,而肾动脉血管重建只解决了肾血管性高血压,因此治愈高血压少见,主要疗效为高血压减轻或易于控制。部分患者甚至无效,这可能是长期高血压和肾缺血已经导致了肾实质损害,演变为肾实质性高血压。目前认为,以控制高血压为目的的肾动脉支架术,入选患者需满足二个关键点:(1)RAS≥70%,且能证明狭窄与血压升高存在因果关系。(2)顽固性高血压或不用降压药高血压达Ⅲ级水平[57]。已发表的许多文献表明,对于粥样硬化性RAS人群,如以肾功能变化作为主要终点事件进行药物治疗或血管重建的随机临床研究,其结果往往是中性的[56]。一般认为,如果要取得有益结果,需要具备以下二个条件[57-61]:(1)患侧肾小球大部分存活(≥50%),且无不可逆损伤,尤其是双侧或单功能肾的肾动脉严重狭窄(≥70%)所致的缺血性肾病。(2)从事肾动脉介入的治疗团队富有经验,能有效防范介入对肾脏的直接损害。
介入治疗方法包括经皮球囊成形术(percutaneous transluminal angioplasty,PTA)和支架置入术。指南建议粥样硬化性RAS要获得满意的血管重建和减少再狭窄率应常规使用支架置入[3-7],但对于小部分不适合支架置入的病变仍可采用球囊扩张术治疗。药物涂层支架可能有助于降低再狭窄的发生率[62],但尚未见大样本的随机临床研究报道。有研究显示,肾动脉支架术后约10%~20%的患者会出现支架内再狭窄[63],对于肾动脉支架内再狭窄,如果单纯球囊扩张效果欠佳,可考虑采用药物涂层支架、药物涂层球囊和经皮短距离放射治疗等[64-67]。
4.3.2 非粥样硬化性RAS的介入治疗
非粥样硬化性RAS患者(主要指FMD及大动脉炎),大多数发病年龄在40岁前,合并原发性高血压少见,如果肾动脉直径狭窄≥50%,伴有持续高血压Ⅱ级或以上,依赖降压药,则单纯肾血管性高血压的诊断基本确立,应该接受肾动脉血管重建治疗,以免长期高血压的不良影响。一般首选PTA,不提倡使用血管内支架,有二个原因:(1)单纯PTA治疗FMD及大动脉炎的疗效较好,再狭窄率明显低于动脉粥样硬化性病变。(2)此类病变放置支架的生物学效果及远期结果并不清楚。
FMD患者肾动脉主干或主要分支的局限狭窄,多数研究报告PTA技术成功率超过90%,早期临床成功率较高[68,69]。对于FMD累及肾动脉分支和(或)合并动脉瘤仍倡导重建分支血管的外科方法,但已有研究报道FMD累及肾动脉一级分支患者行PTA成功,提示该方法可作为一种替代治疗。PTA后如果发生严重夹层或二次再狭窄,建议支架置入;PTA如不能充分扩张病变,不提倡用切割球囊,以免血管破裂或假性动脉瘤形成,推荐外科手术处理[25]。
如病因系大动脉炎所致,在炎症活动期不宜实施介入手术,一般要用糖皮质激素治疗使血沉降至正常范围后2个月方可考虑行PTA。非活动病变或炎症已控制后,推荐首选PTA治疗,技术成功率约70%~90%,高血压治愈或改善率也可达70%~90%[70-73]。PTA未成功患者包括球囊扩张后病变即刻发生弹性回缩或夹层,病变坚硬难以充分扩张,导致影像结果不满意。在这类患者中,选择性支架置入术或加用切割球囊扩张可能是备选的治疗方式之一。最近有较大样本的研究比较了选择性支架置入术与单纯球囊扩张术的中远期临床结果[74],显示单纯球囊扩张与选择性支架置入术相比,在血压控制、肾功能改善方面差异无统计学意义,但选择性支架置入术组2年初次通畅率更低,闭塞率及再次介入率更高。该研究也显示支架置入、残存狭窄率≥50%、女性及及炎症活动期与介入后再狭窄显著相关。因此,大动脉炎所致RAS选择性支架置入应谨慎实施,严格把握手术指征。药物涂层支架或生物可降解支架能否为选择性支架置入术带来更好的结果尚需研究[75]。一些小样本研究报道外科手术也是大动脉炎所致RAS患者可行的治疗措施[76-78]。
4.3.3 特殊情况的RAS血管重建治疗
副肾动脉狭窄的血管重建治疗:副肾动脉一般供血不到该侧肾脏的1/3,理论上严重狭窄可引起所供肾区的局部血流量减少,肾组织缺血,促进局部肾素合成和释放,引起肾血管性高血压,但由于范围的限制几乎不可能显著影响肾功能。因此,对直径<4 mm,供血范围较小的副肾动脉狭窄,并不建议行血管重建治疗[79]。虽然也有副肾动脉狭窄介入治疗成功的个案或小样本报道[80],但目前尚未见关于副肾动脉狭窄血管重建治疗的系统性研究证明其临床价值,因此临床上是否对副肾动脉狭窄进行介入治疗需要基于病变血管的直径、供血范围、病理生理意义综合评估。
移植肾RAS的血管重建治疗: 移植肾RAS多发生于吻合口,相当于单功能肾RAS。如果狭窄有功能意义,且排除移植肾排异相关的肾功能减退和环孢霉素A毒性相关的高血压,建议行介入治疗,首选PTA,如果影像结果不满意或失败,可直接置入支架[81,82]。
RAS并存冠心病或颈动脉狭窄的处理:RAS并存冠心病或颈动脉狭窄在老年患者中并不少见,如何选择术式及干预次序应根据患者靶病变引起的临床症状、严重程度、手术风险等因素综合评估。一般倾向于高危和靶病变复杂的患者分期处理,反之可同期处理。干预次序可能有潜在风险,需要提前防范。RAS合并颈动脉狭窄患者,如果先处理颈动脉狭窄,由于RAS导致的高血压未解除而可能诱发脑高灌注综合征;如果先处理RAS,由于血压下降可能导致脑供血不足,诱发缺血性脑卒中。RAS合并冠心病患者,如果先处理冠状动脉病变,由于RAS未解除可能诱发心力衰竭、肾功能不全等;如先处理RAS,由于血压过渡下降可能诱发心绞痛和心肌梗死。另外,当不同靶病变涉及外科手术和介入手术杂交时,需要考虑处理的顺序,避免介入手术后抗血小板治疗带来的外科手术出血风险或手术被迫延迟。
4.3.4 RAS介入治疗围术期处理
RAS介入治疗围术期处理与其他动脉类似的部分在此不再复述,主要阐述其特殊方面。术前选择性检查包括:尿蛋白,血肌酐,卧、立位血浆肾素-血管紧张素-醛固酮,C反应蛋白,血沉,24 h动态血压,肾脏/肾动脉超声/CTA或MRA,卡托普利肾显像,分侧肾小球滤过率。
在严格把握肾动脉介入的适应证后,防范介入对肾脏的直接损害,提高手术成功率,是保证肾动脉介入术疗效的核心。肾动脉介入术后急性肾功能损害的主要原因有:(1)介入操作过程中发生的肾动脉栓塞及其他损伤。(2)对比剂诱发的肾毒性。(3)血容量不足导致的肾灌注不足。这些潜在的并发症,尤其对已存在肾功能不全的患者明显有害。通过严格规范肾动脉介入术者的准入制度,提高团队的围手术期治疗经验,有可能克服这些不利因素,提高介入的疗效和安全性。
RAS介入围手术期也要注意并发症的识别与处理。肾动脉介入术是一个相对安全的手术,与操作相关的肾动脉并发症少见,往往与术者经验有关,主要严重并发症有肾动脉破裂、穿孔、夹层、闭塞、胆固醇栓塞、急性肾功能衰竭等,发生率一般低于3%[3,7]。并发症主要包括:(1)肾动脉穿孔:主要为导丝操作不当所致。造影可见肾实质内造影剂潴留,肾囊大量积液。如破口小、出血程度轻,可用球囊反复堵塞肾动脉几次(3~5 min/次)并注射鱼精蛋白中和肝素,往往有效。如此方法无效,可行超选择性动脉栓塞术。 (2)肾动脉栓塞:介入操作可能导致动脉斑块的破裂、脱落,如果斑块、胆固醇结晶栓塞较多分支,可引起肾功能损伤。表现为介入术后,肾内血流明显减少,肾功能受损,目前尚无明确的诊断方法。临床上患者多仅为轻、中度肾功能受损,而严重者发生急性肾功能衰竭则需依赖透析疗法;而目前远端保护装置在肾动脉介入中预防栓塞的地位仍不明确。(3)肾动脉主干夹层或闭塞:往往由于操作中球囊或支架直径过大或扩张加压过高所致,如发现操作部位有撕裂的内膜片,并明显限制血流,需留置导丝在远端真腔内予以支架治疗,使内膜贴壁,恢复血流。(4)肾动脉破裂:往往由于操作中球囊或支架直径过大或扩张加压过高所致,如发现操作部位有造影剂大量外漏,患者腹痛明显,要立刻球囊压迫止血,反复几次(3~5 min/次)并注射鱼精蛋白中和肝素。如无效,要尽快用覆膜支架堵住破口。无法用覆膜支架处理的破口需尽快由血管外科直视手术。(5)预防对比剂肾病:有研究表明,虽然肾动脉介入与其他周围动脉介入比较对比剂肾病的风险并未显著增加[83],但直接向肾动脉注入对比剂,尤其是有肾功能异常的患者,有增加对比剂肾病的风险,需要严密防范。首先要根据术前肾功能,尽可能少用对比剂,至少不超过剂量上限,推荐最大对比剂用量=5 ml×体质量(kg)/基础血清肌酐(mg/d1);其次水化法是公认有效的预防措施[84],在心功能允许的情况下,术前6~12 h开始静脉补液(生理盐水1~2 ml/min),保证充足的血容量,术后4 h保证尿量在1 000 ml以上,常规术后继续生理盐水水化12~24 h。要监测尿量、尿常规、肾功能24~48 h。有研究表明冠状动脉介入患者术前大剂量使用他汀类药物可能有肾保护作用[85,86],但用于肾动脉介入患者是否有类似结果尚不清楚。
围术期药物方面需注意抗血小板治疗,由于该方面尚缺乏针对肾动脉介入的临床研究,因此目前临床上一般是基于冠状动脉介入治疗的经验和RAS病因实施抗血小板治疗[7]。动脉粥样硬化性RAS支架术患者常规予以双联抗血小板治疗(阿司匹林100 mg/d+氯吡格雷75 mg/d)。双联抗血小板治疗术前3天开始,大部分患者选用裸支架,维持至术后 3个月,随后一种抗血小板药物长期维持;少部分患者选用药物支架,需适当延长维持时间,一般建议半年以上。非动脉粥样硬化性RAS的介入治疗以PTA为主,建议一般情况下选用一种抗血小板药物即可,维持3个月以上。如果这类患者置入支架,需要规范的双联抗血小板治疗。部分患者术后血压仍控制不良,或大动脉炎患者使用泼尼松20 mg/d以上,双联抗血小板有增加出血的风险,要谨慎使用。
4.4 肾血管重建疗效判断
(1)解剖成功:PTA后病变肾动脉直径残余狭窄<50%,或支架术后残余狭窄<30%。(2)血流动力学成功:狭窄前后跨病变压差收缩压<20 mmHg, 平均压<10 mmHg。(3)临床成功(疗效至少维持6个月后才能作出临床评估):①血压标准:治愈:不用降压药,血压<140 /90 mmHg;改善:需保持手术前的降压药,或减少降压药种类和剂量后,血压较术前下降>10%;无效:血压无变化或下降但未达到上述目标;②肾功能标准:GFR提高、稳定或下降速度明显减慢,其他参考指标包括血清肌酐、胱抑素、24 h尿蛋白改善;③心血管结局标准:心脑血管事件风险下降。
4.5 重建血管通畅程度的判断
(1)解剖再狭窄:选择性动脉造影、CTA、MRA或超声影像判断介入部位狭窄>50%,如狭窄≤50%则为通畅。(2)临床再狭窄:血管重建术后高血压和或肾功能变为正常或改善,但逐渐回到术前水平或更高,影像检查发现介入部位再狭窄>50%。
5 RAS血管重建术后随访
(1)根据患者的病情,通常1~2个月随诊1次,观测血压、肾功能的变化。(2) 每6~12个月行肾脏与肾动脉B超检查1次,了解肾脏的大小及血流通畅情况,必要时同位素检查了解分肾功能。(3)如术后血压先明显下降,随访中又回升至术前水平,则提示再狭窄,需血管造影复查。(4) 大动脉炎患者要根据血沉和C反应蛋白水平,在维持其正常的情况下逐步减少免疫抑制剂用量,直至停药。
学术顾问:刘力生(中国医学科学院阜外医院),高润霖(中国医学科学院阜外医院),王继光(上海市高血压研究所),李南方(新疆维吾尔自治区人民医院)、陈鲁原(广东省人民医院),张源明(新疆医科大学第一附属医院),陶军(广州中山医科大学第一附属医院),王焱(厦门市心血管病医院),蔡琳(成都市第三人民医院)
专家共识起草组成员(姓名按拼音排序):陈晓平(四川大学华西医院),程康(西安市第三医院),董徽(中国医学科学院阜外医院),宫海滨(徐州市心血管病研究所),贾楠(中山大学附属第八医院),蒋文(新疆维吾尔自治区人民医院),蒋雄京(中国医学科学院阜外医院),李萍(南昌大学第二附属医院),刘新文(浙江医院),卢统庆(牡丹江医学院附属红旗医院),卢新政(江苏省人民医院)、罗建方(广东省人民医院),罗素新(重庆医科大学附属第一医院),彭猛(郑州大学第一附属医院),沈松鹤(河南大学第一附属医院),唐礼江(浙江医院),田红燕(西安交通大学第一附属医院),王浩(河南省人民医院),王珊珊(河南省人民医院),许建忠(上海交通大学附属瑞金医院),杨滨(山西省心血管病医院),余静(兰州大学第二医院),张英(大连医科大学附属第一医院),郑泽琪(南昌大学第一附属医院),邹玉宝(中国医学科学院阜外医院)
执笔:蒋雄京,邹玉宝
[1] Safian RD, Textor SC. Renal artery stenosis. N Engl J Med, 2001, 344: 431-442.
[2] Caps MT, Perissinotto C, Zierler RE, et al. Prospective study of atherosclerotic disease progression in the renal artery. Circulation, 1998, 98: 2866-2872.
[3] Martin LG, Rundback JH, Wallace MJ, et al. Quality improvement guidelines for angiography, angioplasty, and stent placement for the diagnosis and treatment of renal artery stenosis in adults. J Vasc Interv Radiol, 2010, 21: 421-430.
[4] European Stroke Organisation, Tendera M, Aboyans V, et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the task force on the diagnosis and treatment of peripheral artery diseases of the European Society of Cardiology (ESC). Eur Heart J, 2011, 32: 2851-2906.
[5] Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/ AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Circulation, 2013, 127: 1425-1443.
[6] Parikh SA, Shishehbor MH, Gray BH, et al. SCAI expert consensus statement for renal artery stenting appropriate use. Catheter Cardiovasc Interv, 2014, 84: 1163-1171.
[7] 动脉粥样硬化性肾动脉狭窄诊治中国专家建议(2010)写作组. 动脉粥样硬化性肾动脉狭窄诊治中国专家建议(2010). 中华老年医学杂志, 2010, 29: 1-15.
[8] de Mast Q, Beutler JJ. The prevalence of atherosclerotic renal artery stenosis in risk groups: a systematic literature review. J Hypertens, 2009, 27: 1333-1340.
[9] Börgel J, Springer S, Ghafoor J, et al. Unrecognized secondary causes of hypertension in patients with hypertensive urgency/emergency: prevalence and co-prevalence. Clin Res Cardiol, 2010, 99: 499-506.
[10] Piecha G, Wiecek A, Januszewicz A. Epidemiology and optimal management in patients with renal artery stenosis. J Nephrol, 2012, 25: 872-878.
[11] Kwon SH, Lerman LO. Atherosclerotic renal artery stenosis: current status. Adv Chronic Kidney Dis, 2015, 22: 224-231.
[12] Hansen KJ, Edwards MS, Craven TE, et al. Prevalence of renovascular disease in the elderly: a population-based study. J Vasc Surg, 2002, 36: 443-451.
[13] Gao Y, Chen G, Tian H, et al. Prevalence of hypertension in china: a cross-sectional study. PLoS One, 2013, 8: e65938.
[14] Bavishi C, de Leeuw PW, Messerli FH. Atherosclerotic renal artery stenosis and hypertension: pragmatism, pitfalls, and perspectives. Am J Med, 2016, 129: 635. e5-635. e14.
[15] Safley DM, Chhatriwalla AK. The kidney connection: holy grail or wild goose chase?. JAMA Intern Med, 2014, 174: 1851-1852.
[16] de Leeuw PW, Postma CT, Kroon AA. Treatment of atherosclerotic renal artery stenosis: time for a new approach. JAMA, 2013, 309: 663-664.
[17] Tynes WV. Unusual renovascular disorders. Urol Clin North Am, 1984, 11: 529-542.
[18] 郑德裕. 肾血管性高血压//刘力生主编. 高血压. 北京: 人民卫生出版社, 2001: 622-630.
[19] Peng M, Jiang XJ, Dong H, et al. Etiology of renal artery stenosis in 2047 patients: a single-center retrospective analysis during a 15-year period in China. J Hum Hypertens, 2016, 30: 124-128.
[20] 李彬, 彭猛, 蒋雄京, 等. 支架术联合规范药物治疗对粥样硬化性肾动脉狭窄患者的疗效. 中国循环杂志, 2016, 31: 122-126.
[21] Chrysochou C, Kalra PA. Epidemiology and natural history of atherosclerotic renovascular disease. Prog Cardiovasc Dis, 2009, 52: 184-195.
[22] Bookstein JJ, Abrams HL, Buenger RE, et al. Radiologic aspects of renovascular hypertension. JAMA, 1972, 220: 1218-1224.
[23] 中华医学会风湿病学分会. 大动脉炎诊断及治疗指南. 中华风湿病学杂志, 2011, 15: 119-120.
[24] 邹玉宝, 宋雷, 蒋雄京. 大动脉炎诊断标准研究进展. 中国循环杂志, 2017, 32: 90-92.
[25] Persu A, Giavarini A, Touzé E, et al. European consensus on the diagnosis and management of fibromuscular dysplasia. J Hypertens, 2014, 32: 1367-1378.
[26] Tarzamni MK, Nezami N, Rashid RJ, et al. Anatomical differences in the right and left renal arterial patterns. Folia Morphol (Warsz), 2008, 67: 104-110.
[27] Saba L, Sanfilippo R, Montisci R, et al. Evaluation using multidetector-row computed tomographic angiography. Acta Radiol, 2008, 49: 278-284.
[28] Rundback JH, Sacks D, Kent KC, et al. Guidelines for the reporting of renal artery revascularization in clinical trials. J Vasc Interv Radiol, 2002, 13: 959-974.
[29] Olin JW, Piedmonte MR, Young JR, et al. The utility of duplex ultrasound scanning of the renal arteries for diagnosing significant renal artery stenosis. Ann Intern Med, 1995, 122: 833-838.
[30] Radermacher J, Chavan J, Bleck J, et al. Use of Doppler ultrasonography to predict the outcome of therapy for renal artery stenosis. N Engl J Med, 2001, 344: 410-417.
[31] Raza SA, Chughtai AR, Wahba M, et al. Multislice CT angiography in renal artery stent evaluation: prospective comparison with intraarterial digital subtraction angiography. Cardiovasc Intervent Rasiol, 2004, 27: 9-15.
[32] Raman R, Napel S, Beaulieu CF, et al. Automated generation of cured planar reformations from volume data: method and evaluation. Radiology, 2002, 223: 275-280.
[33] Stafford RB, Sabati M, Mahllati H, et al. 3D Non-contrast enhanced MR angiography with balanced steady-state free precession dixon method. Magn Reson Med, 2008, 59: 430-433.
[34] Tan KT, Van Beek EJ, Brown PW, et al. Magnetic resonance angiography for the diagnosis of renal artery stenosis: a meta-analysis. Clin Radiol, 2002, 57: 617-624.
[35] Broome DR, Girguis MS, Baron PW, et al. Gadodiamide-associated nephrogenic systemic fibrosis: why radiologists should be concerned. Am J Roentgenol, 2007, 188: 586-592.
[36] Tuttle KR. Ischemic nephropathy. Curr Opin Nephrol Hypertens, 2001, 10: 167-173.
[37] Taylor A. Functional testing: ACEI renography. Semin Nephrol, 2000, 20: 437-444.
[38] Stevens LA, Coresh J, Greene T, et al. Assessing kidney function--measured and estimated glomerular filtration rate. N Engl J Med, 2006, 354: 2473-2483.
[39] Odudu A, Vassallo D, Kalra PA. From anatomy to function: diagnosis of atherosclerotic renal artery stenosis. Expert Rev Cardiovasc Ther, 2015, 13: 1357-1375.
[40] 蒋雄京, 吴海英, 张慧敏, 等. 经皮肾动脉支架术治疗肾血管性高血压的临床结果. 中国循环杂志, 2006, 21: 89-92.
[41] 中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南(2016年修订版). 中国循环杂志, 2016, 31: 937-953.
[42] 彭猛, 蒋雄京, 董徽, 等. 动脉粥样硬化性肾动脉狭窄支架术后强化降脂或常规降脂治疗对肾功能的影响: 一项前瞻性随机对照研究. 中华高血压杂志, 2017, 25: 232-238.
[43] Yang L, Zhang H, Jiang X, et al. Clinical manifestations and longterm outcome for patients with Takayasu arteritis in China. J Rheumatol, 2014, 41: 2439-2446.
[44] Alibaz-Oner F, Aydin SZ, Akar S, et al. Assessment of patients with takayasu arteritis in routine practice with indian takayasu clinical activity score. J Rheumatol, 2015, 42: 1443-1447.
[45] Mukhtyar C, Guillevin L, Cid MC, et al. EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis, 2009, 68: 318-323.
[46] Ozen S, Duzova A, Bakkaloglu A, et al. Takayasu arteritis in children: preliminary experience with cyclophosphamide induction and corticosteroids followed by methotrexate. J Pediatr, 2007, 150: 72-76.
[47] Eleftheriou D, Varnier G, Dolezalova P, et al. Takayasu arteritis in childhood: retrospective experience from a tertiary referral centre in the United Kingdom. Arthritis Res Ther, 2015, 17: 36.
[48] Borg FA, Dasgupta B. Treatment and outcomes of large vessel arteritis.Best Pract Res Clin Rheumatol, 2009, 23: 325-337.
[49] Daina E, Schieppati A, Remuzzi G. Mycophenolate mofetil for the treatment of Takayasu arteritis: report of three cases. Ann Intern Med, 1999, 130: 422-426.
[50] 中国高血压防治指南修订委员会. 中国高血压防治指南2010. 中华心血管病杂志, 2011, 39: 579-616.
[51] Cooper CJ, Murphy TP, Cutlip DE, et al. Stenting and medical therapy for atherosclerotic renal-artery stenosis. N Engl J Med, 2014, 370: 13-22.
[52] Khosla S, Ahmed A, Siddiqui M, et al. Safety of angiotensin-converting enzyme inhibitors in patients with bilateral renal artery stenosis following successful renal artery stent revascularization. Am J Ther, 2006, 13: 306-308.
[53] Evans KL, Tuttle KR, Folt DA, et al. Use of renin-angiotensin inhibitors in people with renal artery stenosis. Clin J Am Soc Nephrol, 2014, 9: 1199-1206.
[54] 李彬, 蒋雄京. 粥样硬化性肾动脉狭窄的支架术: 当前的困惑与未来. 中国循环杂志, 2015, 30: 3304-305.
[55] ASTRAL Investigators, Wheatley K, Ives N, et al. Revascularization versus medical therapy for renal-artery stenosis. N Engl J Med, 2009, 361: 1953-1962.
[56] Raman G, Adam GP, Halladay CW, et al. Comparative effectiveness of management strategies for renal artery stenosis: An updated systematic review. Ann Intern Med, 2016, 165: 635-649.
[57] 蒋雄京, 高润霖. 肾动脉支架术的临床地位和争论. 中华心血管病杂志, 2010, 38: 3-4.
[58] Tan J, Filobbos R, Raghunathan G, et al. Efficacy of renal artery angioplasty and stenting in a solitary functioning kidney. Nephrol Dial Transpl, 2007, 22: 1916-1919.
[59] 蒋雄京, 吴海英, 张慧敏, 等. 肾动脉支架置入对缺血性肾病患者肾功能的影响. 中华医学杂志, 2005, 85: 2046-2049.
[60] Zeller T, Frank U, Muller C, et al. Predictors of improved renal function after percutaneous stent-supported angioplasty of severe atherosclerotic ostial renal artery stenosis. Circulation, 2003, 108: 2244-2249.
[61] Jiang X, Peng M, Li B, et al. The efficacy of renal artery stent combined with optimal medical therapy in patients with severe atherosclerotic renal artery stenosis. Curr Med Res Opin, 2016, 32(Sup2): 3-7.
[62] Zähringer M, Sapoval M, Pattynama PMT, et al. Sirolimus-eluting versus bare-metal low-profile stent for renal artery treatment (GREAT Trial): angiographic follow-up after 6 months and clinical outcome up to 2 years. J Endovasc Ther, 2007, 14: 460-468.
[63] Takahashi EA, McKusick MA, Bjarnason H, et al. Treatment of instent restenosis in patients with renal artery stenosis. J Vasc Interv Radiol, 2016, 27: 1657-1662.
[64] Zähringer M, Pattynama PMT, Talen A, et al. Drug-eluting stents in renal artery stenosis. Eur Radiol, 2008, 18: 678-682.
[65] Diop AN, Hoang VV, Cassagnes L, et al. Treatment of atheromatous renal artery in-stent restenosis in 51 patients. Diagn Interv Imaging, 2013, 94: 68-77.
[66] Itani HS, Mudawwar WA, Tanios BY, et al. First use of a drug-eluting balloon in the treatment of acute renal artery occlusion and in-stent restenosis. Am J Med Sci, 2013, 346: 244-246.
[67] Silverman SH, Exline JB, Silverman LN, et al. Endovascular brachytherapy for renal artery in-stent restenosis. J Vasc Surg, 2014, 60: 1599-1604.
[68] Garovic V, Textor SC. Renovascular hypertension: current concepts. Semin Nephrol, 2005, 25: 261-271.
[69] 蒋雄京, 吴艳, 杨倩, 等. 经皮血管成形术治疗肾动脉纤维肌性发育不良. 中华高血压杂志, 2010, 18: 643-647.
[70] Tyagi S, Singh B, Kaul UA, et al. Balloon angioplasty for renovascular hypertension in Takayasu's arteritis. Am Heart J, 1993, 125: 1386-1393.
[71] Park HS, Do YS, Park KB, et al. Long term results of endovascular treatment in renal arterial stenosis from Takayasu arteritis: angioplasty versus stent placement. Eur J Radiol, 2013, 82: 1913-1918.
[72] Sapoval M, Tamari I, Goffette P, et al. One year clinical outcomes of renal artery stenting: the results of ODORI Registry. Cardiovasc Intervent Radiol, 2010, 33: 475-483.
[73] Sharma S, Gupta H, Saxena A, et al. Results of renal angioplasty in nonspecific aortoarteritis (Takayasu disease). J Vasc Interv Radiol, 1998, 9: 429-435.
[74] Peng M, Ji W, Jiang X, et al. Selective stent placement versus balloon angioplasty for renovascular hypertension caused by Takayasu arteritis: Two-year results. Int J Cardiol, 2016, 205: 117-123.
[75] Agarwal G, Vats HS, Raval AN, et al. Chronic total occlusion and successful drug-eluting stent placement in Takayasu arteritis-induced renal artery stenosis. Clin Med Res, 2013, 11: 233-236.
[76] Shao P, Qin C, Meng X, et al. Hybrid laparoscopic technique for renal artery Takayasu arteritis. Eur J Vasc Endovasc Surg, 2011, 42: 803-808.
[77] Ham SW, Kumar SR, Wang BR, et al. Late outcomes of endovascular and open revascularization for nonatherosclerotic renal artery disease. Arch Surg, 2010, 145: 832-839.
[78] Weaver FA, Kumar SR, Yellin AE, et al. Renal revascularization in Takayasu arteritis-induced renal artery stenosis. J Vasc Surg, 2004, 39: 749-757.
[79] Bude RO, Forauer AR, Caoili EM, et al. Is it necessary to study accessory arteries when screening the renal arteries for renovascular hypertension?. Radiology, 2003, 226: 411-416.
[80] Zeina AR, Vladimir W, Barmeir E. Fibromuscular dysplasia in an accessory renal artery causing renovascular hypertension: a case report. J Med Case Rep, 2007, 1: 58.
[81] Wang L, Liu B, Yan J, et al. Interventional therapy for transplant renal artery stenosis is safe and effective in preserving allograft function and improving hypertension. Vasc Endovascular Surg, 2017, 51: 4-11.
[82] Voiculescu A, Schmitz M, Hollenbeck M, et al. Management of arterial stenosis affecting kidney graft perfusion: A single-centre study in 53 patients. Am J Transplant, 2005, 5: 1731-1738.
[83] Peng M, Jiang XJ, Dong H, et al. A comparison of nephrotoxicity of contrast medium in elderly patients who underwent renal or peripheral arterial vascular intervention. Intern Med, 2016, 55: 9-14.
[84] Owen RJ, Hiremath S, Myers A, et al. Canadian Association of Radiologists consensus guidelines for the prevention of contrast-induced nephropathy: update 2012. Can Assoc Radiol J, 2014, 65: 96-105.
[85] Barbieri L, Verdoia M, Schaffer A, et al. The role of statins in the prevention of contrast induced nephropathy: a meta-analysis of 8 randomized trials. J Thromb Thrombolysis, 2014, 38: 493-502.
[86] Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Periprocedural effects of statins on the incidence of contrastinduced acute kidney injury: a systematic review and meta-analysis of randomized controlled trials.Ren Fail, 2015, 37: 664-671.
2017-05-22)
(编辑:宁田海)
蒋雄京 Email: jxj103@hotmail.com 邹玉宝 Email: zouyb1973@sina.com
R54
C
1000-3614(2017)09-835-10
10.3969/j.issn.1000-3614.2017.09.002

