金针菇菇根废弃物多糖提取工艺优化研究*
王翠,何文胜
(福建生物工程职业技术学院,福建 福州 350002)
金针菇菇根废弃物多糖提取工艺优化研究*
王翠,何文胜
(福建生物工程职业技术学院,福建 福州 350002)
以金针菇菇根废弃物为原料,用物理破碎法和热水浸提法研究金针菇废弃物多糖提取的最优工艺条件。通过采用单因素实验和正交实验进一步优化提取工艺条件,确定影响多糖得率的主次因素分别为乙醇浓度、浸提比和提取时间。结果表明:金针菇菇柄废弃物多糖提取的最优工艺条件为浸提温度90℃,浸提2次,浸提时间90min、料液比1∶20(m∶v)、乙醇浓度80%,该条件下多糖提取率达8.09%。该工艺具有工艺过程简单、成本低廉、设备要求低、提取率高的特点,适合工厂化生产,有较高的推广价值。
金针菇;菇根;多糖;提取;工艺优化
金针菇学名毛柄金钱菌,又称毛柄小火菇、构菌、朴菇、冬菇、冻菌、金菇、智力菇等,植物学名为Flammulina velutiper(Fr.)Sing.[1]。金针菇富含蛋白质、糖类、氨基酸、维生素和铁锌硒等微量元素,适合气血不足、营养不良的老人、儿童、癌症患者、肝脏病及胃、肠道溃疡、心脑血管疾病患者食用,是一种很好的保健食品[2]。
金针菇多糖(Flammulina velutipes polysaccharides,FVP)是金针菇中一种具有生物活性的物质,它对小鼠肉瘤 S-180有明显的抑制作用[3]。此外FVP在抗炎、抗疲劳、耐缺氧及提高巨噬细胞吞噬功能方面均有显著作用[4]。若直接食用金针菇,金针菇多糖的含量低,功效不能完全发挥[5]。将金针菇多糖从金针菇中提取富集,制成口服液、胶囊等产品,既实现了金针菇的深加工,其提高附加值,又可以充分发挥金针菇多糖的功效。金针菇采收时,紧邻培养基的菇柄部分会被切除,产生大量的废弃物,约占原料的20%~30%。虽然菇柄废弃物可以作为培养基再次利用,但其中含有木质素、纤维素、蛋白质、多糖、矿质元素等营养物质[6]没有得到充分利用。从菇柄中提取金针菇多糖可以降低生产成本,还可以减少金针菇加工过程的废弃物,促进食用菌产业的健康快速发展。
金针菇多糖提取方法一般为热水浸提法,经常用酶解、微波、超声波[7]等辅助措施,以提高多糖提取率。研究[6,8-12]表明,金针菇多糖热水浸提法的最优条件为温度90℃左右,料液比1:20~40(m:v),提取2~4次,提取率为0.99%~8.07% ,该法工艺简单,但提取率稍低。超声辅助热水浸提法的条件为超声波功率80~420W,处理时间9~50min,料液比1:20~35(m:v),提取率为1.26% ~3.14%[10,13,14],该工艺提高了多糖提取率,但设备复杂,不适于工业化规模化生产。梁敏等[15]研究了酶解辅助热水浸提法的最优条件,为温度55℃,木瓜蛋白酶浓度0.6%,pH值7,提取3h,提取率为7.6%,该工艺对提取率有较大提高,但对提取条件要求严格。黄琼等[16]研究了微波协同酶法对多糖提取率的影响,优化的工艺条件下多糖提取率高达21.76% ,但所需设备繁琐,工艺复杂,对提取条件要求严格,不适合工业化生产。因此,在中国现有的技术装备和经济情况下,酶解、超声波等辅助热水浸提法均不适合工业化生产,必须进一步研究热水浸提法,提高提取率。
试验以金针菇的废弃物菇柄为原料,采用烘干物理破碎法和热水浸提法提取金针菇多糖,研究金针菇废弃物多糖经济、高效的提取工艺,提高提取率,为金针菇多糖产品开发提供一定参考,为金针菇菇柄废弃物的资源化利用提供技术支持。
1 材料与方法
1.1 材料与仪器
材料:金针菇菇根下脚料(由福建省裕兴农业科技有限公司提供);95%乙醇、33%H2O2、氯仿、正丁醇、丙酮均为国产分析纯试剂;
仪器:恒温干燥箱,电热恒温水浴锅、离心机、分析天平等。
1.2 方法
1.2.1 金针菇多糖提取率的测定
1.2.1.1 材料预处理:试验采用物理法破碎,处理方法:取金针菇菇根下脚料,除去栽培基质等杂质,65℃条件下干燥24h,磨碎过0.25mm筛,备用。
1.2.1.2 多糖浸提液的制备:在分析天平上准确称取2g粉末放入大试管中,加适量的水浸泡30min,使粉末充分吸水膨胀,便于多糖的浸出,减少蒸煮时间。将复水的浆体里按照一定浸提比加入蒸馏水,将大试管放入90℃的水浴锅浸提一定时间,每隔15min摇晃大试管1次,使菌多糖被充分浸提出来,然后冷却,以4500r/min离心15min,取上清,浸提2次,在沉淀洗涤后再次按料液比加水浸提,每个处理重复3次。将上清液加热浓缩,直至滤液体积降为原来的1/4~1/5,再将浓缩液转入大试管中,加3倍体积的10%H2O2加热脱色,使淡黄色褪去。将脱色液倒入分液漏斗中,用Sevage[17]法除去蛋白质,即加入氯仿和正丁醇(5:2)0.5倍量,振荡萃取,取上层液,反复萃取2~3次至游离蛋白质完全去除,并用茚三酮检验。将萃取液倒入大试管中,加入95%乙醇至一定浓度饱和度,静置过夜,以3000r/min离心15min,并用丙酮漂洗沉淀2次,除去其中的脂类和色素。沉淀物采用烘箱干燥法,将其转入铝盒中,放入干燥箱70℃干燥15h。
1.2.1.3 多糖的测定和多糖得率计算:多糖测定采用DNS法。

1.2.2 金针菇菇柄多糖提取的单因素试验
1.2.2.1 料液比对提取率的影响:料液比(m:v)处理为1:10、1:20、1:30、1:40,其他条件为浸提时间120min、pH 7、乙醇浓度70%、温度90℃、浸提2次,其他操作同方法1.2.1.2。
1.2.2.2 乙醇浓度对提取率的影响:乙醇浓度处理为60%、70%、80%、90%,其他条件为浸提时间120 min、pH 7、料液比1:30(m:v)、温度90℃、浸提2次,其他操作同方法1.2.1.2。
1.2.2.3 浸提时间对提取率的影响:浸提时间处理为90、120、150、180min,其他条件为pH 7、料液比1:30(m:v)、乙醇浓度70%、温度90℃、浸提2次,其他操作同方法1.2.1.2。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 料液比对菇根废弃物多糖提取率的影响
由图1可知,菇柄多糖提取率随料液比的增加而增加,当料液比达到1:20以后,提取率增加缓慢。

图1 料液比对金针菇多糖提取率的影响
2.1.2 乙醇浓度对菇根多糖提取率的影响
由图2可知,多糖提取
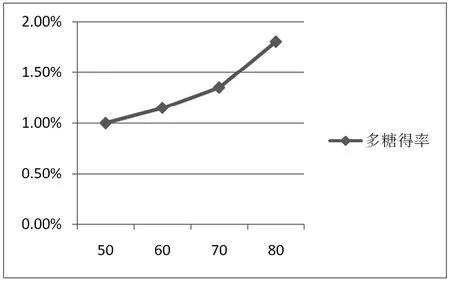
图2 乙醇浓度对金针菇多糖提取率的影响
率随乙醇浓度升高而升高,当乙醇浓度为70%~80%时多糖提取效果最佳。2.1.3浸提时间对菇柄多糖提取率的影响
由图3可知,浸提时间的增加,多糖提取率先升高后降低,浸提时间120 min的提取率最高,但与90 min时的提取率基本相同。随浸提时间的增加,提取率下降,这是因为长时间的高温下,浸提液中的多糖发生降解。

图3 浸提时间对金针菇多糖提取率的影响
2.2 金针菇菇柄废弃物多糖提取的正交试验
2.2.1 正交试验因素选择
根据单因素实验结果选择料液比、乙醇浓度、提取时间作为3个试验因素,各取3个水平,采用3因素3水平进行正交试验,因素水平表如1,结果与分析如表2。

表1 多糖提取条件正交试验水平因素
2.2.2 正交试验结果分析

表2 多糖提取条件正交试验结果及分析表
由表2可知,影响金针菇废弃物多糖提取率的3个因素的主次顺序为 C>A>B,即乙醇浓度>浸提时间>料液比。通过正交试验,金针菇废弃物多糖的最优提取条件是A1B2C3,即时间90 min、料液比 1:20(m:v)、乙醇浓度80%。
2.3 验证实验
在最优工艺条件下进行金针菇菇柄废弃物多糖提取的验证实验,结果表明,在最优工艺条件下,菇柄废弃物多糖的提取率高达8.09%。
3 结论
本试验根据史琦云等[18]研究采用浸提温度90℃,浸提2次条件下,利用单因素和正交试验确定了金针菇菇柄废弃物多糖提取的最优工艺条件:浸提时间90min、料液比1:20(m:v)、乙醇浓度80%,在该条件下金针菇菇柄废弃物多糖提取率达8.09%。以福建省裕兴农业科技有限公司为例,金针菇日产4000包,每包平均425g,切除菇脚后400g,以金针菇含水量90%,价格8元/kg计,利用新鲜金针菇子实体,按照本工艺生产1kg金针菇多糖需要新鲜金针菇子实体124 kg,成本992元,利用菇柄废弃物生产没有原料成本,经济效益可观。
[1]暴增海.食用菌栽培原理与技术[M].北京:中国标准出版社,2000:105-107.
[2]黄家莉,李明元,徐锦,等.金针菇加工副产物水溶性多糖提取工艺研究[J].食用菌,2012(3):62-63、74.
[3]Ceung M.Y.K,Fung K.P,Choy Y.M.The isolation and characterization of an immunomodulatory and antitumor polysaccharide preparation from Flammulina velutipes [J].Immune Pharmacology,1997,35(3): 255-263.
[4]崔玉海,郝学志,李文春,等.金针菇多糖抗炎及免疫试验研究[J].基层中药杂志,1999,13(1):17-18.
[5]占建波.金针菇多糖提取纯化及生物活性研究[D].贵阳:贵州大学,2009.
[6]王丽威,郭旭颖,陈梁成,等.水浴法和微波法提取金针菇下脚料多糖的优化及比较研究[J].食品工业科技,2012,33(8):322-325.
[7]刘孝永,陈蕾蕾,裘纪莹,等.金针菇多糖研究进展[J].中国食物与营养,2010,18(5):63-67.
[8]占建波,郁建平,蔡立,等.金针菇水溶性多糖提取工艺的研究[J].食品科学,2008,29(8):265-268.
[9]冯昆,张东杰,张涧铮,等.金针菇多糖提取条件的优化[J].黑龙江八一农垦大学学报,2005,17(5):73-76.
[10]于沺,李凤林.微波辅助提取法提取金针菇多糖的工艺研究[J].吉林农业, 2010(12):75,79.
[11]蒋海明,张秀华.金针菇多糖最优提取工艺探讨研究[J].安徽农业科学,2011,39(11):6524-6525,6528.
[12]何轩辉,廖森泰,刘吉平,等.应用Box-Behnken组合设计优化金针菇多糖提取条件[J].食用菌学报,2008,15(3):64-67.
[13]罗登宏.超声波辅助提取金针菇多糖工艺参数优化研究[J].江苏农业科学,2010(2):316-317.
[14]李志洲,杨海涛,闵锁田.金针菇多糖最优提取工艺研究[J].宝鸡文理学院学报(自然科学版),2003,23(1):37-38,41.
[15]梁敏,邹东恢,郭宏文,等.复合酶法提取金针菇多糖及光谱分析[J].湖北农业科学,2012,51(6):1210-1213.
[16]黄琼,丁玲.微波协同酶法提取金针菇多糖工艺的优化[J].食品与机械,2013,29(1):128-130,166.
[17]杨焱,周昌艳,白韵琴,等.猴头菌子实体和菌丝体多糖的分离纯化与理化特征的比较[J],菌物系统,2001,20(3):18-24.
[18]史琦云,郭玉蓉,陈德蓉. 食用菌多糖提取工艺研究[J],食品工业科,2004(2):98-100.
TS254.7
:A
:1007-550X(2017)04-0028-04
10.3969/j.issn.1007-550X.2017.04.001
福建生物工程职业技术学院院级青年基金项目(项目编号2014kj04)。
2017-03-24
王翠(1984- ),女,山东新泰人,硕士研究生,研究方向:食用菌种质资源与遗传育种。

