菲律宾蛤仔过敏原的性质研究
黄姝玲
(福建省产品质量检验研究院,福建 福州 350002)
菲律宾蛤仔过敏原的性质研究
黄姝玲
(福建省产品质量检验研究院,福建 福州 350002)
文章以菲律宾蛤仔为对象,对其过敏原进行性质研究。采用丙酮沉淀、等电点沉淀、硫酸铵盐析及加热处理等方法纯化过敏原;采用SDS-PAGE和Western-blot鉴定该过敏原;通过pH稳定性试验、消化稳定性试验进一步分析其性质。结果显示菲律宾蛤仔中主要过敏原的分子量为35kDa,耐酸碱性良好,且具有较高的消化稳定性,其降解产物仍具有抗原性。研究验证了菲律宾蛤仔中的主要过敏原是原肌球蛋白(tropomyosin,TM),并对其性质进行了分析,为过敏原的安全控制提供了基础数据。
菲律宾蛤仔;过敏原;原肌球蛋白;性质研究
过敏原是过敏发生的必要条件,是指能发生过敏反应的抗原,常见的有2000-3000种,医学文献记载接近2万种。与其他过敏原相比,食物过敏原的种类更多,成分更复杂,环境影响因素也较多。
贝类是最优质的食用蛋白质资源之一,但贝类引起的过敏性现象较为常见,属于联合国粮农组织公布的8大类容易引起过敏的食物之一[1-2]。菲律宾蛤仔,是我国四大养殖贝类之一,产量占全世界的90%以上[3]。蛤肉蛋白质含量高,脂肪含量低且含人体所需的必需氨基酸种类齐全,同时,富含脂肪酸、EPA和DHA,具有良好的保健作用[4],深受消费者的喜爱,但其却是引发人过敏反应较为常见的食用贝类之一。
研究以菲律宾蛤仔为对象,对其主要过敏原进行分离纯化,并通过SDS-PAGE分析其纯化效果与分子量大小,随之进行pH稳定性的研究,再通过模拟胃肠液消化实验分析其消化稳定性并在此基础上采用热处理方法研究加工工艺对菲律宾蛤仔主要过敏原的影响,同时通过Western-blot来检测其抗原性。此研究可为开发低过敏原甚至无过敏性的可食用贝类食品提供基础研究依据。
1 材料与方法
1.1 材料、试剂与仪器
新鲜的菲律宾蛤仔购于厦门市集美菜市场,取肉后立即进行实验;Tris Base:美国Novon;SDS、TEMED(四甲基一烯二铵)、Pancreatin、丽春红:美国Sigma;丙烯酰胺:美国Bio-Rad;脱脂奶粉:中国内蒙古伊利实业集团股份有限公司;DTT:美国Bio-Rdd;APS、考马斯亮蓝R-250:中国厦门星隆达化学试剂有限公司;Glycine:美国Promega;β-巯基乙醇:美国Bio-Basic-Inc;Tween-20, C.P.:中国医药集团上海化学试剂公司;预染标准蛋白:美国New Egnland Biolabs。
垂直电泳槽Mini protean:美国Bio-Rad;电转移装置PS-9:中国Jim-X;冷冻离心机Avanti-25:美国Beckman;凝胶成像仪Bio-profile:法国Vibler Lourmat;凝胶成像仪Alpha:美国Proteinsimple;超纯水系统RIOS8:美国Millipore
1.2 实验方法
1.2.1 菲律宾蛤仔过敏原的纯化[5]
取蛤肉100g,加入10倍体积Buffer A(50mmol/L KCl,2mmol/L NaHCO3,10 mmol/L EDTA),捣碎匀浆,4℃离心,取沉淀重复操作4次,取上清;丙酮搅拌过滤,风干;加入10倍体积的Buffer B(20 mmol/L Tris-HCl,1 mol/L KCl,10 mmol/L β-巯基乙醇),4℃离心,得上清;调节pH至4.5,充分沉淀,4℃离心,取沉淀,用20mmol/L Tris-HCl(pH7.5)溶解;加入41%~60%(NH4)2SO4,搅拌,静置,4℃离心,所得沉淀溶于20mmol/L Tris-HCl(pH7.5)并于95℃水浴10min,4℃离心,所得的上清溶液分装并于-20℃保存。
1.2.2 菲律宾蛤仔过敏原pH稳定性的研究
将纯化过敏蛋白分别加入不同pH值的缓冲液中(pH值1.0、2.0、6.0、7.0、8.0、9.0、10.0、11.0、13.0),置于4℃冰箱内分别反应0.5h和6h,之后取出,调节pH至7.0,立即进行SDS化,以置于pH7.0缓冲液的样品为对照。
1.2.3 菲律宾蛤仔过敏原消化稳定性的研究
1.2.3.1 体外模拟胃液消化[6]
总反应体系为1mL,胃蛋白酶(12 U/mg)与纯化过敏蛋白的比例为1:50(w:w)。将含有胃蛋白酶的模拟胃液SGF(50mmol/L NaCl,pH1.2)于37℃预热15min,加入纯化的过敏蛋白混匀,振荡反应;分别在反应0、1、2、5、10、15、30、60 min时取100 μL反应液,加入30μL、200mmol/L Na2CO3混匀,置于冰上。对照试验不加胃蛋白酶。
1.2.3.2 体外模拟肠液消化[7]
总反应体系为1mL,胰蛋白酶(390 U/mg)与纯化的过敏蛋白比例为1:50(w:w),胰凝乳蛋白酶(360 U/mg)与底物的比例是1:1000(w:w)。将含有胰蛋白酶或胰凝乳蛋白酶的模拟肠液S I F(50mmol/L KH2PO4,pH7.5)在37℃预热15min,加入纯化的过敏蛋白混匀,振荡反应;分别在反应0、1、5、15、30、60、120、240 min时取100μL反应液,95℃加热5min,置于冰上。对照反应不加蛋白酶。
1.2.3.3 二相模拟胃肠液消化实验
将含有胃蛋白酶的SGF于37℃预热15min,加入纯化的过敏蛋白混匀,反应一定时间后取出100μL反应液,加入30μL 200mmol/L Na2CO3,混匀后置于冰上。加入Na2CO3中和终止反应并使消化环境pH值在7.5左右,加入胰蛋白酶与胰凝乳蛋白酶或胰酶,反应一定时间后取100μL反应液,95℃下加热5min,置于冰上。其中,0min样品是将含有蛋白酶的SGF与SIF先加热失活终止反应,再加入底物。对照反应不加蛋白酶,其余步骤相同。
1.2.4 SDS-PAGE电泳分析
各阶段的纯化效果及纯化蛋白质的分子量用SDS-PAGE分析,以分子量为116.0-14.4kDa的标准蛋白质作为对照,方法是在Leammli等[8]的基础上略作改动。分离胶和积层胶浓度均为12%,上样量为8 μL,Marker上样量为4μL,染色液为考马斯亮蓝R250。
1.2.5 Western-blotting免疫分析
Western-blotting参照Towbin[9]等的方法进行。标准蛋白使用Prestained Marker,染液为丽春红,用5%脱脂奶粉作封闭液,兔抗锯缘青蟹TM特异性多克隆抗体作为一抗,羊抗兔多克隆抗体作为二抗,锯缘青蟹TM作为阳性对照,牛血清蛋白(BSA)作为阴性对照,并采用ECL法进行显色。
2 结果与分析
2.1 菲律宾蛤仔过敏原的分离纯化结果与Westernblotting确认
菲律宾蛤仔肉经过丙酮沉淀、等电点沉淀、硫酸铵盐析及加热处理等方法处理后,分离得到纯化的过敏原,进行SDS-PAGE分析,结果如图1所示,该过敏原分子量在35kDa左右。
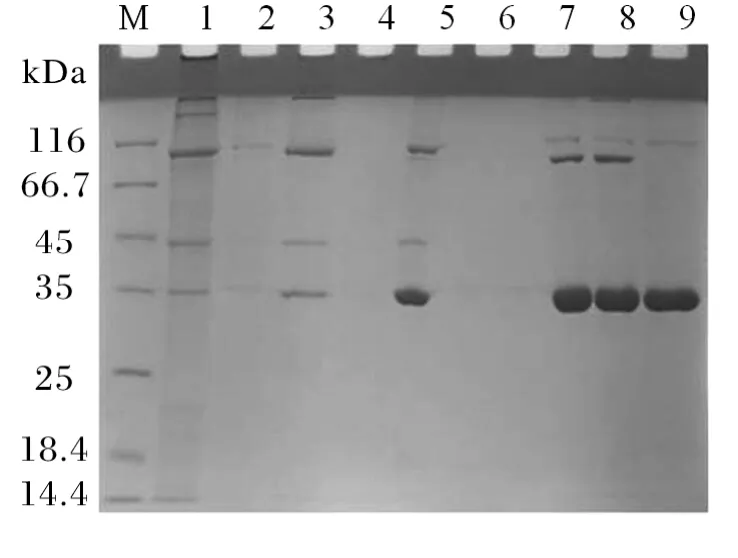
图1 菲律宾蛤仔主要过敏原纯化电泳图
据国内外研究表明,虾和贝类动物中的主要过敏原为原肌球蛋白(Tropomyosin,Tm),是一种种间交叉反应明显的糖蛋白[10-11]。研究以此为据,将通过电泳分离得到的菲律宾蛤仔蛋白质凝胶进行Western-blotting免疫分析,主要以兔抗锯缘青蟹TM特异性多克隆抗体作为一抗、锯缘青蟹TM为阳性对照进行分析。经ECL显色,结果如图2所示,纯化的过敏蛋白(泳道1)和青蟹TM(泳道2)均与抗体发生阳性反应,而BSA(泳道3)未与抗体发生特异性结合。因此,可确认菲律宾蛤仔中的主要过敏蛋白为原肌球蛋白。

图2 纯化蛤仔TM的Western-blot分析
2.2 菲律宾蛤仔过敏原pH稳定性的SDS-PAGE分析
菲律宾蛤仔原肌球蛋白pH稳定性试验结果如图3所示,在不同pH条件下,分别反应0.5h(图3a)与6h(图3b),TM条带均未出现消减现象,由此说明菲律宾蛤仔TM在酸碱条件下都具有良好的稳定性。

图3 纯化蛤仔过敏蛋白的pH稳定性电泳图
2.3 纯化菲律宾蛤仔TM的模拟胃肠液消化试验分析
2.3.1 纯化菲律宾蛤仔TM单相模拟胃肠液消化
纯化菲律宾蛤仔TM的体外SGF、SIF消化结果见图4。从图中可知,胃蛋白酶与蛤仔TM比例为1/50进行SGF消化,条带几乎没有发生变化,消化1h后TM仍然没有被降解,说明TM对胃蛋白酶有很强的耐降解性(图4a);而胰蛋白酶与蛤仔TM以1/100的比例反应,1min后TM即开始降解,60min后,TM被完全分解,随着反应时间的延长,在20~30 kDa之间也逐渐产生降解条带,消化4h后,仅在20 kDa处能观察到一条微弱的蛋白条带(图4b)。同样的,胰凝乳蛋白酶与TM以比值为1/1000进行实验,反应1min TM即开始降解,随着反应时间的延长,原始TM条带被分解,并主要在30 kDa左右逐渐产生降解条带,消化4h后,在30kDa处仍能观察到一条清晰的蛋白条带(图4c)。

图4 纯化蛤仔原肌球蛋白的模拟胃肠液消化
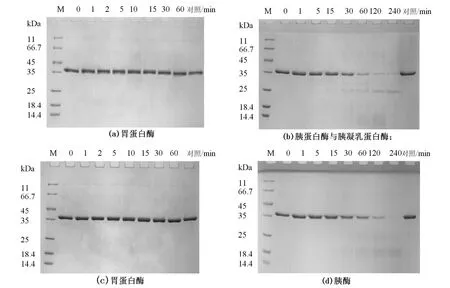
图5 纯化蛤仔原肌球蛋白的模拟二相胃肠液消化
2.3.2 纯化菲律宾蛤仔TM二相模拟胃肠液消化
人的消化过程是由口腔开始,经食道进入胃,再由小肠进行消化与营养吸收,一般而言,食物在胃部停留30~60min,在小肠停留约8h。过敏原若未经过胃蛋白酶消化,可能导致胰蛋白酶和胰凝乳蛋白酶的作用位点不会完全暴露出来。同时,相比于胰蛋白酶与胰凝乳蛋白酶,胰酶更接近于人体内小肠中的消化酶。因此,按照人体的消化顺序、消化时间分别进行了胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶对TM的消化试验以及胃蛋白酶与胰酶对TM的消化试验,然后通过SDS-PAGE分析,进行对比。如图5所示,菲律宾蛤仔TM对胃蛋白酶有较强的稳定性,反应60 min完全没有被降解(图5a,图5c);相比之下,胰蛋白酶和胰凝乳蛋白酶反应15 min,菲律宾蛤仔TM即开始降解,但在240 min后蛋白原始条带仍然未完全降解(图5b);胰酶对菲律宾蛤仔TM的消解效果与之相似,反应15 min出现降解条带,但在240 min后原始蛋白条带被完全降解(图5d)。推测可能是由于胰酶中含有更多种类的消化酶从而促使了菲律宾蛤仔TM的降解。总体而言,2组实验对TM的降解效果差异不明显。
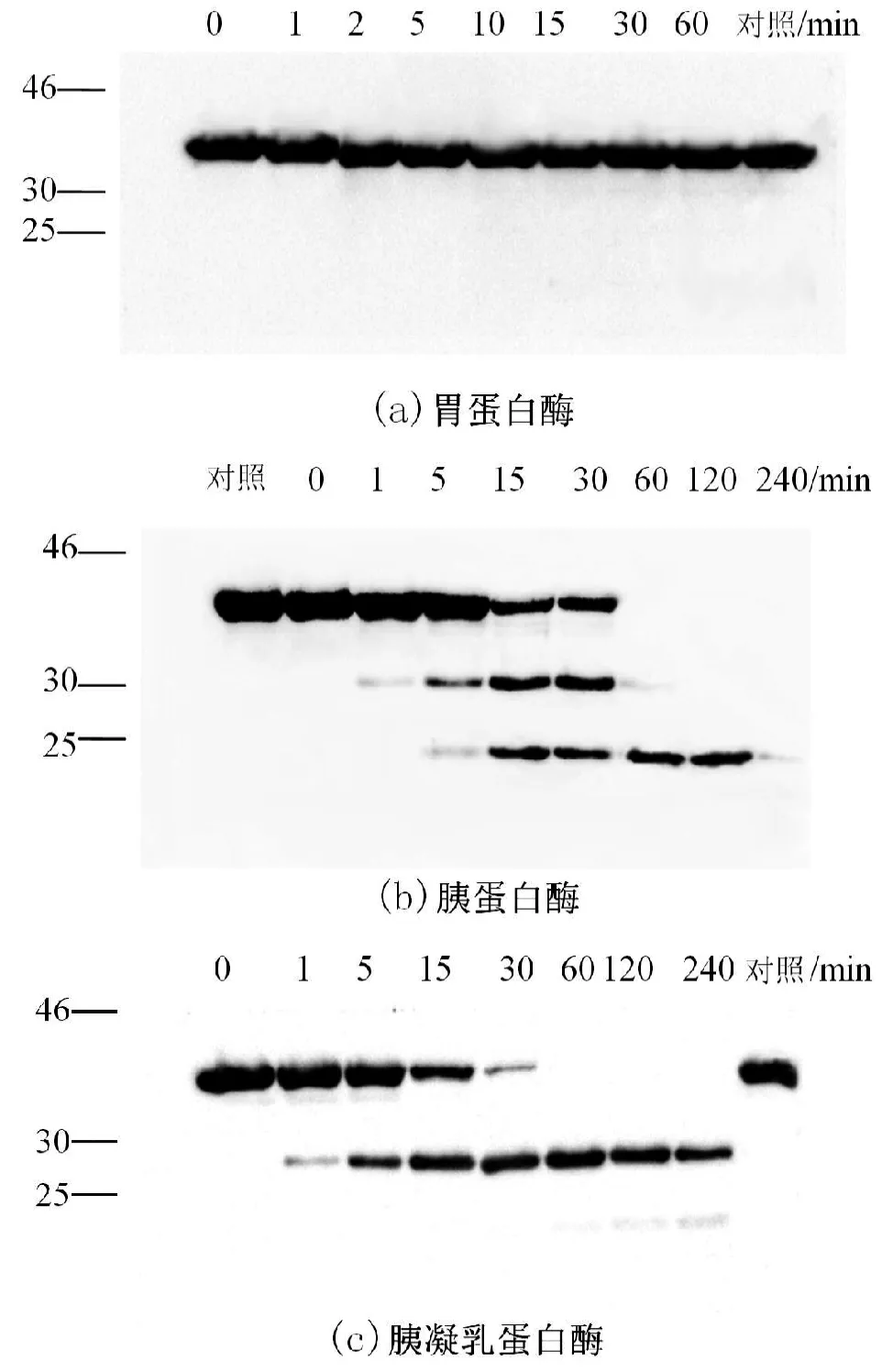
图6 免疫印迹检测模拟胃肠液对TM的消化情况
2.4 纯化菲律宾蛤仔TM模拟胃肠液消化Westernblotting分析
为了确认蛤仔TM经消化降解后其抗原性的变化情况,采用兔抗青蟹TM特异性多克隆抗体以Western-blot鉴定TM的降解过程及其产物。图6a显示,胃蛋白酶对原肌球蛋白的降解作用微弱,反应60min后,主条带仍然未被降解,其抗原性也没有发生明显的变化。在模拟肠液消化实验中,以胰蛋白酶作为消化酶时,反应5min即有降解产物生成,并在30kDa和23kDa处产生降解条带。随着反应时间的延长,这些降解条带被进一步分解(图6b),这些降解条带都存在一定的抗原性。胰凝乳蛋白酶分解TM的结果与胰蛋白酶相似,但胰凝乳蛋白酶作用后主要在28 kDa处产生1条带(图6c)。不同的酶作用TM产生的降解条带不同,这与消化酶对底物的作用位点不同有关。
3 讨论与结论
虽然已有研究证实原肌球蛋白是贝类动物的主要过敏原,但是不能排除不同物种间存在差异的可能性。文章以菲律宾蛤仔为研究对象,通过分离得到纯化的过敏原,采用免疫印迹法,以兔抗青蟹TM特异性多克隆抗体对其进行分析,结果显示该致敏蛋白分子量为35kDa,同国内报道的原肌球蛋白分子量相近[12],并且与蟹类TM抗体具有较强的交叉反应,故确认菲律宾蛤仔中的主要过敏蛋白为原肌球蛋白TM。
过敏原通常具有良好的稳定性,文章对TM的pH稳定性和消化稳定性进行了研究、分析。从pH稳定性试验的结果可以看出,TM在不同酸碱环境中均能保持良好的稳定性,由此可知,当人体摄入TM后,胃酸并不能使TM降解;研究模拟人体消化酶对菲律宾蛤仔过敏蛋白的分解作用,结果表明TM对胃蛋白酶具有很强的耐消化性,酶/蛋白比值为1/50(w/w)反应60min后,TM仍然没有被降解;胰蛋白酶与蛤仔TM反应,1min后TM即出现微弱的降解,60min后原始蛋白条带已被完全降解,在分子量为23、30 kDa处出现降解产物条带。同样的,TM与胰凝乳蛋白酶反应1min开始出现降解,并在28kDa左右出现降解条带,随后继续消化1h,仅剩下小分子量的降解产物,TM原始蛋白条带完全被分解。该结果与其他学者对食品过敏原的消化特征的研究结果相似[13,14]。菲律宾蛤仔TM被3种蛋白酶降解过程中,产生不同分子量的降解条带,主要是因为不同消化酶对肽段的特异性分解位点不同所致[15]。如胰蛋白酶特异选择Lys和Arg残基的P1位置,而胰凝乳蛋白酶则优先选择靠芳香族氨基酸(Tyr,Trp,Phe)和Leu的P1位置。但文章未探讨酶解过程中过敏蛋白的结构变化,尚待进一步深入研究分析。
[1]Moneret-Vautrin DA. Epidemiologiede Ialler gieal imentaire etpreva-lencere lativede stroph allergenes[J].Cah Nutr Diet,2001,36(4): 247-252.
[2]Schafer T. Epidemiology of food allergy/food intolerance in adults: associations with other manifestations ofatopy[J].Allergy,2001,56(12): 1172-1179.
[3]张国范,闫喜武. 菲律宾蛤仔养殖学[M]. 北京: 科学出版社,2010:11-12.
[4]吴云霞,梁健,闫喜武,等. 菲律宾蛤仔营养成分分析与评价[J]. 营养学报,2012,34(4): 409-413.
[5]Huang MC,Ochiai Y. Fish fast skeletal muscle tropomyosins show species-specific thermal stability[J]. Comp Biochem Physiol,2005,141(4): 461-471.
[6]Thomas K,Aalbers M,Bannon GA,et al. A multilaboratory evaluation of a common in vitro pepsin digestion assay protocolused in assess ing the safety of novel proteins[J]. Regul Toxico Pharmacol,2004,39(2): 87- 98.
[7]Astwood JD,Leach JN,Fuchs RL. Stability of food allergens to digestion in vitro[J]. Nat Biotechnol,1996(14):1269-1 273.
[8]Leammli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Natural,1970,227(15):680- 685.
[9]Towbin H,Staehelin T,Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocelluLose sheets:Procedure and some applications[J]. PNAS,1979,76(9): 4350-4354.
[10]Dual CB,Slattery M,Reese G,et al. Identification of the major brown shrimp (Penaeus aztecus) as the muscle protein tropomyosin[J]. Int Arch Allergy Immunol,1994,105(1): 49-55.
[11]Leung PS,Chu KH. cDNA cloning and molecular identification of the major oyster allergen from the Pacific oyster Crassostrea gigas[J]. Clin Exp Allergy,2001,31(8): 1287-1294.
[12]吕良涛,蔺海鑫,高卿,等. 菲律宾蛤仔过敏原原肌球蛋白的鉴定与分子克隆[J]. 食品安全质量检测学报,2015,6(11): 4538-4544.
[13]Fu TJ,Abbott UR,Hatzos C. Digestibility of food allergens and nonallergenic proteins in simulated gastric fluid and simulated intestinal fluid-A comparative study[J]. Food Chem,2002,50: 7154-7160.
[14]Shimakura K,Tonomura Y,Hamada Y,et al. Allergenicity of crustacean extractives and its reduction by protease digestion[J]. Food Chem,2005,91: 247-253.
[15]刘光明,黄园园,蔡秋凤,等. 淡水鱼类主要过敏原的模拟肠胃液消化[J]. 水产学报, 2010,34(7): 1136-1142.
TS254.7
:A
:1007-550X(2017)04-0038-06
10.3969/j.issn.1007-550X.2017.04.003
2017-02-13
黄姝玲(1989-),女,福州永泰人,助理工程师,硕士,主要研究方向:微生物学。

