鲫鱼对水中有机防晒剂的富集及代谢酶响应
陆光华,李 晟,宗永臣,黄 毅(.西藏农牧学院水利土木工程学院,西藏 林芝 860000;.河海大学环境学院浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 0098)
鲫鱼对水中有机防晒剂的富集及代谢酶响应
陆光华1*,李 晟2,宗永臣1,黄 毅1(1.西藏农牧学院水利土木工程学院,西藏 林芝 860000;2.河海大学环境学院浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
采用半静态水体暴露方法研究了有机防晒剂对二甲氨基苯甲酸异辛酯(OD-PABA)在鲫鱼不同组织的分布、累积及生态毒理效应.结果表明,OD-PABA在不同组织中的含量随着水体暴露浓度的升高而持续升高,并在14或28d达到最大.不同浓度的OD-PABA在不同组织的生物富集因子(BCF)存在明显差异,基于暴露 14d和 28d计算得到的 BCF值,肝脏为 123~186,皮肤为 117~163,肾脏为90.2~147.OD-PABA对鲫鱼肝脏EROD、PROD、BFCOD和GST活性都产生了诱导效应,其中EROD和GST的响应更为显著,最大诱导倍数分别为0.97和0.53倍.结果表明,水中的OD-PABA可在鲫鱼体内富集,并通过I相和II相代谢酶进行生物转化.
鲫鱼;OD-PABA;组织分布;生物富集;代谢酶
有机防晒剂(Organic UV Filters, OUVFs)是具有羰基共轭或杂环的芳香族有机化学品,具有强烈地选择性吸收紫外线的性能.OUVFs除了作为防晒成分用于个人护理品以外,还被广泛添加到家居产品、纺织品、塑料、光学产品、农业化学品和涂料等产品中,防止紫外线照射[1].近年来,紫外线辐射的危害已经引起人们高度关注, OUVFs的生产和使用呈现出激增的趋势,已经成为一类重要的新型污染物.
OUVFs可以通过水上娱乐活动、涂料的雨水冲刷、生产废水及生活污水排放等途径进入水环境[2],在水体、沉积物和生物体内被广泛检出.Sang等在香港近海生物体内检出了7种有机防晒剂,其中甲氧基肉桂酸乙基己酯和对二甲氨基苯甲酸异辛酯(OD-PABA)是主要污染物[3]. Ma等在南京地表水中检出8种有机防晒剂,其中二苯酮-3(BP3)具有高风险[4].研究表明,多种有机防晒剂对鱼类具有雌激素活性,并干扰其产卵和繁殖[5-6].中国、美国和欧盟规定化妆品中允许添加OD-PABA的最大浓度为8%.OD-PABA在自来水、地表水及污水中浓度范围在2~110ng/L之间[4,7-9].因其疏水性强,水环境中的 OD-PABA具有潜在的生物累积风险[10].目前,针对有机防晒剂的生物累积效应研究很少,这些化合物进入生物体内可能对其生理功能产生负面影响,因此,这方面研究亟待加强.
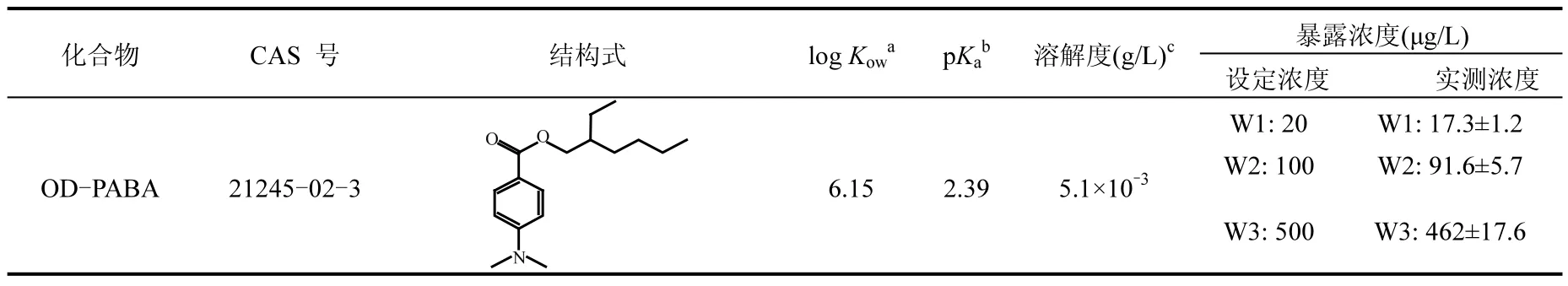
表1 OD-PABA的结构式、理化参数及暴露浓度Table 1 Structural formula, physicochemical parameters and exposure concentrations of OD-PABA
为了探讨OD-PABA对水生生物的影响,本文以广泛分布的鲤科鲫鱼为模式生物,采用半静态水体暴露方法,研究水中OD-PABA在鱼体内的组织分布和累积规律,分析鲫鱼肝脏代谢系统相关酶系的胁迫响应,本文可为今后深入研究和科学评价这类新型污染物提供重要参考.
1 材料与方法
1.1 材料
OD-PABA购自百灵威科技有限公司(上海,中国),结构式和理化性质见表 1.一龄鲫鱼(Carassius auratus)购自南京水产养殖研究所,体长10±1.5cm,体重35±2.9g.实验开始前将鲫鱼驯化两周,每天定时喂食摇蚊幼虫.
1.2 水体暴露
根据OECD测试指南(OECD 305)进行鲫鱼暴露实验.采用曝气自来水稀释OD-PABA的甲醇储备液,制成OD-PABA试验溶液,加入50L的玻璃鱼缸中,最后暴露溶液体积为 30L,甲醇浓度为0.01%(V/V).每个鱼缸放入随机选取的12条鲫鱼,采用半静态的方式暴露 28d,每天更换一半试验溶液,暴露过程中喂食占鱼重 3%的摇蚊幼虫.根据文献报道的 OD-PABA的半数效应浓度(EC50=3000µg/L)[12],为了避免在富集实验过程中对鱼产生毒性效应,OD-PABA的暴露浓度设置为 20,100,500μg/L,同时设置空白和溶剂对照组,每组设置3个平行.暴露期间,每天采集水样分析OD-PABA的浓度.在第3,7,14d每个平行采集2条鱼,解剖并取肝脏,用于生物标志物测定;在第7,14,28d每个平行采集2条鱼,解剖并取肝、脑、肌肉、皮、鳃、肾脏等组织,用于OD-PABA含量测定.
1.3 样品预处理
水样首先过 0.45μm的玻璃纤维滤膜滤,再采用Oasis HLB 固相萃取柱(200mg,6mL,Waters, Milford, USA)进行萃取.萃取前,依次用 5mL二氯甲烷、5mL甲醇和5mL超纯水对萃取柱进行活化处理.随后,将水样以3~5mL/min流速通过萃取柱,再用10mL超纯水淋洗后,继续抽滤30min,以去除柱子中的水分.然后用 10mL二氯甲烷与甲醇等体积比混合液洗脱,洗脱液经氮吹浓缩后,定容至1mL,在-20℃条件下储存待测.
不同组织样品先用0.15mol/L的KCl冲洗,再用滤纸吸干,然后采用加速溶剂萃取仪(ASE 350,美国 DIONEX公司)提取生物组织中的OD-PABA.首先取0.5~1g组织样品,与硅藻土混匀后,装入萃取池.萃取条件为 160℃,压力1500psi,萃取溶剂为乙酸乙酯与正己烷混合液(4/1,V/V).萃取液定量浓缩至1mL以下,再用甲醇定容.然后在0℃以下以12000×g离心15min除去脂质,取上清液 0.5mL,保存于-20℃待测.组织脂质含量采用减差法测定[13],称取生物样 5g,加速溶剂萃取后,定量浓缩至恒重,根据浓缩器皿加样前及浓缩后的重量差,计算脂肪含量.
1.4 OD-PABA定量分析
采用正离子电喷雾电离(ESI+)为离子源的高效液相色谱与-质谱联用仪(LC/MS/MS, Agilent 1290/6460),色谱柱型号为 Eclipse Plus C18(2.1mm×30mm×1.7μm),柱温 30℃,进样量10μL.采用多反应离子监测模式分析目标化合物.水样的检出限(LOD)和定量限(LOQ)分别为 0.9和 4ng/L,方法回收率 88%~102%.生物样品的LOD为0.2~0.4ng/L,LOQ为0.8~2ng/L,回收率为81%~107%.
1.5 生物标志物测定
肝脏样品用KCl溶液洗涤后,放入5mL离心管,按照1:9的质量体积比加入Tris-HCl缓冲液(0.1mol/L Tris-HCl溶液,pH值7.4,0.15mol/L KCl)匀浆,匀浆液在9000×g下冷冻离心30min,取上清液作为粗酶液.EROD、PROD和BFCOD活性采用类似的荧光法测定[14-15].在96孔板中加入Tris缓冲液、底物和粗酶液,加入 NADPH启动反应,10min后加入冰甲醇终止反应,测定产物的浓度.底物分别为7-乙氧基异吩唑酮、7-羟基吩噁唑嗪酮二戊醚和 7-羟基-4-三氧甲基香豆素,产物分别为试卤灵、试卤灵和7-羟基香豆素.采用酶标仪(TECAN Infinite 200)测定产物的荧光强度(试卤灵:激发波长 530nm,发射波长 590nm;7-羟基香豆素:激发波长 410nm,发射波 538nm),酶活性单位为pmol/mg protein/min.
GST活性采用Frasco和Guilhermino的方法测定[16].将 100μL pH 为 6.5的磷酸缓冲溶液(0.1mM),10μL CDNB(1.0mM),10μL GSH(1.0mM)和880μL超纯水混匀后,组成反应体系.在96孔板中加入 170μL反应体系和 10μL粗酶液.在340nm测定反应产物2,4-二硝基苯-谷胱甘肽的生成速率,活性单位为nmol/mg protein/min.
肝组织蛋白质含量测定采用改进的Bradford方法进行,以牛血清蛋白为标准物质[17].
1.6 统计分析
采用Shapiro-Wilk和Levene方法对数据进行正态性检验和同方差检验.采用ANOVA分析方法中的 Dunnet’s检验来比较不同组别数据之间的差异性,当P<0.05时表示两组数据之间有显著性差异.数据的统计分析均采用 SPSS 17.0软件进行处理.
2 结果与讨论
2.1 鲫鱼对OD-PABA的累积效应
在28d的暴露期内,未发现鲫鱼死亡或畸形的情况.空白和溶剂对照组的样品均未检出OD-PABA.不同处理组OD-PABA的实测浓度介于设定浓度的86.5%~92.4%之间(表1).鲫鱼各组织脂肪含量分别为肝5.1%、脑9.8%、鳃1.8%、肾4.4%、皮6.5%、肌肉3.8%.鲫鱼不同组织中OD-PABA的浓度随暴露时间的变化见图1.
从图1可见,OD-PABA在不同组织中的含量随着暴露浓度的升高而持续升高.在低浓度暴露组(W1),OD-PABA在肝和皮中的累积量最高,鳃和肾累积量相对较低.不同组织累积量随时间的变化趋势不同,所有组织在前 14d的累积量都不断增加,到第28d,脑的累积量继续升高,肝、肾、鳃有所下降,而肌肉、皮肤变化不大.在W2组暴露28d后,肾的累积量最高,肝、脑和皮的累积量次之,鳃和肌肉的累积量相对较低.暴露14d各组织浓度较第7d都有明显升高,暴露28d脑和肾组织的累积量继续升高,其余组织累积量变化不大.在最高浓度组(W3)组,整个暴露期肝和脑组织中的OD-PABA含量持续升高,在第28d达到最大,而鳃、肾、皮和肌肉的累积在第 14d达到最大,之后变化不显著.
对比不同暴露浓度,组织分布规律存在差异.但是,对于所有暴露浓度,肝脏都是重要的累积组织,这与双氯芬酸、罗红霉素等药物化合物在鲫鱼体内的累积分布规律类似[18-19].肝脏是进行有机物代谢清除的重要场所,当代谢速率低于吸收速率就容易发生累积.此外,两个高浓度组在皮肤和肾脏的累积量也比较大.由于皮肤可直接从水中吸收亲脂性的防晒剂,因此,对于水体暴露而言,皮肤也是主要的累积部位.肾脏是生物的重要排泄组织,当肝脏不能有效地代谢转化摄入的 ODPABA时,可导致肾脏中的OD-PABA浓度升高[20].OD-PABA在肝脏、鳃、肌肉组织中的累积量随时间变化表现为先升高再下降的趋势,这可能是由于污染物在组织中的浓度达到一定水平后(也可以认为是一个阈值),鲫鱼会启动或者在已有基础上增强机体代谢功能,加快体内有毒成分的清除,以降低外源性物质对自身的伤害[21-22].
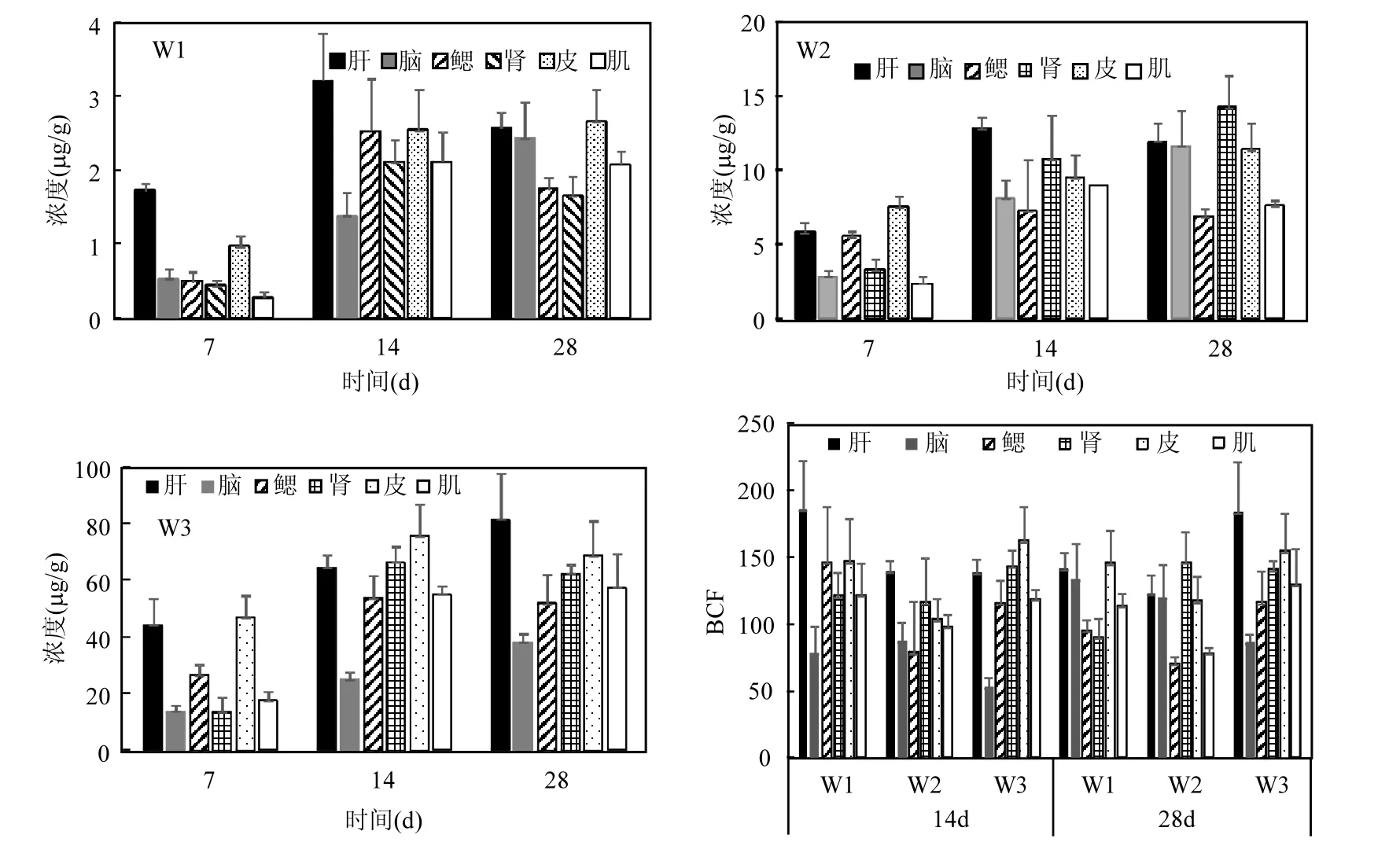
图1 OD-PABA在鲫鱼组织中的浓度及暴露28d的BCF值(平均值±标准偏差,n=3)Fig.1 Concentrations of OD-PABA in fish tissues and BCF values at day 28, and values are expressed as mean±standard deviation (n=3)
环境中的污染物在生物体内的累积是引起亚慢性和慢性毒性作用的基础,生物富集因子(BCF)是生态毒理效应的重要评价指标之一.本文利用暴露14d和28d后,鲫鱼各组织中污染物的浓度与水体实际暴露浓度的比值得到BCF值,结果见图1.不同暴露浓度的OD-PABA在不同组织的BCF值存在一定差异,主要的累积部位是肝脏、皮肤和肾脏,BCF值范围分别为123~186、117~163和 90.2~147.在以前的斑马鱼暴露研究中,得到BP3的BCF值为19~94[23],奥克立林为41~136[24].由于这几种防晒剂的亲脂性都比较强,实验得到的BCFs明显低于基于Kow的理论预测值.这些物质可能在鱼体内发生了代谢转化和排除,导致生物富集水平比较低.比如,BP3在鱼体内能够代谢生成二苯酮-1(BP1),并排出体外[23].此外,亲脂性强的 OUVFs可能被鱼的排泄物吸收,使其生物可利用性降低,导致鱼的生物富集减少[25].
2.2 OD-PABA暴露下鲫鱼肝脏代谢酶系的响应
OD-PABA对EROD、PROD、BFCOD和GST活性的影响见图 2.由于空白对照与溶剂对照无显著差异,本文采用溶剂对照与处理组进行对比分析.
OD-PABA暴露增加了鲫鱼肝脏EROD的活性,两个低浓度组在第3d显著诱导了EROD的活性(P<0.05),诱导倍数分别为0.58和0.65倍.随着暴露时间的延长,各浓度组的EROD活性逐渐降低至对照水平.从浓度效应来看,不同暴露浓度组之间EROD活性无显著差异.水体OD-PABA暴露条件下,不同处理组鲫鱼肝脏PROD的活性都有所增加,但是只有W2组在第3d和第14d显著诱导了鲫鱼肝脏 PROD的活性(P<0.05),其余暴露组 PROD活性与对照组并无显著差异. BFCOD的活性变化与PROD相似,不同浓度和不同时间OD-PABA暴露都增加了BFCOD的活性,但是除了W2组在第14d的显著诱导效应外,其余处理组与对照组无显著差异.OD-PABA暴露增加了鲫鱼肝脏 GST的活性,最高浓度的OD-PABA显著诱导了 GST活性(P<0.05),诱导倍数在 0.40~0.53之间,随暴露时间的延长,诱导倍数逐渐降低,但是并无显著差异.
生物体在自身的生长过程中,需要不断地代谢清除生物体自身合成的(内源)以及从外部环境中累积的(外源)各种有机化合物,以达到代谢清除或对有毒化合物进行解毒的目的.P450酶系作为生物体 I相代谢酶的重要组成部分,在环境污染物的生物监测和生态效应评价领域有着广阔的应用前景.其中,鱼类 CYP1A家族在致癌物的代谢和活化中发挥重要作用,也被称为药物代谢酶[26].研究发现多种药物如罗红霉素、普萘洛尔、磺胺甲恶唑、咖啡因等,可以诱导鲫鱼肝脏与CYP1A关联的EROD活性[27-29],而EROD的诱导效应与药物在鱼体内的生物富集和生物转化有关[27].目前,有关鱼类 I相代谢酶对 OUVFs的响应研究还比较少.Grabicova等[30]研究发现2-苯基苯并咪唑-5-磺酸在 1~1000μg/L浓度范围内暴露21d,对虹鳟鱼(Oncorhynchus mykiss)的EROD、PROD和BFCOD活性都产生了显著诱导,这与本文结果相似.
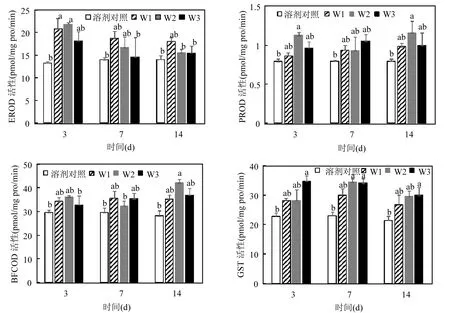
图2 水中OD-PABA暴露对鲫鱼肝脏酶活性的影响(n=3,不同字母表示存在显著性差异,P<0.05)Fig.2 Effects of OD-PABA in water on enzymatic activities in fish liver (n=3, values that do not share the same superscript letters are significantly different, P<0.05)
GST是生物体进行II相代谢反应的一个重要酶系,不仅参与外源污染物的II相代谢,还能够消除生物体内的过氧化物,抵御DNA损伤和脂质氧化[31-32].一些药物化合物诱导鱼类肝脏 EROD的同时,GST活性也显著增加[28,33].Liu等[34]将鲫鱼暴露于0.5和5mg/L的二苯酮类防晒剂(BP-1和BP-3)7d和14d,肝脏GST活性显著增加.GST的诱导效应表明鱼类产生了氧化应激的适应性反应,或者该物质发生了代谢和排泄[35].
3 结论
3.1 水体暴露的OD-PABA能够在鲫鱼脑、肝、肾、鳃、肌肉、皮肤等组织中分布和累积,暴露28d生物富集因子在71~184之间,其中肝脏、皮肤和肾脏是主要的累积组织.
3.2 OD-PABA对鲫鱼肝脏P450酶系EROD、PROD和BFCOD产生了诱导效应,其中,EROD的活性增加最为显著,诱导倍数最高达到0.97倍.高浓度的OD-PABA对鲫鱼肝脏GST活性产生了显著的诱导效应,诱导倍数最高达到0.53倍.
3.3 结果表明,鲫鱼可以从水环境中吸收和累积OD-PABA,并通过I相和II相代谢酶进行生物转化.
[1]Fent K, Zenker A, Rapp M. Widespread occurrence of estrogenic UV-filters in aquatic ecosystems in Switzerland [J]. Environmental Pollution, 2010,158:1817–1824.
[2]Tsui M M P, Leung H W, Lama P K S, et al. Seasonal occurrence, removal efficiencies and preliminary risk assessment of multiple classes of organic UV filters in wastewater treatment plants [J]. Water Research, 2014,53:58–67.
[3]Sang Z, Leung K S Y. Environmental occurrence and ecological risk assessment of organic UV filters in marine organisms from Hong Kong coastal waters [J]. Science of the Total Environment, 2016,566–567:489–498.
[4]Ma B, Lu G, Liu Fi, et al. Organic UV filters in the surface water of Nanjing, China: occurrence, distribution and ecological risk assessment [J]. Bulletin of Environmental Contamination and Toxicology, 2016,96:530–535.
[5]Coronado M, De Haro H, Deng X, et al. Estrogenic activity and reproductive effects of the UV-filter oxybenzone (2-hydroxy-4-methoxyphenyl-methanone) in fish [J]. Aquatic Toxicology, 2008,90:182–187.
[6]Díaz-Cruz M S, Barceló D. Chemical analysis and ecotoxicological effects of organic UV-absorbing compounds in aquatic ecosystems [J]. TrAC Trends in Analytical Chemistry, 2009,28:708–717.
[7]Díaz-Cruz M S, Gago-Ferrero P, Llorca M, et al. Analysis of UV filters in tap water and other clean waters in Spain [J]. Analytical and Bioanalytical Chemistry, 2012,402:2325–2333.
[8]Rodil R, Quintana J B, López-Mahía P, et al. Multi-residue analytical method for the determination of emerging pollutants in water by solid-phase extraction and liquid chromatography–tandem mass spectrometry [J]. Journal of Chromatography A, 2009,1216:2958–2969.
[9]Magi E, Scapolla C, Di Carro M, et al. Emerging pollutants in aquatic environments: Monitoring of UV filters in urban wastewater treatment plants [J]. Analytical Methods, 2013,5:428–433.
[10]León-González Z, Ferreiro-Vera C, Priego-Capote F, et al. Bioaccumulation assessment of the sunscreen agent 2-ethylhexyl 4-(N,N-dimethylamino) benzoate in human semen by automated online SPE-LC-MS/MS [J]. Analytical and Bioanalytical Chemistry, 2011,401:1003–1011.
[11]Pestotnik K, Kosjek T, Heath E. Transformation products of personal care products: UV filters case studies [C]// Lambropoulou D A, Nollet L M L. Transformation Products of Emerging Contaminants in the Environment: Analysis, Processes, Occurrence, Effects and Risks. Chichester:John Wiley and Sons Ltd, 2014:459–492.
[12]Schreurs R H, Sonneveld E, Jansen J H, et al. Interaction of polycyclic musks and UVfilters with the estrogen receptor (ER), androgen receptor (AR), and progesterone receptor (PR) in reporter gene bioassays [J]. Toxicological Sciences, 2005,83:264–272.
[13]Shen M, Xia X, Wang F, et al. Influences of multiwalled carbon nanotubes and plant residue chars on bioaccumulation of polycyclic aromatic hydrocarbons by Chironomus plumosus larvae in sediment [J]. Environmental Toxicology and Chemistry, 2012,31:202–209.
[14]Hahn M E, Lamb T M, Schultz M E, et al. Cytochrome P4501A induction and inhibition by 3,3′,4,4′-tetrachlorobiphenyl in an Ah receptor-containing fish hepatoma cell line (PLHC-1) [J]. Aquatic Toxicology, 1993,26:185–208.
[15]Smith E M, Wilson J Y. Assessment of cytochrome P450 fluorometric substrates with rainbow trout and killifish exposed to dexamethasone, pregnenolone-16α-carbonitrile, rifampicin, and β-naphthoflavone [J]. Aquatic Toxicology, 2010,97:324–333.
[16]Frasco M, Guilhermino L. Effects of dimethoate and betanaphthoflavone on selected biomarkers of Poecilia reticulata [J]. Fish Physiology and Biochemistry, 2002,26:149–156.
[17]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72:248–254.
[18]Schwaiger J, Ferling H, Mallow U, et al. Toxic effects of the non-steroidal anti-inflammatory drug diclofenac: Part I: histopathological alterations and bioaccumulation in rainbowtrout [J]. Aquatic Toxicology, 2004,68:141–150.
[19]Liu J, Lu G, Ding J, et al. Tissue distribution, bioconcentration, metabolism, and effects of erythromycin in crucian carp (Carassius auratus) [J]. Science of the Total Environment, 2014, 490:914–920.
[20]Mehinto A C, Hill E M, Tyler C R. Uptake and biological effects of environmentally relevant concentrations of the nonsteroidal anti-inflammatory pharmaceutical diclofenac in rainbow trout (Oncorhynchus mykiss) [J]. Environmental Science & Technology, 2010,44:2176–2182.
[21]Sun Y, Yu H, Zhang J, et al. Bioaccumulation, depuration and oxidative stress in fish Carassius auratus under phenanthrene exposure [J]. Chemosphere, 2006,63:1319–1327.
[22]Cheng J, Mao L, Zhao Z, et al. Bioaccumulation, depuration and biotransformation of 4,4′-dibromodiphenyl ether in crucian carp (Carassius auratus) [J]. Chemosphere, 2012,86:446–453.
[23]Blüthgen N, Zucchi S, Fent K. Effects of the UV filter benzophenone-3 (oxybenzone) at low concentrations in zebrafish (Danio rerio) [J]. Toxicology and Applied Pharmacology, 2012, 263:184–194.
[24]Blüthgen N, Meili N, Chew G, et al. Accumulation and effects of the UV-filter octocrylene in adult and embryonic zebrafish (Danio rerio) [J]. Science of the Total Environment, 2014,476: 207–217.
[25]Kaiser D, Sieratowicz A, Zielke H, et al. Ecotoxicological effect characterisation of widely used organic UV filters [J]. Environmental Pollution, 2012,163:84–90.
[26]Uno T, Ishizuka M, Itakura T. Cytochrome P450 (CYP) in fish [J]. Environmental Toxicology and Pharmacology, 2012,34:1–13.
[27]Liu J, Lu G, Wang Y, et al. Bioconcentration, metabolism, and biomarker responses in freshwater fish Carassius auratus exposed to roxithromycin [J]. Chemosphere, 2014,99:102–108.
[28]Li Z, Lu G, Yang X, et al. Single and combined effects of selected pharmaceuticals at sublethal concentrations on multiple biomarkers in Carassius auratus [J]. Ecotoxicology, 2012,21: 353–361.
[29]Ding J, Lu G, Li S, et al. Biological fate and effects of propranolol in an experimental aquatic food chain [J]. Science of the Total Environment, 2015,532:31–39.
[30]Grabicova K, Fedorova G, Burkina V, et al. Presence of UV filters in surface water and the effects of phenylbenzimidazole sulfonic acid on rainbow trout (Oncorhynchus mykiss) following a chronic toxicity test [J]. Ecotoxicology and Environmental Safety, 2013, 96:41–47.
[31]van der Oost R, Beyer J, Vermeulen N P. Fish bioaccumulation and biomarkers in environmental risk assessment: a review [J]. Environmental Toxicology and Pharmacology, 2003,13:57–149.
[32]张家禹,刘丽丽,李 国,等.毒死蜱对斑马鱼胚胎氧化应激效应研究 [J]. 中国环境科学, 2016,36(3):927–934.
[33]Liu J, Lu G, Wu D, et al. A multi-biomarker assessment of single and combined effects of norfloxacin and sulfamethoxazole on male goldfish (Carassius auratus) [J]. Ecotoxicology and Environmental Safety, 2014,102:12–17.
[34]Liu H, Sun P, Liu H, et al. Hepatic oxidative stress biomarker responses in freshwater fish Carassius auratus exposed to four benzophenone UV filters [J]. Ecotoxicology and Environmental Safety, 2015,119:116–122.
[35]Xie Z, Lu G, Li S, et al. Behavioral and biochemical responses in freshwater fish Carassius auratus exposed to sertraline [J]. Chemosphere, 2015,135:146–155.
Bioconcentration of organic UV filters in Carassius auratus and metabolic enzyme response.
LU Guang-hua1*, LI Sheng2, ZONG Yong-chen1, HUANG Yi1(1.College of Hydraulic and Civil Engineering, Xizang Agriculture and Animal Husbandry College, Linzhi 860000, China;2.Key Laboratory of Integrated Regulation and Resources Development of Shallow Lakes, Ministry of Education, College of Environment, Hohai University, Nanjing 210098, China). China Environmental Science, 2017,37(9):3576~3582
The semi static exposure test was used to investigate the distribution and accumulation of organic UV filter 2-ethylhexyl 4-dimethylaminobenzoate (OD-PABA) in different tissues in Carassius auratus and to determine its ecotoxicological effects. The contents of OD-PABA in different tissues increased corresponding to the increasing exposure concentrations, and reached the maximum at day 14 or 28. The bioconcentration factor (BCF) of OD-PABA in different tissues obviously depended on the different exposure concentrations, and the BCF values calculated at day 14 and 28 were 123~186 in liver, 117~163 in skin and 90.2~147 in kidney, respectively. OD-PABA significantly induced EROD, PROD, BFCOD and GST activities in fish liver, EROD and GST activities showed more remarkable responses, and the maximum induction folds were 0.97 and 0.53, respectively. Our results suggest that OD-PABA in water can concentrate in Carassius auratus and be biotransformed by I phase and II phase metabolic enzymes.
Carassius auratus;OD-PABA;tissue distribution;bioconcentration;metabolic enzyme
X171.5
A
1000-6923(2017)09-3576-07
2017-02-15
西藏农牧学院雅江学者计划(2015XYA01);国家自然科学基金创新群体项目(51769034)
* 责任作者, 教授, ghlu@hhu.edu.cn
陆光华(1969-),女,吉林乾安人,教授,博士,主要从事水环境保护研究.发表论文170余篇.

