子宫内膜癌组织中miRNA-302c的表达变化及其意义
杜宁宁,谭文举,李洪言,付娟娟
(1安徽省亳州市人民医院,安徽亳州 236800;2安徽医科大学第一附属医院;3安徽医科大学第二附属医院)
子宫内膜癌组织中miRNA-302c的表达变化及其意义
杜宁宁1,谭文举1,李洪言2,付娟娟3
(1安徽省亳州市人民医院,安徽亳州236800;2安徽医科大学第一附属医院;3安徽医科大学第二附属医院)
目的观察子宫内膜癌组织中miRNA-302c的表达变化,并探讨其临床意义。方法选择2012年1月~2013年12月收治的51例子宫内膜癌患者的手术切除肿瘤组织标本为观察组,同期因子宫肌瘤行全子宫切除术的40例患者的正常子宫内膜组织标本为对照组。采用实时荧光定量PCR法检测两组标本中的miRNA-302c。分析51例子宫内膜癌患者肿瘤组织标本miRNA-302c相对表达量与临床病理参数的关系。采用受试者工作曲线和最大约登指数法确定用子宫内膜癌组织标本miRNA-302c表达量预测患者死亡和复发的截断值,将其用截断值分为高miRNA-302c表达组和低miRNA-302c表达组,采用Kaplan-Meier法计算并比较高、低miRNA-302c表达组的3年累计生存率和复发率。结果观察组、对照组miRNA-302c表达量分别为1.721±2.804、4.024±6.518,两组相比P<0.05。51例子宫内膜癌患者子宫内膜癌组织标本miRNA-302c表达量与临床分期、分化程度、淋巴结转移有关(P均<0.05)。用肿瘤组织标本miRNA-302c表达量预测患者死亡的截断值为1.568,用其将51例子宫内膜癌患者分为高miRNA-302c表达组(miRNA-302c表达量<1.568)30例和低miRNA-302c表达组(miRNA-302c表达量≥1.568)21例,其3年累计生存率分别为96.67%(29/30)、90.47%(19/21),P<0.05。用肿瘤组织标本miRNA-302c表达量预测患者复发的截断值为1.803,用其将51例子宫内膜癌患者分为高miRNA-302c表达组(miRNA-302c表达量<1.803)24例和低miRNA-302c表达组(miRNA-302c表达量≥1.803)27例,其复发率分别为16.67%(4/24)、29.63%(8/27),P<0.05。结论子宫内膜癌组织miRNA-302c表达降低。检测子宫内膜癌组织miRNA-302c表达有助于判断子宫内膜癌的临床分期、分化程度、淋巴结转移及预测预后、复发。
子宫内膜癌;微小RNA;微小RNA-302c
子宫内膜癌是临床上较为常见的女性生殖道肿瘤之一,主要是指原发于子宫内膜的一组上皮性恶性肿瘤[1]。有研究报道显示,子宫内膜癌为女性生殖道的三大恶性肿瘤之一,其发病率在所有女性肿瘤中位居第四,仅低于大肠癌、肺癌以及乳腺癌[2]。因此,对患者进行早期有效的诊断及治疗显得尤为重要。而明确其具体的发病机制是临床有效治疗的必经途径[3]。近年来研究报道,在子宫内膜癌的发生、发展过程中,微小RNA(miRNA)表达谱具有显著的异常[4]。miRNA-302c参与了卵巢癌的发生发展过程[5]。但是目前子宫内膜癌组织中miRNA-302c表达的变化及其临床意义尚未见研究报道。我们对此进行了研究。
1 资料与方法
1.1 临床资料 选择2012年1月~2013年12月收治的51例子宫内膜癌患者的手术切除肿瘤组织标本为观察组。患者年龄51~74(61.2±4.2)岁。均根据2009年国际妇产科联盟所制定的子宫内膜癌诊断及分期标准确诊,临床分期Ⅰ期37例,Ⅱ期4例,Ⅲ期5例,Ⅳ期5例;分化程度低分化5例,中分化18例,高分化28例;有淋巴结转移6例,无淋巴结转移45例;有肌层浸润4例,无肌层浸润47例。患者手术前均未行激素治疗及放化疗。随访3年,临床及随访资料齐全。另取同期因子宫肌瘤行全子宫切除术的40例患者的正常子宫内膜组织标本为对照组,患者年龄53~73(61.3±4.3)岁。两组患者年龄相比P>0.05。本研究已经医院伦理委员会批准,入组者均已签署知情同意书。
1.2 miRNA-302c检测方法 采用实时荧光定量PCR法。先参照RNAiso Plus试剂盒说明书操作提取总RNA,然后采用Takara公司生产的miRNA专用逆转录试剂盒行逆转录,反应体系(10 μL)为mRQ Buffer(2×)5 μL,RNA Sample 3.75 μL,mRQ Enzyme 1.25 μL。反应条件为37 ℃ 1 h,85 ℃ 5 min。然后行实时荧光定量PCR。反应体系(20 μL)为SUBR Premix Ex Taq Ⅱ(2×)10 μL,PCR For-ward Primer(10 μmol/L)0.8 μL,PCR Reverse Primer(10 μmol/L)0.8 μL,R0X Reference Dye Ⅱ(50×)0.4 μL,DNA2.0 μL,ddH2O 6.0 μL。反应条件:95 ℃ 30 s,95 ℃ 3 s,61 ℃ 30 s,重复40个循环。以U6为内参照,采用2-△△Ct表示miRNA-302c表达量。
1.3 子宫内膜癌组织miRNA-302c表达与子宫内膜癌预后和复发的关系分析方法 绘制用子宫内膜癌组织标本miRNA-302c表达量预测患者死亡和复发的受试者工作曲线,用最大约登指数法确定截断值,据此将子宫内膜癌患者分为高、低miRNA-302c表达组,比较3年累计生存率和复发率。
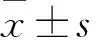
2 结果
2.1 两组miRNA-302c表达量比较 观察组、对照组miRNA-302c相对表达量分别为1.721±2.804、4.024±6.518,两组相比P<0.05。
2.2 子宫内膜癌组织miRNA-302c表达与子宫内膜癌临床病理参数的关系 见表1。子宫内膜癌患者子宫内膜癌组织标本miRNA-302c表达量与临床分期、分化程度、淋巴结转移有关(P均<0.05),与肌层浸润无关(P>0.05)。
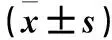
表1 子宫内膜癌组织miRNA-302c表达与子宫内膜癌临床病理参数的关系
2.3 子宫内膜癌组织miRNA-302c表达与子宫内膜癌预后和复发的关系 用子宫内膜癌组织标本miRNA-302c表达量预测患者死亡的截断值为1.568,用其将51例子宫内膜癌患者分为高miRNA-302c表达组(miRNA-302c表达量<1.568)30例和低miRNA-302c表达组(miRNA-302c表达量≥1.568)21例,其3年累计生存率分别为96.67%(29/30)、90.47%(19/21),P<0.05。用子宫内膜癌组织标本miRNA-302c表达量预测患者复发的截断值为1.803,用其将51例子宫内膜癌患者分为高miRNA-302c表达组(miRNA-302c表达量≥1.803)24例和低miRNA-302c表达组(miRNA-302c表达量<1.803)27例,其复发率分别为16.67%(4/24)、29.63%(8/27),P<0.05。
3 讨论
子宫内膜癌占所有女性生殖道恶性肿瘤的20%~30%,且随着我国人们生活水平的不断改变以及生活习惯的逐渐变化,该病发病率正呈逐年上升趋势,甚至开始趋于年轻化,严重影响了我国妇女的身心健康[6,7]。虽然大部分子宫内膜患者均存在显著的临床症状,可得到早期有效的诊断以及治疗,但仍有部分患者在就诊时便已是晚期。由此,子宫内膜癌的早期发现以及治疗对改善疾病预后以及延长患者生存时间具有极其重要的意义[8]。近年来随着人们对miRNA分子的作用以及机制了解的逐渐深入,其已成为临床研究肿瘤发生、发展的热点[9,10]。miRNA是由22~25个核苷酸组成的一种非编码单链小RNA,其主要作用是通过和靶基因mRNA产生作用,从而使得其在转录后的翻译过程中受到抑制或被降解,进一步降低了其蛋白表达水平,最终在多项生命过程中发挥至关重要的作用[11,12]。有研究报道显示,miRNA-302c会对细胞周期产生一定影响,同时在染色体结构的形成以及p63基因的蛋白、mRNA表达方面均具有一定的作用[13,14]。国内外已有研究报道显示,miRNA-302c在多种恶性肿瘤中具有抑制肿瘤细胞增长殖的作用。
本研究结果显示子宫内膜癌组织中miRNA-302c表达低于正常子宫内膜组织。这提示miRNA-302c表达下调与子宫内膜癌有关。安琪等[15,16]研究显示,miRNA-302c在肝癌细胞中发挥的作用是通过抑制异黏蛋白的表达,从而对内皮-间充质转化产生一定的抑制作用,进一步对肝癌细胞的生长繁殖产生明显的抑制作用。周胤健等[17,18]研究证实,乳腺癌细胞中miRNA-302c可有效抑制下游基因ERα表达。结合本研究结果,笔者认为在子宫内膜癌组织中,miRNA-302c也可能是通过与靶基因的结合,从而达到抑制肿瘤生长繁殖的目的。
本研究结果显示,临床分期Ⅰ期者子宫内膜癌组织miRNA-302c表达量高于Ⅱ~Ⅳ期者,低分化子宫内膜癌组织miRNA-302c表达量低于中、高分化患者,有淋巴结转移的子宫内膜癌组织miRNA-302c表达量低于无淋巴结转移者。表明miRNA-302c与子宫内膜癌的临床分期、分化程度及淋巴结转移有关,且miRNA-302c可能发挥类似抑癌基因的作用。王颖等[19,20]认为,肿瘤细胞中miRNA-302c可直接或间接发挥抑癌基因的作用,并以此对肿瘤细胞的增殖、分化以及凋亡进行调节,参与了肿瘤的发生、发展、侵袭以及转移。本研究结果与其相似。这提示我们检测子宫内膜癌组织miRNA-302c表达有助于判断子宫内膜癌的临床分期、分化程度、淋巴结转移。目前对于miRNA-302c如何调控细胞的增殖、分化以及凋亡仍不清楚,可以确定的是miRNA-302c可以通过与多种癌基因的3′非编码区片段结合,从而阻断基因的表达,但哪些基因是miRNA-302c的作用靶点仍不清楚,而研究其作用机制将是我们今后研究的重点,这有利于为子宫内膜癌的早期诊断以及有效治疗。
本研究结果显示,子宫内膜癌组织miRNA-302c表达与患者预后和复发有关,miRNA-302c表达相对较低者复发较多,预后不佳。这进一步证明miRNA-302c在子宫内膜癌组织中具有类似抑癌基因的功能。检测子宫内膜癌组织miRNA-302c有助于判断子宫内膜癌组织的预后和复发情况,具有重要的临床意义。
[1] 张凤仙,张建,陈素芸,等.18F-FDG PET/CT显像SUVmax对子宫内膜癌术前浸润及转移的评估价值[J].中华核医学与分子影像杂志,2017,37(2):75-80.
[2] 孔祥怡.微小RNA与子宫内膜癌关系的研究进展[J].现代妇产科进展,2013,22(10):843-845.
[3] Wilczynski M, Danielska J, Dzieniecka M, et al. Prognostic and clinical significance of miRNA-205 in endometrioid endometrial cancer[J]. PLoS One, 2016,11(10):164687-164688.
[4] Alowayed N, Salker MS, Zeng N, et al. LEFTY2 controls migration of human endometrial cancer cells via focal adhesion kinase activity (FAK) and miRNA-200a[J]. Cell Physiol Biochem, 2016,39(3):815-826.
[5] Dong P, Ihira K, Xiong Y, et al. Reactivation of epigenetically silenced miR-124 reverses the epithelial-to-mesenchymal transition and inhibits invasion in endometrial cancer cells via the direct repression of IQGAP1 expression[J]. Oncotarget, 2016,7(15):20260-20270.
[6] 饶云霞.子宫内膜癌患者血清 HE4、CP2、HCgp-39含量与肿瘤恶性程度的关系探究[J].海南医学院学报,2017,23(4):444-447.
[7] 叶文蔚,郑飞云,程爱花,等.miR-205对Ⅱ型子宫内膜癌细胞生物学行为的调空作用研究[J].医学研究杂志,2016,45(7):47-51.
[8] 张金霞,林明燕,林亚,等.miR-34c抑制人子宫内膜癌的机制分析[J].中华全科医学,2016,14(8):1282-1285.
[9] 李飘飘,包珊.子宫内膜癌中miRNA与自噬的研究进展[J].海南医学,2014,25(21):3201-3203.
[10] 王淑芳,冯玉珍,霍新龙,等.MicroRNA在子宫内膜癌发生、发展及临床诊治中的研究[J].中国医药导报,2013,10(6):30-32.
[11] 杨艳.食管癌相关微RNA研究进展[J].肿瘤研究与临床,2017,29(2):129-133.
[12] 孔祥怡,周怀君.miRNA-30c及其靶基因MTA-1在子宫内膜癌裸鼠皮下移植瘤中的作用[J].东南大学学报(医学版),2016,35(3):364-370.
[13] 李华伟,张哲.miR-302a在胃癌中表达及其对胃癌细胞凋亡与细胞周期影响[J].临床军医杂志,2017,45(1):42-45.
[14] Gui J, Yan F, Yu B, et al. MicroRNA miR-302?inhibits the tumorigenicity of endometrial cancer cells by suppression of Cyclin D1 and CDK1[J]. Cancer Lett, 2014,345(01):39-47.
[15] 安琪,马晓欣.miRNA-302 c在子宫内膜癌组织中的表达及其与临床病理资料的关系[J].现代肿瘤医学,2017,25(1):127-130.
[16] 李宝恒,宋岩峰.microRNA在妇科疾病中的作用[J].中华临床医师杂志(电子版),2016,10(6):844-848.
[17] 周胤健,杜英,梅丽娜,等.子宫内膜癌microRNA表达谱的初步研究[J].中华实验和临床病毒学杂志,2014,28(4):280-282.
[18] Zhou C, Gu HF, Rong T, et al. MicroRNA 302/367 cluster effectively facilitates direct reprogramming from human fibroblasts into functional neurons[J]. Stem Cells Dev, 2015,24(23):2746-2755.
[19] 王颖,阿迪拉·斯依提,张晓明,等.子宫内膜癌微小RNA的表达特点及其临床意义[J].中华病理学杂志,2014,43(2):88-94.
[20] 刘霞,夏伟,邵宁生,等.微小RNA-200b对子宫内膜癌细胞中TIMP2基因表达的影响[J].中华妇产科杂志,2013,48(11):867-869.
10.3969/j.issn.1002-266X.2017.35.015
R737.35
B
1002-266X(2017)35-0047-03
2017-05-23)
安徽省科技厅科技攻关项目(1604a0802098) 。

