草甘膦农药残留检测方法研究进展
李燕虹,王飞翔,陈春牡,潘俊坤,王 耀
草甘膦农药残留检测方法研究进展
李燕虹,王飞翔,陈春牡,潘俊坤,⋆王 耀
(河南科技大学食品与生物工程学院,河南洛阳 471023)
草甘膦农药因具有低毒、高效的特点,目前已成为全球生产及使用量最大的除草剂之一,但其潜在毒性近年来也引起了人们的广泛关注,并且对于草甘膦残留的检测研究也备受重视。对草甘膦残留的检测方法及研究进展进行综述,主要探讨了化学分析法、酶联免疫吸附测定法、分光光度法、高效液相色谱法、高效液相色谱-质谱联用法、气相色谱法、气相色谱-质谱联用法、电化学方法在草甘膦残留检测中的应用,为草甘膦残留检测深入研究提供参考。
草甘膦;残留;检测;研究进展
0 引言
草甘膦(Glyphosate) 是目前世界上使用量最大的除草剂之一,广泛应用于控制农田或非耕作用地中的一年生或多年生杂草生长[1]。草甘膦是一种生物蛋白质合成的抑制剂,通过抑制5-烯醇丙酮莽草酸3-磷酸盐合成酶(5-enolpyruvylshikimate-3-phosphatesynthase,EPSPs) 的活性,使蛋白质合成受阻,致使植物死亡[2]。草甘膦及其代谢物易吸附于土壤中,经食物链富集作用危害人体健康,经一系列研究证实,草甘膦具有致畸作用[3],对生物的遗传、发育和生殖[4-5]都有一定的毒副作用。由于环境中存在的草甘膦残留对人体健康具有潜在危害,近年来针对草甘膦残留的检测研究备受重视。对目前草甘膦残留的检测方法和研究进展进行综述,以期对检测方法的深入研究提供参考,为加强草甘膦残留监控、降低草甘膦残留风险提供支撑。
1 草甘膦残留概述
1.1 草甘膦的化学性质
1.2 草甘膦的特性及作用机制
草甘膦是一种内吸传导型除草剂,可被植株上所有绿色部分吸收。向植物喷洒草甘膦农药后,能被植株的茎叶吸收并向下传导,杀死多年生深根植物深埋地下的根茎;也可以在同一植株的不同分蘖间进行传导,杀死未接触到药剂的分蘖或分枝。草甘膦在植物韧皮部和木质部的传导速度受植物种类、发育阶段、土壤的湿度、环境的相对湿度和温度等多种因素的影响[6]。草甘膦属广谱灭生性除草剂,对几乎所有的双子叶杂草、一年生或多年生禾本科植物和灌木等都具有较好的防除作用,能杀死世界上最难根除的多年生深根性杂草,如香附子、假高粱、马唐、通灵草、油草等,且不易使杂草对其产生抗性。
草甘膦的除草作用是通过抑制莽草酸途径中的EPSPS活性来实现的。因EPSPS在芳香氨基酸(如苯丙氨酸、酪氨酸和色氨酸) 的生物合成中具有重要的作用,而草甘膦抑制EPSPS的活性使莽草酸途径堵塞,使蛋白质合成受到抑制,从而导致高等植物消耗芳香族氨基酸,致使植物死亡,达到除草目的[7]。
1.3 草甘膦的危害
草甘膦在很长一段时间被认为是一种较为安全、毒性较低的除草剂,然而毒理学研究显示,长期接触草甘膦会对人体健康造成一定的影响,尤其是在生殖发育方面。2015年3月,世界卫生组织的国际癌症研究机构(IARC)将草甘膦定义为“对人类可能的致癌物”。有研究显示,孕妇在妊娠期间暴露于含有草甘膦的环境下,其生出的后代存在包括无脑畸形、小头畸形及颅骨畸形等的生育缺陷[3]。Mink P J等人[4]从草甘膦早期使用者中随机抽取536个家庭中的1 532名儿童作为样本,通过电话随访进行调查记录,调查发现父母接触过草甘膦的儿童患多动症风险与父母未接触草甘膦的儿童相比要高2.6倍。Clegg B S等人[5]发现双脐螺在10%的草甘膦有效质量分数下暴露4周,可导致其生存率和产卵数与对照组相比有比较明显降低,且异常卵的数量显著增加。
1.4 草甘膦残留限量标准
据了解,当天,楚雄供电局安全监察部员工孔雷、李辉福、大姚供电局石羊供电所员工文华及驾驶员尹亮正驱车前往大姚县石羊镇岔河二队,准备对10kV石西线大修技改施工现场开展安全监督检查。途径石羊长园水库时,他们注意到水库边上围着一群人,所有人神色慌张,不知所措。直觉告诉孔雷,出事了,他立即将车叫停,三步并作两步冲向人群,原来是一辆面包车不慎驶入了里长园水库。
草甘膦在农业生产上的大量使用,导致其在自然环境中存在较大残留量,残留物质污染环境,并通过食物链的富集作用转移到人体,威胁人体健康,目前已有多篇报道表明水源水及食品均有草甘膦的残留。例如,2015年河南省生活饮用水和水源水中草甘膦污染状况的初步调查显示,在3个不同地区采取水源水样品54份,生活饮用水29份,其中生活饮用水中均未检出草甘膦残留,水源水样品中草甘膦的检出率为24.07%[8]。我国台湾省食药署2016年燕麦产品抽检结果显示,总计抽检的市售36款燕麦片产品中有10款燕麦片检出草甘膦农药[9]。德国慕尼黑环境研究所2016年公布的一份实验室检测报告显示,德国最受欢迎的14种啤酒中被检测出含有不同程度的农药残留物草甘膦,这些啤酒中的草甘膦含量介于 0.46~29.74 μg/L[10]。吴晓刚等人[11]和诸力等人[12]利用高效液相色谱法对部分市售茶进行检测,部分样本也检出草甘膦残留。
草甘膦及其代谢产物(AMPA)可在自然界长期持久存在且不易被代谢,可被人群以多种途径接触后影响机体的健康。因此,很多国家和地区都对草甘膦的使用作出了限制,并将其残留限量列入相关法规和标准中,美国现行 的饮用水标准中规定草甘膦污染物最高质量浓度(Maximumcontaminant level,MCL)为0.7 mg/L[13]。同样,我国生活饮用水卫生国家标准(GB 5749—2006) 中规定的草甘膦最大残留限量也为0.7 mg/L;食品中草甘膦残留的最大限量则规定得更为详细。
国家标准GB 2763—2014规定的各类食品中草甘膦最大残留限量见表1。
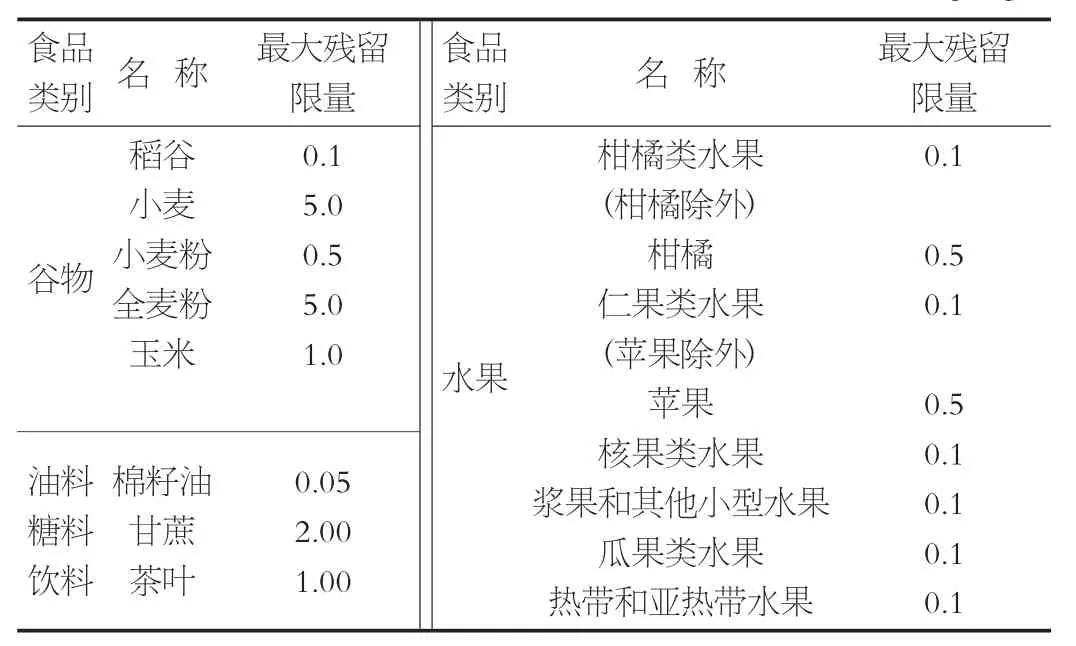
表1 国家标准GB 2763—2014规定的各类食品中草甘膦最大残留限量/mg·kg-1
由这些严格的限量规定可以看出,目前对于草甘膦残留的检测已成为农药残留检测中的重要检测项目,对于其检测方法的研究和开发具有较强的现实意义。
2 草甘膦残留检测方法
2.1 化学分析法
化学分析法是根据特定的反应与剂量关系对待测物质进行分析,包括质量分析及滴定分析等方法[14],属于最传统的一类检测方法。周洁薇[15]建立了一种电位滴定测定草甘膦的方法,即以汞电极作为指示电极,根据标准溶液用量测出络合物总量,以偶氮胂Ⅱ为络合指示剂测定杂质含量,用差减法计算草甘膦含量。范淑霞[16]采用亚硝酸钠标准溶液滴定的方法对草甘膦进行了分析,结果显示该法平行误差在0.2%~0.5%。董文庚等人[17]建立间接测定草甘膦的褪色分光光度方法,在pH值6.5醋酸-醋酸钠缓冲溶液中草甘膦与微量过量溴发生化学反应,使罗丹明B褪色,检测范围随着加入溴溶液浓度变化而变化,溴浓度为1.44×10-5mol/L和2.72×10-5mol/L时,测定范围分别为0~0.5 mg/L和0.4~0.9 mg/L。采用化学分析法检测草甘膦残留,虽然方法操作简单、快捷,但检测范围较窄、灵敏度低、测定结果误差较大。
2.2 酶联免疫吸附测定法
酶联免疫吸附测定法(Enzyme linked immunosorbent assay,ELISA)是一种以抗原抗体特异性结合反应为基础,将该反应与酶对底物高效催化作用结合起来的高灵敏免疫学检测方法[18-19]。因其特异性强、稳定性好、准确性高、适用性强、检测迅速、经济实用等优点,在疾病诊断、疫病防控、食品卫生和环境监测[20-23]中应用广泛。
Selvia等人[24]以草甘膦-碱性磷酸酶偶联物作为酶标物质建立了一种简单的竞争ELISA方法,用来测定食品中的草甘膦残留,该方法检测限为2 ng/mL。潘熙萍等人[25]采用EDC法将草甘膦分别与BSA和OVA偶联制备免疫原(PMG-BSA)和包被原(PMGOVA),通过用合成的免疫原对新西兰大白兔进行免疫采血,制备草甘膦多抗血清,建立了草甘膦间接竞争ELISA检测方法。Morti M等人[26]建立ELISA方法,对地下水资源中草甘膦残留进行检测,结果显示检测范围为0.05~0.12 μg/L。ELISA虽然已是一类成熟的免疫学检测方法,但其在草甘膦残留检测中的应用仍十分有限。
2.3 分光光度法
用来检测草甘膦的分光光度法主要有紫外分光光度法和褪色分光光度法。分光光度法操作简便、分析快速,但容易受到其他离子,尤其是受其最大吸收波长相近物质的干扰。吴淑彬等人[27]利用草甘膦在酸性条件下与亚硝酸钠反应生成草甘膦亚硝基衍生物,这种化合物于波长243 nm处有最大吸收峰的特点,根据所生成的衍生物在一定浓度范围内吸光度含量的线性关系绘制标准曲线,由标准曲线确定草甘膦含量。
Jan M R等人[28]建立了一种简便的分光光度法检测环境和生物样品中草甘膦的含量,利用草甘膦与二硫化碳形成二硫代氨基甲酸并随后在氨存在下与铜形成配合物,于波长435 nm处测定得到的黄色铜二硫代氨基甲酸盐络合物的吸光度,测得草甘膦检测限与定量限分别为1.1 ng/mL和3.7 ng/mL。汪海萍等人[29]研究并讨论了亚硝基衍生化紫外分光光度法用于检测废水中草甘膦的实用性,通过改变加入硫酸量来分析其对亚硝化反应的影响,结果表明应根据样品的酸碱性来调整硫酸的用量,该方法的检测限是0.069 mg/L,检测上限是50.0 mg/L。李国鹏等人[30]在甘氨酸存在的情况下用紫外分光光度计法来测定废水中草甘膦,测定其质量分数为1.10%。
2.4 高效液相色谱法
高效液相色谱是以经典液相色谱法为基础发展而来的一种具有高分离速率、高分离效率和高检测灵敏度等特点的柱色谱技术。不受样品挥发性、热稳定性及相对分子质量的限制,流动相选择范围广,可与样品分子发生选择性的相互作用,为控制和改善分离条件提供了一个可变因素,该方法是草甘膦检测的常用方法之一[31-33]。Ofitserova M等人[34]和Zhang Y等人[35]采用高效液相色谱荧光法检测大豆中的草甘膦残留量,结果均获得较低检测限。Wang Shu等人[36]用9-芴基氯仿衍生草甘膦后,采用高效液相色谱荧光法检测海水中的草甘膦,检测限为0.60 ng/L。Rodríguez等人[37]以 1,2-萘醌 -4-磺酸作为柱前衍生剂,采用高效液相色谱法测定土壤中草甘膦和氨甲基膦酸的含量,测得草甘膦和氨甲基膦酸的检测限分别为0.064 mg/kg和0.098 mg/kg。
高效液相色谱-质谱联用法是高效液相色谱检测方法的发展,目前国内外在检测食品及水中草甘膦残留方面已有应用[11,38-40]。Todorovic G R 等人[40]建立了一种用硼酸钠提取土壤中的草甘膦,经SPE步骤净化提取液,利用高效液相色谱-质谱联用检测草甘膦的方法。Guo H等人[41]采用高效液相色谱-电喷雾质谱的方法检测环境水中草甘膦含量,结果显示添加回收率为85%~112%,线性相关系数大于0.997。Chamkasem N等人[42]采用液相色谱-质谱法直接检测大豆、玉米中的草甘膦含量,结果显示其线性范围为10~1 000 ng/mL,相关系数大于0.995。
2.5 气相色谱法
气相色谱法以气体作为流动相,利用混合物中各组分在两相中的吸附系数或者分配系数的不同进行分离,通常用来监测分析气态物质或在一定的温度下能够转化为气体的物质。气相色谱分离效能高、选择性高、灵敏度高,但是操作步骤繁琐、仪器昂贵、对操作人员要求高。王天玉等人[43]采用气相色谱检测白茯苓、山药等中药材中的草甘膦残留量,固相萃取后用三氟乙醇(TFE) 和三氟乙酸酐(TFAA)进行衍生,经氮磷检测器检测,检测限为0.05 mg/kg。
气相色谱-质谱联用是将气相色谱的高效分离能力与质谱的准确鉴定能力有效地结合起来,以达到提高检测水平的目的。Saito T等人[44]和Motojyuku M等人[45]都采用气相色谱-质谱法检测血清中草甘膦及其代谢物含量。Saito T等人[44]将样品经C-C-18单片旋转柱萃取后检测,结果显示草甘膦及其分解物的检测限分别为10,5 ng/mL;Motojyuku M等人[45]对经固相萃取后的血清进行检测,结果显示草甘膦及其代谢物在3~100 ng/mL范围内呈线性关系。Steinborn A等人[46]建立了一种以三氟乙酸衍生化草甘膦,然后经气相色谱-质谱检测的方法,该方法的检测限为1 ng/mL。
2.6 电化学方法
电化学方法是将生物组分(如酶、抗体等)与电化学相结合,制备生物传感器,检测特定的化合物。该法具有高度专一、分析速度快、灵敏度高、选择性高、价格低廉等优势,多被用于医疗分析、环境质量控制等方面。
有研究以纳米材料和多酚氧化酶修饰的玻碳电极为工作电极,Hg/HgCl为参比电极,铂丝为对电极建立三电极体系,用于检测草甘膦残留量。碳纳米材料与多酚氧化酶质量比为1∶2修饰工作电极,在pH值为6时,所得传感器对草甘膦的检测限为3.5 μg/L,线性检测范围为 5~60 μg/L。采用电化学沉积法将辣根过氧化物酶修饰金电极表面,依据加入缓冲液中草甘膦标准溶液质量浓度变化能够引起底物H2O2浓度变化的原理,建立了一种生物电化学检测草甘膦含量的方法,线性范围为0.25~14.0 ng/L,检测限为1.70 ng/L。
3 小结及展望
近年来,有关草甘膦残留对人体健康存在威胁的研究报道越来越多,人们对草甘膦残留问题的关注度也越来越高,对草甘膦残留检测方法研究更加重视。目前,草甘膦残留检测的方法包括化学分析法、分光光度法、高效液相色谱法、气相色谱法等传统方法,以及酶联免疫法、电化学分析等快速方法。在这些方法中,色谱方法和质谱联用方法已取得阶段性成果,在草甘膦残留检测方面应用较为普遍,但这些方法前处理复杂、检测耗时、难以进行高通量分析,对其推广应用产生了一定限制。与国外相比,我国免疫检测、电化学检测等快速检测技术起步较晚,方法还未成熟,仍有较大的发展空间。
近年来,随着纳米技术的飞速发展,促进了其与传统检测方法的融合,发展出许多简便省时、灵敏特异的检测方法,为农药残留检测提供了新思路。因此,目前针对草甘膦残留的检测方法如果能够在利用纳米材料或其他识别分子的基础上进行改进,必将创新出更多高通量、高灵敏、强特异的快速检测方法,为草甘膦的安全检测与监控提供强有力的技术支撑。
[1]Duke S O,Powles S B.Glyphosate:a once in a century herbicide[J].Pest Management Science,2008,64 (4):319-325.
[2]卢信,赵炳梓,张佳宝,等.除草剂草甘膦的性质及环境行为综述 [J].土壤通报,2005,36(6):147-152.
[3]Barky F A,Abdelsalam H A,Mahmoud M B,et al.Influence of atrazine and roundup pesticides on biochemical and molecular aspects of biomphalaria alexandrina snails[J].Pesticide Biochemistry and Physiology,2012(1):9-18.
[4]Mink P J,Mandel J S,Lundin J I,et al.Epidemiologic studies of glyphosate and non-cancer health outcomes:a review[J].Regulatory Toxicology and Pharmacology,2011,61 (2):172-184.
[5]Clegg B S,Stepheesoo G R,Hall J C.Development of an enzyme-linked immunosorbent assay for the detection of glyphosate[J].Journal of Agricultural and Food Chemistry,1999,47(12):5 031-5 037.
[6]Marc J, Mulner Lorillon O, Bellé R.Glyphosate based pesticides affect cell cycle regulation[J].Biology of the Cell,2004 (3):245-249.
[7]卢素格,翟志雷,张榕杰,等.河南省生活饮用水和水源水中草甘膦污染现状的初步调查 [J].环境卫生学杂志,2015(1):55-57.
[8]周垂帆,李莹,张晓勇,等.草甘膦毒性研究进展 [J].生态环境学报,2013,22(10):1 737-1 743.
[9]中国食品科技网.台湾地区抽检燕麦产品美国桂格燕麦检出草甘膦 [EB/OL].2016-05-27.http://www.tech-food.com/news/detail/n1282810.htm.
[10]央视新闻.德国多种啤酒中检测出农药残留物草甘膦[EB/OL].2016-02-26.http://news.cntv.cn/2016/02/26/ARTI8wcooIar n6Q0YNdJCRXy160226.shtml
[11]吴晓刚,陈孝权,肖海军,等.柱前衍生-超高效液相色谱-串联质谱法同时检测茶叶中草甘膦和草铵膦的残留量 [J].色谱,2015,33(10):1 090-1 096.
[12]诸力,陈红平,周苏娟,等.超高效液相色谱-串联质谱法测定不同茶叶中草甘膦、氨甲基膦酸及草铵膦的残留 [J].分析化学,2015(2):271-276.
[13]刘强,王晓昌,李世俊,等.美国现行饮用水水质标准简介 [J].给水排水,2006,32(11):106-111.
[14]刘晓玉,肖珊珊,李军,等.食品和水质中草甘膦检测方法及研究进展 [J].食品安全质量检测学报,2015(6):2 241-2 247.
[15]周洁薇.电位滴定法测定草甘膦 [J].农药,1981(3):24-25.
[16]范淑霞.亚硝化滴定法分析草甘膦 [J].农药,1988(3):25-31.
[17]董文庚,陈学诚,郎志敏,等.褪色分光光度法间接测定草甘膦 [J].分析化学,1997(10):1 210-1 212.
[18]Gonzalez-Martinez M Á,Brune M,Puchades R,et al.Glyphosateimmunosensor:applicationfor water and soil analysis[J].Analytical Chemistry,2005 (13):4 219-4 227.
[19]Rubio F,Veldhuis L J,Clegg B S,et al.Comparison of a direct ELISA and an HPLC method for glyphosate determinations in water[J].Journal of Agricultural and Food Chemistry,2003,51 (3):691-696.
[20]麻安喆.酶联免疫法和胶体金法对比检测病毒性丙型肝炎 [J].检验医学与临床,2014(7):953-956.
[21]梁艳,吴雪琼,王兰,等.应用酶联免疫斑点试验检测入伍新兵结核潜伏感染 [J].中国感染控制杂志,2011,10(4):244-247.
[22]张也,刘以祥.酶联免疫技术与食品安全快速检测 [J].食品科学,2003(8):200-204.
[23]刘娜,孟庆雷,钟立华.酶联免疫吸附法在环境监测领域中的应用 [J].安徽农业科学,2008(24):10 673-10 674.
[24]Selvia A,Sreenivasa M A,Manonmani H K.Enzymelinked immunoassay for the detection of glyphosate in food samples using avian antibodies[J].Food and Agricultural Immunology,2011,22 (3):217-228.
[25]潘熙萍,楼佳俊,张高精,等.草甘膦残留的酶联免疫分析方法的建立 [J].湖北农业科学,2012,51(5):1 002-1 005.
[26]Morti M,Nemeth G,Juracsek J,et al.Determination of glyphosate residues in hungarian water samples by immunoassay[J].Microchemical Journal,2013 (10):143-151.
[27]吴淑彬,刘国红,王欣茹,等.紫外分光光度法检测血清草甘膦中毒方法的建立和应用 [J].国际检验医学杂志,2014(8):1 024-1 025.
[28]Jan M R, Shah J, Muhammad M, et al.Glyphosate herbicide residue determination in samples of environmental importance using spectrophotometric method[J].Journal of Hazardous Materials,2009 (1):742-745.
[29]汪海萍,邵燕,王志良,等.分光光度法测定废水中草甘膦的探讨 [J].环境监测管理与技术,2012,24(3):56-59.
[30]李国鹏,周彩荣,石晓华,等.分光光度法测定草甘膦生产废水中草甘膦和甘氨酸的含量 [J].郑州大学学报(理学版),2012,44(2): 81-84.
[31]汪琳,曾锦明,韩燕飞,等.直接进样高效液相色谱-柱后衍生法检测水中草甘膦和氨甲基膦酸 [J].现代科学仪器,2010(6):99-100.
[32]王聪,刘颖超,庞民好,等.高效液相色谱柱后衍生法测定农田沟渠水中草甘膦残留 [J].植物保护,2012(5):96-99.
[33]索莉莉,胡美华,朱群英.超高效液相色谱柱后衍生法检测水中的草甘膦 [J].现代预防医学,2015(15):2 806-2 809.
[34]Ofitserova M,Smith R,Pickering M.Glyphosate analysis in soy beans,corn, and sunflower seeds by HPLC with post-column derivatization and fluorescence detection[J].LC GC North America,2011 (6):34-35.
[35]Zhang Y, Zhang Y, Qu Q, et al.Determination of glyphosate and aminomethylphosphonic acid in soybean samples by high performance liquid chromatography using a novel fluorescent labeling reagent[J].Analytical Methods,2013 (5):6 465-6 472.
[36]Wang Shu,Liu Baomin,Yuan Dongxing.A simple method for the determination of glyphosate and aminomethy lphosphonic acid in seawater matrix with high performance liquid chromatography and fluorescence detection[J].Talanta,2016(6):700-706.
[37]Rodriguez, Ávila J A.Determination of glyphosate and aminomethylphosphonic acid in soils by HPLC with precolumn derivatization using 1,2-naphthoquinone-4-sulfonate[J].2014(5):1 298-1 309.
[38]Ehling S,Reddy T M.Analysisofglyphosate and aminomethylphosphonic acid in nutritional ingredients and milk by derivatization with fluorenyl methyloxycarbonyl chlo-
[39]ride and liquid chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry,2015,63 (4):10 562-10 568.
[40]Ding J,Jin G,Jin G,et al.Determination of underivatized glyphosate residues in plant-derived food with low matrix effect by solid phase extraction-liquid chromatography-tandem mass spectrometry[J].Food Analytical Methods,2016 (10):2 856-2 863.
[41]Todorovic G R,Mentler A,Popp M,et al.Determination of glyphosate and AMPA in three representative agricultural Austrian soils with a HPLC-MS/MS method[J].Soil and Sediment Contamination:An International Journal,2013,22 (3):332-350.
[42]Guo H,Riter L S,Wujcik C E,et al.Direct and sensitive determination of glyphosate and aminomethylphosphonic acid in environmental water samples by high performance liquid chromatography coupled to electrospray tandem mass spectrometry[J].JournalofChromatographyA,2016(14):93-100.
[43]Chamkasem N,Harmon T.Direct determination of glyphosate,glufosinate,and AMPA in soybean and corn by liquid chromatography/tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2016 (18):4 995-5 004.
[44]王天玉,武秀停,赵静,等.固相萃取-气相色谱法测定薏苡仁、白茯苓和山药中的草甘膦残留 [J].分析科学学报,2014,30(1):63-66.
[45]Saito T,Miura N,Namera A,et al.Mixed-mode C-C18 monolithic spin-column extraction and GC-MS for simultaneous assay of organophosphorus compounds,glyphosate,and glufosinate in human serum and urine[J].Forensic Toxicology,2012,30 (1):1-10.
[46]Motojyuku M,Saito T,Akieda K,et al.Determination of glyphosate,glyphosatemetabolites,andglufosinateinhuman serum by gas chromatography-mass spectrometry[J].Journal of Chromatography B,2008(2):509-514.
[47]Steinborn A,Alder L,Michalski B,et al.Determination of glyphosate levels in breast milk samples from Germany by LC-MS/MS and GC-MS/MS[J].Journal of Agricultural and Food Chemistry,2016,64 (6):1 414-1 421.◇
Advances in the Detection Methods Research of Glyphosate Residues
LI Yanhong,WANG Feixiang,CHENChunmu,PANJunkun,⋆WANG Yao
(College of Food and Bioengineering,He'nan University of Science and Technology,Luoyang,He'nan 471023,China)
Because of its low toxicity,high efficiency,glyphosate has become one of the most widely used herbicides in the world.However,its potential toxicity and the study of glyphosate residue detection have attracted much attention in recent years.In this paper,the methods of detecting glyphosate residues in recent years are reviewed,mainly discusses the chemical analysis methods,enzyme linked immunosorbent assay,spectrophotometry,high performance liquid chromatography,high performance liquid chromatography-mass spectrometry,gas chromatography,gas chromatography-mass spectrometry,electrochemical method for residue detection advantages and disadvantages in the application of glyphosate,provide reference for further research on detection of glyphosate.
glyphosate;residue;detection;research advance
TS207.53
A
10.16693/j.cnki.1671-9646(X).2017.09.020
1671-9646(2017) 09a-0070-05
2017-05-12
国家级大学生创新创业训练计划项目(201610464035);河南科技大学大学生研究训练计划项目(2016064);河南科技大学博士科研启动基金项目(13480062);河南省高等学校重点科研项目(15A550003)。
李燕虹(1992— ),女,硕士,研究方向为食品安全检测。
⋆通讯作者:王 耀(1986— ),男,博士,讲师,研究方向为食品安全检测。

