盐胁迫下硝态氮对甘薯根系发育及荧光系统活性的影响
李路瑶,丁效东,李威威,张德龙,刘庆,史衍玺,张士荣
(青岛农业大学资源与环境学院,山东 青岛 266109)
盐胁迫下硝态氮对甘薯根系发育及荧光系统活性的影响
李路瑶,丁效东,李威威,张德龙,刘庆,史衍玺,张士荣
(青岛农业大学资源与环境学院,山东 青岛 266109)
选取商19(盐敏感型)和济23(耐盐型)两个甘薯品种,设两个盐氮(NaCl:1、120 mmol·L-1;NO3--N:1、10 mmol·L-1)水平,采用营养液水培法,研究盐氮交互作用对耐盐型和盐敏感型甘薯根系发育及叶片荧光系统活性的影响。结果表明:1)相同盐、氮水平处理时,两基因型甘薯其根系总长度差异不显著,同一盐水平,J23根系干重随氮浓度增加呈降低趋势,S19随氮素加入而升高;而盐敏感型甘薯在轻盐水平或重盐水平下根尖数都多于耐盐型甘薯;相同盐氮耦合处理下,与耐盐型(J23)相比,盐敏感型(S19)甘薯根系活力受到的影响更为严重;2)耐盐型和盐敏感型甘薯最大光化学效率平均值差异不显著,因此甘薯品种之间的耐盐性对植株最大光化学效率的影响差异不显著;3)相同氮水平下,随NaCl浓度升高,甘薯的根系总长度、根表面积、根体积、根系活力以及最大光化学效率等指标都有所下降;4)相同NaCl水平下,随氮素营养的加入甘薯细胞中硝态氮含量随之增加,甘薯的根系总长度、根表面积、根体积、根系活力以及最大光化学效率等指标都有所上升;5)硝态氮的供应可缓解盐胁迫对甘薯根系生物量、根系活力以及叶绿素荧光系统的抑制作用。
盐胁迫;硝态氮;甘薯;根系;荧光系统
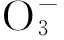
KeywordsSalt stress; Nitrate nitrogen; Sweet potato; Root; Fluorescence system
甘薯(IpomoeabatatasLam.)是一种产量高、风味好、营养价值高的粮食作物,我国甘薯栽培面积和产量均居世界前列[1]。我国长江以北以及沿海许多地区,土壤中盐碱含量往往过高,这使得甘薯的经济产量和增产潜力受到限制。盐胁迫是灌溉农业的主要限制因子,对植物的生长影响是不可忽视的[1]。盐分诱导的渗透胁迫和离子胁迫,导致许多生理生化如水分关系、气体交换、离子平衡等过程的紊乱,导致作物产量降低,甚至绝收[2]。植株体内的生理过程决定植物对环境胁迫的响应,并受到许多环境因素的影响。荧光系统活性是植物生长发育的基础,以往围绕改善植物光合及荧光性能的研究较多。前人在生物膜能量流动的基础上建立了针对快速叶绿素荧光诱导动力学曲线的分析技术(JIPtest),使研究逆境对光合组织影响成为可能,并在高温、低温和盐胁迫等方面得到广泛应用[3, 4]。
研究表明,硝酸盐(NO3)是植物重要氮源,根系对其吸收是通过细胞膜上的硝酸盐转运体吸收转运,由H+-ATP酶提供H+梯度[5],是主动吸收过程。因此研究盐胁迫下硝态氮如何影响制约荧光系统活性具有重要意义[6]。近年来,研究发现部分甘薯品种具有一定耐盐性,但品种间差异较大,且对不同基因型甘薯耐盐机理及其耐盐差异的研究进展不大[7]。本研究选取耐盐型、盐敏感型两个基因型甘薯,研究盐胁迫下硝态氮对甘薯根系生长发育及叶绿素荧光系统的影响,旨在为甘薯耐盐生理研究和高产栽培提供理论依据。
1 材料与方法
1.1试验材料
供试甘薯品种,商19(S19,盐敏感型)和济23(J23,耐盐型)。试验于2014年在青岛农业大学植物营养网室进行。采用水培试验,以自然光作为光源;水培容器为5 L塑料桶,并覆盖带有小孔的泡沫板,每孔种植1株甘薯幼苗。营养液为霍格兰营养液和阿农微量元素营养液,配方(mol·L-1):Ca(NO3)2·4 H2O 2.0×10-3、K2SO40.75×10-3、KCl 0.1×10-3、KH2PO40.25×10-3、MgSO4·7H2O 0.65×10-3、H3BO31.0×10-6、MnSO4·H2O 1.0×10-6、ZnSO4·7H2O 1.0×10-6、CuSO4·5H2O 1.0×10-7、(NH4)6Mo7O24·4H2O 5.0×10-9、EDTA-NaFe 0.1×10-3。
1.2试验设计
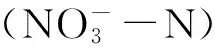
水培期间,每隔3天换1次营养液。高盐处理时达最高盐浓度预定值24天后,收获植株,测其鲜重、干重,并测定总根长、根系表面积、根系总体积及相关生理指标。
1.3测定指标及方法
1.3.1 地上部和根系鲜重、干重测定 将现取植株的地上部和根系分开,离子水冲洗,吸干,称重,记录鲜重;然后将植物鲜样放在烘箱中105℃杀青30 min,80℃烘72 h,称重,记录干重。
1.3.2 甘薯总根长、根系表面积、根系总体积测定 取收获后甘薯根系,利用根系扫描仪(LA1600+scanner,Cannada)扫描根系形态,用WinRHIZO根系分析系统分析根系参数(根系总根长、表面积、总体积)。
1.3.3 甘薯根系活力测定 根系用蒸馏水洗净后,用TTC法进行根系活力测定[8]。
1.3.4 甘薯叶片荧光系统活性 利用美国汉莎公司生产的M-PEA仪器,在甘薯生长30天时测定叶片叶绿素荧光参数。测定时,选取不同处理的甘薯第5片功能叶进行暗适应30 min,然后利用仪器与电脑连接进行测定。
1.4统计分析
采用SPPS统计分析软件包(SPPS 16.0 for windows,Chicago,USA)对数据进行统计分析。两者之间的比较用独立样本t检验,三者或三者以上的比较用多重比较。多重比较时,首先对数据进行方差齐性检验,若方差检验结果为齐性,采用LSD法进行多重比较;若方差检验结果为非齐性,则用Tamhane’s T2法进行多重比较。
2 结果与分析
2.1不同盐氮处理对不同基因型甘薯根系生长发育的影响
由表1可知,N1、N2处理,无论盐敏感型(S19)或耐盐型(J23)甘薯其根系干重均随盐浓度增加而降低。同一盐水平,J23根系干重随氮浓度增加呈降低趋势,S19随氮素加入而升高。可知对盐敏感型甘薯来讲,氮素的加入可使盐分对甘薯根系有机物积累的抑制起到缓解作用,但高盐处理下的耐盐型(J23)甘薯,加入氮素反而加重了盐分对甘薯根系有机物积累的抑制。
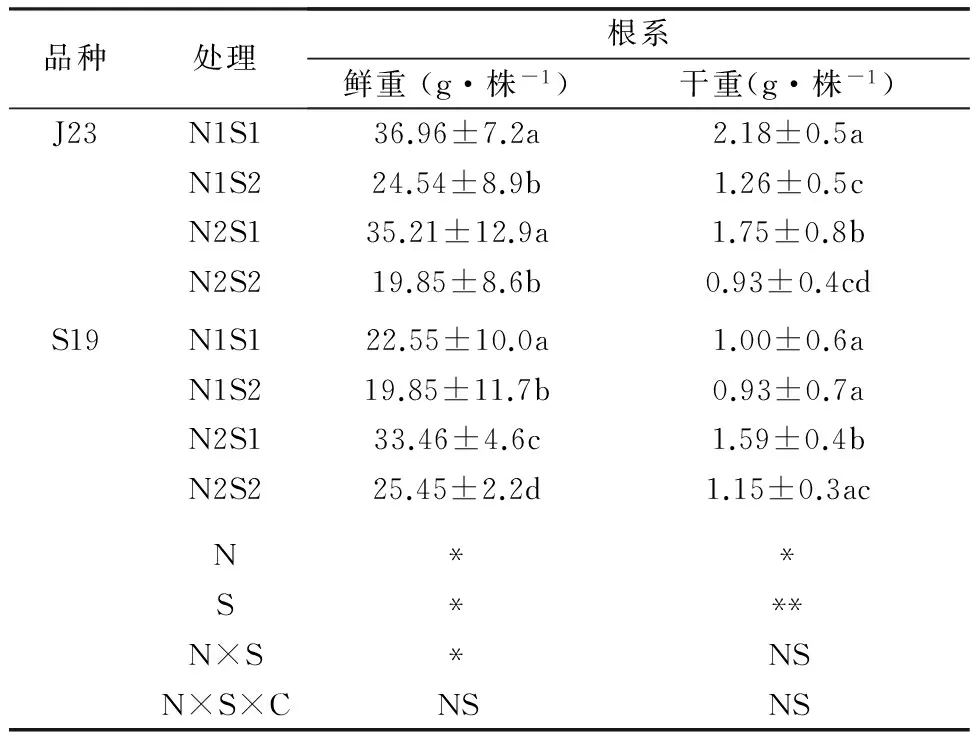
表1不同盐氮处理植株根系生物量
注: 表中同品种同列数据后不同小写字母表示处理间差异显著(P<0.05);*表示P<0.05,**表示P<0.01,下同。
由表2可以看出,耐盐型甘薯(J23)在相同氮水平下,随着盐分浓度增加甘薯根尖数、根总表面积以及总根长显著下降,表明盐胁迫对其根系的形态发育有较为明显的抑制作用;而相同盐水平下,增加氮素营养,根尖数、根总表面积以及总根长都有一定幅度的增加,表明氮素的加入可缓解盐分对根系生长发育带来的抑制。盐敏感型甘薯(S19)在相同氮水平下,随盐浓度的升高,甘薯根尖数、根总表面积以及总根长显著下降,表明盐浓度对盐敏感型甘薯根系发育的影响较大;而在相同盐水平下,增加氮素营养,根尖数、根总表面积以及总根长都有一定幅度的增加,尤其是根尖数的增幅是巨大的,即氮素的增加可缓解盐分对根系发育带来的抑制。
两种基因型甘薯比较,在相同处理下,耐盐型(J23)和盐敏感型(S19)甘薯在根表面积及总根长两者之间的差异不明显。但单从根尖数这一指标来看,盐敏感型(S19)甘薯在轻盐水平或重盐水平下根尖数都多于耐盐型(J23)甘薯,且随氮素营养的增加,根尖数的增幅远远大于耐盐型(J23)甘薯。
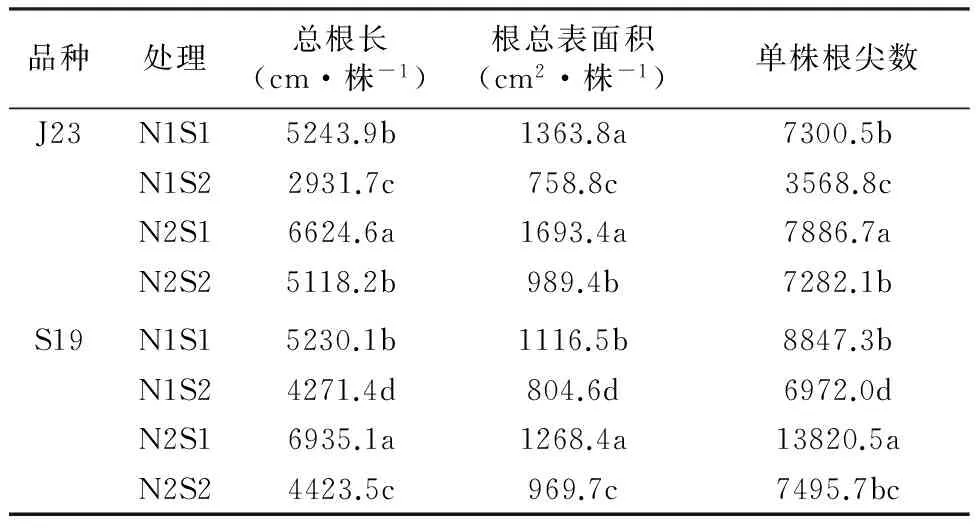
表2盐氮处理对不同基因型甘薯根系生长发育的影响
2.2盐氮耦合对不同基因型甘薯根系活力的影响
由图1可知,耐盐型(J23)甘薯在同一氮素水平下,随着盐分浓度增加根系活力减小,而在同一盐水平下,随着氮素营养增加,根系活力有所增加,显示氮素可缓解盐分胁迫对甘薯苗期根系活力的抑制。盐敏感型甘薯(S19)与此趋势相同。
J23根系活力范围在385.0~531.9 mg·g-1·h-1之间,平均根系活力为443.2 mg·g-1·h-1;S19根系活力平均范围是115.4~441.5 mg·g-1·h-1之间,平均根系活力为290.0 mg·g-1·h-1。即相同盐氮耦合处理下,与耐盐型(J23)相比,盐敏感型(S19)甘薯根系活力受到的影响更为严重。综合分析,盐胁迫对不同基因型甘薯根系活力的抑制明显,氮素增加可有效缓解抑制,相比于耐盐型其对盐敏感型 (S19)甘薯根系活力带来的缓解作用更为显著。
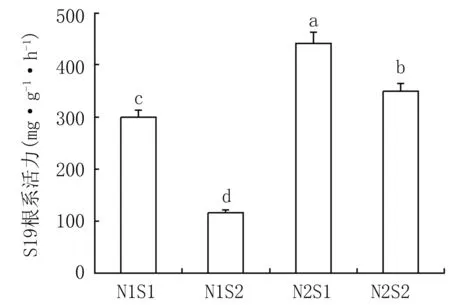
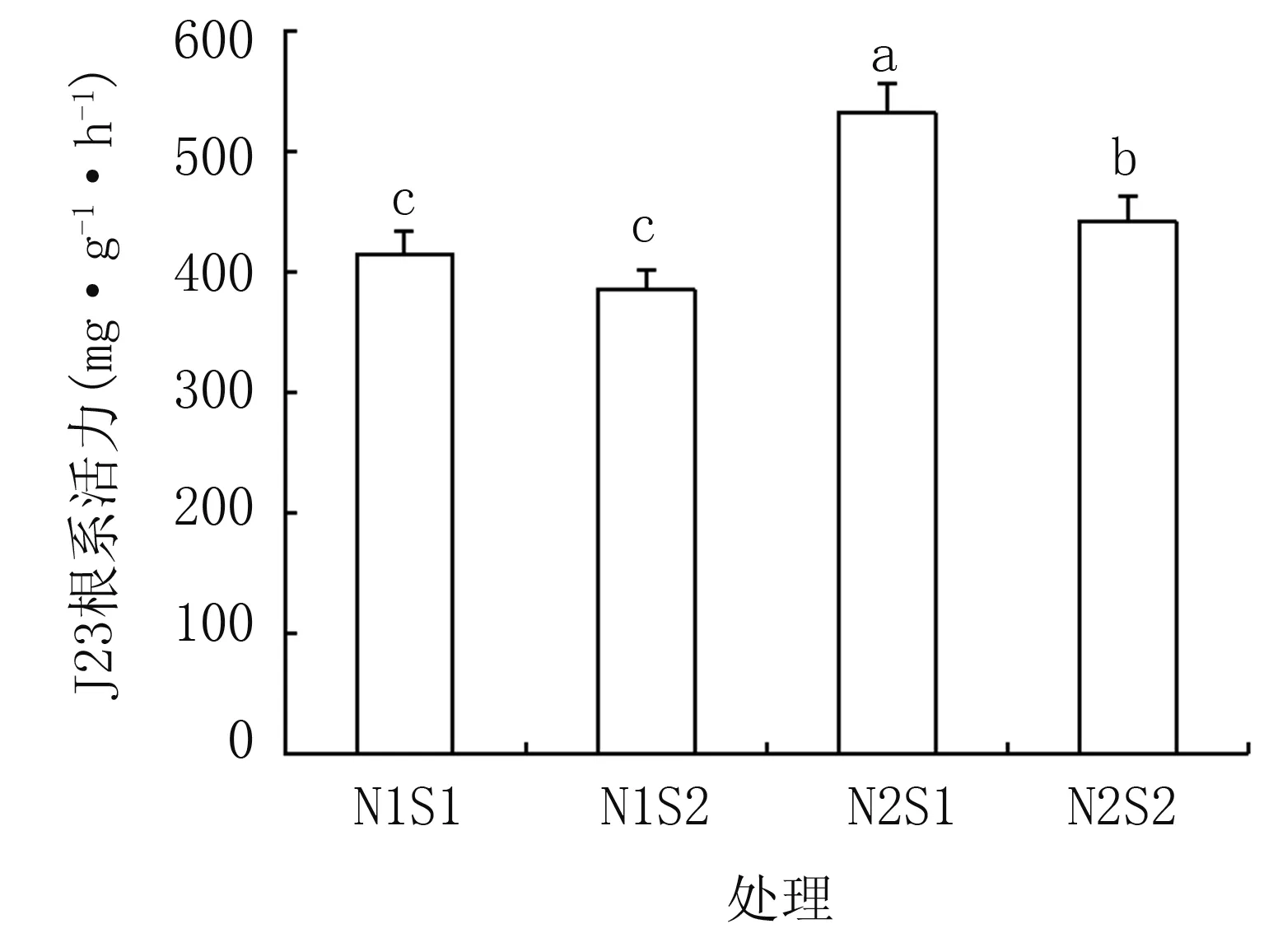
图1 盐氮处理对不同基因型甘薯植株根系活力的影响
2.3不同盐氮耦合对不同基因型甘薯叶片荧光系统性能的影响
由表3可以看出,耐盐型甘薯J23在相同氮水平下,最大光化学效率(Fv/Fm)随盐分浓度的升高而降低,但差异不显著;在相同盐水平S1下,最大光化学效率(Fv/Fm)随氮素含量的增加而增加,差异也不显著。盐敏感型甘薯S19在相同氮水平(N1)下,最大光化学效率(Fv /Fm)随盐浓度的升高而降低,且差异显著;在相同盐水平(S2)下,最大光化学效率(Fv /Fm)随氮素含量的增加而增加,且差异显著。可以看出,盐胁迫会导致 PSⅡ系统受到轻微损害。综合分析,两种基因型甘薯在高盐浓度下可以引发光合电子传递受阻,导致 PSⅡ受到损害,最大光化学效率(Fv/Fm)下降,而随氮素的增加最大光化学效率(Fv/Fm)有所提高,表明氮素的加入缓解了此种抑制。
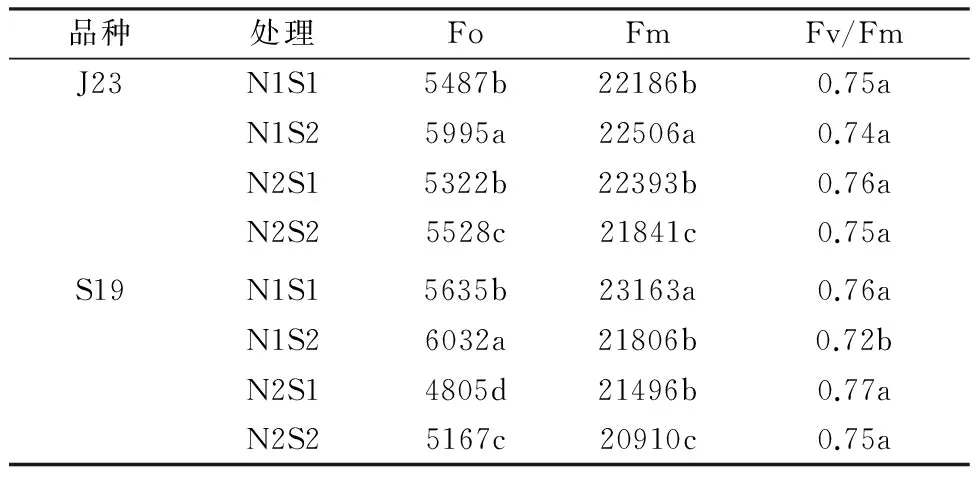
表3不同盐氮处理对不同基因型甘薯叶绿素荧光参数的影响
注:Fo:初始荧光,Fm:最大荧光,Fv:可变荧光,Fv/Fm:最大光化学效率。
由图2可知,耐盐型甘薯J23在相同氮水平下,叶片的PIABS随盐分浓度的升高而降低,可知在高盐浓度下光合反应中心活性降低;在相同盐水平下,叶片的PIABS随氮素含量的增加而增加,缓解了盐害对光合反应的抑制。盐敏感型甘薯趋势相同。耐盐性甘薯(J23)本身的自我适应性调节,一定程度上可以恢复维持基本生理功能的光合电子传递速率,但在高盐浓度下盐敏感型比耐盐型光合反应中心活性降低更加显著。综合分析,两种基因型甘薯叶片在高盐浓度下其光合反应中心活性显著下降,叶片的PIABS呈下降趋势,而随氮素的增加叶片的PIABS呈上升趋势,表明氮素的加入缓解了此种抑制。
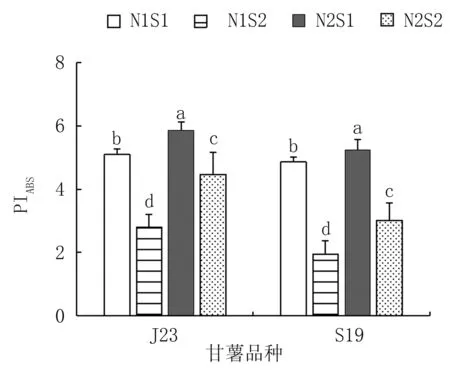
图2 不同盐氮处理对不同基因型甘薯叶绿素荧光参数的影响
3 讨论与结论
3.1盐氮耦合处理对不同基因型甘薯根系生长发育的影响
李金耀等[7]认为盐分可抑制植物组织和器官的生长和分化,提早植物的发育进程。张建锋等[9]发现盐分对苗木的成活和生长都有一定的抑制作用,随盐分浓度的升高,苗木成活率、苗高与苗重、地下部分生物量、叶片叶绿素含量都下降,叶片脯氨酸含量提高。本研究中盐胁迫对两种基因型甘薯根系的生长发育都有一定的抑制作用,随盐浓度增加而受到的抑制作用越明显,向其加入适量氮素会减缓其抑制作用,尤其是对盐敏感型甘薯(S19)来讲,盐浓度增加对其根系各项生理指标的影响更为严重。但对于耐盐型甘薯在高盐环境中来讲,其本身的耐盐能力可减缓盐分对根系带来的影响,若向此环境中继续加入氮素养分,随着硝态氮在甘薯根系中积累而使其离子浓度过高而对根系的生长发育造成抑制,因此在高盐环境中,对于氮肥的施入更应注意。
3.2盐氮耦合处理对不同基因型甘薯根系活力的影响
盐胁迫下,植物根系最早感受逆境胁迫信号,并产生相应的生理反应,继而影响地上部生长,且盐胁迫常导致植物根系生长受抑制[11]。本研究结果表明,盐胁迫下两种基因型甘薯的根系活力均呈下降趋势,说明盐胁迫对甘薯根系活力有抑制作用;盐敏感型甘薯根系活力比耐盐型的根系活力受影响更严重;随氮素的加入甘薯根系活力有所增加,表明氮素加入缓解了盐胁迫对甘薯根系活力的抑制。
3.3不同盐氮处理对甘薯叶片荧光系统性能的影响
叶绿素荧光被视为是研究植物光合作用与环境胁迫之间关系的内在探针,任何逆境对光合作用各过程产生的影响都可通过植物体内叶绿素荧光诱导动力学参数的变化反映出来[12, 13]。张晓海等[14]研究表明:在盐胁迫下,烤烟幼苗植株的生长和光合作用及荧光活性均受到明显抑制。色素分子由于吸收光量子转化为激态,从外围的天线系统传递到更接近反应中心(RC) 的光系统Ⅱ(PSⅡ)。室温下绝大多数叶绿素荧光都来自PSⅡ[15]。Fv/Fm 是指开放的PSⅡ反应中心捕获激发能的效率,即潜在光化学效率,该参数可反映植物PSⅡ受伤害的程度[16]。在非胁迫条件下,植物叶片的Fv/Fm比较恒定,不受物种和生长条件的影响,一般在0.80~0.85 之间[17]。Fv/Fm 的变化代表 PSⅡ光化学效率的变化,而以吸收光能为基础的性能指数PIABS可以更为准确地反映植物光合机构的状态,是光抑制程度的一个重要指标,其比值越高表明光抑制的程度越低,是研究植物胁迫的重要参数[18]。Aro等[19]认为盐胁迫可以改善 PSⅡ的功能,Everard等[20]则认为盐胁迫可以抑制PSⅡ的功能。叶绿素荧光参数 Fv/Fm和PIABS是光抑制程度的重要指标。本研究结果表明,随着盐胁迫浓度升高,两种基因型甘薯 Fv/Fm和PIABS均呈下降趋势,甘薯叶片光能吸收利用效率下降,均受到光抑制。可见盐胁迫首先影响了甘薯叶片PSⅡ 对光能的吸收和电子传递,进而降低了PSⅡ反应中心活性,使光合机构及活性中心受损。而随氮素的增加叶绿素荧光参数 Fv/Fm和PIABS均呈上升趋势,说明氮素的加入改善了盐胁迫对叶片荧光系统活性的抑制。
[1] 马代夫,李强,曹清河,等. 中国甘薯产业及产业技术的发展与展望[J]. 江苏农业学报,2012,28(5):969-973.
[2] 刘友良,毛才良,汪良驹. 植物耐盐性研究进展[J]. 植物生理学通讯,1987,23(4):1-7.
[3] Zhang Y L,Luo H H,Hu Y Y,et al. Characteristics of photosystemⅡ behavior in cotton (GossypiumhirsutumL.) bract and capsule wall[J]. Journal of Integrative Agriculture,2013,12(11):2056-2064.
[4] 张守仁,陈兰,周玉荣,等. 暖温带落叶阔叶林土庄绣线菊光合作用、叶绿素荧光、叶形态解剖特征对增强UV-B辐射的响应[C]//纪念殷宏章先生百年诞辰暨全国光合作用学术研讨会论文摘要汇编.中国植物生理学会光合与代谢专业委员会,2008.
[5] Aslan M,Travis R I,Huffaker R C. Comparative kinetics and reciprocal inhibition of nitrate and nitrite uptake in roots of uninduced and induced barley (HordeumvulgareL.) seedlings[J]. Plant Physiology,1992,99(3):1124-1133.
[6] Ding X D,Tian C Y,Zhang S R,et al. Effects of NO3-N on the growth and salinity tolerance ofTamarixlaxaWilld[J]. Plant and Soil,2010,331(1/2):57-67.
[7] 李金耀,张富春,马纪,等. 植物分子水平的耐盐机制[J]. 植物生理学通讯,2003,39(6): 715-719.
[8] 刘家尧,刘新. 植物生理学实验教程[M]. 北京:高等教育出版社,2010:46-47.
[9] 张建锋,孙启祥,Makeschin F. 盐胁迫对柳树新无性系苗木生长和土壤酶活性的影响[J]. 水土保持学报,2005,19(3):125-129.
[10] 白莉萍,隋方功,孙朝晖,等. 土壤水分胁迫对玉米形态发育及产量的影响[J]. 生态学报,2004,24(7):1556-1560.
[11] Cramer G R,Läuchli A,Epstein E. Effects of NaCl and CaCl2on ion activities in complex nutrient and root growth of cotton[J]. Plant Physiol.,1986,81:792-797.
[12] Maxwell K,Johnson G N. Chlorophyll fluorescence - a practical guide [J]. Journal of Experimental Botany,2000,51(345):659-668.
[13] Jiang C D,Gao H Y,Zou Q. Changes of donor and accepter side in photosystemⅡ complex induced by iron deficiency in atatched soybean and maize leaves[J]. Photosvnthetica,2003,41(2):267-271.
[14] 张晓海,蔡寒玉,汪耀富,等. 盐胁迫对烤烟幼苗生长及抗性生理的影响[J]. 中国农学通报,2005,21(11):189-192.
[15] 吴敏兰,贾洋洋,李荭荭,等. 镉胁迫对不同品种烟草生理及生长状况的影响[J]. 西北农林科技大学学报(自然科学版),2015,43(1):69-76.
[16] 黄建,冯耀祖,刘易,等. NaCl胁迫对蓖麻功能叶光系统Ⅱ荧光特性的影响[J]. 干旱区资源与环境,2015,29(7):145-149.
[17] Genty B,Briantais J M,Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J]. Biochimicaet Biophysica Acta (BBA):General Subjects,1989,990(1):87-92.
[18] 张谧,王慧娟,于长青. 超旱生植物沙冬青高温胁迫下的快速叶绿素荧光动力学特征[J]. 生态环境学报,2009,18(6):2272-2277.
[19] Aro E M,Vvirgin I,Andersson B. Photoinhibition and DI protein degradation in peas acclimated to different growth irradiance [J]. Plant Physiology,1993, 103:835-843.
[20] Everard J D,Gucci R,Kann S C,et al. Gas exchange and carbon partitioning in the leaves of celery (ApiumGraveolensL.) at various levels of root zone salinity[J]. Plant Physiology,1994,106(1):281-292.
EffectsofNitrateNitrogenonRootSystemDevelopmentandFluorescenceSystemActivityofSweetPotatounderSaltStress
Li Luyao, Ding Xiaodong, Li Weiwei, Zhang Delong, Liu Qing, Shi Yanxi, Zhang Shirong
(CollegeofResourcesandEnvironment,QingdaoAgriculturalUniversity,Qingdao266109,China)
10.14083/j.issn.1001-4942.2017.09.019
2017-05-23
国家甘薯产业技术体系岗位专家项目(CARS-11-B-14);青岛农业大学高层次人才科研基金项目(编号:6631115036);青岛农业大学2016年大学生科技创新项目“硝态氮对盐胁迫下甘薯的渗透调节作用”
李路瑶 (1996—),女,本科,主要从事甘薯生理生态研究。E-mail: 2546590462@qq.com
张士荣(1980—),女,讲师,主要从事植物营养与生理研究。E-mail:zhang_shirong@126.com
S531
A
1001-4942(2017)09-0101-06

