分子标记在石榴种质资源遗传多样性研究中的应用
王庆军,郝兆祥,罗华,赵丽娜,毕润霞,赵亚伟
(1.枣庄市石榴研究中心,山东 枣庄 277300;2.山东农业大学园艺科学与工程学院,山东 泰安 271018)
分子标记在石榴种质资源遗传多样性研究中的应用
王庆军1,2,郝兆祥1,罗华1,赵丽娜1,毕润霞1,赵亚伟1
(1.枣庄市石榴研究中心,山东 枣庄 277300;2.山东农业大学园艺科学与工程学院,山东 泰安 271018)
石榴为我国重要的浆果树种之一,种质资源丰富,全世界范围内有1 000多个石榴品种及野生型品种。本文综述了国内外分子标记在石榴种质资源遗传多样性研究中的应用进展,以期为该技术用于石榴种质资源的收集、分类、保存、遗传多样性评价及亲缘关系鉴定等研究提供更加科学的手段。
石榴;分子标记;遗传多样性;种质资源
AbstractPomegranate (PunicagranatumL.) is one of the important berry tree species in China, and its germplasm resources are abundant. There are more than 1 000 pomegranate cultivars and wild cultivars in the world. The current progresses at home and abroad in the application of molecular marker in pomegranate germplasm genetic diversity research were reviewed in this study. The aim of the study was to provide more scientific references for the collection, classification, preservation, genetic diversity evaluation and genetic relationship identification of pomegranate germplasm resources.
KeywordsPunicagranatumL.; Molecular marker; Genetic diversity; Germplasm
石榴(PunicagranatumL.)为石榴科(Punicaceae)、石榴属(PunicaL.)落叶灌木或小乔木,在我国南方则为常绿灌木或小乔木,起源于伊朗、土库曼斯坦和印度北部等地区,向东传播到东亚等国,向西传播到地中海地区及南、北美洲各适生地[1,2]。石榴具有较高的经济价值、营养价值、生态价值、观赏价值、文化价值等,越来越受到消费市场的青睐,国内外石榴产业发展迅速[3]。石榴在长期的传播和栽培过程中因基因突变、天然杂交、实生、分株、嫁接等原因形成了许多变异资源,极大地丰富了石榴的遗传多样性。到目前为止,全世界范围内有1 000多个石榴品种及野生型品种[4]。但石榴品种分类模糊不清,分类标准尚未统一,给石榴种质资源收集、保存、评价、创新等带来不便[5]。除了传统的形态学标记、细胞学标记和生物化学标记等技术在石榴种质资源遗传多样性研究上的广泛应用外,近年来,分子标记技术在石榴上的应用研究也快速发展。分子标记是以个体间遗传物质内核酸序列变异为基础的新型遗传标记,是DNA分子水平遗传多态性的直接反映。分子标记与形态学标记相比,是对基因的直接反映,不受外界环境等因素的影响,在植物生长的任何时期、任何部位都可检测到,不存在表达与否的问题,且标记位点极多,多态性丰富,检测方法迅速、简单,结果重复性好[6,7]。目前,RAPD、AFLP、SSR、SRAP等分子标记已在石榴种质资源遗传多样性研究上得到广泛应用。本文将系统介绍当前分子标记主要类型及特征,分别对常用的5种分子标记(RAPD、AFLP、SSR、ISSR、SRAP)在石榴种质资源遗传多样性研究中的应用进行综述,以期为石榴种质资源收集、保存、分类、遗传多样性及亲缘关系等方面研究提供可靠有效的手段参考。
1 RAPD分子标记
RAPD(random amplified polymorphic DNA)分子标记即随机扩增多态性标记,是由Willimas和Welsh等在1990年建立起来的一种以PCR技术为核心的新型分子遗传标记技术,其采用随机的核苷酸序列为引物(通常以10个核苷酸为引物),以基因组DNA为模板进行PCR扩增反应,形成不同大小的DNA片段,用于检测DNA序列的多态性[8]。由于其引物的设计具有随机性、DNA需要量少、技术简单、分析速度快、成本低等诸多优点,目前RAPD分子标记技术是国内外石榴种质资源遗传多样性研究中使用最多的分子标记技术之一(表1)。
在国内,卢龙斗等[9]以我国云南、安徽、河南等地的55份石榴栽培种质为试验材料,利用筛选出的15条多态性及重复性较好的引物进行RAPD研究,共扩增出125条带,其中多态性条带92条,多态性百分率达73.60%,表明种质间具有丰富变异。品种间的遗传距离为0.0889~0.9808,对55份材料进行聚类分析,从亲缘关系树状图看,在遗传距离4.0处把55份材料分为4个类群,从基因水平上揭示了石榴种质之间的亲缘关系。将聚类结果与形态特征中的花色、重萼或重瓣等分类结果进行对比,结果表明,与形态特征分类具有一定的差异,与依据花色及果味进行的分类无相关性,却与依据瓣型进行的分类存在一定的相关性。热娜·卡司木等[10]采用RAPD技术对新疆23份石榴品种进行遗传多样性及亲缘关系鉴定等研究,在50条10 bp随机引物中筛选出多态性高的7条引物进行RAPD扩增,共扩增出88个位点,其中多态性位点为61个,多态性百分率达69.00%。对23份材料的Nei相关系数进行聚类分析,从亲缘关系树状图看,在遗传距离0.848处把23份材料分为5个类群, RAPD结果与通过风味进行的品种分类存在一定相关性,但也未完全支持酸、酸甜和甜3类的品种划分方法。研究结果表明,即使父、母本相同,其石榴品种间的遗传多态性也存在明显差异,具有丰富的遗传多样性。马丽等[11]采用RAPD技术对38份石榴品种进行遗传多样性及亲缘关系研究,筛选出多态性及重复性较好的20条引物进行RAPD扩增,共扩增出146个DNA位点,其中多态性位点为109个,多态性百分率达74.60%。品种间的遗传相似系数为0.45~1.00,对38份材料进行聚类分析,从亲缘关系树状图看,在遗传相似系数0.58处把38份材料分为4个类群,结果显示,品种间的亲缘关系与形态学和地理分布没有明显相关性。利用20条RAPD引物的扩增结果对全部品种进行主坐标聚类分析,从主坐标二维聚类图可以看出,38份材料分为两大类,主坐标分析结果与UPGMA的聚类结果具有一定差异。以上研究都表明,采用RAPD技术可以把供试材料划分为不同类群,但杨荣萍等[12]采用RAPD技术对云南25份石榴品种进行遗传多样性及亲缘关系研究,从128条随机引物中筛选出多态性及重复性较好的12条引物进行RAPD扩增,共扩增出110条条带, 平均每个引物9.17条条带,多态性百分率达71.80%,扩增结果表明,25份石榴品种间存在一定的亲缘关系。品种间的遗传距离为0.027~0.342,对25份材料进行聚类分析,从亲缘关系树状图看,25份云南石榴品种的遗传背景较复杂且品种间具有丰富变异,难以划分类群。聚类结果与生产上根据风味、花色、皮色、籽粒颜色、核软硬程度及栽培目的等性状的分类结果不一致。张彦苹等[13]以16份石榴种质为试验材料,利用筛选出的10条多态性及重复性较好的引物进行RAPD分析,结果显示,石榴遗传多样性丰富,说明可以通过RAPD分子标记对石榴种质进行分子水平的种质鉴定及遗传多样性分析。
在国外,Sarkhosh等[14]采用RAPD技术对24个伊朗石榴品种的遗传多样性进行研究,从100个随机十聚体引物中筛选出多态性及重复性较好的16条RAPD引物,对试验材料进行RAPD扩增,共扩增出178条条带,平均每个引物扩增出11.13条条带,其中多态性条带有102条,多态性百分率达57.30%。对试验材料进行遗传相似性系数及聚类分析,遗传相似性系数为0.29~0.89,在60%的遗传相似性处,将试验材料分为4个类群。Masoud等[15]采用RAPD技术对10个石榴品种的遗传多样性进行研究,筛选出多态性及重复性较好的40条引物进行RAPD扩增,共扩增出2 050条条带,平均每个引物扩增出51.25条条带,其中215条为多态性条带,多态性百分率达10.50%,遗传相似性系数为0.36~0.86,表明RAPD分子标记是进行石榴遗传多样性分析的有效工具,特别是出现了特定条带,特定条带可以更好地区分不同的品种,也显示RAPD分子标记与形态学研究结果具有不一致性。Shinde等[16]采用RAPD技术对8份石榴品种进行遗传多样性及亲缘关系研究,筛选出多态性及重复性较好的5条引物进行RAPD扩增,共扩增出28条条带,其中多态性条带为25个,多态性百分率达89.28%。5条引物进行RAPD扩增条带数为4~7条,品种间的遗传相似系数为0.32~0.72,平均遗传相似系数为0.61。Sarkhosh、Masoud、Shinde等各自研究都表明,石榴品种具有丰富的遗传多样性,RAPD技术可有效运用于石榴品种的遗传多样性分析。Sarkhosh等[17]对来自伊朗的21份不同基因型的软籽石榴材料,通过37个形态性状分析与采用RAPD技术进行遗传多样性及亲缘关系分析,筛选出多态性及重复性较好的14个引物进行RAPD扩增,共扩增出146条条带,其中43条为多态性条带,多态性百分率达29.45%,基因型间的遗传相似系数为0.13~1.00,基于品种果实性状的分类与分子标记分类两者间无明显的相关性(r=-0.36)。Zamani等[18]采用RAPD技术与形态学性状分析了伊朗北部50个石榴品种,这50个石榴品种包括37个野生品种、12个栽培品种及1个外地品种。从形态学特征分析表明,果实直径、花青素指数、可溶性固形物、可滴定酸度、籽粒、籽粒硬度、果味及果皮厚度等为多态性主要指标。RAPD技术扩增出229条条带,其中174条为多态性条带,多态性百分率达76.90%,遗传相似系数为0.15~0.78,平均遗传相似系数为0.42,表明遗传多样性丰富,但形态学性状与RAPD分子标记之间的相关性较低(r=0.45)。Sarkhosh、Zamani等各自研究都表明,基于某些形态学性状的分类与分子标记分类间无明显的相关性。Hasnaoui等[19]采用RAPD技术对12个突尼斯石榴品种的遗传多样性进行研究,从12个引物中筛选出多态性及重复性较好的4个引物进行RAPD扩增,共扩增出29条条带,平均每个引物扩增出7.25条,4个引物扩增的条带数在3~11条,其中多态性条带24条,多态性百分率达82.76%。品种间的遗传相似系数为0.042~0.792,平均遗传相似系数为0.384,RAPD分类结果与石榴品种的地理来源无关。

表1 RAPD分子标记应用于石榴种质资源遗传多样性研究的情况
注:GS为遗传相似系数;GD为遗传距离,下表同。
2 AFLP分子标记
AFLP(amplified fragment length polymorphism)分子标记即扩增片段长度多态性,是由Zabeau和Vos在1993年发明的以PCR技术为核心的分子标记技术,该技术需经DNA提取、酶切、连接、预扩增、选择性扩增、变性聚丙烯酞胺凝胶电泳等步骤, 产生扩增片段长度不同的多态性带型[6]。AFLP分子标记具有多态性高、稳定性强、重复性好、技术精准高效、DNA量少、不需预知DNA序列信息等优点,目前在对石榴基因组序列等信息缺乏了解的情况下,AFLP分子标记技术是石榴种质资源遗传多样性研究的一种有效手段(表2)[20-22]。
在国内,赵丽华等[23]采用AFLP技术对四川和云南的42个石榴品种遗传多样性及亲缘关系进行分析,从64对引物中筛选出多态性好的5对引物进行AFLP扩增,共扩增出362条条带,其中多态性条带有235条,平均每对引物扩增出72.4条条带和47条多态性条带,多态性比率达65.66%,平均观测等位基因数(Na)、平均有效等位基因数(Ne)、平均Nei’s基因多样度(H)和平均香农信息指数(I)分别为1.6566、1.2607、0.1603和0.2531。品种间的遗传相似系数为0.7127~0.9254,平均为0.8142。通过聚类分析,在遗传相似性系数为0.8200时,可将试验材料分为4个类群。研究结果表明,四川和云南石榴品种资源间具有较丰富的遗传多样性。尤其随着荧光标记的使用,AFLP技术变得更简单快速。Yuan等[24]采用荧光标记AFLP技术对我国山东、河南、陕西等6个栽培主产区石榴群体的85个品种类型进行遗传多样性分析,8对引物在种级水平扩增的多态性条带为135~185条,平均每对引物扩增出多态性条带158.25条,多态性条带比率为62.5%~86.11%,平均为73.26%,表明中国石榴的遗传多样性较高,石榴品种间的遗传多样性高于群体水平。对试验材料进行聚类分析,来自同一区域的多数品种聚为一类。苑兆和等[25]利用荧光AFLP技术对山东25个石榴品种遗传多样性及亲缘关系进行分析,从64对引物中筛选出多态性好、谱带清晰的8对引物进行AFLP扩增,共扩增出1 728条带,多态性条带为70~126条,多态性条带共722条,平均每对引物扩增出216条条带和90.25条多态性条带,平均多态性条带比率41.78%,平均观测等位基因数(Na)、平均有效等位基因数(Ne)、平均Nei’s基因多样度(H)和平均香农信息指数(I)分别为1.4178、1.1874、0.1133和0.1752。通过聚类分析,在遗传相似系数为0.786时,可将试验材料分为4个类群。研究结果表明,山东石榴具有丰富的遗传多样性。
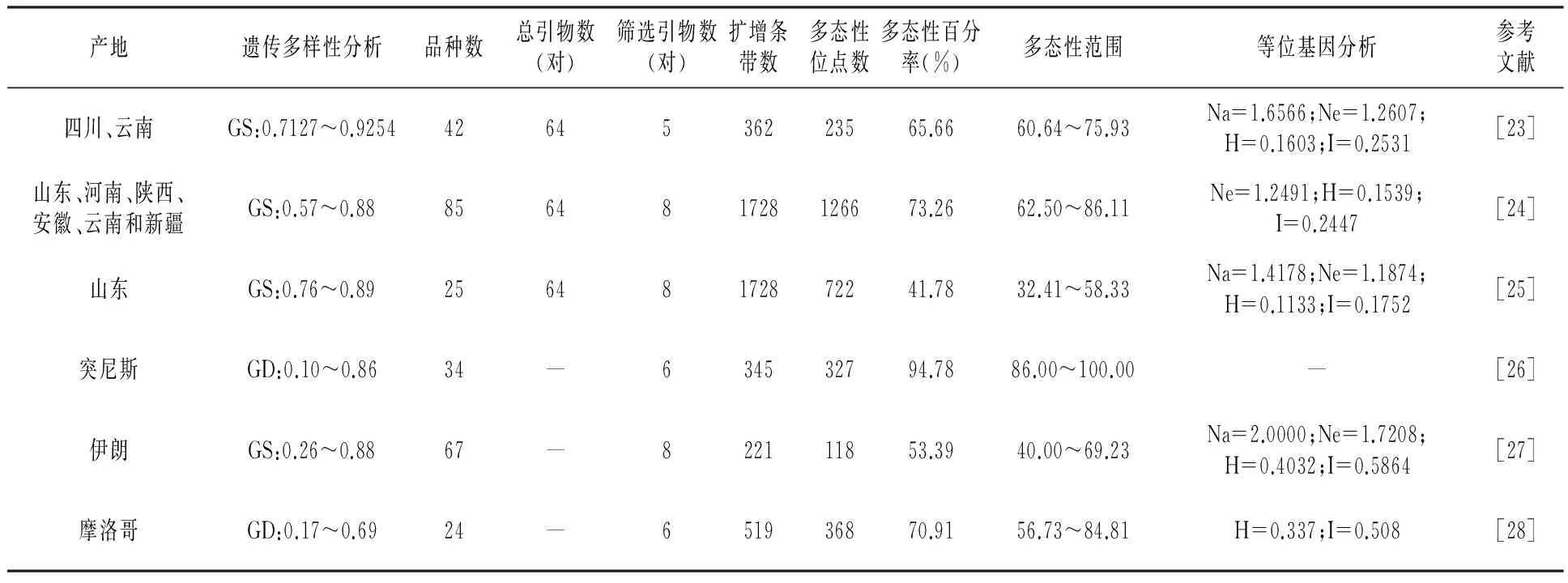
表2 AFLP分子标记应用于石榴种质资源遗传多样性研究的情况
注:Na为平均观测等位基因;Ne为平均有效等位基因数;H为平均Nei’s基因多样度;I为平均香农信息数,下表同。
在国外,Jbir等[26]采用AFLP技术对34份突尼斯石榴品种进行遗传多样性分析,利用筛选出的多态性好的6对引物进行AFLP扩增,共扩增出345条条带,其中多态性条带为327条,多态性比率达94.78%,研究结果表明,突尼斯石榴品种遗传多样性很丰富,且AFLP标记区分品种具有很高的可靠性。Moslemi等[27]采用AFLP技术对来自4个群体67份伊朗石榴品种进行遗传多样性分析,利用筛选出的多态性好的8对引物进行AFLP扩增,共扩增出221条条带,其中多态性条带有118条,平均每对引物扩增出27.63条条带和14.75条多态性条带,多态性比率达53.39%,遗传相似系数为0.26~0.88,通过聚类分析,可将试验材料分为6个类群,在某些情况下,来自同一区域的多数品种聚为一类,且主要的遗传变异(87.6%)发生在群体内。通过遗传距离的主坐标分析表明AFLP分子标记是进行石榴种质资源遗传多样性分析的有效工具。Ajal等[28]用6对引物对24个摩洛哥石榴品种进行AFLP遗传多样性分析,共扩增出519条条带,其中多态性条带有368条,多态性比率达70.91%。研究表明,摩洛哥石榴品种遗传多样性丰富,品种间的遗传多样性高于群体水平,UPGMA和PCA分析表明石榴品种具有的遗传多样性与地理起源和品种名称无关,且AFLP技术可有效运用于石榴品种区分及遗传多样性分析。
3 SSR分子标记
SSR(simple sequence repeat)分子标记即简单重复序列,是由Hamade在1982年发现的以DNA重复序列为核心的第二代分子标记技术。SSR分子标记以孟德尔方式遗传,为共显性标记,具有等位基因、单基因座变异多、数量丰富、多态性高、重复性好、信息量高、操作简单、稳定性好、种族特异性强、引物序列易交换、进化所受选择压小等优点,但引物开发设计需预先克隆和测序,成本较高且费时费力[29]。目前国内外SSR分子标记在石榴种质资源遗传多样性研究中得到广泛应用(表3)。
在国内,Jian等[30]采用SSR技术对18个国内外主栽石榴品种和24个来自国内山东、陕西、河南的地方石榴品种共42个品种进行遗传多样性研究,从59对SSR引物序列中筛选出18对进行SSR扩增,共得到42个等位基因,观察到的杂合度(Ho)和多态信息含量(PIC)分别为0.119~0.619(平均为0.381)、0.091~0.656(平均为0.402)。研究表明SSR分子标记可有效运用于石榴遗传多样性分析。潘海发等[31]使用SSR技术对10个石榴栽培品种进行遗传多样性研究,利用筛选出的8对SSR特异引物进行SSR扩增,共扩增出93条条带,其中多态性条带54条,多态性比率达58%,每对引物扩增的条带数为11~12条,且通过3对SSR特异性引物(Pom13、Pom21、Pom24)可将10个品种区别开。通过聚类分析,在欧式距离平方系数阈值为14.00~15.00时,可将所有品种分为6大类,且品种之间有按照系谱聚类的趋势。研究结果表明SSR分子标记为共显性,每个位点的分辨力很高、重复性和稳定性很好,SSR技术可有效运用于石榴品种区分及遗传多样性分析。
在国外,Hasnaoui等[32]在2010年运用SSR技术对27份突尼斯石榴品种进行种质资源遗传多样性研究,利用筛选的11对SSR特异引物对试验材料进行扩增,得到25个等位基因,每个位点的等位基因数量为1~4个,观测杂合度(Ho)为0.037~0.592,研究结果表明SSR分子标记可以有效运用于石榴品种遗传多样性分析。2012年,Hasnaoui等[33]采用SSR技术又对32份突尼斯石榴品种和1份意大利石榴品种共33份材料进行遗传多样性分析,从15对SSR引物中筛选12对特异引物对试验材料进行扩增,共得到34个等位基因,每个位点的等位基因数量为2~4个,平均为2.83个。预期杂合度(He)为0.030~0.758,平均预期杂合度(He)为0.245, 观测杂合度(Ho)为0.030~0.527,平均观测杂合度(Ho)为0.243,多态信息含量(PIC)为0.031~0.525。Pirseyedi等[34]采用SSR技术对来自伊朗亚兹德资源圃的60份石榴品种进行遗传多样性分析,利用从80对SSR引物中筛选的58对特异引物对试验材料进行扩增,得到35个等位基因,每个位点的等位基因数量为3~5个,平均为2.90个。预期杂合度(He)和观测杂合度(Ho)分别为0.29~0.65和 0.15~0.87,多态信息含量(PIC)为0.26~0.61,平均为0.43。表明SSR分子标记是对形态学的有效补充,也是进行石榴遗传资源多样性分析的有效工具。Rania等[35]采用SSR技术对32份突尼斯石榴品种进行遗传多样性分析,用13对SSR引物对试验材料进行扩增,得到40个等位基因和46个确定基因型,表明突尼斯石榴种质资源在分子水平上具有较高的多样性。聚类分析图表明,32份突尼斯石榴种质遗传多样性分类结构与地理分布及命名无关。Parvaresh等[36]采用SSR技术对来自伊朗、日本、土库曼斯坦、俄罗斯、意大利和美国的75份石榴品种进行遗传多样性分析。25对引物中的10对引物表现出12个多态性位点,38个等位基因,每个位点的等位基因数量为2~6个,平均为3.1667个,预期杂合度(He)为0.0132~0.6280,平均预期杂合度(He)为0.4231, 观测杂合度(Ho)为0.0133~1.0000,平均观测杂合度(Ho)为0.4399,多态信息含量(PIC)为0.0132~0.5588,平均为0.3583,通过对比这些国家不同石榴品种,伊朗石榴品种具有最高遗传多样性。
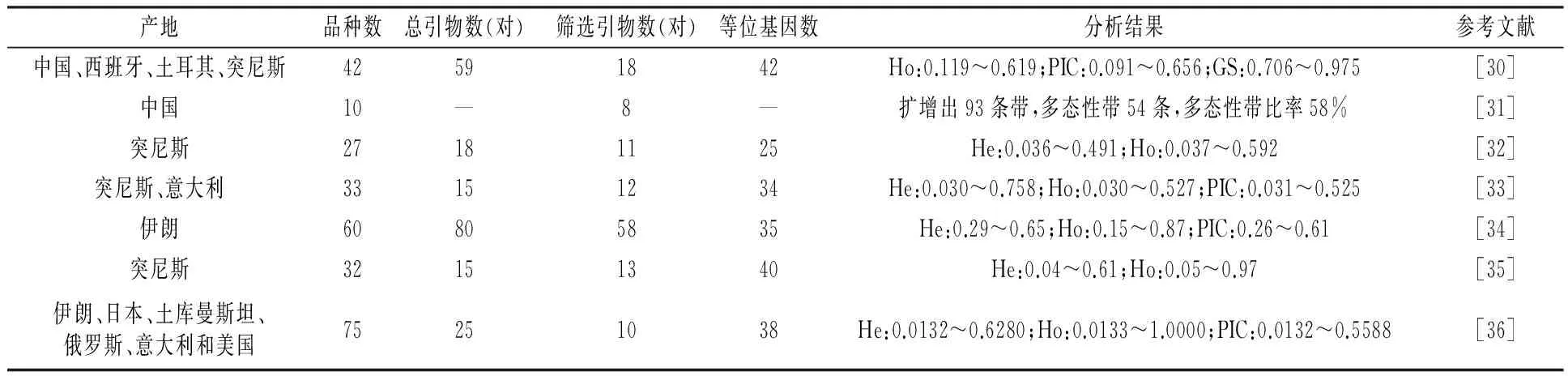
表3 SSR分子标记应用于石榴种质资源遗传多样性研究的情况
注:Ho为观测杂合度;He为预期杂合度; PIC为多态信息含量;GS为遗传相似系数。
4 ISSR分子标记
ISSR(inter-simple sequence repeat)分子标记即简单重复序列区间,是Zietkiewicz等[37]在1994年以DNA重复序列为核心、运用PCR技术和重复序列技术组合发展起来的一种微卫星基础上的分子标记。ISSR分子标记快速易操作,设计引物随机无需预知基因组序列,同时具有AFLP、SSR、RAPD等分子标记的优点,ISSR标记以其高多态性已被广泛应用于石榴遗传多样性等研究(表4)。
在国内,沈进[38]采用ISSR技术对我国具有代表性的45份石榴品种进行遗传关系研究,从45个ISSR引物中筛选出条带清楚、重复性好的引物17个,对试验材料进行PCR扩增,共扩增出187条条带,其中多态性条带157条,平均每个引物11条,多态性比率达83.96%,表明我国石榴栽培品种遗传背景较复杂。通过聚类分析,以遗传距离19为阀值,45份石榴品种分为4个类群,分类结果与传统形态学分类不完全一致。赵丽华等[39]采用ISSR技术对我国47个石榴品种进行遗传关系研究,筛选出多态性好的6个ISSR引物对我国47个石榴品种进行扩增,共扩增出120条条带,其中多态性条带为109条,多态性比率达90.83%,平均有效等位基因数(Ne)为1.2945,平均Nei’s基因多样度(H)为0.1897,平均Shannon 信息指数(I)为0.3091,遗传距离为0.0750~0.4000,表明我国47个石榴品种间具有比较丰富的遗传多样性, 通过UPGMA 法构建分子树状图,以遗传相似性系数(GS)0.7767为阈值,将47个石榴品种分为5个类群,分类结果与形态和地理分布无关。同时检测到15条特异性条带可作为11个石榴品种鉴定的参考性标记。赵丽华[40]为了更有效地对石榴种质资源进行收集、保存及利用,采用ISSR技术对我国7个石榴主产区46个石榴品种进行研究。研究表明:7个石榴种群遗传多样性从大到小依次为:山东种群>陕西种群>云南种群>河南种群>安徽种群>四川种群>新疆种群;7个石榴种群间的基因分化系数(Gst)为0.1911,表明在7个石榴种群间的遗传变异为19.11%,种群内的遗传变异为81.89%,种群间遗传分化较低;群间基因流的估测值(Nm)为2.1169,7个石榴种群间的遗传相似性(I)为0.9218~0.9759,表明7个石榴种群间具有强大的基因流及很高的遗传相似性,石榴品种间的遗传多样性可以维持。马丽等[41]采用ISSR技术对我国82个石榴品种进行遗传多样性及亲缘关系研究,筛选出扩增条带清晰、重复性好、多态性较好的10个引物对我国82个石榴品种进行扩增, 共扩增出186个位点,其中多态性位点178个,多态性比率达95.69%,平均等位基因数(Na)、平均有效等位基因数(Ne)、平均 Nei’s 基因多样性指数(H)、平均 Shannon信息指数(I)分别为1.9570、1.3024、0.2140、0.3567,品种间遗传相似系数(GS)为0.4784~0.9946,表明我国82个石榴品种间具有丰富的遗传多样性, 通过UPGMA 法构建分子树状图,以遗传相似性系数(GS)0.735为阈值,将82个石榴品种分为4个类群。ISSR聚类结果与以结实性、花瓣类型、籽粒硬度性状为依据的分类结果有较高的吻合度,与地理生态环境也存在一定的相关性。
在国外,Ghobadi等[42]采用ISSR技术对24个伊朗石榴品种进行遗传多样性及亲缘关系研究,筛选出6个扩增引物,多态性条带为64条,24个伊朗石榴品种在65%相似性水平下分为5个类群,ISSR分子标记与形态学分类结果不一致。Narzary等[43]采用ISSR技术对印度49个野生石榴品种(代表8个不同群体)进行遗传多样性分析,筛选出17个引物扩增出268条多态性条带,多态性率达87.01%,遗传距离0.05~0.45,平均为0.25,表明野生石榴具有较高的遗传多样性。Ajal等[44]采用ISSR技术对27个摩洛哥石榴品种的进行遗传多样性分析,筛选出8个引物扩增出70条带,其中多态性条带为61条,多态性率达87.14%,遗传距离0.12~1.00,平均为0.67,总基因多样性参数和群体内基因多样性参数分别为0.35和0.32,且种群间基因流(5.8) 较大,ISSR聚类结果与品种的地理来源无关。
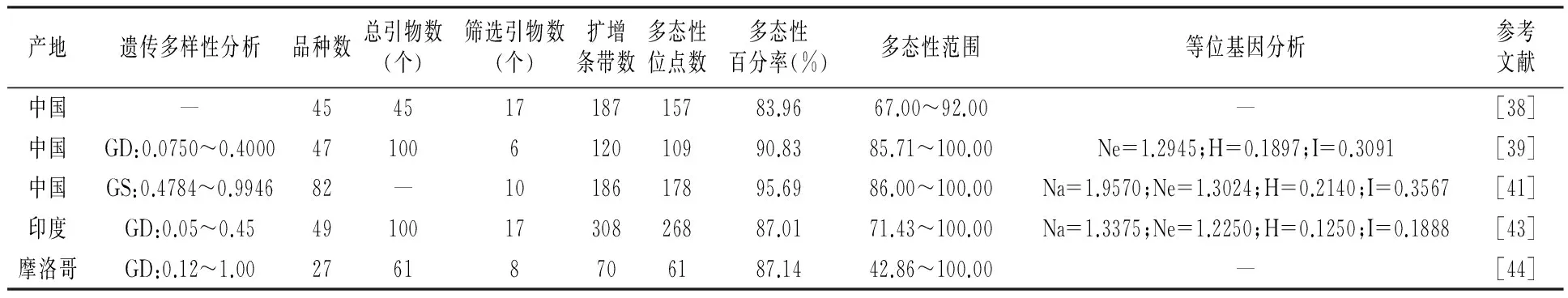
表4 ISSR分子标记应用于石榴种质资源遗传多样性研究的情况
5 SRAP分子标记
SRAP分子标记 (sequence related amplified polymorphism) 即相关序列扩增多态性,是Li和Quiros等[45]在2001年创立的一种新型的基于PCR特定引物的标记系统。该标记采用独特的双引物设计,对基因的特定区域进行PCR扩增,上游引物长17 bp,对外显子区域进行特异性PCR扩增, 下游引物长18 bp,对启动子和内含子区域进行特异性PCR扩增,由于其生物物种和个体的启动子、内含子与间隔区域长度大小不等而产生多态性,PCR产物进行凝胶电泳分离DNA条带。SRAP为共显性标记,具有扩增多态性高、重复性好、产率高、较易测序、操作简便、成本低等优点[46]。目前国内外SRAP分子标记在石榴种质资源遗传多样性研究中得到广泛应用(表5)。
在国内,张四普等[47]采用SRAP技术对23个石榴基因型进行遗传多样性分析,从25对引物中筛选出扩增条带清晰、重复性好的7对引物进行扩增,共扩增出1 380条条带,平均每对引物扩增出197.14条条带,其中多态性条带662条,多态性百分率为47.97%。基因型间的遗传距离为0.0769~0.4131,进行聚类分析,从亲缘关系树状图看,在遗传距离0.33处可将石榴基因型分为5个类群。研究结果表明,石榴基因型具有丰富的遗传多样性,SRAP技术可有效运用于石榴基因型的遗传多样性分析。陈芸等[48]釆用SRAP技术对21份新疆石榴种质资源进行遗传多样性及亲缘关系分析,从36对引物中筛选出扩增条带清晰、多态性高的16对引物进行扩增,共扩增出271个位点,平均每对引物扩增出16.94个位点和12.13个多态性位点,其中多态性位点194个,多态性比率达71.59%。21份材料间的遗传相似系数为0.63~0.89,平均为0.77。对21份材料进行聚类分析,从亲缘关系树状图看,在遗传相似性系数为0.776时,可将21份材料分为5个类群。21份材料间的平均观测等位基因(Na)为1.7122,平均有效等位基因数(Ne)为1.3528,平均Nei’s基因多样度指数(H)为0.1999,平均Shannon 信息指数(I)为0.3105。研究结果表明,遗传多样性最为丰富是新疆喀什地区石榴品种;SRAP聚类结果与石榴的表型特征具有一致性,SRAP技术可有效运用于石榴基因型的遗传多样性分析。涂勋良[49]釆用SRAP技术对釆自四川省会理县海潮石榴母本园的36个石榴品种进行遗传多样性分析,从100对随机引物中筛选出扩增带清晰、重复性好的30对引物进行扩增,共扩增出5 868个位点,位点分布在100~2 000 bp之间,其中多态性位点4 032个,多态性比率达98.04%。引物不同扩增的多态性也不同,扩增的多态性位点分布在78~251个之间,平均每对引物扩增多态性位点有134.40个。基于Nei-Li遗传相似系数,将36个石榴品种进行聚类分析,从亲缘关系树状图看, 在遗传相似系数阈值为0.77处,可将36个石榴品种分为8个类群。
在国外,Ranade等[50]采用SRAP技术对印度63份石榴品种进行遗传多样性研究,这63份石榴品种包括15份野生品种、34份半野生品种及14份栽培品种。利用筛选出的扩增条带清晰、多态性高的12对引物进行扩增,共扩增出259个位点,通过构建进化树可以把印度63份石榴品种分成不同的遗传谱系,使得所有的栽培品种(除CBd70)和野生品种(除W101)很好地区分开,而把半野生品种分成三个类群。栽培品种、半野生品种和野生品种之间检测的最大和最小遗传距离分别为0.94和0.12、0.97和0.24、0.95和0.38。表明印度63份石榴品种具有丰富的遗传多样性。Soleimani等[51]采用SRAP技术对伊朗63份来自五个不同地区的野生石榴、栽培石榴及观赏石榴进行遗传多样性分析,筛选出扩增条带清晰、多态性高的13对引物进行扩增,共扩增出250个位点,其中多态性位点133个, 平均每对引物扩增出19.23个位点和10.23个多态性位点,多态性比率达53.20%。63份材料间的遗传距离为0.10~0.37,平均为0.24。对63份材料进行NJ法聚类分析,表明观赏石榴与部分野生石榴亲缘关系较近,SRAP分子标记技术是进行石榴遗传多样性分析的有效工具。
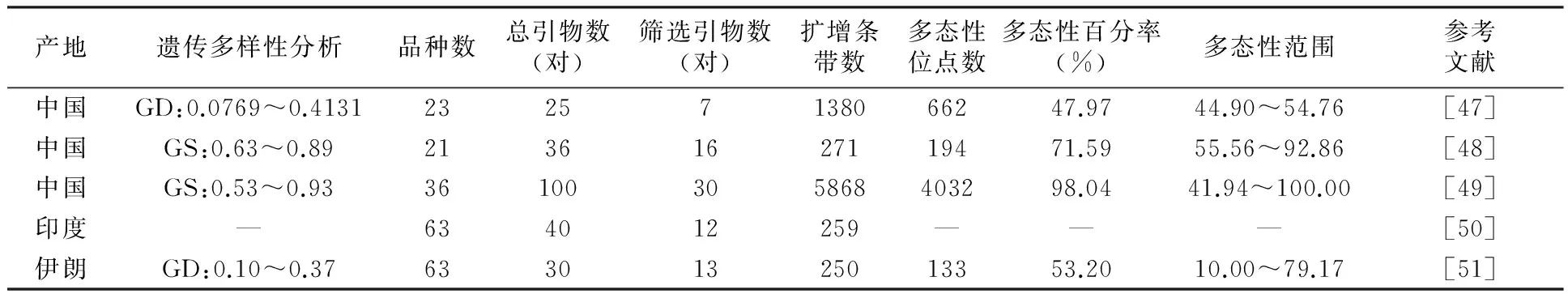
表5 SRAP分子标记应用于石榴种质资源遗传多样性研究的情况
6 结论与展望
综上所述,分子标记具有多态性高、重复性强、稳定性好、检测手段简单快捷等优点,已在石榴种质资源遗传多样性研究中得到了广泛应用。分子标记技术不但适合于石榴种内水平,也适合于组内种间水平遗传多样性的研究。随着分子标记技术的发展,分子标记对石榴种质资源及遗传多样性的研究起到积极作用。利用分子标记对石榴种质资源遗传多样性进行评价和鉴定,不仅有利于石榴种质资源的收集、分类、保存、评价、综合利用及分类学、系统学、进化等的研究,而且有利于从野生石榴资源中筛选优良的栽培品种,为石榴新品种的育种创新提供遗传学和生物学基础。
分子标记技术不受外界环境因素的影响,能够直接分析遗传物质本身,不仅广泛应用于石榴遗传多样性分析研究,而且在遗传图谱构建、基因定位、分子标记辅助育种等方面也得到应用。生物技术快速发展,具备快捷、低成本、高通量等特性的分子标记技术将不断出现,随着DNA提取方法的改进、电泳带和数据的自动分析、与目标基因密切相关分子标记的筛选及cDNA 和 EST文库的不断构建,分子标记技术将不断优化,这将为今后石榴种质资源研究工作提供更加可靠的技术支撑。
[1] Holland D, Hatib K , Bar-Ya’akov I. Pomegranate: botany, horticulture, breeding[J]. Horticultural Reviews, 2009, 35:127-191.
[2] Ozguven A L, Yilmaz C, Keles D. Pomegranate biodiversity and horticultural management[J]. Acta Horticulturae, 2012, 940:21-27.
[3] 曹尚银,侯乐峰.中国果树志石榴卷[M].北京:中国林业出版社,2013:1-4.
[4] Lansky E P, Newman R A.Punicagranatum(pomegranate) and its potential for prevention and treatment of inflammation and cancer[J]. Journal of Ethnopharmacology, 2007, 109(2):177-206.
[5] Lu L J, Yang J, Zhang S M,et al. Advances in molecular marker techniques in pomegranate (PunicagranatumL.) [J]. Agricultural Science & Technology, 2016, 17(1): 8-11.
[6] 周延清. DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:2-179.
[7] 贾继增.分子标记种质资源鉴定和分子标记育种[J].中国农业科学,1996,29(4):1-10.
[8] 邱芳,伏建民,金德敏,等.遗传多样性的分子检测[J].生物多样性,1998,6(2):143-150.
[9] 卢龙斗,刘素霞,邓传良,等.RAPD技术在石榴品种分类上的应用[J].果树学报,2007,24(5):634-639.
[10] 热娜·卡司木,帕丽达·阿不力孜,朱焱.新疆石榴品种的RAPD分析[J].西北植物学报,2008,28(12):2447-2450.
[11] 马丽,马耀华,郝兆祥,等. 38个石榴品种的RAPD遗传关系分析[J].北方园艺,2014(9):101-105.
[12] 杨荣萍,龙雯虹,张宏,等.云南25份石榴资源的RAPD分析[J].果树学报,2007,24(2):226-229.
[13] 张彦苹,曹尚银,初建青,等.16份石榴RAPD扩增产物的两种电泳方法检测及其序列特征[J].基因组学与应用生物学,2010, 29(5):890-896.
[14] Sarkhosh A, Zamani Z, Fatahi R, et al. RAPD markers reveal polymorphism among some Iranian pomegranate (PunicagranatumL.) genotypes[J]. Scientia Horticulturae,2006,111(1):24-29.
[15] Masoud S, Saneghi A, Shahreiyari Z H, et al. RAPD and cytogenetic study of some pomegranate (PunicagranatumL.) cultivars[J]. Caryologia, 2008,61(1):68-73.
[16] Shinde, Amol S, Mahajan, et al. RAPD based molecular diversity analysis of different varieties of pomegranate (PunicagranatumL.) [J]. International Journal of Agricultural Sciences, 2015,11 (1): 141-145.
[17] Sarkhosh A, Zamani Z, Fatahi R, et al. Evaluation of genetic diversity among Iranian soft-seed pomegranate accessions by fruit characteristics and RAPD markers[J]. Scientia Horticulturae,2009,121: 313-319.
[18] Zamani Z, Adabi M, Khadivi-Khub A. Comparative analysis of genetic structure and variability in wild and cultivated pomegranates as revealed by morphological variables and molecular markers[J]. Plant Systematics and Evolution,2013,299(10):1967-1980.
[19] Hasnaoui N, Mars M, Chibani J, et al. Molecular polymorphisms in Tunisian pomegranate (PunicagranatumL.) as revealed by RAPD fingerprints[J]. Diversity,2010,2(1):107-114.
[20] 曹仪植.植物分子生物学[M].北京:教育出版社,2004:142-159.
[21] 赵丽华.石榴AFLP反应体系的建立及优化[J].北方园艺,2012(21):79-82.
[22] 闰龙,关建平,宗绪晓.木豆种质资源遗传多样性研究中的AFLP技术优化及引物筛选[J].植物遗传资源学报,2004,5(4):342-345.
[23] 赵丽华,李名扬,王先磊.川滇石榴品种遗传多样性及亲缘关系的AFLP分析[J]. 林业科学, 2010, 46(11): 168-173.
[24] Yuan Z, Yin Y, Qu J, et al. Population genetic diversity in Chinese pomegranate (PunicagranatumL.) cultivars revealed by fluorescent- AFLP markers[J]. Journal of Genetics and Genomics,2007,34(12):1061-1071.
[25] 苑兆和,尹燕雷,朱丽琴,等.山东石榴品种遗传多样性与亲缘关系的荧光AFLP分析[J].园艺学报,2008,35(l):107-112.
[26] Jbir R, Hasnaoui N, Mars M, et al. Characterization of Tunisian pomegranate (PunicagranatumL.) cultivars using amplified fragment length polymorphism analysis[J]. Scientia Horticulturae,2008,115(3):231-237.
[27] Moslemi M, Zahravi M, Khaniki G B. Genetic diversity and population genetic structure of pomegranate (PunicagranatumL.) in Iran using AFLP markers[J]. Scientia Horticulturae, 2010,126(4): 441-447.
[28] Ajal E A, Jbir R, Legua P, et al. Genetic diversity of Moroccan pomegranate (PunicagranatumL.) cultivars using AFLP markers[J].Australian Journal of Crop Science,2015,9(1):22-29.
[29] 罗兵,孙海燕,徐港明,等. SSR分子标记研究进展[J].安徽农业科学,2013,41(12):5210-5212,5246.
[30] Jian Z H, Liu X S, Hu J B, et al. Mining microsatellite markers from public expressed sequence tag sequences for genetic diversity analysis in pomegranate[J]. Journal of Genetics,2012,91(3): 353-358.
[31] 潘海发,束冰,张金云,等. 石榴种质资源亲缘关系及其营养系芽变的RAPD、SSR分析[J].园艺学报,2013,40(S):2615.
[32] Hasnaoui N, Buonamici A, Sebastiani F, et al. Development and characterization of SSR markers for pomegranate (PunicagranatumL.) using an enriched library[J]. Conservation Genet Resour,2010,2(1): 283-285.
[33] Hasnaoui N, Buonamici A, Sebastiani F, et al. Molecular genetic diversity ofPunicagranatumL. (pomegranate) as revealed by microsatellite DNA markers (SSR)[J].Gene,2012,493(1):105-112.
[34] Pirseyedi S M, Valizadehghan S, Mardi M, et al. Isolation and characterization of novel microsatellite markers in pomegranate (PunicagranatumL.)[J]. International Journal of Molecular Sciences,2010,11(5): 2010-2016.
[35] Rania J, Salwa Z, Najib H, et al. Microsatellite polymorphism in Tunisian pomegranates (PunicagranatumL.): cultivar genotyping and identification[J].Biochemical Systematics and Ecology,2012,44:27-35.
[36] Parvaresh M, Talebi M, Sayed-Tabatabaei B-E. Molecular diversity and genetic relationship of pomegranate (PunicagranatumL.) genotypes using microsatellite markers[J]. Scientia Horticulturae,2012,138: 244-252.
[37] Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2): 176-259.
[38] 沈进. 中国石榴资源初级核心种质构建及其ISSR分子标记研究[D].合肥:安徽农业大学,2008.
[39] 赵丽华,李名扬,王先磊,等.石榴种质资源遗传多样性及亲缘关系的ISSR分析[J].果树学报,2011,28(1):66-71.
[40] 赵丽华. 中国石榴居群遗传结构的ISSR分析[J].北方园艺,2011(10):103-107.
[41] 马丽,侯乐峰,郝兆祥,等.82个石榴品种遗传多样性的ISSR分析[J].果树学报,2015,32(5):741-750.
[42] Ghobadi S, Khoushkhoui M, Tabatabaei B E S. Phylogenetic relationships among some Iranian pomegranate accessions revealed by inter-simple sequence repeat (ISSR) markers[J].Iranian Journal of Horticultural Science and Technology,2005,6(3):111-120.
[43] Narzary D, Rana T S, Ranade S A. Genetic diversity in inter-simple sequence repeat profiles across natural populations of Indian pomegranate (PunicagranatumL.)[J].Plant Biology,2010,12(5):806-813.
[44] Ajal E A, Jbir R, Melgarejo P, et al. Efficiency of inter simple sequence repeat (ISSR) markers for the assessment of genetic diversity of Moroccan pomegranate (PunicagranatumL.) cultivars [J].Biochemical Systematics and Ecology,2014,56:24-31.
[45] Li G, Quiros C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging inBrassica[J]. Theoretical and Applied Genetics, 2001, 103: 455-461.
[46] 李严,张春庆.新型分子标记—SRAP技术体系优化及应用前景分析[J].中国农学通报,2005,21(5):108-112.
[47] 张四普,汪良驹,曹尚银,等.23个石榴基因型遗传多样性的SRAP分析[J].果树学报,2008,25(5):655- 660.
[48] 陈芸,王继莲,丁晓丽,等.新疆石榴种质资源遗传多样性的SRAP分析[J].西北植物学报,2016,36(5):916-922.
[49] 涂勋良. 36个石榴品种的SRAP遗传多样性研究[D]. 雅安:四川农业大学,2012.
[50] Ranade S A, Rana T S, Narzary D. SPAR profiles and genetic diversity amongst pomegranate (PunicagranatumL.) genotypes[J]. Physiology and Molecular Biology of Plants,2009,15(1):61-70.
[51] Soleimani M H, Talebi M, Sayed-Tabatabaei B E. Use of SRAP markers to assess genetic diversity and population structure of wild, cultivated, and ornamental pomegranates (PunicagranatumL.) in different regions of Iran[J]. Plant Systematics and Evolution,2012, 298:1141-1149.
ApplicationofMolecularMarkerinGeneticDiversityResearchofPunicagranatumGermplasm
Wang Qingjun1,2, Hao Zhaoxiang1, Luo Hua1, Zhao Lina1, Bi Runxia1, Zhao Yawei1
(1.ZaozhuangPomegranateResearchCenter,Zaozhuang277300,China; 2.CollegeofHorticultureScienceandEngineering,ShandongAgriculturalUniversity,Taian271018,China)
10.14083/j.issn.1001-4942.2017.09.028
2016-12-19
国家公益性行业(农业)科研专项(201204402);山东省农业良种工程计划项目(鲁科字[2014]96号);枣庄英才集聚工程项目(枣政办字[2016]23号);山东省重点研发计划项目(2016GNC110002); 山东省农业科技发展资金项目(2015);枣庄市科技计划项目(2016NS09)
王庆军(1987—),男,硕士研究生,主要从事石榴种质资源收集保存、创新利用等研究。E-mail:wangqingjun163@126.com
赵亚伟(1963—),男,工程师,主要从事石榴种质资源收集保存、创新利用等研究。E-mail: zzzyw5566@163.com
S665.4
A
1001-4942(2017)09-0146-10

