滇红食用玫瑰生根培养基的试验筛选研究
李晓亮,张军云 *,张 钟,董春富,杨世先,王文智,张建康,张翠萍
(1. 玉溪市农业科学院,云南 玉溪 653100;2. 通海锦海农业科技发展有限公司,云南 通海 652700)
滇红食用玫瑰生根培养基的试验筛选研究
李晓亮1,张军云1 *,张 钟1,董春富2,杨世先1,王文智1,张建康1,张翠萍1
(1. 玉溪市农业科学院,云南 玉溪 653100;2. 通海锦海农业科技发展有限公司,云南 通海 652700)
利用植物组织培养快繁技术可以解决食用玫瑰传统种苗繁育所存在的瓶颈,但长期以来瓶内生根困难是包括食用玫瑰在内的大多数木本植物组织培养面临的最大技术障碍。为此,采用“L16(45)正交试验和追加试验”的方法,开展了52组滇红食用玫瑰瓶内生根试验,研究基础培养基、6-BA等6种因素对生根的影响,分析筛选出适宜生根的培养基。结果表明,不同试验处理间滇红食用玫瑰分化生长和生根的差异较大;玫瑰茎段成株率和植株生根率主要受到激素的控制,植株的根发生主要有4种方式;生根的适宜培养基是1/2MS+6-BA 0.5 mg/L+IBA1.0 mg/L+AC0.1 %或1/2MS+6-BA 2.0 mg/L+IBA1.0 mg/L+AC0.1 %,他们的茎段成株率分别为92.86 %和93.33 %,植株生根率分别为95.38 %和96.43 %,生根方式均为根从茎段的基部发出且基部无愈伤组织,根系发育良好,植株整齐、叶绿、生长茂盛。该结果可应用于滇红食用玫瑰工厂化组织培养育苗。
食用玫瑰;组织培养;瓶内生根;培养基;正交试验
食用玫瑰为蔷薇科蔷薇属,原产中国。目前不仅中国广泛栽培,日本、朝鲜、及欧、美各国亦有大量栽培。玫瑰花香味纯正,产油量高,可用于食品、饮料、化妆品、保健品、药品等众多方面。食用玫瑰集药用、食用、香化、绿化于一体,种植效益好,发展前景十分广阔[1]。
近年来,我国食用玫瑰产业发展迅速,已形成一定的产业规模。仅山东平阴,食用玫瑰的栽培就超过1300 hm2,甘肃苦水及新疆建设兵团农八师也有大面积的种植[2]。在云南,食用玫瑰的种植面积达到4666.7 hm2,成为中国乃至亚洲的主产区[3]。据市场调查,中国药用、食用、酒用、化工及出口玫瑰花年需30万t以上,而年产量却只有几万t,市场预测短期内(10年内)全国食用玫瑰的产量将供不应求[4]。
种苗是食用玫瑰生产的一个重要前提。目前食用玫瑰主要是采取扦插、嫁接、压条等传统的种苗繁育方法[1-2],其缺点是繁殖系数低、速度慢、周期长、变异大、病害传播严重、品质差、成本高等,成为了食用玫瑰种苗供应的瓶颈,直接影响食用玫瑰的生产能力和市场竞争力。
植物组织培养技术具有繁殖速度快,整齐度高,且不受地理环境和季节的限制、遗传背景一致、生长周期短、成本低等诸多优点[5-6],可以用于大量繁殖紧缺和常规繁殖方法难于繁殖的植物,并已有大量成功的实例[7]。因此,利用植物组织培养技术繁育食用玫瑰种苗,是解决传统种苗繁育瓶颈的一种重要技术途径,对促进食用玫瑰种苗生产具有重要意义。
长期以来,瓶内生根困难是木本植物组织培养最大的技术障碍[7-9]。近年来,一种新的组培苗生根技术(瓶外生根)应运而生[10-12],在一些植物上已有研究报道,如欧李[13]、黄金槐[14]、蓝莓[15]等。然而,瓶外生根技术对外界环境条件要求十分严格,光、温、湿等微环境不易调控[15],存在着易受环境波动影响、占用空间大、难以大批量工厂化操作等诸多问题。玫瑰组织培养相比其他植物组织培养起步晚,历时短,诸如培养基选择和提高增殖速度等很多技术问题尚未清楚[16],玫瑰组织培养的研究报道较少[17-18]。
为此,本研究开展滇红食用玫瑰瓶内生根试验研究,旨在分析探索不同因素对生根的影响,筛选出适宜生根的培养基,解决食用玫瑰瓶内生根困难的问题,为食用玫瑰工厂化组织培养育苗提供技术依据。
1 材料与方法
1.1 试验时间、地点
于2014年9月至2015年2月在玉溪市农业科学院组培室实施试验。
1.2 试验材料
采用玉溪市农业科学院组培室培养的无菌滇红食用玫瑰植株作为供试材料。
1.3 试验设计
以基础培养基、6-BA、NAA、IBA、IAA为5种主要因素,各4水平,采用L16(45)正交表设计正交试验,共16组试验处理。根据试验情况,分析比较后,对各因素作调整,主要采用对比法设计追加试验,直到筛选到合适的培养基时试验结束,共涉及试验处理52组,每组处理接种15瓶。
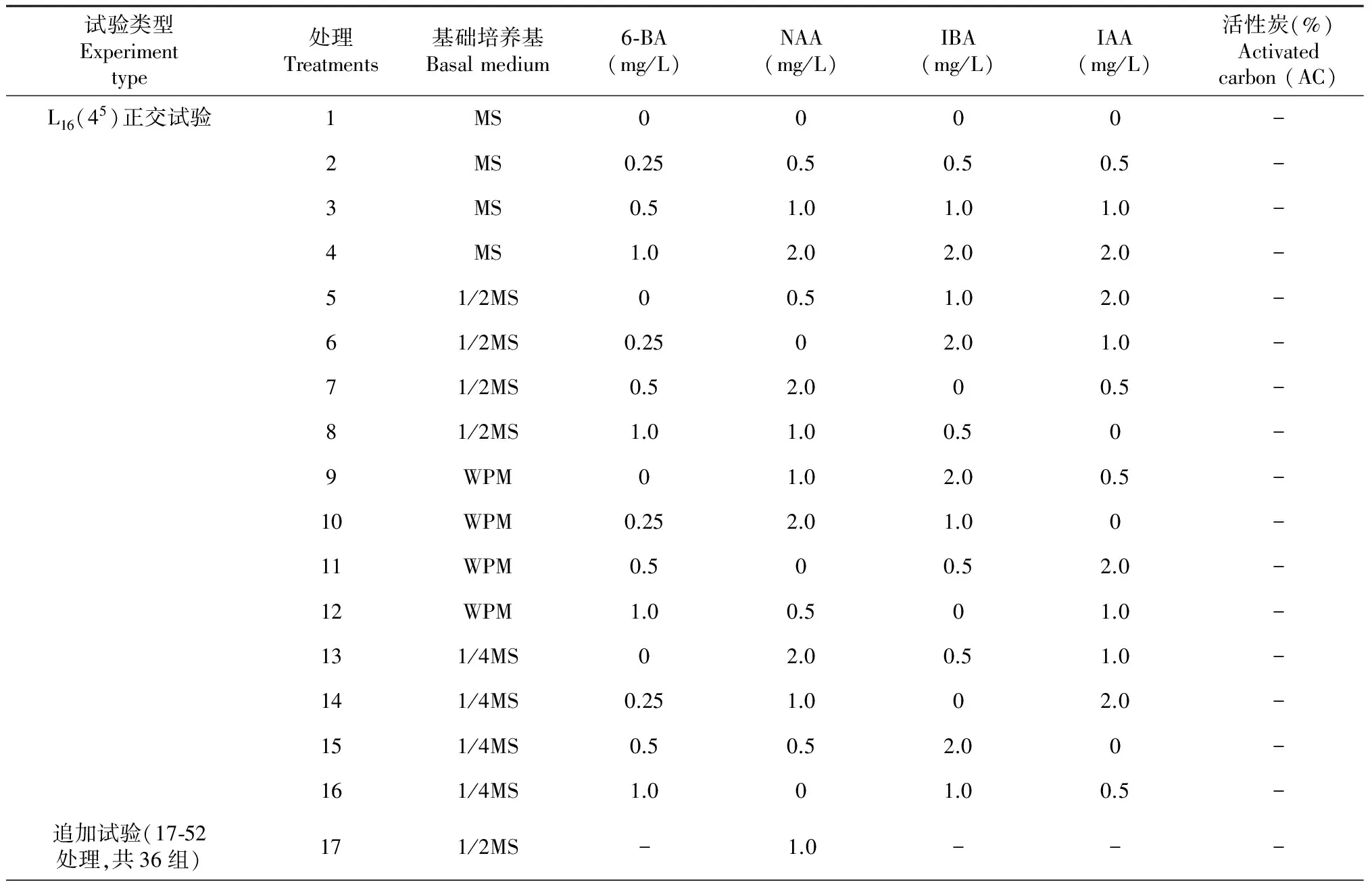
表1 滇红食用玫瑰生根培养基的试验设计

续表1 Continued table 1
1.4 试验方法
为保证试验的均匀性,接种操作时均选择生长相对一致、高大笔直的无菌植株。将无菌植株切成单腋芽的茎段,接种到每个处理的培养基中,每瓶接种5段,培养30~35 d后立即开展试验调查。
所有培养基含琼脂(强度900 g/cm2)5.5 g/L,白砂糖(GB317)30 g/L,pH 5.6~5.8。培养基经121 ℃高压蒸汽灭菌25 min。培养室温度(25±2) ℃,湿度30 %~45 %,日光灯照明,光照强度2000~3000 lx,光照时间12 h/d。
1.5 试验调查和数据统计
调查内容:每个处理的瓶数、成株数、生根的植株数、株高、植株生根量、根长、生长情况。
当调查株高、植株生根量和根长时,均分别在各自所有样本中随机取样调查5个样本,若样本量不足5,则以实际样本调查。
成株率( %)=成株数/茎段数×100
植株生根率( %)=生根的植株数/成株数×100
对采用L16(45)正交试验设计的1~16处理进行茎段成株率和植株生根率的极差分析。
采用Excel 2003和SPSS 16.0处理和分析数据。
2 结果与分析
2.1 成株率
滇红食用玫瑰茎段接种到不同处理的培养基中,分化形成植株的差异较大(表2)。茎段成株率变化范围为0~93.33 %。其中,成株率0~60.00 %的处理占63.46 %;成株率61.00 %~79.00 %的处理占19.23 %;成株率80.00 %~89.50 %的处理占11.54 %;成株率≥90.00 %仅有3个处理,只占5.77 %,3个处理是处理29、47、50,其成株率分别为90.00 %、92.86 %、93.33 %。
2.2 植株的生根率
滇红食用玫瑰植株生根率不同处理间差异较大,变化范围为17.86 %~100.00 %(表2)。其中,生根率17.86 %~60.00 %的处理占22.92 %;生根率60.50 %~79.00 %的处理占22.92 %;生根率80.00 %~89.00 %的处理占16.67 %;生根率≥90.00 %处理占37.50 %,分别是处理39(90.00 %)、26(90.91 %)、45(92.00 %)、20(92.31 %)、19(93.10 %)、14(93.33 %)、17(95.12 %)、47(95.38 %)、50(96.43 %)、43(97.14 %)。生根率为100.00 %的处理有8个,分别是处理3、4、5、9、10、15、30、40。
2.3 株高
滇红食用玫瑰株高不同处理间差异较大,变化范围为1.60~6.66 cm(表2)。其中,株高1.60~2.90 cm的处理占33.33 %;株高3.00~3.99 cm的处理占37.50 %;株高4.00~4.99 cm的处理占12.50 %;株高5.00~5.90 cm的处理占10.42 %;株高>6.00 cm的处理有3个,占6.25 %,为处理6、12、11,其株高分别为(6.22±0.70)、(6.28±0.09)、(6.66±0.14)cm。
2.4 植株生根量
滇红食用玫瑰植株生根量不同处理间差异较大,变化范围为1.20~8.60条(表2)。其中,生根量1.20~2.90条的处理占33.33 %;生根量3.00~4.90条的处理占37.50 %;生根量5.00~6.90条的处理占16.67 %;生根量7.00~8.60条的处理有6个,占12.50 %,为处理50、10、39、8、42、20,其植株生根量分别为(7.00±0.32)、(7.00±0.71)、(7.00±1.22)、(7.67±1.86)、(8.20±1.16)、(8.60±0.51)条。
2.5 根长
滇红食用玫瑰植株根长不同处理间差异较大,变化范围为0.40~11.60 cm(表2)。其中,根长0.40~0.99 cm的处理占25.00 %;根长1.00~1.99cm的处理占31.25 %;根长2.00~3.99 cm的处理占25.00 %;根长4.00~4.90 cm的处理占10.42 %;根长>5.00 cm的处理有4个,占8.33 %,是处理3、1、9、10,其根长分别为(8.50±1.61)、(9.00±2.30)、(9.60±0.68)、(11.60±1.08)cm。

表2 不同处理对滇红食用玫瑰生根的影响

续表2 Continued table 2
注:表中数据为平均值±标准误。
Note: Values were means±SE.

表3 不同因素对滇红食用玫瑰茎段成株率和植株生根率影响的极差分析
2.6 植株生根方式
滇红食用玫瑰植株的生根方式差异较大(表2),主要包括4种方式:根从基部发出,基部无愈伤组织(占35.42 %);根从基部发出,基部无或附少量甚至微量愈伤组织(占14.58 %);根从基部的愈伤组织发出,基部愈伤组织多寡不一(占47.92 %);根从基部或基部少量愈伤组织发出(占2.08 %)。
2.7 不同因素对玫瑰生根的影响
茎段成株率极差分析(表3)表明,因素影响的主次关系为:NAA>IBA>6-BA>IAA>基础培养基,可见滇红食用玫瑰茎段分化成植株主要是受到激素的影响,NAA影响最大。从各因素的水平和水平均值(表3)可以看出:随NAA水平的上升,成株率呈下降趋势;随IBA水平的上升,成株率呈现出先增后降的趋势;随6-BA水平的上升,成株率呈下降趋势;随IAA水平的上升,成株率呈增加趋势;随基础培养基水平的上升,各水平间的成株率差异不明显。因此,茎段成株率水平均值较大时的各因素应取水平是:NAA 0 mg/L,IBA 0~0.5 mg/L,6-BA 0~0.5 mg/L,IAA 0~2.0 mg/L,基础培养基MS或WPM或1/2MS或1/4MS。
植株生根率极差分析(表3)表明,因素影响的主次关系为:IBA>6-BA>IAA> NAA>基础培养基,可见滇红食用玫瑰植株生根主要是受到激素的影响,IBA影响最大。从各因素的水平和水平均值(表3)可以看出:随IBA水平上升,生根率呈现出先降后增的趋势;随6-BA水平上升,生根率呈降低趋势;随IAA水平上升,生根率呈先降后增的趋势;随NAA水平上升,生根率呈增加的趋势;随基础培养基水平的上升,生根率有下降趋势,但水平间差异不明显。因此,植株生根率水平均值较大时的各因素应取水平是:IBA 0~2.0 mg/L,6-BA 0~0.5 mg/L,IAA 0或2.0 mg/L,NAA 0~2.0 mg/L,基础培养基MS或WPM或1/2MS或1/4MS。
在处理21和22、处理24和25的两组对比试验中(表1~2),培养基中没有加入AC时(处理22、25),植株基部均有愈伤组织,特别是处理25的植株基部有大量愈伤组织,根部分褐化呈黑色,而加了AC后(处理21、24),植株基部均无愈伤组织,根为白色,而且极大地提高了植株的生根量,处理24的植株生根量明显大于处理25,其生根量分别为(4.60±0.81)、(1.40±0.24)条。由此可见,AC对滇红食用玫瑰生根有明显影响,AC是玫瑰生根培养基的必需成分。
综合考虑各因素对生根的影响(表1~3),各因素用于滇红食用玫瑰生根时适合考虑选取的范围是:MS或WPM或1/2MS或1/4MS+6-BA 0~0.5 mg/L+NAA 0 mg/L+IBA 0~0.5 mg/L +IAA 0~2.0 mg/L+AC0.1 %。
2.8 适宜生根培养基的选择
根据不同因素对滇红食用玫瑰生根的影响规律(表1~3),对各因素及其水平调整后进行追加试验,综合分析各试验处理的茎段成株率、植株生根率、根的发生方式以及植株生长情况(表1~2),结果表明,滇红食用玫瑰生根的适宜培养基是处理471/2MS+6-BA 0.5 mg/L+IBA 1.0 mg/L+AC0.1 %)或处理50(1/2MS+6-BA 2.0 mg/L+IBA 1.0 mg/L+AC0.1 %),其茎段成株率分别为92.86 %、93.33 %,植株生根率分别为95.38 %、96.43 %,生根方式均为从基部发出且基部无愈伤组织、根系发育良好。但是,处理47中有少量植株枯死(1.54 %~3.08 %),而处理50无植株死亡现象发生,且处理50的植株生根量(7.00±0.32条)和根长(1.44±0.10 cm)均大于处理47(5.00±0.71条、0.66±0.11 cm)。因此,滇红食用玫瑰生根的最佳培养基是处理50(1/2MS+6-BA2.0 mg/L+IBA1.0 mg/L+AC0.1 %)。
3 讨 论
植物组织培养中涉及生根的主要影响因素有基础培养基类型、基础培养基的元素养分组成、6-BA、NAA、IBA、IAA、AC等,加之各因素对应不同的水平,导致处理组合数(培养基)特别多。对生根困难的木本植物而言,要从较多数目的处理中寻找到适合的生根培养基,显得繁琐复杂,工作量巨大。从而,很多人宁肯尝试瓶外生根技术[13-15],也不愿意花大力气去寻找生根培养基。本研究先正交试验,根据生根试验情况(表1~2),分析出各因素适合选取的水平范围(表3),据此范围再对各因素对比调整追加试验(表1~2),直到找到适合生根的培养基为止,共试验52组获得成功,工作量属于可以接受的范围。这种研究方法,为生根困难的植物(特别是木本植物)寻找适宜生根培养基提供了一个重要的参考范例。
植物激素在植物组织培养的生根过程中起着重要作用[6]。本研究也表明,激素对滇红食用玫瑰的生根产生了重要影响(表3)。NAA、IBA是组织培养中常用的生长素,作用主要是促进植物细胞分裂和根的分化,6-BA是组织培养中常用的细胞分裂素,作用主要与细胞分裂、顶端优势改变和芽的分化等有关[6], NAA、IBA、6-BA对不同植物组织培养的具体影响会有差异。为分析NAA、IBA和6-BA对滇红食用玫瑰生根的具体影响,避免因素间的交互效应,在追加试验中分别对NAA、IBA、6-BA单独设置梯度变化试验(表1~2),结果表明:在处理42、26、27、28、23中,随着NAA浓度逐步加大(0~3.0 mg/L),基部愈伤组织由无逐渐增多,茎段成株率和植株生根率也逐渐降低,特别是当NAA浓度为3.0 mg/L时(处理23),茎段大量愈伤化致不能分化形成植株;在处理42、29、33、37中,随着IBA浓度逐步加大(0~2.0 mg/L),基部愈伤组织的量由无变化到少量,茎段成株率和植株生根率表现出先增后降的趋势;在处理47、49、50中,随着6-BA浓度逐步加大(0.5~2.0 mg/L),基部仍无愈伤组织,茎段成株率和植株生根率表现出先降后增的趋势;同样,追加试验中对基础培养基单独设置梯度变化试验(表1~2),在处理42、43、45中,不同的基础培养基对滇红食用玫瑰的生根影响差异不明显。由此说明,单独对激素和基础培养基设置梯度追加试验的结果与正交试验结果接近(表3),表明NAA、IBA、6-BA 和基础培养基等因素之间的交互作用对滇红食用玫瑰生根的影响不大。
AC是植物组织培养中一种重要的培养基成分。有研究表明,AC可以促进器官发生,形成根或芽[6]。本试验发现AC在滇红食用玫瑰生根中发挥了重要作用,其可以抑制玫瑰植株基部的愈伤组织化,极大地促进植株生根,减少根的褐化程度,这可能主要是由于AC吸附培养基中的某些成分(激素等)或吸附植物体释放到培养基中的分泌物(酚类物质等)或AC释放到培养基中的某些杂质影响培养物代谢等[19]。
植物组织培养中根的发生是由根原基或愈伤组织分化形成[6],不同的分化机理形成不同的根形态,最终影响幼苗移栽驯化的成活率。本研究中,不同处理中,激素种类及其水平差异较大(表1),致使滇红食用玫瑰茎段的成株率和植株生根率差异较大(表3),形成了4种不同的发根方式(表2),而只有能使植株基部无愈伤组织的培养基才是试验筛选的目标,因为只有这种根形态才有利于以后幼苗的移栽驯化。植株基部有愈伤组织或根是从愈伤组织发出的(愈伤根),均不利于幼苗的生长,因为基部的愈伤组织会阻碍水分养分的运输,且从愈伤组织处产生的根系不与分化芽的疏导系统相通(不与维管束相连),吸收功能比较弱,成活较难[20]。
本研究不同的试验处理,因基础培养基营养成分、激素种类及水平的差异(表1),致使滇红食用玫瑰的茎段成株率、植株生根率、株高、生根量、根长、生根方式、生长等表现出了较大差异(表2),通过试验,获得了滇红食用玫瑰的生根规律,筛选出了最佳生根培养基,其成株率和生根率均大于90 %,根系发育良好,植株生长茂盛(表2)。本研究筛选出的生根培养基可应用于滇红食用玫瑰工厂化组织培养育苗。
[1]陈 燕,蒋德俊.食用玫瑰高产高效栽培技术[J].现代农业,2003(2):14-15.
[2]李文玲,马大鹏,王会娟,等.食用玫瑰的栽培技术[J].河南农业科学,2005(4):67-68.
[3]汪禄祥,黎其万,陈锦玉,等.不同品种食用玫瑰的主要营养成分测定[J].广东农业科学,2006(12):44-45.
[4]苏 江.我国食用玫瑰供不应求[J].农村实用科技信息,2008(2):58.
[5]孙晓丽,贾艳芳,高 仪,等.欧李增殖培养基的优化研究[J].中国农学通报,2013,29(31):118-122.
[6]胡尚连,王 丹.植物生物技术[M].成都:西南交通大学出版社,2004.
[7]李浚明.植物组织培养教程[M].北京:北京农业大学出版社,1991.
[8]徐妙珍,张雅君,李 伟,等.林木组织培养的障碍因素及其对策[J].林业科技,1992,17(3):10-12.
[9]张红晓,经剑颖.木本植物组织培养技术研究进展[J].河南科技大学学报(农学版),2003,23(3):66-69.
[10]徐振华,王学勇,李敬川,等.试管苗瓶外生根的研究进展[J].中国农学通报,2002,18(4):84-86,89.
[11]赵玉芬,徐 强,孟维英.试管苗瓶外生根技术[J].河北林业科技,2004(2):50.
[12]黄卓忠,严华兵.试管苗瓶外生根技术[J].广西农业科学,2007,38(2):124-126.
[13]焦淑华.欧李试管苗瓶外生根研究[J].赤峰学院学报(自然科学版),2008,24(1):31-33.
[14]范志强,付 瑞,陈爱美,等.黄金槐组培苗的瓶外生根试验[J].山东林业科技,2005(5): 19-20.
[15]程淑云.蓝莓组培苗瓶外生根技术的研究[J].农业科技通讯, 2009(4): 48-50.
[16]康 冰,于福科,张广军,等.应用正交试验筛选玫瑰茎段增殖培养基[J].西北植物学报,2003,23(4): 653-655.
[17]于福科.关于玫瑰组培快繁关键技术的研究[D].杨凌:西北农林科技大学,2003.
[18]靳 松,陈泽斌,夏体渊,等.食用玫瑰组培快繁关键技术研究[J].西南农业学报,2015,28(6):2701-2705.
[19]黄学林,李 菊.高等植物组织离体培养的形态建成及其调控[M].北京:科学出版社,1995.
[20]张存旭,宋 敏,赵 忠.栓皮栎茎段离体培养的研究[J].西北植物学报,2004,24(7): 1260-1265.
(责任编辑 王家银)
ScreeningTestofRootingMediuminTissueCultureofDianhongEdibleRose
LI Xiao-liang1, ZHANG Jun-yun1 *, ZHANG Zhong1, DONG Chun-fu2, YANG Shi-xian1, WANG Wen-zhi1, ZHANG Jian-kang1, ZHANG Cui-ping1
(1.Yuxi Academy of Agricultural Sciences, Yunnan Yuxi 653100, China; 2. Tonghai Jinhai Agricultural Science and Technology Development Company Limited, Yunnan Tonghai 652700, China)
The plant tissue culture technology can be used to solve bottleneck existing in the traditional seedling breeding of edible roses. In this approach, the biggest technological obstacle is greatly difficult for rooting induction which always impedes tissue culture development of most wood plants including edible roses for a long time. For this, L16(45) orthogonal experiment and additional experiments were conducted on Dianhong edible rose to study effects of different factors on tube rooting and to screen out an appropriate rooting medium in tissue culture. The results showed that the great differences occurred in differentiation, growth and rhizogenesis among different treatments. The formation plant rate and the pant rooting rate were mainly controlled by hormones, and plant root formation was in 4 ways. The appropriate tube rooting medium for Dianhong edible rose was 1/2MS+6-BA0.5 mg/L+IBA 1.0 mg/L+AC0.1 % or 1/2MS+6-BA 2.0 mg/L+IBA 1.0 mg/L+ AC0.1 %, which had 92.86 % and 93.33 % of formation plants rate, 95.38 % and 96.43 % of pant rooting rate, respectively. Plant root formation in the appropriate tube rooting medium was from the base of a stem segment and the base without callus, which had fine toots, yellow leaves and flourishing plants. Therefore, the results could be applied to industrial tissue culture seedling of Dianhong edible rose.
Edible roses; Tissue culture; Tube rooting; Medium; Orthogonal experiment
1001-4829(2017)3-0656-08
10.16213/j.cnki.scjas.2017.3.031
S685.12
A
2015-05-11
玉溪市农业科学院科研项目“作物组培扩繁及配套栽培技术研究与应用”(YXNKY201303)
李晓亮(1982-),男,农艺师,硕士,主要从事农业技术和植物组织培养技术的研究,E-mail:lixiaoliangyn@qq.com,*为通讯作者,E-mail:yuhebio@163.com。

