靶基因iNOS、EPO表达对卵巢上皮性肿瘤发生发展的影响机制研究
苏雪锋+陈桂丽+邹云峰


[摘要] 目的 研究靶基因誘导型一氧化氮合酶(iNOS)、促红细胞生成素(EPO)在卵巢上皮性肿瘤中的表达对卵巢上皮性肿瘤发生发展的影响机制。 方法 随机选取2014年3月~2016年12月我院手术切除并经病理证实的卵巢上皮性肿瘤组织和正常卵巢组织标本共84例。患者均由手术切除取标本切片,经甲醛固定,石蜡包埋,作4 μm连续切片,分别进行HE染色及免疫组化染色。综合染色强度和阳性细胞占总细胞数的百分比进行半定量处理,计数肿瘤细胞总数和阳性细胞个数,计算阳性百分率。 结果 正常卵巢组织上皮细胞中iNOS和EPO几乎没有表达,从良性卵巢肿瘤-卵巢交界性肿瘤-恶性卵巢肿瘤,iNOS表达阳性率分别为17.39%、47.06%、87.50%,EPO表达阳性率分别为73.91%、88.24%、100.00%,差异有统计学意义(P<0.05)。肿瘤的组织学分级与EPO及iNOS的表达有关,肿瘤分化程度越低,EPO及iNOS的表达含量越高,且EPO与患者的临床分期有关,差异有统计学意义(P<0.05);而iNOS与患者的临床分期无关(P>0.05)。分析发现,恶性卵巢上皮性肿瘤中EPO蛋白表达和iNOS蛋白表达之间呈正相关,差异具有统计学意义(P<0.05)。 结论 EPO蛋白和iNOS蛋白在卵巢上皮性肿瘤能促进肿瘤细胞的增殖及血管生成,对卵巢上皮肿瘤的发生、发展具有一定的预测作用。
[关键词] 靶基因iNOS;EPO;卵巢上皮性肿瘤;影响机制
[中图分类号] R737.3 [文献标识码] A [文章编号] 1673-9701(2017)25-0022-04
Study on the influencing mechanism of target genes iNOS and EPO expression on the occurrence and development of ovarian epithelial tumors
SU Xuefeng1 CHEN Guili1 ZOU Yunfeng2
1.Department of Gynecology and Obstetrics, Yuyao People's Hospital in Zhejiang Province, Yuyao 315400, China; 2.Department of Pathology, Yuyao People's Hospital in Zhejiang Province, Yuyao 315400, China
[Abstract] Objective To study the influencing mechanism of expression of target gene-inducing nitric oxide synthase (iNOS) and erythropoietin(EPO) in ovarian epithelial tumors on the occurrence and development of ovarian epithelial tumors. Methods A total of 84 cases of specimens of ovarian epithelial tumor tissue and normal ovarian tissue who were given incision and pathologically confirmed in our hospital from March 2014 to December 2016 were randomly selected. Patients were all given surgical incision to remove the slices of specimens, fixed by formaldehyde, embedded by paraffin to make a 4 μm continuous slices. Immunohistochemical staining and HE staining were performed respectively. Comprehensive staining intensity and percentage of positive cells in the total number of cells were used to perform semi-quantitative treatment. The total number of tumor cells and the number of positive cells were counted, and the positive percentage was calculated. Results iNOS and EPO in normal oviran epithelial cells were barely expressed. The positive rates of iNOS expression were 17.39%, 47.06% and 87.50% respectively in benign ovarian tumors-ovarian borderline tumors-malignant ovarian tumors. The positive rates of EPO expression were 73.91%, 88.24% and 100.00% respectively. The differences were statistically significant(P<0.05). The histological grade of tumor was related to the expression of EPO and iNOS.The lower the degree of tumor differentiation, the higher the expression level of EPO and iNOS. EPO was correlated with the clinical stage of the patients, and the difference was statistically significant(P<0.05); and iNOS was not correlated with clinical stage(P>0.05). There was a positive correlation between EPO protein expression and iNOS protein expression in malignant epithelial ovarian tumors, and the difference was statistically significant(P<0.05). Conclusion EPO protein and iNOS protein can promote tumor cell proliferation and angiogenesis in epithelial ovarian tumors, and have a certain predictive effect on the occurrence and development of ovarian epithelial tumors.endprint
[Key words] Target gene iNOS; EPO; Ovarian epithelial tumors; Influencing mechanism
卵巢上皮性肿瘤发病位置隐匿,易于扩散和转移,生存率低,是造成女性患者死亡的重要原因[1]。如何提高恶性卵巢上皮性肿瘤的早期诊断率及预后评价的准确性,是临床亟待解决的难题[2]。近年来,多种肿瘤因子被用于预测肿瘤的病变程度,但未找到特异性高、敏感性强的指标指导临床治疗方案。诱导型-氧化氮合酶(iNOS)只在病理状态下通过催化生成血管舒张因子实现病理中的生物学过程[3]。促红细胞生成素(EPO)是一种糖蛋白激素,由肾和肝脏产生,具有增加血红细胞、调节荷尔蒙的作用[4-5]。基于以上研究基础,iNOS和EPO蛋白的联合检测研究恶性卵巢上皮性肿瘤发生、发展过程,寻找临床诊断依据,现报道如下。
1 资料与方法
1.1 一般资料
随机选择2014年3月~2016年12月间我院手术切除并经病理证实的84例卵巢上皮性肿瘤组织和正常卵巢组织患者,其中正常卵巢组织12例,年龄37~72岁,平均(47.24±6.08)岁;良性卵巢上皮性肿瘤23例,年龄35~72岁,平均(45.21±9.52)岁;卵巢交界性上皮性肿瘤17例,年龄32~73岁,平均(43.27±8.52)岁;其中恶性卵巢上皮性肿瘤32例,年龄36~73岁,平均(46.48±9.42)岁。各组间年龄比较,差异无统计学意义(P>0.05)。在32例恶性卵巢癌中:黏液性囊腺癌11例,浆液性囊腺癌16例,其他类型5例;FIGO分期:Ⅰ~Ⅱ期11例,Ⅲ~Ⅳ期21例;组织学分级:高分化14例,中低分化18例。排除标准:排除术前接受放疗、化疗及免疫治疗的患者。该研究获得了医院伦理学批准,患者均签署知情同意书。
1.2 方法
患者均由手术切除取标本切片,经甲醛固定后石蜡包埋,作4 μm连续切片,分别进行HE染色及免疫组化染色。切片常规脱蜡至水,H2O2灭活内源性过氧化物酶,微波修复抗原,正常山羊血封闭,EpoR单克隆抗体以1:20稀释,4℃过夜,滴加过氧化物及生物素化二抗标记抗体,DAB显色,苏木精复染脱水封片。将染色阳性的卵巢癌组织作为阳性对照,选择PBS代替一抗为阴性对照。EPO、iNOS蛋白阳性标准为肿瘤细胞胞浆出现棕黄色颗粒,参照Bimer方法,利用半定量方法处理综合染色强度和阳性细胞占总细胞数的百分比。在400倍光镜下随机选择5个高倍视野观察区域,统计阳性细胞数和肿瘤细胞总数,算出阳性率。
1.3 观察指标
染色强度评分[6]:染色强为3分,染色清晰为2分,染色弱但强于阴性颜色为1分;10%≤阳性率≤50%为2分,51%≤阳性率≤80%为3分,>80%为4分。两项评分加和,不管其染色强度,只要阳性率<10%为(-);3分为(+);4~5分为(++);6~7分为(+++)。
1.4 统计学分析
采用SPSS18.0统计软件对实验数据进行统计分析,计数资料以均数±标准差(x±s)表示,两组间比较采用t检验;计量资料以例表示,两组间比较采用χ2检验;等级资料用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同卵巢组织中iNOS和EPO的表达比较
正常卵巢组织上皮细胞中iNOS和EPO几乎没有表达,从良性卵巢肿瘤-卵巢交界性肿瘤-恶性卵巢肿瘤,iNOS表达阳性率分别为17.39%、47.06%、87.50%,EPO表达阳性率分别为73.91%、88.24%、100.00%,数据比较差异有统计学意义(P<0.05)。见表1。
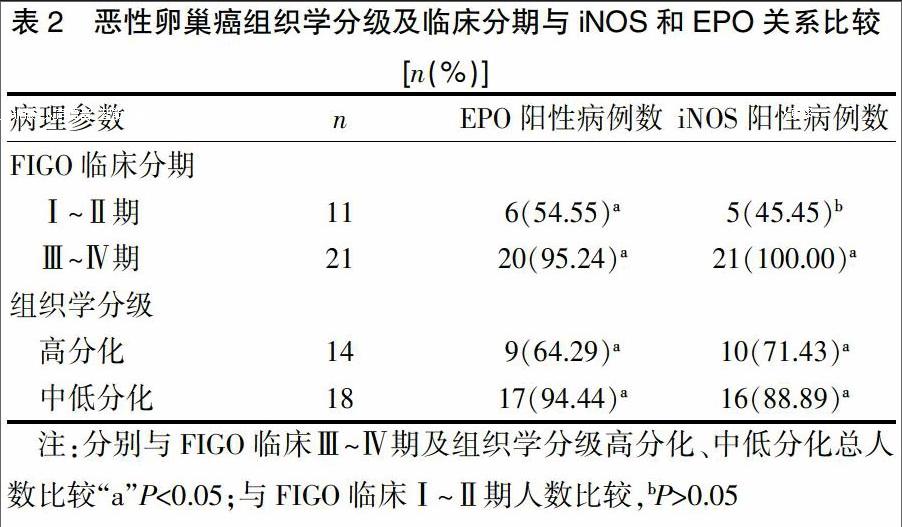
2.2 恶性卵巢癌组织学分级及临床分期与iNOS及EPO关系比较
肿瘤的组织学分级与EPO及iNOS的表达有关,肿瘤分化程度越低,EPO及iNOS的表达含量越高,且EPO与患者的临床分期有关,差异有统计学意义(P<0.05);而iNOS与患者的临床分期无关(P>0.05)。见表2。
2.3 恶性卵巢上皮性肿瘤与EPO、iNOS蛋白表达的相关性
分析发现,恶性卵巢上皮性肿瘤中EPO蛋白表达和iNOS蛋白表达之间呈正相关,差异具有统计学意义(P<0.05)。见表3。
3 讨论
在妇女生殖道癌瘤中,卵巢是造成患者死亡和生存者功能障碍的主要原因[7]。引起患者月经紊乱,性功能和生育功能障碍,严重影响患者生存期的生活质量[8]。临床研究证明,卵巢上皮肿瘤的发生、发展是一个涉及多因素及基因的复杂过程[9-10]。肿瘤细胞高度增殖导致组织缺氧,通过自身作用适应和调节缺氧环境,肿瘤细胞仍不断浸润、增殖[11-15]。有学者认为,肿瘤的发生发展必然导致患者缺血缺氧,从而诱导靶基因一氧化氮合酶(iNOS)和促红细胞生成素(EPO)的合成和分泌。机体通过增加靶基因在肿瘤组织中的表达量,使肿瘤细胞适应缺血缺氧环境,加速肿瘤细胞的侵袭和转移[16-17]。
iNOS在正常生理状态不表达,只有在病理条件下通过催化一氧化氮因子来实现病理的生物学过程转化[18]。NO的肿瘤病理生物学具有双重调节作用,高浓度时抑制肿瘤生长;低浓度时促进肿瘤的发生、发展。研究证明,NO既能维持和完善血管内皮生长因子(VEGF)的生物学功能;又能激活环氧合酶而刺激产生前列腺素,这两种物质均可促进形成肿瘤新生血管[19]。肿瘤细胞的iNOS蛋白表达量高于正常组织,且与肿瘤分级、分期呈正相关关系。促红细胞生成素(EPO)的特异性膜受体属于Ⅰ型细胞因子受体,由胞外配体跨膜域、结合域及包内域三部分组成[20]。EPO在肿瘤细胞及血管内皮细胞中均有表达,具有抑制肿瘤细胞及血管内皮细胞的凋亡,促进增殖分化。EPO通过减少神经细胞的坏死和保护凋亡发挥神经,抑制iNOS蛋白表达保护EPO而发挥保护作用。实验表明,EPO具有保护内源性抗氧化酶SOD活性,能保护卵巢上皮細胞免受过氧化酶的伤害,维持细胞膜的稳定性[21]。endprint
研究显示,正常卵巢组织上皮细胞中iNOS和EPO几乎没有表达,从良性卵巢肿瘤-卵巢交界性肿瘤-恶性卵巢肿瘤,iNOS表达阳性率分别为17.39%、47.06%、87.50%,EPO表达阳性率分别为73.91%、88.23%、100.00%,这说明iNOS和EPO的阳性表达率促进了肿瘤细胞的生长作用,随着iNOS贮存诱导产生大量的NO促发细胞毒作用。大量的NO与上皮肿瘤细胞产生的氧自由基结合生成氧亚硝酸盐阴离子(ONOO-),进一步分解产生自由基HO.;HO.与ONOO-都具有强氧化性,使细胞膜发生脂化损坏卵巢上皮细胞[22-23]。肿瘤的组织学分级与EPO及iNOS的表达有关,肿瘤分化程度越低,EPO及iNOS的表达含量越高,且EPO与患者的临床分期有关;而iNOS与患者的临床分期无关。分析发现,恶性卵巢上皮性肿瘤中EPO蛋白表达和iNOS蛋白表达之间呈正相关。
综上所述,EPO蛋白和iNOS蛋白在卵巢上皮性肿瘤能促进肿瘤细胞的增殖及血管生成,对卵巢上皮肿瘤的发生、发展具有一定的预测作用。
[参考文献]
[1] 陈静,李春艳,赵苗青,等.EZH2蛋白在卵巢上皮性肿瘤中的表达及其作用[J].山东大学学报医学版,2015, 60(2):65-70.
[2] 武红,高蜀君,程劫.卵巢上皮性肿瘤患者人乳头状瘤病毒感染及核转录因子表达与临床相关性研究[J].中华医院感染学杂志,2015,25(1):8-10.
[3] Chiu WT,Huang YF,Tsai HY,et al.FOXM1 confers to epithelial-mesenchymal transition, stemness and chemoresistance in epithelialovarian carcinoma cells[J].Oncotarget,2015,6(4):2349-2365.
[4] 乔海芝,李淼,钱智.Galectin-3、CAⅨ在卵巢上皮性肿瘤的表达及意义[J].中国妇产科临床杂志,2015,16(1):63-64.
[5] Chevalier N,Paris F,Fontana S,et al.Postpubertal persistent hyperestrogenemia in mccune-albright syndrome:Unilateral oophorectomy improved fertility but detected an unexpected borderline epithelial ovarian tumor[J]. J Pediatr Adolesc Gynecol,2015,28(6):169-172.
[6] 邱建,傅云峰,周彩云,等.上皮性卵巢癌组织CK2β和p53蛋白表达临床意义分析[J]. 中华肿瘤防治杂志,2015, 22(6):451-456.
[7] Ma J,Zhou C,Yang J,et al.Expression of AQP6 and AQP8 in epithelial ovarian tumor[J]. J Mol Histol,2016, 47(2):129-134.
[8] 王伟明,刘辉,秦金金,等. DJ-1蛋白在卵巢上皮性肿瘤组织和血清中的表达及相关性[J].中国现代医学杂志,2015,25(14):30-34.
[9] 晋一超,孙莹,周洋,等.血脂水平与卵巢上皮性肿瘤发生发展的相关性分析[J].南京医科大学学报(自然科学版),2015,35(7):1013-1016.
[10] Benedetto G,Hamp TJ,Wesselman PJ,et al.Identification of epithelial ovarian tumor-specific aptamers[J].Nucleic Acid Ther,2015,25(3):162-172.
[11] 陈晓端.卵巢上皮性肿瘤常见病理诊断问题及临床意义[J].实用妇产科杂志,2015,31(11):808-810.
[12] 李红雨,韩会会,朱海,等.恶性卵巢上皮性肿瘤组织中miR-181a、TGF-β_1、TGF-βR1的表达变化及意义[J].山东医药,2015,55(43):59-61.
[13] Oswald AJ,Gourley C.Low-grade epithelial ovarian cancer:A number of distinct clinical entities?[J]. Curr Opin Oncol,2015,27(5):412-419.
[14] 王哲,刘欣.恶性卵巢上皮性肿瘤组织中Gab2蛋白的表达变化及意义[J].山东医药,2015,55(43):62-63.
[15] 李娜,孙丽君,李东林,等.检测ROC1在卵巢恶性上皮性肿瘤组织中的表达及临床意义研究[J].重庆医学,2016,45(2):202-204.
[16] Ramalingam P. Morphologic,immunophenotypic,and molecular features of epithelial ovarian cancer[J].Oncology(Williston Park), 2016,30(2):166-176.
[17] 肖正华,令狐华,刘倩芬.Ras和Sos1蛋白在上皮性卵巢恶性肿瘤组织中的表达及临床意义[J].南方医科大学学报,2016,36(11):1502-1507.
[18] 葛倩倩,陈秀芹,郭琦,等.CD146和TfR1在上皮性卵巢癌中的表达及临床意义[J].西安交通大学学报(医学版),2017,38(1):104-107.
[19] Madsen C,Baandrup L,Dehlendorff C,et al.Tubal ligation and salpingectomy and the risk of epithelial ovarian cancer and borderline ovariantumors:A nationwide case-control study[J]. Acta Obstet Gynecol Scand,2015,94(1):86-94.
[20] 唐灿,邹琼,粟占三,等.卵巢浆液性肿瘤中IGF-2R的表达及其意义[J].临床与实验病理学杂志,2016,32(9):1041-1043.
[21] 胡娜,鲁艳明.上皮性卵巢组织G3BP和OPN表达及相关性研究[J].中华肿瘤防治杂志,2016,23(21):1421-1425.
[22] Qu H,Xu F,Bai Y,et al.Tumor suppressor in lung cancer 1 gene expression in epithelial ovarian cancer[J].Indian J Cancer,2016,53(1):8-11.
[23] 葛静,王景,滑芳,等.细胞周期蛋白E1与卵巢上皮性肿瘤关系的研究[J].中國急救医学,2015,35(s2):171-172.endprint

