脂蛋白相关磷脂酶A2活性检测在评估心血管疾病风险中的临床应用价值
方清
上海市医疗器械检测所( 上海, 201318)
脂蛋白相关磷脂酶A2活性检测在评估心血管疾病风险中的临床应用价值
方清
上海市医疗器械检测所( 上海, 201318)
目的 探讨脂蛋白相关磷脂酶A2(Lp-PLA2)活性检测在评估冠心病等心血管事件风险中的临床应用价值。方法 行冠状动脉造影术确诊为冠心病93例为冠心病组(CAD组), 并按冠状动脉病变数量分为一支病变组32例、 二支病变组28例和三支(及以上)病变组33例。以体检健康者271例为正常对照组(Control组)。检测各组血清中的Lp-PLA2活性水平, 并进行统计学分析。结果 Control组中, 男性的Lp-PLA2活性水平要高于女性, 两性间差异有统计学意义(P<0.01)。CAD组Lp-PLA2活性水平显著高于Control组(P<0.01)。不同病变数量患者的Lp-PLA2活性水平的差异无统计学意义(P>0.05)。CAD组患者血液中Lp-PLA2活性水平与其他单一血脂指标和复合指标有相关性, 且有统计学意义。结论 Lp-PLA2活性检测可用于评估心血管事件的风险。
脂蛋白相关磷脂酶A2; 冠心病; 动脉粥样硬化; 心血管疾病; 风险评估
心血管疾病(Cardiovascular disease, CVD)是一组心脏和血管疾患, 包括冠心病、 心肌梗死和中风等。其病因通常有多个危险因素, 比如烟草使用、 不健康饮食和肥胖、 高血压、 糖尿病和高脂血症等[1]。动脉粥样硬化(Atherosclerosis, AS)是心血管疾病的病理生理学基础, 其主要病症为发病部位产生脂质和各种其他血液成份的沉积, 平滑肌细胞及纤维成份增生, 并逐渐形成局部斑块, 动脉管壁因而增厚、 变硬, 斑块内部组织坏死崩解并与沉积的脂质结合, 逐步发展形成动脉粥样硬化性斑块[2]。由此引发多种后果: 冠状AS导致冠状动脉狭窄, 引起心肌缺血, 发生急性心肌梗死; 脑AS则引起脑缺血、 眩晕、 头痛和昏厥等症状, 亦可促进脑动脉血栓形成或破裂出血, 诱发中风。许多流行病学和临床前瞻性研究发现, 与正常对照组相比, 发生心血管事件者的Lp-PLA2蛋白浓度水平或活性显著升高, 血清Lp-PLA2蛋白浓度水平或活性升高是心血管事件的独立危险因子, 可为心血管事件的预测提供重要的参考[3-7]。作为目前唯一的与血管内壁炎症密切相关的生物标志物, Lp-PLA2的浓度或活性水平反映了患者血管内壁炎症的状态[8], 为临床判断动脉粥样硬化斑块的稳定性提供了直接的实验室指标, 成为心脑血管事件中高危患者早期识别和筛查的特异性指标。因此, 我们对冠心病患者按病变严重程度进行了分类, 并检查了他们的Lp-PLA2活性水平, 探讨Lp-PLA2活性检测在评估心血管疾病风险中的临床应用价值。
1 材料和方法
1.1 研究对象
收集上海市徐汇区中心医院经体检结果正常, 肝功能、 肾功能、 血糖和血脂无异常的271例健康体检者作为正常对照组(Control组), 其中男性131例, 女性140例, 年龄20~79岁。收集上海市第九人民医院收治的, 由主治医师经行冠状动脉造影术确诊为冠心病的93例患者作为冠心病组(CAD组), 其中男性57例, 女性36例, 年龄47~93岁。
1.2 分级标准
所有CAD组患者经行冠状动脉造影术, 按照《冠心病》中的冠状动脉狭窄程度进行分级[9], 任意一支主要冠状动脉(指左冠状动脉主干, 前降支, 回旋支, 右冠状动脉)狭窄程度达到Ⅲ级及以上(即狭窄≥50%), 判断为阳性, 按病变的主要冠状动脉数量分为一支病变组, 二支病变组和三支(包括三支以上)病变组。
1.3 方法
1.3.1 样本采集 采集受试者空腹静脉血5 mL, 室温静止1 h后, 3 500转/min离心10 min分离血清, 检测Lp-PLA2活性。
1.3.2 Lp-PLA2活性测定 采用日立7080全自动生化仪及上海润鸿生物科技有限公司生产的脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(连续监测法)检测样本中的Lp-PLA2活性, 严格按说明书操作。
1.4 统计学方法
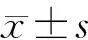
2 结果
2.1 Control组与CAD组Lp-PLA2活性水平比较
Control组中, 男性的Lp-PLA2活性水平要高于女性, 两性间差异有统计学意义(P<0.01)。CAD组Lp-PLA2活性水平显著高于Control组(P<0.01)。CAD组各亚组间的Lp-PLA2活性水平不随冠脉病变程度加重而增加, 各亚组间差异无统计学意义(P>0.05),见表1。
2.2 CAD组中血脂类指标的相关性分析
CAD组患者血液中Lp-PLA2活性水平与其他血脂类生物标志物的相关性分析结果,如表2所示。

表1 Lp-PLA2活性水平比较 / U/LTab.1 Comparison of Lp-PLA2 activity levels

表2 血清Lp-PLA2活性水平与血脂类生化指标的Spearman相关系数Tab.2 Spearman correlation coefficients between Lp-PLA2 activity level in serum and clinical chemistry biomarkers of blood lipids
3 讨论
Lp-PLA2是磷脂酶A2超家族中的一员, 属于PLA2G7, 含有441个氨基酸残基, 是目前唯一与血管内壁炎症密切相关的生物标志物[8-9]。人血清Lp-PLA2由巨噬细胞、 淋巴细胞以及肥大细胞合成与分泌, 可水解血管内膜的氧化卵磷脂, 生成溶血卵磷脂和氧化型游离脂肪酸, 后二者作为促炎介质, 能刺激产生粘附分子和细胞因子, 最终聚集成动脉粥样硬化斑块, 导致血栓形成和心血管事件的发生[10-12]。Lp-PLA2不依赖于如C反应蛋白, 血清淀粉样蛋白A等其他风险预测因子, 相比传统生物标志物反映心血管疾病的发展进程, Lp-PLA2可反映血管内壁的炎症和脂质氧化应激进程, 可为心血管事件的预测提供重要的参考, 对传统危险因素不能鉴别出的风险人群更具有预测价值[13]。
本研究结果表明, Control组中, 男性的Lp-PLA2活性水平为452.18±105.62 U/L, 女性的Lp-PLA2活性水平为362.88±80.61 U/L, 男性的酶活性水平要显著高于女性, 两组间差异有统计学意义(P<0.01), 这可能与雌激素水平有关, 该研究结果与现有研究报道一致[14-15]。
美国心脏病学会基金会(ACCF)/美国心脏协会(AHA)2010年无症状成人心血管风险评估指南建议: 可考虑对中等风险的无症状成人进行Lp-PLA2检测以进一步评估心血管事件的风险[1], 随着Lp-PLA2水平升高, 复合心血管病事件发生率明显升高[16]。本研究中, CAD组男性和女性患者的Lp-PLA2活性水平显著升高, 高于Control组(P<0.01), 说明血清Lp-PLA2活性水平与血管内壁炎症密切相关, 可有效提示心血管事件风险。但是, 本研究中Lp-PLA2活性水平不随冠脉病变程度加重而增加, 一支病变组, 二支病变组和三支病变组组间的Lp-PLA2活性水平差异无统计学意义, 提示Lp-PLA2不能反映血管病变严重程度, 无法进一步甄别患者发生心血管事件的风险等级。而Brilakis等的研究[17]表明, Lp-PLA2水平与冠状动脉病变程度相关, 与本研究结果不符。相比Brilakis等的研究, 1)本研究的样本数量较小(93例 vs. 504例); 2)样本覆盖范围不同: 本研究仅考察阳性病例(冠脉狭窄≥50%), 并以病变冠脉数量分组, 而Brilakis等的研究还额外考察冠脉狭窄≤50%的病例; 3)本研究作为小规模研究, 未考虑吸烟, 高血压等其他心血管危险因子的影响。笔者认为, 以上三点是本文与Brilakis等的研究结果不符的主要原因。
血脂异常是心血管事件的重要危险因子, 而Lp-PLA2主要与血液中的脂蛋白结合, Lp-PLA2活性水平上升与其他致动脉粥样硬化的脂蛋白水平均能反应心血管事件风险[18]。因此, 本研究还探讨了CAD组患者血液中Lp-PLA2活性水平与其他血脂类生物标志物的相关性。由表2可知, Control组中, Lp-PLA2活性水平与TCh, LDLc和apoB正相关, 与HDL和apoAI负相关, 证明Lp-PLA2与致动脉粥样硬化的脂蛋白共存[7,19]。相比Control组, CAD组患者的各项血脂生化指标的平均水平绝对值变化在5%~15%, 而男性组和女性组的Lp-PLA2活性水平绝对值增加均达约25%, 实际临床应用中, 一些冠心病患者的血脂水平也仍处于正常范围内。该结果说明Lp-PLA2活性水平相比传统血脂指标更为敏感, 并且可发现其与TG, HDLc和apoAI的相关性下降, 失去统计学意义, 提示Lp-PLA2活性水平增加, 患者的血脂代谢稳态出现异常。CAD组患者的Lp-PLA2活性水平与LDLc和apoB正相关, 即使在病态环境中Lp-PLA2的活性水平与两者仍有较好的相关性, 这主要是因为Lp-PLA2大部分与低密度脂蛋白结合, 而apoB作为结构蛋白参与Lp-PLA2在血液中的转运过程[19]。对检测结果进行计算后可知, Lp-PLA2活性水平与TCh/HDLc和LDLc/HDLc正相关, 与apoAI/B和TCh/LDLc负相关, 且有统计学意义。HDLc浓度下降和LDLc浓度升高是动脉粥样硬化的特异性指标[1,20], TCh/HDLc反映了血液中剔除HDLc后其他致动脉粥样硬化的脂蛋白的浓度水平, 而LDLc/HDLc和TCh/LDLc则直接说明LDLc在血液中的浓度水平。apoAI和apoB作为结构蛋白, 全面反映了体内HDLc和LDLc的浓度水平和相互关系, 比常规胆固醇比值更具意义。TCh/HDLc和LDLc/HDLc升高, TCh/LDLc和apoAI/B下降均可视为心血管事件的危险指标, 这些复合指标在预测心血管事件风险时优于单一血脂指标。而Lp-PLA2活性水平与这些复合指标的高相关性, 也佐证了在冠心病等心血管疾病风险评估方面, Lp-PLA2活性水平是一种实用的新型预测指标。该Lp-PLA2活性检测甚至优于现有复合指标, 比如apoAI/B<1是心血管疾病的危险信号[21-22], 由图1可知, Lp-PLA2活性检测可检出apoAI/B无法识别的病例, 具有更高的灵敏度。以CAD组患者的Lp-PLA2活性水平中值(467 U/L)为阈值, 当apoAI/B比值处于1.00~1.60的正常参考区间时, 许多冠心病患者的Lp-PLA2活性水平已经升高超出Control组的平均水平, 达到危险水平。笔者认为, 由于心血管疾病的发生是多种危险因子共同作用的结果, 血脂异常不能完全反映发病机制, 而Lp-PLA2作为血管内壁易损斑块的炎症标志物, 更能说明血管内壁的病程, 提示远期发生心血管事件的风险。
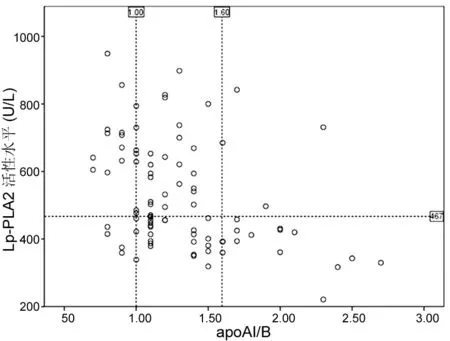
图1 Lp-PLA2活性水平与apoAI/B相关性分析结果Fig.1 Correlation analysis of Lp-PLA2 activity level and apoAI/B
本研究通过对271例健康个体和93例冠心病患者的Lp-PLA2活性水平进行检测、 分组比较得知, 在正常人群中, 男性的Lp-PLA2活性水平(452.18±105.62) U/L要高于女性(362.88±80.61) U/L, 而CAD组男性和女性患者的Lp-PLA2活性水平显著升高, 分别为(569.40±167.68 )U/L和(452.47±102.71)U/L, 两组间差异有统计学意义。证明在传统危险因素评估的基础上, 可检测Lp-PLA2活性水平以进一步评估未来心血管疾病的风险。同时, 冠心病患者的Lp-PLA2活性水平在血脂异常环境中与多种单一血脂指标和复合指标有相关性, 说明Lp-PLA2参与血液中的脂质循环, 与脂质代谢有关联, 但又不同于传统血脂指标反映血液内脂质水平, Lp-PLA2反映血管内壁的炎症和氧化应激状态, 可作为冠心病等心血管疾病的独立危险因素。综上所述, Lp-PLA2活性检测可用于评估心血管事件的风险, 但他汀类药物对Lp-PLA2水平影响较大[23-24], 在临床应用时应注意Lp-PLA2检测的局限性。
[1] Greenland P, Alpert J S, Beller G A, et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American college of cardiology foundation/American heart association task force on practice guidelines[J].J Am Coll Cardiol, 2010, 56(25): e50-e103.
[2] Hansson G K, Libby P, Schonbeck U, et al.Innate and adaptive immunity in the pathogenesisof atherosclerosis [J]. Circ Res, 2002, 91(4): 281-291.
[3] Toth P P, McCullough P A, Wenger M S, et al. Lipoprotein-associated phospholipase A2: role in atherosclerosis and utility as a cardiovascular biomarker [J]. Expert Rev Cardiovasc Ther, 2010, 8(3): 425-438.
[4] Caslake M J, Packard C J. Lipoprotein-associated phospholipase A2as a biomarker for coronary disease and stroke [J]. Nat Rev Cardiol, 2005, 2(10): 529-535.
[5] Packard C J, O'Reilly D S J,Caslake M J, et al. Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease [J]. N Engl J Med, 2000, 343(16): 1148-1155.
[6] Cai A,Zheng D, Qiu R, et al. Lipoprotein-associated phospholipase A2(Lp-PLA2): a novel and promising biomarkerfor cardiovascular risks assessment [J]. Dis Markers, 2013, 34(5):323-331.
[7] Cai A, Li G, Chen J, et al. Increased serum level of Lp-PLA2 is independentlyassociated with the severity of coronary arterydiseases: a cross-sectional study of Chinesepopulation [J]. BMC Cardiovas Disor,2015, 15:14.
[8] Rosenson R S,Stafforini D M. Modulation of oxidative stress, inflammation, andatherosclerosis by lipoprotein-associated phospholipase A2 [J]. 2012, J Lipid Res, 53(9): 1767-1782.
[9] 宋来凤. 冠心病 [M]. 北京:人民卫生出版社,2002.
[10] Munzel T, Gori T. Lipoprotein-associated phospholipase A2, a marker of vascular inflammation and systemic vulnerability [J]. Eur Heart J, 2009, 30(23): 2829-2831.
[11] Epps K C, Wilensky RL. Lp-PLA2- a novel risk factor for high-risk coronary and carotid artery disease [J]. J Int Med, 2011, 269(1): 94-106.
[12] Herrman J, Mannheim D, Wohlert C, et al. Expression of lipoprotein-associated phospholipase A2 in carotid arteryplaques predicts long-term cardiac outcome [J]. Eur Heart J, 2009, 30(23):2930-2938.
[13] Koenig W, Twardella D, Brenner H, et al. Lipoprotein-associated phospholipase A2 predicts future cardiovascular events in patients with coronary heart disease independently of traditional risk factors, markers of inflammation, renal function, and hemodynamic stress [J]. Arterioscler Thromb Vasc Biol, 2006, 26(7): 1586-1593.
[14] Feng L, Feng G, Chen Y. Evaluation of lipoprotein-associated phospholipase A2 in healthy Chinese Han adult serum [J]. Lipids Health Dis, 2014, 13: 6.
[15] Lee K K, Fortmann S P, Varady A, et al. Racial variation in lipoprotein-associated phospholipase A2 in older adults [J]. BMC Cardiovasc Disor, 2011, 11: 38.
[16] Sabatine M S, Morrow D A, O'Donoghue M, et al. Prognostic utility of lipoprotein-associated phospholipase A2 for cardiovascular outcomes in patients with stable coronary artery disease[J]. Arterioscler Thromb Vasc Biol, 2007, 27(11): 2463-2469.
[17] Brilakis E S, McConnell J P, Lennon R J, et al. Association of lipoprotein-associated phospholipase A2 levels with coronary artery disease risk factors, angiographic coronary artery disease, and major adverse events at follow-up[J].Eur Heart J, 2005, 26(2): 137-144.
[18] Xu R, Zhang Y, Li X, et al.Relationship between plasma phospholipase A2 concentrations andlipoprotein subfractions in patients with stable coronary artery disease [J]. Clin Chim Acta,2015, 446: 195-200.
[19] Zalewski A, Macphee C. Role of lipoprotein-associated phospholipase A2 in atherosclerosis biology, epidemiology, and possible therapeutic target [J]. Arterioscler Thromb Vasc Biol, 2005, 25(5): 923-931.
[20] Kastelein J J P, van der Steeg W A, Holme I, et al. Lipids, apolipoproteins, and their ratios in relation to cardiovascular events with statin treatment [J]. Circulation, 2008, 117(23):3002-3009.
[21] 杜江蕾,黄淑田. 血脂异常与冠心病及冠心病合并高血压的相关性分析 [J]. 中西医结合心血管病杂志, 2014, 2(17): 94-95.
[22] Carnevale Schianca G P, Pedrazzoli R, Onolfo S, et al. ApoB/apoA-I ratio is better than LDL-C in detecting cardiovascular risk [J]. Nut Metab Cardiovas Dis, 2011, 21(6): 406-411.
[23] Albert M A, Glynn R J, Wolfert R L, et al. The effect of statin therapy on lipoprotein associated phospholipase A2 levels [J].Atherosclerosis, 2005, 182(1): 193-198.
[24] Saougos V G, Tambaki A P, Kalogirou M, et al. Differential effect of hypolipidemicdrugs on lipoprotein-associated phospholipase A2 [J]. Arterioscler Thromb Vasc Biol,2007,27(10): 2236-2243.
Clinical Application Significance of Detecting the Activity of Lipoprotein-associated Phospholipase A2(Lp-PLA2) for the Assessment of Cardiovascular Risks
FANG Qing
Shanghai Testing & Inspection Institute for Medical Devices(Shanghai,201318)
Objective We aimed to investigate the clinical application significance of detecting the activity of lipoprotein-associated phospholipase A2(Lp-PLA2) for the assessment of cardiovascular risks. Methods 93 patients diagnosed coronary artery disease were enrolled as CAD group. Coronary angiograms were performed and the patients were divided into single-vessel disease subgroup (32 patients), two-vessels disease subgroup (28 patients) and three-vessels (or multiple-vessels) disease subgroup (33 patients) according to the number of arteries with stenosis. The control group included 271 healthy participants. Serum Lp-PLA2activity levels were detected in both groups, and the results were analyzed statistically. Results In control group, the activity levels of Lp-PLA2in males were higher than those in females and there were significant differences between two genders (P<0.01). The activity levels of Lp-PLA2in CAD group were significantly higher compared to those in control group (P<0.01). The activity levels of Lp-PLA2in subgroups of CAD group were not positively correlated with the severity of coronary artery diseases (the number of coronary artery stenosis) and there were no statistically differences among subgroups (P>0.05). The activity levels of Lp-PLA2in patients of CAD group were correlated with other single or complex blood lipid biomarkers with statistical significance. Conclusion Detecting activity levels of Lp-PLA2can be applied for the assessment of cardiovascular risks.
lipoprotein-associated phospholipase A2, coronary artery disease, atherosclerosis, cardiovascular disease, risk analysis
10.3969/j.issn.1674-1242.2017.03.004
方清,E-mail: cmtc_fq@163.com
R54
A
1674-1242(2017)03-0145-05
2016-11-23)