臭氧催化体系中沸石分解臭氧的研究
刘智武 胡斯翰 裘建平 蒙媛

摘要:考察了沸石对水中臭氧的催化分解能力,实验研究了各个反应条件(沸石性能、反应pH值、温度)对沸石催化臭氧能力的影響,实验发现:沸石的存在能显著促进水中臭氧的分解,并能催化臭氧产生成羟基自由基;沸石进行盐酸改性能提高臭氧的分解速率,且随着盐酸的浓度升高而提高,主要归因于其比表面积的增大;随着pH 值升高,沸石催化臭氧的能力也随之提高,但是当Ph和沸石本身的pHpzc时,沸石催化臭氧的效率最高。温度的提高也能促进沸石催化臭氧的能力。
关键词:沸石;臭氧;催化;羟基自由基
中图分类号:X513
文献标识码:A文章编号:16749944(2017)18005804
1引言
臭氧在水中可短时间内自行分解,没有二次污染,是理想的绿色氧化药剂\[1\]但是臭氧的氧化为选择性氧化且研究也发现单独臭氧的氧化效率偏低,因此就使得单独臭氧在实际废水中很难应用。如何提高臭氧的处理效率,将其应用于实际废水处理中就是臭氧的研究方向。研究发现诸如紫外光、超声、金属离子、半导体催化剂联用可以使其降解有机物的能力得到大幅提高。因此,基于臭氧的联用处理技术已逐渐成为一种日益受到关注的高级氧化技术\[2~4\]。其中非均相臭氧催化技术由于经济性得到了更多的研究,由于其在水处理中的高氧化能力、流程简单、能耗少等优点而日益受到关注。常用的催化剂主要是过渡金属离子及其氧化物 \[5,6\]。一般认为羟基自由基(OH·)与有机污染物的反应速率要远高于水溶液中的臭氧分子,氧化性能也比臭氧分子更强,水溶液中催化剂的存在可以加速臭氧分子分解产生OH·\[7\]。但是受限于催化剂的价格,臭氧的利用率以及催化剂的回收都大大限制了该技术在实际氨氮废水深度处理的应用。研究就提出通过将臭氧催化剂负载到某种物质上来解决上述问题就显得尤为关键。目前研究者将催化剂利用活性炭、陶瓷片、粉体或者制备成膜\[8~10\]。但是这样制备的产品却限制了TiO2的作用面积和分散性,因此寻找一种高效的负载材料就非常关键。沸石以其特殊的结构(多孔、轻质、强度高),且储量丰富、价格低廉、无二次污染,被研究者称为理想的负载材料。
如果要将沸石作为负载材料应用于臭氧催化,除了研究其负载能力,更为关键的是要研究其在臭氧体系中的臭氧催化能力。因此本研究就选用沸石作为催化剂,研究其在臭氧体系中对臭氧分解的途径,以及考察反应体系及沸石表面的化学性质对水中催化臭氧能力的影响。
2实验方法
2.1实验材料
沸石,购买于浙江临安(粒径100 mm)。沸石的处理,首先采用超声清洗,然后用去离子水清洗,最后在干燥箱烘干备用。沸石的改性,将一定量的沸石放置于不同浓度的HCl溶液的烧杯,在搅拌的作用下放置12 h,用去离子水清洗后在干燥箱烘干供试验用,不同温度的样品分别标记为F0.5、F1、F2。实验室用到的化学试剂均为分析纯。
2.2实验步骤及分析
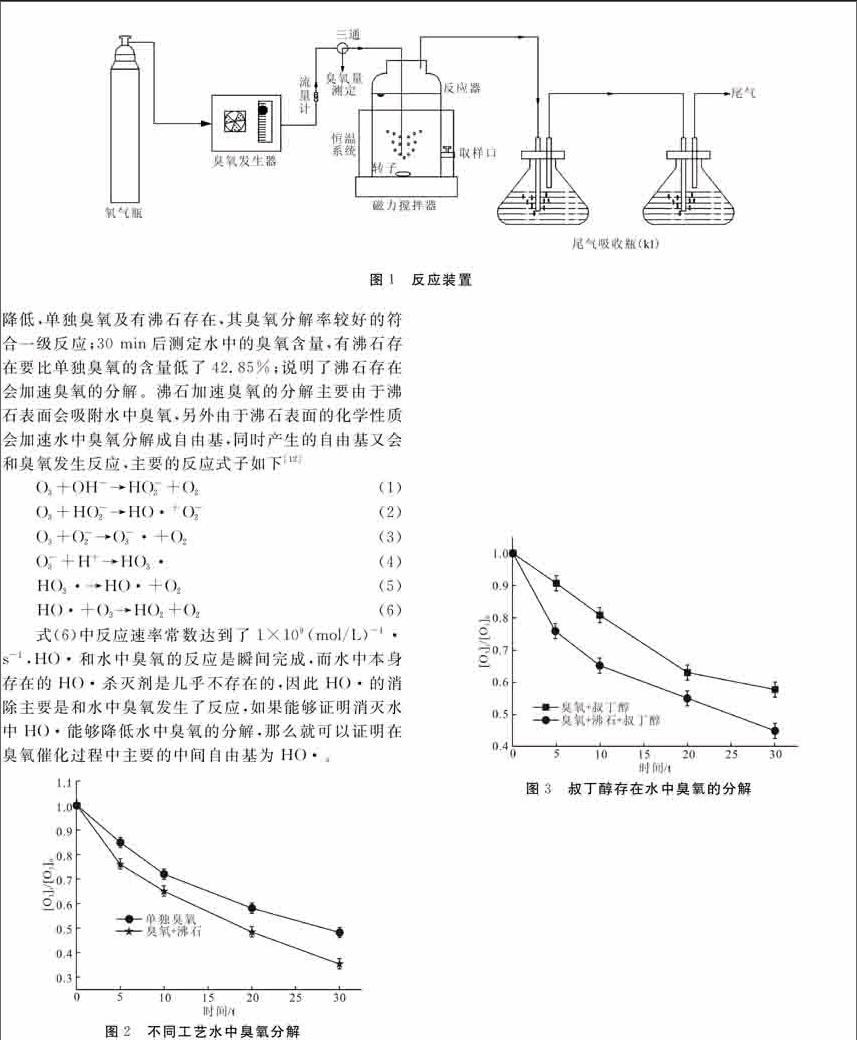
实验装置为臭氧供气系统和尾气处理系统的玻璃反应器\[120 mm(H) × 80 mm(Φ)\],置于恒温水槽中,见图1。将塑料曝气头固定在反应器的底部正中间位置。臭氧发生器为CHYF-3A型臭氧发生器(杭州荣欣电子设备有限公司,臭氧产量范围为0 ~ 6.2 g /h)。采用交流稳压电源,钢瓶氧气为气源,在线产生含臭氧气体,臭氧投加量通过臭氧管路上的流量计精确计量。剩余臭氧通入含2% KI溶液的吸收瓶吸收。通过一定时间让水中溶液的臭氧含量稳定在1.2 g/L,然后开启磁力搅拌器,和恒温水浴装置,使得温度恒定。反应溶液的初始pH值(pH=7)用磷酸二氢钾,磷酸二氢纳,磷酸氢二纳进行调节,催化剂投量为1 g/L。每隔一定时间测定水中的臭氧含量,采用靛蓝法测定进行测定[11],沸石的比表面积采用Micromeritics ASAP 2020 apparatus吸附仪,在液氮温度保护下以N2为吸附质。复合光催化剂在100℃下真空脱气2 h,通过多点BET法利用相对压力为0.05~0.3所对应的氮吸附数据测定催化剂的比表面积。
3结果与分析
3.1沸石催化臭氧的机理研究
降低,单独臭氧及有沸石存在,其臭氧分解率较好的符合一级反应;30 min后测定水中的臭氧含量,有沸石存在要比单独臭氧的含量低了42.85%;说明了沸石存在会加速臭氧的分解。沸石加速臭氧的分解主要由于沸石表面会吸附水中臭氧,另外由于沸石表面的化学性质会加速水中臭氧分解成自由基,同时产生的自由基又会和臭氧发生反应,主要的反应式子如下\[12\]
式(6)中反应速率常数达到了1×109(mol/L)-1·s-1,HO·和水中臭氧的反应是瞬间完成,而水中本身存在的HO·杀灭剂是几乎不存在的,因此HO·的消除主要是和水中臭氧发生了反应,如果能够证明消灭水中HO·能够降低水中臭氧的分解,那么就可以证明在臭氧催化过程中主要的中间自由基为HO·。
(反应条件:臭氧浓度1.2 mg/L,pH=7,T=20,沸石投加量1 g/L)
众所周知,叔丁醇是一种典型的HO·杀灭剂,能够快速和水中HO·发生反应,同时反应的产物包含其他的自由基,且不会有臭氧本身发生反应,是验证水中HO·含量的有效方法。因此通过实验中加入一定剂量的叔丁醇,就可以判断臭氧分解理论中是否中间产生了HO·\[13\]。实验在单独臭氧及沸石存在下,加入了一定量质量浓度为10 mg/L的叔丁醇,进行臭氧分解的试验,结果如图3,从图中可以发现,单独臭氧及沸石臭氧在加入熟丁醇后,其分解速度都有了明显的降低,单独臭氧,在30 min后臭氧在水中的含量升高了25%,沸石存在下臭氧在水中的含量35%,说明了叔丁醇的加入抑制了臭氧的分解,可以发现沸石存在下抑制的效果比单独臭氧的更加明显,也间接可以证明臭氧在沸石存在下,可以促进臭氧分解成HO·,一般认为HO·的氧化能力要比臭氧分子更强,因此可以说明沸石臭氧在废水中的处理能力要比单独臭氧要来的好。
(反应条件:臭氧浓度1.2 mg/L,pH=7,T=20℃,沸石投加量1 g/L,叔丁醇 10 mg/L)
3.2改性沸石對臭氧催化的影响
天然沸石表面性质存在一定的缺陷,研究者们在利用沸石降解废水过程中都会对沸石进行改性,因此在沸石催化臭氧的过程中,利用对天然沸石改性来研究改性对催化臭氧的效率也非常重要,实验通过对天然沸石进行NACL改性,改性剂分别控制在0.5 mol/L;1 mol/L;2 mol/L对沸石进行改性后进行臭氧催化试验,实验条件控制:臭氧浓度1.2 mg/L,PH值7,T 20,沸石投加量1 g/L,反应时间30 min,结果见图2~3,从图中可以发现随着改性剂的浓度的升高,催化臭氧分解的能力也有了很大的提高,但是也发现1 mol/L和2 mol/L提升的幅度不是很大。主要原因归结于改性后的沸石的比表面积提高,比表面积提高有助于臭氧吸附在沸石表面以及在表面进行催化分解成HO·,从而降低了水中臭氧的浓度,当F1和F2比表面积提高不是很大时,臭氧分解也提高不大,因此可以得出结论,沸石催化臭氧分解主要取决于其比表面积。各改性沸石的比表面积如下表1。
(反应条件:臭氧浓度1.2 mg/L,pH=7,T=20℃,沸石投加量1 g/L)
3.3pH值的影响
水溶液的pH值也是影响臭氧分解的重要因素之一,水中的OH-的浓度直接影响着臭氧的分解程,一般来讲碱性条件下更容易促进臭氧的分解,而臭氧分子在酸性条件下更容易存在,为了研究沸石催化臭氧过程中pH的影响,实验考察了pH值为2、pH值为4、pH值为7、pH值为10的溶液下臭氧分子的水中含量,结果见图3。从图中可以发现,随着pH值为2~7时,臭氧水中的含量确实逐渐降低,也证实了碱性条件,因其有大量的OH-会和臭氧反应,会促进臭氧的分解。但是我们也发现了当pH值达到了10时,OH-存在量依然比pH值为7来的多,但是臭氧的分解却降低了,这样归因于另外一个理论,当水中有催化剂存在时,水中臭氧的分解就不能当看OH-来判断其分解性能,臭氧在催化剂存在的分解性能还与催化剂表面零电荷点pHpzc、催化剂本身的结构组成有关。若溶液的PH和催化剂的表面零电荷点接近时,可以加速臭氧的分解,当远离催化剂的表面零电荷点,就会导致催化剂在水中表面电荷发生了改变呈现质子化或去质子化状态,OH-与臭氧结合促使其分解概率要超过催化剂表面对臭氧的吸附催化分解能力,从而抑制了催化剂催化。因此当水中溶液达到了10时,臭氧分解的能力不升反降了。而且,溶液中高pH值会导致矿化过程中各类自由基捕获剂的生成(如 CO2-3,HCO3- 等),从而降低了溶液中HO·的浓度\[14\]。另外,在碱性条件下,由于HO·+HO-·O-+H2O的平衡存在\[15\],产生的HO·很快转变为氧阴离子。
3.4温度的影响
由于季节温度的差异,要将沸石催化臭氧应用于实际中,就必须研究温度对沸石催化臭氧分解进行研究。为了观测温度在沸石催化臭氧过程中的影响对,本实验分别对10℃、20℃和30℃三个温度进行研究。如图6所示,当温度从10℃上升到30℃时臭氧催化降解效率逐渐提高,这是引文温度的升高,导致溶液中各种分子的运动会加快,会加速臭氧分解速率,提高沸石的催化臭氧能力,另一方面温度升高也不利于臭氧分子在水溶液中的存活,也意味着将会有更多的溶解臭氧产生HO·。
5结论
(1)沸石的存在能显著促进水中臭氧的分解,并能催化臭氧产生成羟基自由基.
(2)沸石进行盐酸改性能提高臭氧的分解速率,且随着盐酸的浓度升高而提高,主要归因于其比表面积的增大。
(3)随着pH值升高,沸石催化臭氧的能力也随之提高,但是当pH和沸石本身的pHpzc接近时,沸石催化臭氧的效率最高。温度的提高也能促进沸石催化臭氧的能力。
参考文献:
[1]
刘艳芳,张智理,姜国平,等. 非均相催化臭氧氧化水中难降解有机物效率与机理研究进展\[J\],煤炭与化工,2016,39(9):29~35.
\[2\] Maste S J,Davis S H R. The use of ozonation to degrate organic contaminates in wastewater\[J\]. Envir.Sci.Technol,2013,28(4):180~184.
\[3\]Chen C,Chen H,Guo X,et al. Advanced ozone treatment of heavy oil refining wastewater by activated carbon supported iron oxide\[J\]. J Ind Eng Chem,2014,20(5):2782~2791.
\[4\]刘智武,蒙媛,刘建锋. 臭氧/TiO_2纳米管工艺处理水中2,4-二氯酚的效能研究\[J\]. 环境工程,2015(9):31~34.
\[5\]Kasprzyk-Hordern,B,Ziolek,M,Nawrocki,J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment\[J\]. Appl. Catal. B-Environ, 2003,46(4):639~669.
\[6\]Pines D S,Reckhow D A. Solid phase catalytic ozonation process for the destruction of a model pollutant\[J\]. Ozone Sci, Eng, 2003,25(1):25~39
\[7\]Sheng h L,Cheng L L. Kinetic characteristics of textile wastewater ozonation in fluidized and fixed activated carbon beds\[J\].Water Research,2000,34(3):763~772.
\[8\]Beltran F J,Rivas F J,Montero-de-Espinosa R. Catalyticozonation of oxalic acid in an aqueous TiO2 slurry reactor\[J\]. Appl Catal B:Environ.,2002,39(3):221~231.
\[9\]Chen B B; Zhu X B; Wang Y D Gold stabilized on various oxide supports catalyzing formalde hydeoxidation at room temperature\[J\]. Chin J Chem,2016(37):1729–1737.
\[10\]張华,唐卫军,吴百春,等. 改性花生壳活性炭吸附催化臭氧氧化处理反渗透浓水\[J\]. 环境工程学报,2016,10(10):5637~5643.
\[11\]Bader H,Hoigne J. Determination of ozone in water by the indigo method\[J\] Water Res,1981,15(4):449~456.
\[12\]Gunten V U. Ozonation of drinking water:oxidationkinetics and product formation\[J\]. Water Res,2003,37(7):1443~1467.
\[13]Langlais B,Reckhow D A,Deborah R B. Ozone in water treatment:application and engineering\[M\]. Michigan:Lewis Publishers,1991:18~19.
\[14\]Pi,Y Z,Wang,J L.The mechanism and pathway of the ozonation of 4-chlorophenol in aqueous solution \[J\]. Sci.China. Ser. B,2006,49(4):379~384
\[15\]Ku,Y,Wang,W ,Shen,Y S. Reaction behaviors of decomposition of monocrotophos in aqueous solution by UV and UV/O3 processes\[J\]. J. Hazard. Mater. 2000,72(1):25~37.
Catalytic Ozone aqueous Decomposition Promoted by Zeolite
Liu Zhiwu1, Hu Sihan2, Qiu Jianping1, Meng Yuan1
(1. JinHua Polytechnic, JinHua 321000, China; 2. Zhejiang Environmental Monitoring Engineering Limited Company, Hangzhou 31000, China)
Abstract: This study investigated the catalytic decomposition of zeolite for ozone in water and studied the various reaction conditions (zeolite performance, reaction pH, temperature) on the zeolite catalytic ozone capacity. It was found the presence of a zeolite can significantly promote water and decomposition of ozone, which can catalyze ozone into hydroxyl radical; The hydrolysis of zeolite can improve the decomposition rate of ozone and increases with the increase of hydrochloric acid concentration, which is mainly due to the increase of specific surface area; as the pH value increased, the ability that zeolite catalyzes ozone also increases, but when the Ph and zeolite are at itself pHpzc, it has highest catalytic efficiency. The increase in temperature can promote the ability of zeolite catalytic ozone.
Key words: zeolite; ozone; catalysis; hydroxyl radicals

