栉孔扇贝(Chlamys farreri)闭壳肌分离蛋白的糖基化特性
姜梦云,刘俊荣,周晏琳,张晴,刘慧慧,田元勇
(大连海洋大学 食品科学与工程学院,辽宁 大连,116023)
栉孔扇贝(Chlamysfarreri)闭壳肌分离蛋白的糖基化特性
姜梦云,刘俊荣*,周晏琳,张晴,刘慧慧,田元勇
(大连海洋大学 食品科学与工程学院,辽宁 大连,116023)
为探索海洋无脊椎动物肌肉分离蛋白的功能特性,以栉孔扇贝(Chlamysfarreri)为研究对象,针对其闭壳肌分离蛋白的糖基化特性开展研究。首先,将原料肌肉蛋白进行酸溶分离得到酸溶蛋白(ACSP),再于等电点回收得到分离蛋白(ACPP);将酸溶蛋白和分离蛋白分别进行糖基化处理;考察了葡萄糖、乳糖和葡聚糖等3种还原糖的糖基化效果,以及温度(40、50、60 ℃)、蛋白/糖质量比(1∶3、1∶5、1∶7)和酸溶蛋白的pH(3、5、7) 等3个反应参数,并以赖氨酸、果糖胺及吸光度为反应指标。研究结果发现,以分离蛋白(ACPP)为蛋白底物时,葡萄糖的糖基化效果最明显,该处理组的赖氨酸减少了43.09%,果糖胺增加1.41 mmol/L;较高的温度会促进糖基化反应,60℃处理组结果显示,赖氨酸减少46.95%,果糖胺增加1.41 mmol/L;不同糖浓度的效果差异不大,3种糖浓度处理组的赖氨酸减少46.95%~55.38%,果糖胺增加1.14~1.42 mmol/L。直接作为底物的酸溶蛋白(ACSP)则无糖基化效果,当调节酸溶蛋白(ACSP)pH至中性时,其糖基化功能得以显现,此时赖氨酸减少48.89%,果糖胺增加1.49 mmol/L。表明糖基化是栉孔扇贝分离蛋白的有效改性手段。
栉孔扇贝(Chlamysfarreri);闭壳肌;分离蛋白;糖基化
自1999年HULTIN将蛋白分离原理用于分离鱼蛋白制备以来[1],国外陆续将其用于鱼类加工副产物蛋白回收以提高鱼片产量,还有将分离鱼蛋白用作油炸食品的涂层以达到减油效果,以及制备具有功能性的蛋白肽等[2-3]。目前为止,分离鱼蛋白的研究大多局限在水产脊椎动物即经济鱼类,针对无脊椎动物如牡蛎[4]、南极磷虾[5]和扇贝[6]等的研究较少,且以扇贝为对象的研究重点普遍围绕分离蛋白的提取方法。
分离鱼蛋白具有少脂、无色及无腥臭等诸多优点。制备过程经历了极端pH调节,肌球蛋白结构发生改变导致分离产物功能性下降,进一步通过改性调节以提高分离鱼蛋白的功能特性。糖基化是最常见的蛋白质改性手段。大部分糖基化的研究主要集中在植物蛋白和乳蛋白,如大豆、豌豆、大麦、酪蛋白及乳清蛋白等。针对经济水产动物蛋白的糖基化研究主要围绕肌原纤维蛋白或酶解蛋白开展,例如日本SAEKI[7-10]团队,他们选用过鲤鱼、扇贝和三文鱼等肌原纤维蛋白;我国罗永康[11-12]团队,主要以鲢鱼肌原纤维为研究对象;DECOURCELLE等[13]以虾酶解物为原料;LIU等[14]利用鲣鱼酶解物来进行研究;王军[15]等利用金带细鲹酶解物为原料;另有WAHYUNI[16]选用黑皮旗鱼的水溶蛋白作为研究对象。而对分离鱼蛋白糖基化特性的研究未见系统报道。
本文以经济贝类——栉孔扇贝为研究对象,研究了其分离蛋白的糖基化改性机制。
1 材料与方法
1.1材料
活栉孔扇贝(Chlamysfarreri),采购于大连长兴市场,室温下运输,30 min内运输到实验室,壳长(6±0.3) cm。糖化血清蛋白(GSP)测试盒,购于南京建成生物工程研究所;透析袋MD34,购于北京索莱宝科技有限公司。
1.2实验方法
1.2.1 分离蛋白制备
取切碎的闭壳肌200 g与800 mL蒸馏水混合,10 000 g下均质90 s,用3 mol/L HCl调pH值至2,冰水浴下搅拌30 min,10 000 g下离心15 min,所得上清为酸溶蛋白(acid soluble protein ,ACSP);将ACSP用2 mol/L NaOH调pH值至5,10 000 g下离心15 min,所得沉淀为分离蛋白(acid protein precipitation,ACPP),准确称量ACPP质量,与4倍体积蒸馏水混合,10 000 g下均质90 s,用2 mol/L NaOH调pH值至7。使用双缩脲法测定ACSP和ACPP蛋白浓度。
1.2.2 糖基化
反应体系内蛋白浓度为12 mg/mL。按照表1和表2制备糖基化底物,其中每种样品分装成15 mL小样若干,-40 ℃冷冻12 h,冷冻干燥3 d,然后按照表1和表2温度进行糖基化反应。其中反应湿度为65%,反应0、2、4、6 h后,将样品立即置于冰水浴中冷却降温,与15 mL蒸馏水混合,7 000 g下均质30 s,用NaOH调pH值至7,即为糖基化产物。

表1 酸溶蛋白(ACSP)糖基化处理条件

表2 分离蛋白(ASPP)糖基化处理条件
1.2.3 指标测定
(1)赖氨酸含量。将糖基化产物在4 000 g离心15 min,取上清进行分析。按照GOODNO[17]等方法进行测定。160 mg OPA用4 mL体积分数95%乙醇溶解;2 g SDS用10 mL蒸馏水溶解;38.1 g硼砂用蒸馏水溶解后,用NaOH调pH=9.5,加水定容至1 L;将2 mL OPA、5 mL SDS、50 mL硼砂及0.2 mL 巯基乙醇用水定容至100 mL,即为OPA试剂,当天使用。赖氨酸制作标准曲线。50 μL样液与2 mL OPA试剂混合,静置2 min,340 nm下测吸光度。
(2)果糖胺含量。将糖基化产物在4 000 g离心15 min,将上清透析24 h后进行分析。按照试剂盒方法测定。50 μL样液与1 mL试剂混合,37 ℃水浴加热15 min,室温下冷却,530 nm下测吸光度。
(3)吸光度测定。将糖基化产物在4 000 g离心15 min,取上清进行分析。0.2 mL样液与1 mL 0.1% SDS混匀,420 nm下测吸光度。
(4)溶解性。将糖基化产物在4 000 g离心15 min,取上清进行分析。用考马斯亮蓝法[18]测蛋白浓度。
1.3统计分析
所有试验均进行了3次重复实验,数据以平均值表示,用Excel 2007软件进行分析处理。
2 结果与讨论
2.1闭壳肌分离蛋白(ACPP)的糖基化性能
2.1.1 温度对分离蛋白糖基化性能的影响
图1为ACPP在不同糖基化温度下的反应特性。从中可以观察到,ACPP可以发生糖基化,且温度越高,糖基化反应越剧烈。其中,与对照组相比(N-40 ℃、N-50 ℃、N-60 ℃),加糖组(5G-40 ℃、5G-50 ℃、5G-60 ℃)的赖氨酸均呈明显下降趋势,反应6 h后,各组分别下降了21.57%、31.86%和46.95%,这是因为蛋白底物当中的赖氨酸的ε-氨基最易与糖结合,发生糖基化反应后含量下降。果糖胺是蛋白质和糖聚合物的重排产物[19],会随着反应的进行而逐渐升高,加糖组反应6h后40、50和60 ℃分别增加了0.21、0.86和1.41 mmol/L。溶解性会随着反应的进行而下降,这是由于热变性引起的,3种温度处理组的溶解性无显著差异。此外,3种温度处理组的吸光度也无显著变化(0.008~0.014)。而对照组的各项指标均无显著变化,其中40、50、60 ℃处理组赖氨酸分别减少了0、8.54%和4.56%,果糖胺分别增加了0、0.06和0 mmol/L。由此可见,升高温度对分离蛋白糖基化有促进作用。研究表明,温度对于肌原纤维蛋白的糖基化也有相同影响效果,例如FUJIWARA[7]利用葡聚糖对鲤鱼肌原纤维蛋白进行糖基化处理,在40~60 ℃内,温度的提升对糖基化效果有促进作用;同样地,TANABE[20]用葡萄糖和核糖分别对鲤鱼肌原纤维蛋白进行糖基化,在30~40 ℃内,温度的提高同样会加强糖基化效果。由此可见,无论是分离蛋白还是肌原纤维蛋白,温度的提高对糖基化均有促进作用。
2.1.2 糖浓度对分离蛋白的糖基化性能的影响
图2为ACPP在不同糖浓度下的反应特性。从中不难看出,与对照组(N)相比,在蛋白/糖(质量比)1∶3~1∶7内,糖浓度对糖基化效果并不显著。3组糖浓度(3G、5G、7G)的赖氨酸分别减少了46.95%、51.83%和55.38%,果糖胺则分别增加了1.14、1.41和1.42 mmol/L。推测原因一是体系内赖氨酸含量较少,不需要过多葡萄糖来提供羰基;二是整个糖基化反应的pH值处于7,反应强度低。而其他研究表明,FUJIWARA[7]在低糖浓度下进行的糖基化反应会出现明显差异,但当糖浓度超过蛋白/葡萄糖质量比为1∶4时,反应趋于平稳;SATO[21]在使用蛋白/褐藻胶寡糖质量比为1∶0.4、1∶1、1∶4和1∶9对鲤鱼肌原纤维进行研究发现,糖浓度越高,效果越明显。可见,糖基化体系中反应物类型,即鱼分离蛋白或鱼肌原纤维,会影响糖基化特性。
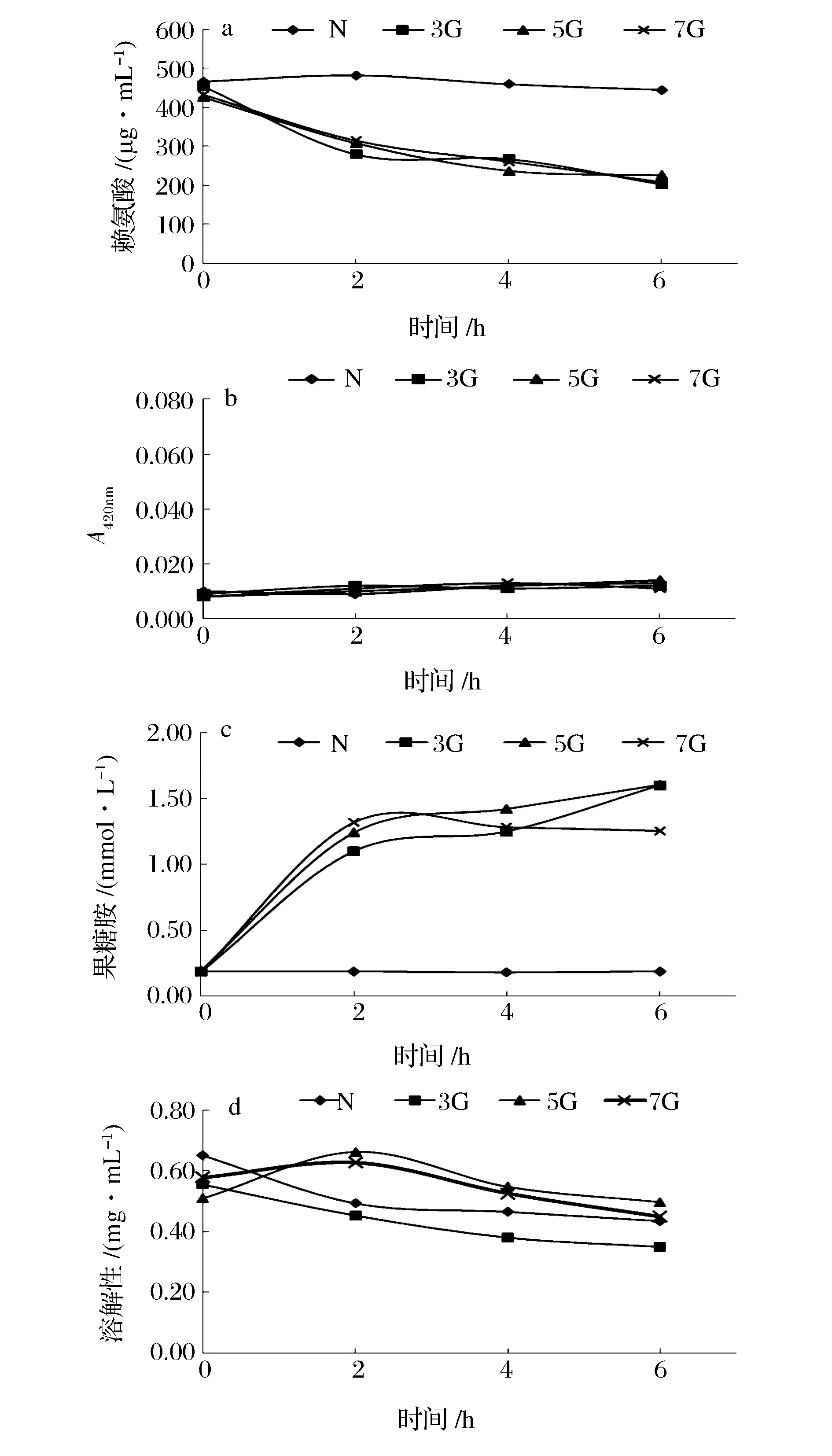
图2 不同糖浓度下栉孔扇贝闭壳肌分离蛋白(ACPP)的糖基化效果Fig.2 The characterization of glycosylation of acid protein precipitation (ACPP) from Chlamys farreri adductor muscle at different weight ratio of protein to sugar
2.1.3 还原糖对分离蛋白的糖基化性能的影响

图3 不同还原糖下栉孔扇贝闭壳肌分离蛋白(ACPP)的糖基化效果Fig.3 The characterization of glycosylation of acid protein precipitation (ACPP) from Chlamys farreri adductor muscle at different reducing sugars
本研究按照糖的聚合度即单糖、双糖及多糖3种类型,分别选用了葡萄糖(G)、乳糖(L)和葡聚糖5 000(D)为糖基供体。图3显示了ACPP与不同还原糖的糖基化反应特性,与乳糖和葡聚糖相比,葡萄糖更利于糖基化进行。其中,葡萄糖、乳糖和葡聚糖组的赖氨酸分别下降了23.22%、25.81%和43.09%,果糖胺分别增加了0.2、0.68和1.41 mmol/L。分析原因为葡萄糖分子质量最低,利于羰基与蛋白结合。同类报道表明,YOU等[22]用木糖、葡萄糖、半乳糖、低聚异麦芽糖和葡聚糖1 000对鲢鱼水溶性蛋白进行糖基化,其中分子质量低的木糖最易发生糖基化,其次为葡萄糖。DECOURCELL[13]利用了木糖和葡聚糖270 kDa对北极甜虾(Pandalusborealis)酶解物进行糖基化,发现木糖对糖基化的作用大于葡聚糖270 kDa。此外,陈欣[23]选用葡萄糖、乳糖、壳聚糖、羧甲基纤维素钠以及葡聚糖(65万)为糖基供体,对罗非鱼肉肌原纤蛋白进行糖基化改性,同样得出小分子糖(葡萄糖和乳糖)与肌原纤维蛋反应的速度较快,但大分子糖(羧甲基纤维素钠和葡聚糖)更有利于乳化性和热稳定性的提高。显而易见,无论在何种蛋白体系类型中,就糖基化效果而言,低分子质量糖更有利于糖基化。值得注意的是,糖基化反应程度与糖基化产物的功能性值得有针对性深入探索。
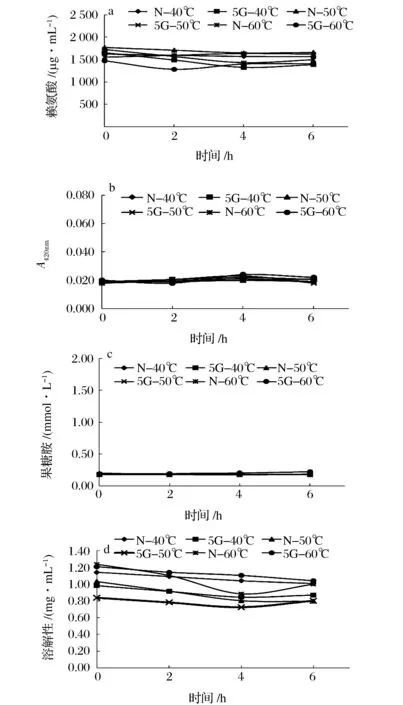
图4 不同温度下栉孔扇贝闭壳肌酸溶蛋白(ACSP)的糖基化效果Fig.4 The characterization of glycosylation of acid soluble protein (ACSP) from Chlamys farreri adductor muscle at different temperatures
2.2闭壳肌酸溶蛋白(ACSP)的糖基化性能
2.2.1 酸溶蛋白的糖基化性能
分离蛋白制备主要包括蛋白质溶出和蛋白质回收两个关键步骤,鉴于操作繁琐及蛋白质损耗等问题,本研究尝试以溶出蛋白为反应物,直接进行糖基化处理。图4~图6分别为温度、糖浓度及还原糖对ACSP糖基化的影响效果,从中不难看出,以酸溶蛋白为出发物几乎不产生糖基化反应。分析原因为羰氨反应是可逆的,酸性环境不利于糖基化产物的积累[17,24]。因此,直接以酸溶ACSP为反应物是无法进行糖基化的。
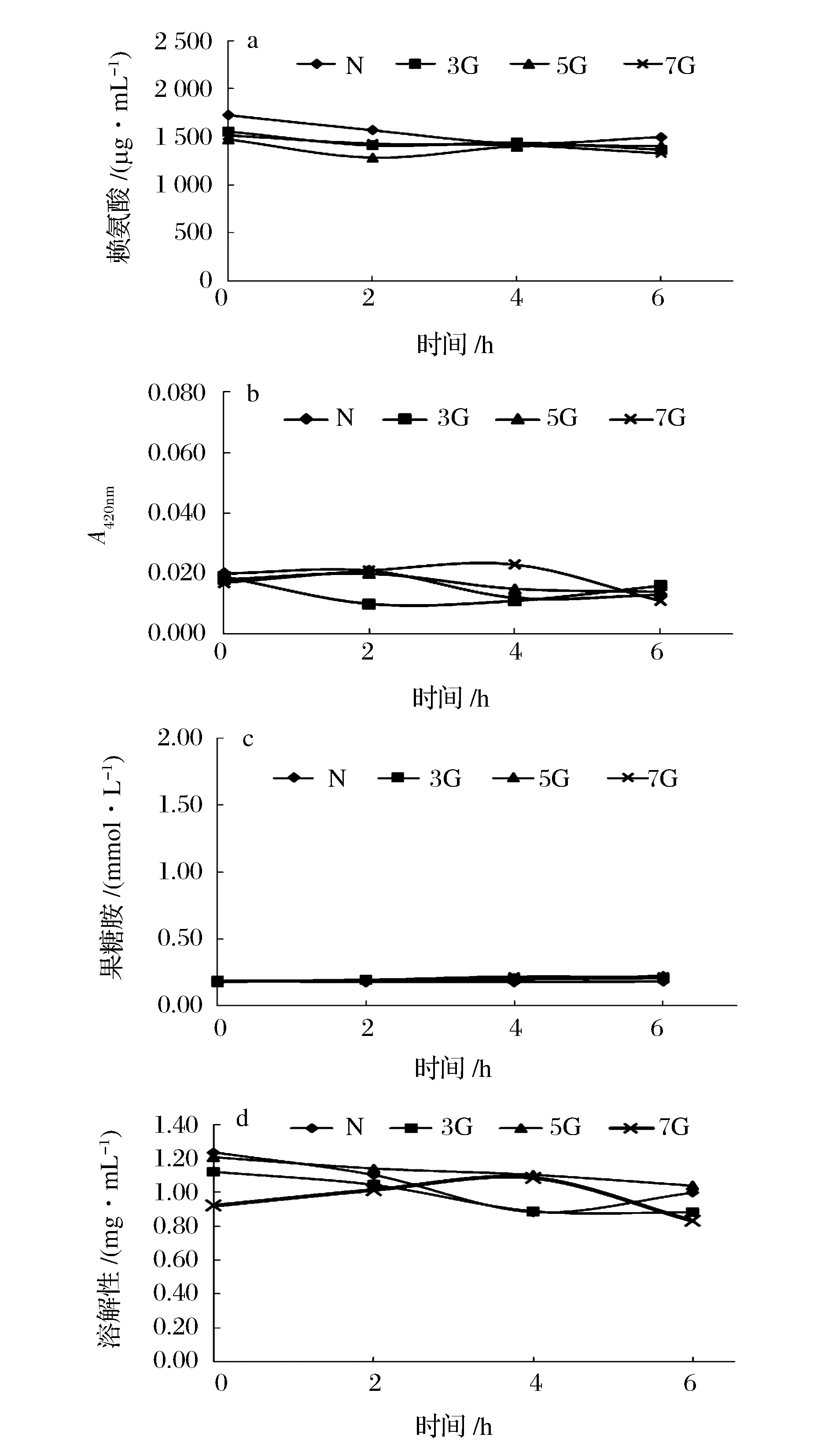
图5 不同糖浓度下栉孔扇贝闭壳肌酸溶蛋白(ACSP)的糖基化效果Fig.5 The characterization of glycosylation ofacid soluble protein (ACSP) from Chlamys farreri adductor muscle at different weight ratio of protein to sugar
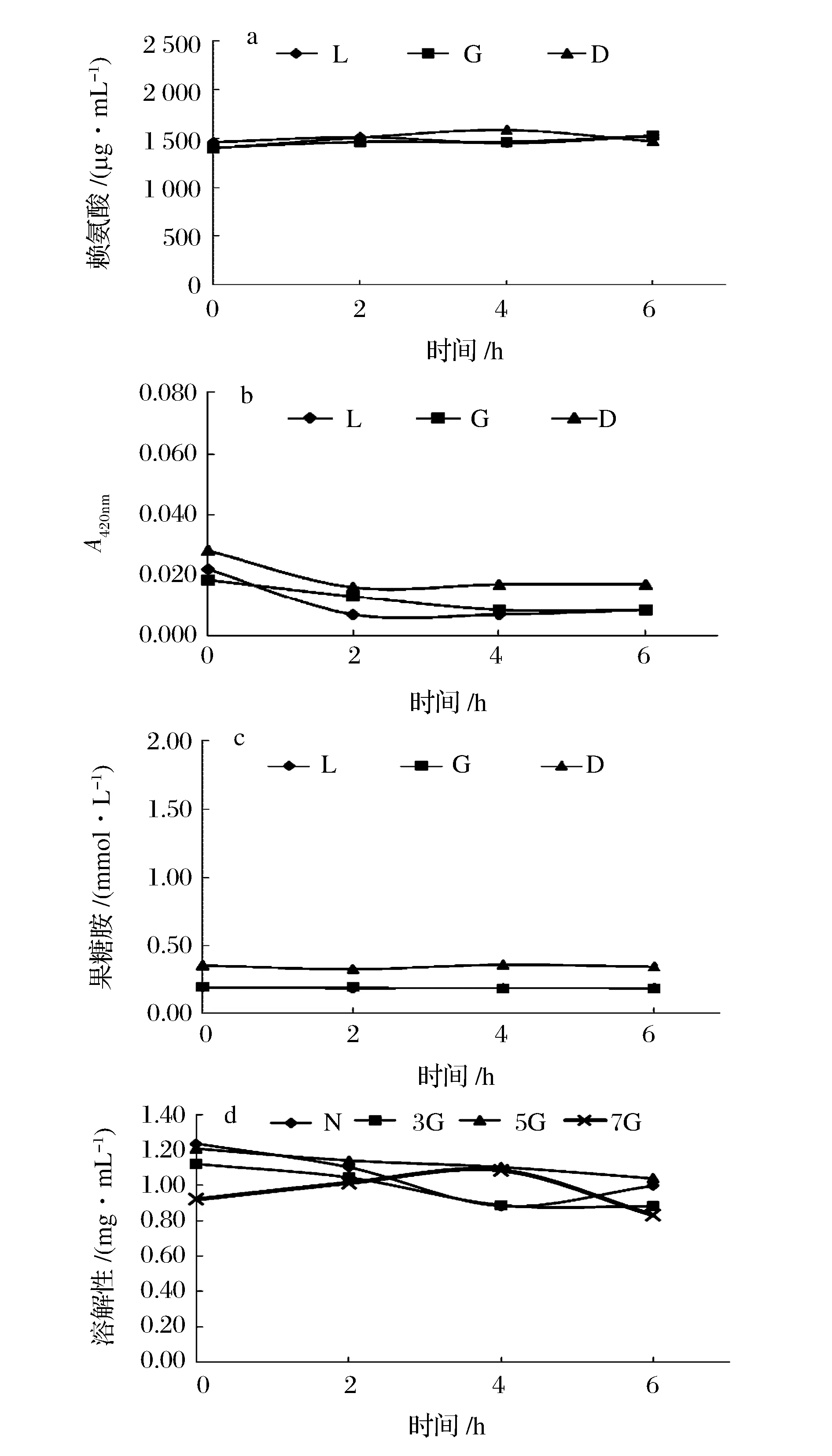
图6 不同还原糖下栉孔扇贝闭壳肌酸溶蛋白(ACSP)的糖基化效果Fig.6 The characterization of glycosylation ofacid soluble protein (ACSP) from Chlamys farreri adductor muscle at different reducing sugars
2.2.2 酸溶蛋白的pH与糖基化性能
酸溶蛋白无法直接作为糖基化反应物,通过提高酸溶蛋白pH值,来探索其糖基化反应的可行性。图7为pH值调至3、5及7后酸溶蛋白的糖基化结果,事实表明,调节pH后的溶出蛋白ACSP的糖基化是可行的,且效果与分离蛋白相媲美。pH值越高,糖基化效果越剧烈。如图7所示,pH 3的酸溶蛋白依旧无法发生糖基化反应;而pH 7的糖基化反应效果最明显,赖氨酸增加了48.89%,果糖胺升高了1.49 mmol/L,吸光度增大到0.071;pH 5 反应强度介于二者中间,赖氨酸增加了22.45%,果糖胺增加了0.97 mmol/L,吸光度增大到0.050。3种pH间溶解性存在差异,其中pH 3时溶解性最大,pH 7次之,pH 5最低,这是由蛋白质两性性质造成的。此外,糖基化反应后,pH值为7的酸溶蛋白(ACSP)会产生显著褐变,而分离蛋白(ACPP)则不会发生,分析原因可能是,酸溶出蛋白没有经过蛋白回收的过程,其中还有游离氨基酸和肽等,这些低分子在糖基化过程极易发生美拉德褐变。孙丽平等[25]以赖氨酸-葡萄糖为模型,在pH 5~pH 9,pH值越高褐变程度越大。孙方达[26]在研究猪骨蛋白水解物时也同样发现,在pH 5~9区间内,赖氨酸含量随着反应pH值的上升而减幅越大。由此可见,低分子含氮物(游离氨基酸或肽)和pH是羰氨反应的关键要素。
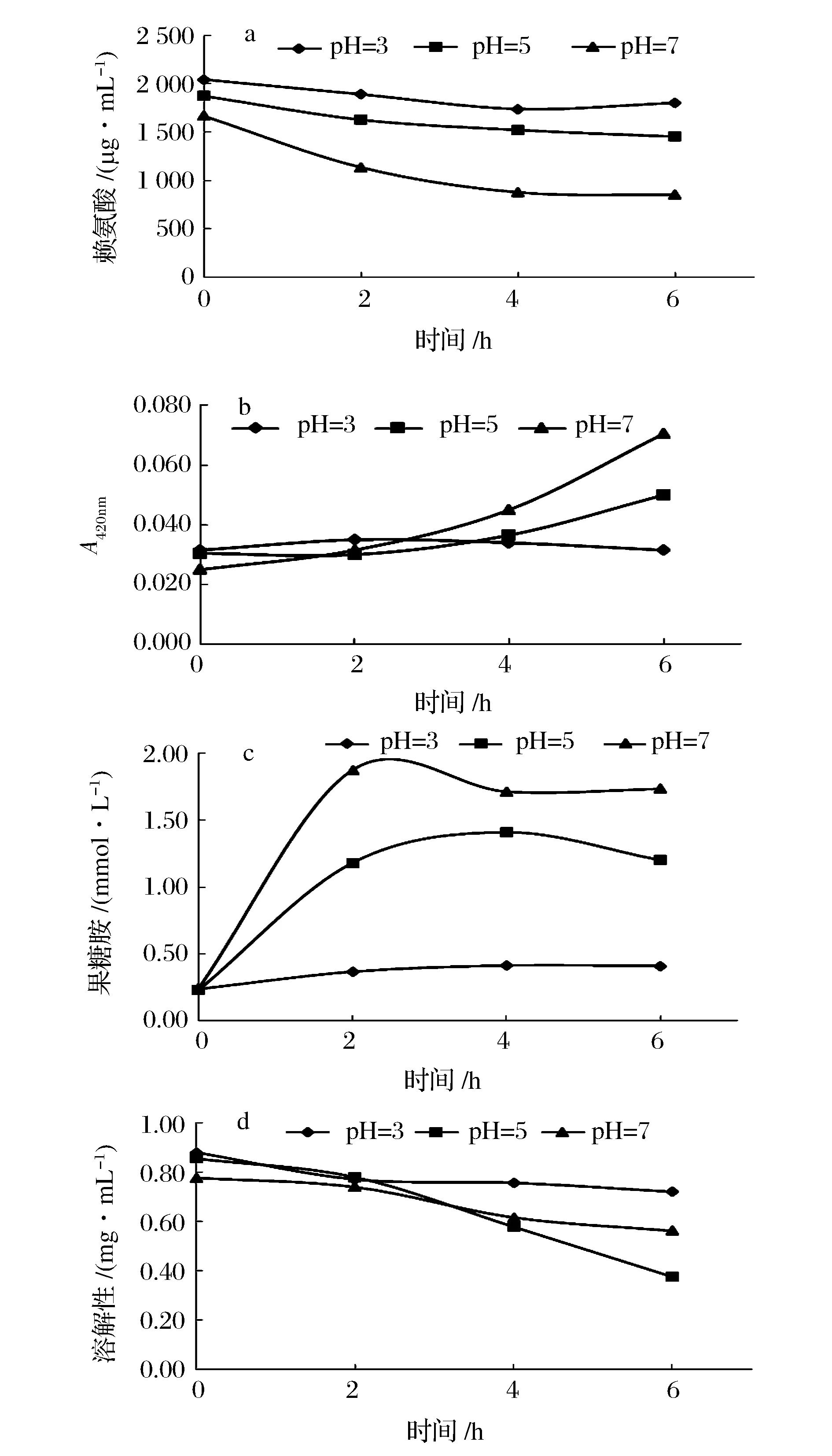
图7 不同pH值下栉孔扇贝闭壳肌酸溶蛋白(ACSP)的糖基化效果Fig.7 The characterization of glycosylation ofacid soluble protein (ACSP) from Chlamys farreri adductor muscle at different pH
3 结论与展望
以栉孔扇贝闭壳肌为出发材料,围绕其分离蛋白糖基化特性开展研究。初步研究结论可以归纳为2点:(1)分离蛋白可以有效进行糖基化,温度的提高对糖基化有促进作用,糖浓度对糖基化的影响则较小,不同还原糖的影响存在差异,葡萄糖最易促进糖基化。(2)对于溶出蛋白而言,酸溶蛋白无法直接进行糖基化反应,可通pH调节使其有效进行糖基化,并达到分离蛋白糖基化的相同效果,如此可以减少蛋白损耗且节省操作步骤。故以溶出蛋白为出发物进行糖基化处理更有实际意义。
需要指出的是,碱溶蛋白的糖基化特性值得今后系统探索对比;此外,糖基化带来的功能性改善效果值得深入研究。
[1] HULTIN H O, KELLEHER S D.Process for isolating a protein composition from a muscle source and protein composition:US,6005073[P/OL].1999-12-21[2014-03-01].http://www.google.com.hk/patents/US6005073?dq=US,6005073&hl=zhCN&sa=X&ei=2ZhsUrT7FsWTiQe-x4DAAg&ved=0CEkQ6AEwAg
[2] HELGI N, INGRID U.The acid and alkaline solubilization process for the isolation of muscle proteins:state of the art[J].Food Bioprocess Technol,2009,2(1):1-27.
[3] PARK J W.Surimi and surimi seafood[M].Florida:CRC Press,2005:107-133.
[4] 郑惠娜,张晶晶,周春霞,等.pH 调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J].中国食品学报,2014,14(7):230-235.
[5] 李芳,刘俊荣,梁姗姗,等.南极磷虾蛋白质的分离特性及其组分分析[J].大连海洋大学学报,2013,28(2):191-194.
[6] 梁姗姗,刘俊荣,马永生,等.虾夷扇贝(Patinopectenyessoensis)外套膜蛋白的分离提取及功能特性研究[J].食品科学,2014, 35(7):12-16.
[7] FUJIWARA K, OOSAWA T, SAEKI H.Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J].Journal of Agricultural and Food Chemistry,1998,46(4):1 257-1 261.
[8] SAEKI H.Preparation of neoglycoprotein from carp myofibrillar protein by maillard reaction with glucose:biochemical properties and emulsifying properties[J].J Agric Food Chem,1997,45(3):680-684.
[9] KATAYAMA S, SHIMA J, SAEKI H.Solubility improvement of shellfish muscle proteins by reaction with glucose and its soluble state in low-ionic-strength medium[J].Journal of Agricultural and Food Chemistry,2002,50(15):4 327-4 332.
[10] TAKEDA H, IIDA T, OKADA A, et al.Feasibility study on water solubilization of spawned out salmon meat by conjugation with alginate oligosaccharide[J].Fisheries Science,2007,73(4):924-930.
[11] 尤娟.鲢鱼鱼肉蛋白抗氧化肽的制备及其糖基化产物功能特性的研究[D].北京:中国农业大学,2014.
[12] 张爱荣.糖基化反应改善鲢鱼肉肌原纤维蛋白功能特性的研究[D].北京:中国农业大学,2005.
[13] DECOURCELLE N, SABOURIN C, AUBRY T, et al.Emulsifying and antioxidant properties of a shrimp (Pandalus borealis) hydrolysate conjugated with xylose or dextran through the maillard reaction by dry-heating in mild conditions[J].Journal of Food Research,2014, 3(3):144-157.
[14] LIU J H, YU F L, ZHOU X X , et al.Protein hydrolysate using combined controlled enzymatic hydrolysis and glycation for improved solubility and emulsifying properties[J].Journal of Food and Nutrition Research, 2015,3(7):471-477.
[15] 王军,王忠合,傅力,等.美拉德反应对金带细鲹鱼肉蛋白酶解物功能特性及潜在危害物形成的影响[J].食品与发酵工业,2015,41(11):23-28.
[16] WAHYUNI M, ISHIZAKI S, TANAKA M.Improvement of thermal stability of fish water soluble proteins with glucose-6-phosphate through the maillard reaction[J].Fisheries Science,1998,64(6):973-978.
[17] GOODNO CC, SWAISGOOD H E, CATIGNANI G L.A fluorimetric assay for available lysine in proteins[J].Anal Biochem,1981,115(1):203-211.
[18] BRADFORD MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry1976,72:248-254.
[19] DAMODARAN S, PARKIN K L, FENNEMA O R.Fennema’s Food Chemistry[M].Boca Raton:CRC Press,2007:825-826.
[20] TANABE M, SAEKI H.Effect of maillard reaction with glucose and ribose on solubility at low ionic strength and filament-forming ability of fish myosin[J].Journal of Agricultural and Food Chemistry, 2001,49(7):3 403-3 407.
[21] SATO R, SAWABE T, KISHIMURA H, et al.Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide:improved solubility in low ionic strength medium[J].Journal of Agricultural and Food Chemistry ,2000,48(1):17-21.
[22] YOU J, LUO Y K, SHEN H X.Functional properties of water-soluble proteins from silver carp (Hypophthalmichthysmolitrix) conjugated with five different kinds of sugar[J].Food Bioprocess Technol,2013,6(12):3 596-3 603.
[23] 陈欣.罗非鱼肉肌原纤维蛋白糖基化改性研究[D].湛江:广东海洋大学,2010.
[24] 吴惠玲,王志强,韩春,等.影响美拉德反应的几种因素研究[J].现代食品科技, 2010,26(5):440-444.
[25] 孙丽平,汪东风,徐莹,等.pH和加热时间对美拉德反应挥发性产物的影响[J].食品工业科技,2009,30(4):122-125.
[26] 孙方达,孔保华,韩齐,等.反应初始pH和加热时间对猪骨蛋白水解物美拉德产物特性的影响[J].食品工业科技,2003,34(22):106-115.
ThecharacterizationofglycosylationofproteinisolatedfromChlamysfarreriadductormuscle
JIANG Meng-yun, LIU Jun-rong*, ZHOU Yan-lin, ZHANG Qing, LIU Hui-hui, TIAN Yuan-yong
(College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China)
To explore the functionality of marine invertebrates’ fish protein isolate,Chlamysfarreriwas studied; fish protein was isolated by using acid-aided solution from adductor muscle, soluble protein (ACSP) was extracted under critical pH. Acidic protein precipitation (ACPP) was obtained from ACSP by isoelectric precipitation. ACSP and ACPP were modified by glycosylation respectively. The characterization of glycosylation in different reducing sugars(glucose, lactose and dextran) , temperature (40,50 and 60 ℃), the mass ratio of protein to sugar (1∶3,1∶5 and 1∶7) and pH were investigated by measuring the available lysine content, fructosamine content and brown color development. Among several reducing sugars, glucose was the most effective in glycosylation, and its available lysine was decreased 43.09%, fructosamine increased 1.41 mmol/L. Significant differences were observed at different temperature, the most efficiency was at 60 ℃ and its available lysine was decreased 46.95%, fructosamine increased 1.41 mmol/L. Glycosylation was not affected by the weight ratio of protein to sugar. ACSP was not glycosylated directly, when adjusting pH to neutral, glycosylation was obtained. Its available lysine was decreased 48.89%, fructosamine was increased 1.49 mmol/L. The results suggested that glycosylation may be a useful approach for modification of fish protein isolate fromChlamysfarreri.
Chlamysfarreri; adductor muscle; protein isolate; glycosylation
硕士研究生(刘俊荣教授为通讯作者,E-mail:ljunrong@dlou.edu.cn)。
国家自然科学基金(31271980)
2017-01-03,改回日期:2017-03-15
10.13995/j.cnki.11-1802/ts.013743

