焦亚硫酸钠复合还原硒、碲、金、铂、钯的热力学及动力学特征分析
王欣欣,郑雅杰,靳利娥,张福元
焦亚硫酸钠复合还原硒、碲、金、铂、钯的热力学及动力学特征分析
王欣欣1, 2,郑雅杰2,靳利娥1,张福元2
(1. 太原理工大学化学化工学院,太原030024;2. 中南大学冶金与环境学院,长沙 410083)
采用焦亚硫酸钠复合还原沉金后液回收硒、碲和捕集金、铂、钯。通过正交实验考察各因素对硒、碲、金、铂、钯还原率的影响,并对焦亚硫酸钠、SO2和水合肼复合还原沉金后液进行动力学及热力学特征分析。结果表明:采用焦亚硫酸钠、SO2和水合肼复合还原沉金后液,对硒、碲还原率的影响从大到小的顺序为反应时间、焦亚硫酸钠用量、水合肼用量。通入 SO2至饱和后,当水合肼用量为1.5 mL/L,焦亚硫酸钠为30 g/L,SO2流量为0.4 L/min,每反应1h通入0.5 h SO2,反应时间为9 h时,金、铂、钯的还原率均达到100%,硒和碲的还原率分别为71.50%和90.30%。焦亚硫酸钠复合还原硒、碲符合一级反应动力学规律,还原硒、碲的表观活化能分别为52.533 kJ/mol和70.828 kJ/mol,硒、碲的还原属化学反应控制。热力学分析表明,沉金后液中金、铂、钯、硒、碲分别以AuCl4−、PtCl42−、PdCl42−、H2SeO3、TeCl62−形态存在,焦亚硫酸钠、SO2主要以H2SO3形态存在,水合肼以N2H5+形态存在。
沉金后液;焦亚硫酸钠;正交实验;热力学;动力学
铜阳极泥是粗铜电解精炼时落于电解槽底的泥状细颗粒物质,主要由阳极粗金属中不溶于电解液的杂质和待精炼的金属组成,是提炼金、银等稀贵金属的主要原料[1−3]。 阳极泥处理工艺一般分为火法流程、选冶联合流程、全湿法或以湿法为主的流程3种。铜阳极泥经过蒸硒,酸浸脱铜,碱浸除碲等工序脱除贱金属,然后氯化分金及亚硫酸钠分银。氯化所得分金液用焦亚硫酸钠等还原剂还原金[4−5],过滤后得到金和沉金后液;沉金后液中还含有未被还原的金、铂、钯和大量的硒、碲,是回收金、铂、钯、硒、碲等稀贵金属的重要原料。
近年来,对于沉金后液中稀贵金属回收的研究,目前主要有Zn粉还原[6]、SO2还原[7−9],亚硫酸钠还原[10]等方法。其中,Zn粉对硒、碲还原能力差,且造成溶液中Zn离子浓度的增加,对后续溶液的处理带来困难。单一SO2、亚硫酸钠还原虽然能达到较好的还原效果,但需大幅调节酸碱度,操作复杂。二氧化硫和水合肼复合还原沉金后液,达到很好的效果,但水合肼用量大且价格昂贵。
本文作者采用焦亚硫酸钠复合还原体系还原沉金后液,试图在焦亚硫酸钠还原金的基础上,降低还原剂的用量,探讨焦亚硫酸钠复合还原剂还原沉金后液中的硒、碲、金、铂、钯的效果。研究表明,以焦亚硫酸钠复合还原剂还原沉金后液,工艺简单,SO2和水合肼等有毒物质用量少,成本低,所得还原渣稀贵金属品位高,且不需要调节酸碱度,并对其反应热力学和动力学特征进行分析,研究结果为工业处理沉金后液提供基础数据和理论指导。
1 实验
1.1 实验原料
以某铜阳极泥处理工序后的沉金后液为实验原料,ICP-AES 分析结果如表1所列。
1.2 实验步骤
准确量取500 mL沉金后液倒入三颈瓶中,启动搅拌,并置于加热套中控制反应温度,通入 SO2至饱和,缓慢加入焦亚硫酸钠固体和水合肼溶液,随后间歇通入SO2,即SO2流量为0.4 L/min,每反应1 h通入0.5 h SO2,反应一段时间后,抽滤,滤液定容分析检测,滤渣干燥称量质量。
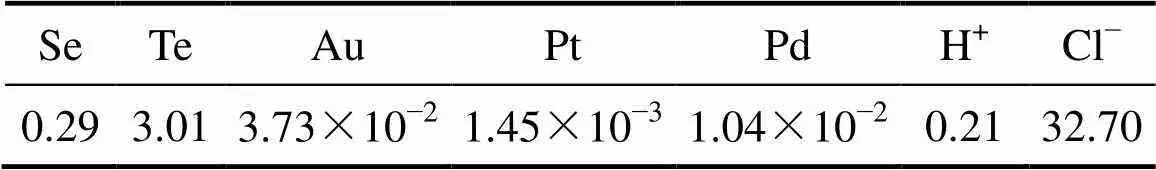
表1 沉金后液中硒、碲、金、铂、钯及H+、Cl−浓度
1.3 分析方法
采用美国热电元素公司的Intrepid II XSP型电感耦合等离子体发射光谱仪 (ICP)分析溶液化学成分;X射线荧光光谱仪(XRF)分析固体物质成分;日本理学D/max−TTR III型X射线衍射仪(XRD)分析固体物质物相;日本电子株式会社JSM.6300型扫描电镜(SEM)观察固体产物微观形貌。
2 结果与讨论
2.1 还原体系的对比实验
实验取500 mL沉金后液,加热至85 ℃,加入还原剂后反应2 h。研究表明,不同还原剂对金、铂、钯的还原效果均可达到100%,硒、碲的还原率如表2所列。由表2可知,SO2对硒的还原效果较好,焦亚硫酸钠和水合肼对碲的还原效果较好,单一SO2对硒的还原率为38.7%,SO2和焦亚硫酸钠复合还原体系对硒的还原率仅为7.0%。当在沉金后液中加入过量的焦亚硫酸钠时,焦亚硫酸钠分解产生亚硫酸钠,亚硫酸钠和单质硒反应生成硒代硫酸钠,降低了硒的还原率。
焦亚硫酸钠、SO2和水合肼复合还原体系对硒、碲均有较好的还原能力,因此,实验采用焦亚硫酸钠、SO2和水合肼复合还原体系还原沉金后液,降低还原剂用量,通过正交实验对实验条件进行优化。当反应温度为85 ℃,间歇通SO2时,选取反应时间、水合肼用量和焦亚硫酸钠用量三因素进行正交试验,正交试验因素水平表及结果分别如表3和表4所列。
研究表明当反应时间为1~4 h、水合肼用量为2~4 mL/L、焦亚硫酸钠用量为15~30 g/L时,金、铂、钯的还原率均达到100%,硒、碲最高还原率分别为46%和66.7%。根据正交试验结果,采用极差分析影响硒、碲的因素强弱,其结果分别如表5和表6所列。
由表5可知,硒的最优条件为A1B1C1,即反应时间4 h,焦亚硫酸钠用量15 g/L,水合肼用量2 mL/L。在三因素中,各因素对硒还原率影响程度由大到小的顺序依次为反应时间、焦亚硫酸钠用量、水合肼用量。

表2 不同还原剂对硒、碲、金、铂、钯还原率的影响

表3 L9(33)正交实验因素水平表
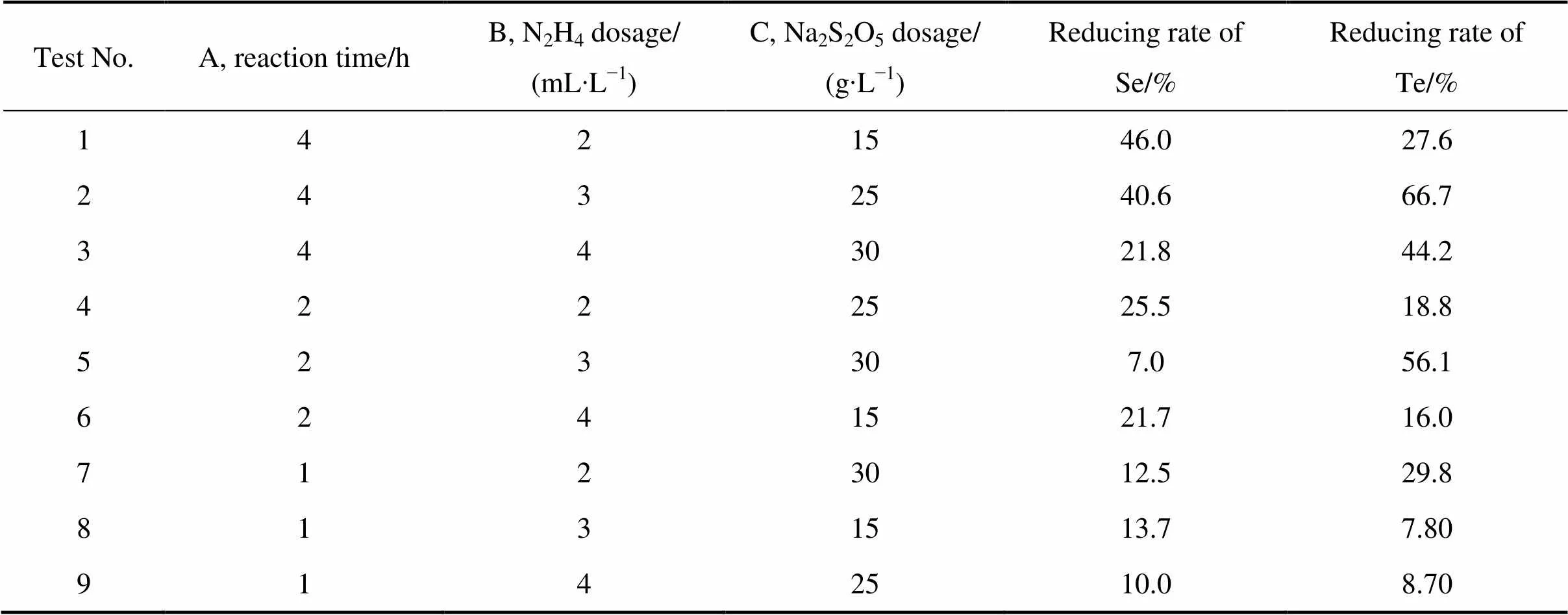
表4 L9(33)正交实验结果

表5 硒还原正交实验结果分析

表6 碲还原正交实验结果分析
在A1B1C1条件下进行验证试验,金、铂、钯的还原率均达到100%,硒还原率为46.00%,碲的还原率为28.00%。
由表6可知,碲的最优条件为A1B2C3,即反应时间4 h,焦亚硫酸钠用量30 g/L,水合肼用量3 mL/L。在三因素中,各因素对碲还原率影响程度由大到小的顺序依次为反应时间、焦亚硫酸钠用量、水合肼用量。最优条件下进行验证试验,金、铂、钯均被完全还原,碲还原率为70.00%,硒的还原率为37.80%。
正交实验表明,反应时间是影响硒、碲还原率最主要因素。延长反应时间进一步考察硒、碲还原率的变化。在反应温度为85 ℃,间歇通SO2,焦亚硫酸钠用量30 g/L,水合肼用量3 mL/L条件下,延长反应时间至9h时,硒的还原率为71.5%,碲的还原率为90.3%。延长反应时间可以达到提高硒、碲还原率的实验结果,进一步验证了正交试验的准确性。
2.2 焦亚硫酸钠复合还原体系下硒、碲还原动力学特征及产物分析
实验取500 mL沉金后液倒入三颈瓶中,将三颈瓶固定在加热套中,启动搅拌,加热至恒温,通入SO2至饱和,加入1.5 mL水合肼和15 g焦亚硫酸钠,随后每反应1 h通入0.5 h SO2,延长反应时间至7 h。当反应温度分别为45、65、75和85 ℃时,沉金后液中硒、碲还原率的变化分别如图1和图2所示。
由图1和图2可知,在相同温度下,硒、碲还原率均随反应时间的增加而增加,反应温度对硒、碲还原率均有影响,且对碲还原率的影响更为显著。
在一定温度下,化学反应速率与各反应物的浓度的若干次方的乘积成正比,常见的反应类型为零级、一级及二级,其动力学方程式如下[11]:
=(零级) (1)

图1 反应时间对硒还原率的影响

图2 反应时间对碲还原率的影响
−ln(1−)=(一级) (2)
1/(1−)=(二级) (3)
式中:为反应还原率;为反应时间;为反应速率常数。
根据图1和2的数据作图,其规律分别如图3和4所示。由图3和4可知,采用焦亚硫酸钠、SO2和水合肼复合还原沉金后液,硒、碲还原反应符合一级反应动力学规律。
根据Arrhenius方程:ln=ln−/(),将ln对1/作图,结果如图5所示,由直线斜率,可近似求得硒、碲表观活化能分别为Se=52.533 kJ/mol,Te=70.828 kJ/mol。一般多相化学反应由化学反应控制时,活化能在40 kJ/mol以上,因此沉金后液中硒、碲还原为化学反应控制。且温度对硒、碲的还原率影响显著,进一步验证该硒、碲还原反应过程受化学反应控制[12−14]。
图6和7所示分别为85 ℃下还原渣的XRD谱和SEM像,由图6可知,还原渣物相为单质碲。由图7可知,其形貌为颗粒集聚体。对还原渣取样进行成分分析,结果如表7所示。由表7可知,还原渣中硒、碲金铂钯的质量分数之和为93.56%,有价金属得到回收且贵金属得到富集。
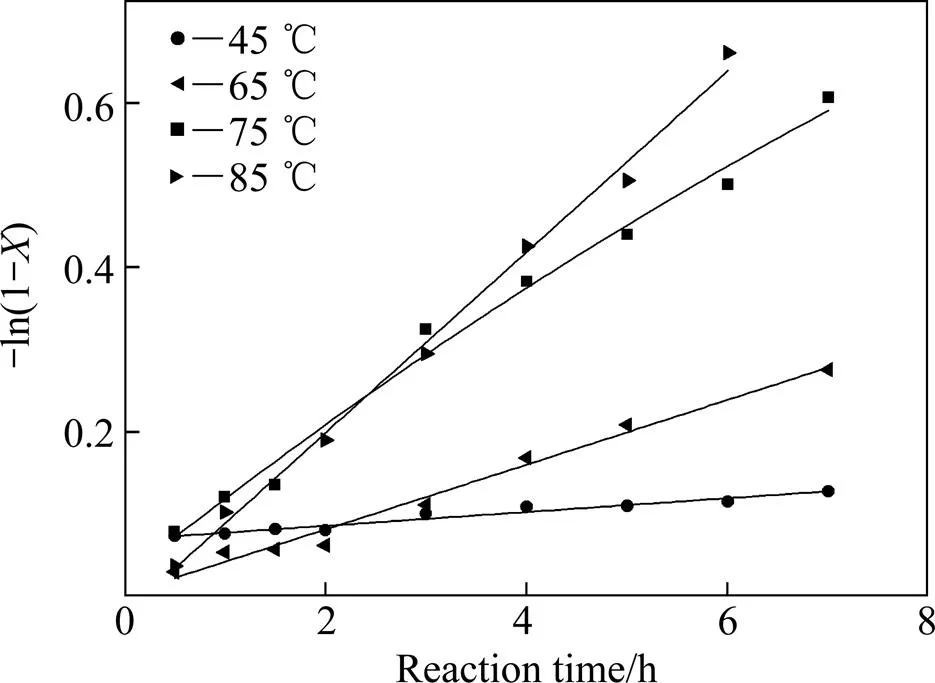
图3 不同反应温度下硒的(−ln(1−X))与t的关系

图4 不同反应温度下碲的(−ln(1−X))与t的关系

图5 lnk与T−1的关系
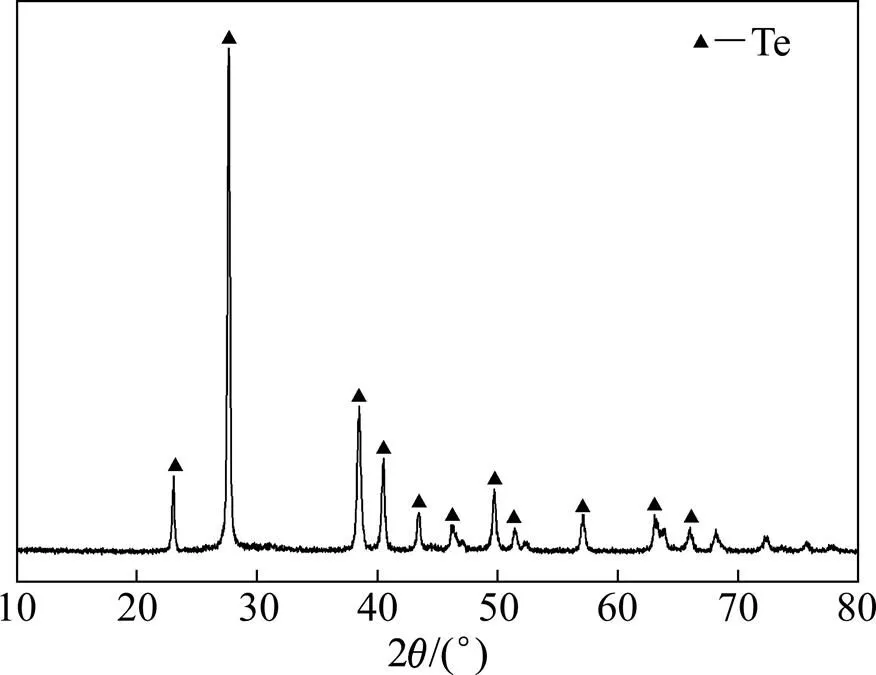
图6 还原产物的XRD谱

图7 还原产物的SEM像

表7 还原渣化学成分
2.3 焦亚硫酸钠复合还原体系热力学分析
沉金后液为氯化所得分金液用焦亚硫酸钠等还原剂还原金过滤后的溶液。在酸性溶液中,硒、碲主要以H2SeO3、H3TeO3+形态存在;当溶液中还有较高Cl−时,溶液中H3TeO3+在Cl−缔合作用下逐渐转变为TeCl62− [8]。本实验中pH为0.68,Cl−浓度为0.92 mol/L,因此,金、铂、钯、硒、碲在溶液中主要存在形式分别为AuCl4−、PtCl42−、PdCl42−、H2SeO3、TeCl62−,沉金后液中主要反应及其电极电势如表8所列[15]。根据表8标准电极电势,其被还原的难易程度由易到难的顺序为AuCl4−、PtCl42−、H2SeO3、TeCl62−、PdCl42−;根据实际电极电势,其被还原的难易程度由易到难的顺序为AuCl4−、H2SeO3、PtCl42−、TeCl62−、PdCl42−。
焦亚硫酸钠是由两分子亚硫酸氢钠脱水而成。在酸性溶液中,焦亚硫酸根离子水解成HSO3−离子[16],HSO3-在酸的作用下分解为SO2[17],反应方程式如下:
S2O52−+H2O=2HSO3−(4)
HSO3−+H+=SO2+H2O (5)

表8 沉金后液中主要电极反应及电极电势
气体SO2通入水溶液中首先生成H2SO3,H2SO3再进一步电离为HSO3−和SO32−,反应方程式如下:
SO2+H2O=H2SO3(6)
H2SO3=HSO3−+H+(7)
HSO3−=SO32−+H+(8)
25 ℃时,H2SO3的电离平衡常数[18]1=1.30×10−2,2=6.30×10−8,计算可得不同pH下溶液中S(IV)) 3种形态的分布系数如图8所示。由图8可知,在强酸性溶液中,S(Ⅳ)主要以H2SO3存在,在弱酸及弱碱中,主要以HSO3−形态存在,在强碱溶液中,主要以SO32−形态存在。当pH=0.68时,[H2SO3]占94%,[HSO3−]占6%,因此,SO2的还原主要是以H2SO3做还原剂的还原过程。
由上述分析可知,酸性溶液中,在沉金后液中通入SO2或焦亚硫酸钠后立即产生亚硫酸,以亚硫酸形态存在的还原剂具有较强还原性。

图8 S(Ⅳ)分布图
在酸性溶液中,N2H4∙H2O与质子结合,其存在形态为N2H5+。
根据还原剂在沉金后液中的存在形态,其相关电极反应及标准电极电势如表9所列。

表9 还原剂电极反应及标准电极电势
由表9可知,水合肼的电极电位最低为−0.23V,说明水合肼还原能力最强,其次为S2O52−、HSO3、SO2−、H2SO3。由表8和表9比较可知,还原剂的存在形态均比还原沉金后液中的硒、碲、金、铂、钯电极电势低,因此,采用焦亚硫酸钠复合还原沉金后液在热力学上可行。
3 结论
1) 焦亚硫酸钠、SO2和水合肼复合还原沉金后液,正交实验得出影响硒、碲还原率的大小顺序依次为反应时间、水合肼用量、焦亚硫酸钠用量。硒的最佳实验条件为反应时间4 h,焦亚硫酸钠用量15 g/L,水合肼用量为2 mL/L;碲的最佳实验条件为反应时间4 h,焦亚硫酸钠用量30 g/L,水合肼用量3 mL/L。
2) 沉金后液中金、铂、钯、硒和碲的浓度分别为3.73×10−2、1.45×10−3、1.04×10−2、1.04×10−2、0.29和3.01 g/L。通入SO2至饱和后,当水合肼用量为1.5 mL/L,焦亚硫酸钠为30 g/L,SO2流量为0.4 L/min,每反应1h通入0.5 h SO2,反应时间为9 h时,金、铂、钯的还原率均达到100%,硒和碲的还原率分别为71.50%和90.3%。还原渣主要物相成分为单质碲,其形貌为颗粒集聚体。
3) 焦亚硫酸钠复合还原硒、碲的反应过程符合一级反应动力学规律,其表观活化能分别为Se=52.533 kJ/mol,Te=70.828 kJ/mol,硒、碲还原过程属于化学反应控制。
4) 热力学分析表明,沉金后液中金、铂、钯、硒、碲分别为AuCl4−、PtCl42−、PdCl42−、H2SeO3、TeCl62−形态存在,焦亚硫酸钠、SO2主要以H2SO3形态存在,水合肼以N2H5+形态存在。
[1] 郑雅杰, 汪 蓓, 史建远, 孙召明, 刘昭成. 铜阳极泥预处理富集金银的研究[J]. 中南大学学报(自然科学版), 2010, 41(3): 865−870. ZHENG Ya-jie, WANG Bei, SHI Jian-yuan, SUN Zhao-ming, LIU Zhao-cheng. Pretreatment of copper anode slime for concentrating gold and silver[J]. Journal of Central South University (Science and Technology), 2010, 41(3): 865−870.
[2] 王爱荣. 从阳极泥中湿法提取金的工艺优化研究[J]. 湿法冶金, 2007, 26(1): 44−46. WANG Ai-rong. Research on optimization process for leaching of gold from copper slime[J]. Hydrometallurgy of China, 2007, 26(1): 44−46.
[3] KHALEGHI A, GHADER S, AFZALI D. Ag recovery from copper anode slime by a cid leaching at atmospheric pressure to synthesize silver nanoparticles[J]. International Journal of Mining Science and Technology, 2014, 24(1): 251−257.
[4] 王吉坤, 张博亚. 铜阳极泥现代综合利用技术[M]. 北京: 冶金工业出版社, 2008. WANG Ji-kun, ZHANG Bo-ya. Modern utilization technology of copper anode slime[M]. Beijing: Metallurgical Industry Press, 2008.
[5] 卢宜源, 宾万达. 贵金属冶金学[M]. 长沙: 中南大学出版社, 2004. LU Yi-yuan, BIN Wanda. Precious metals metallurgy[M]. Changsha: Central South University of Technology Press, 2004.
[6] 胡建辉. 从金还原后液中置换铂钯的工艺优化研究[J]. 湿法冶金, 2000, 19(2): 22−25. HU Jian-hui. Study on optimum process for displacing Pt and Pd from[J]. Hydrometallurgy of China, 2000, 19(2): 22−25.
[7] 郑雅杰, 陈昆昆, 孙召明. SO2还原沉金后液回收硒碲及捕集铂钯[J]. 中国有色金属学报, 2011, 21(9): 2258−2264. ZHENG Ya-jie, CHEN Kun-kun, SUN Zhao-ming. Recycling Se and Te and capturing Pt and Pd from solution after precipitating gold by SO2reduction[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(9): 2258−2264.
[8] 孙召明, 郑雅杰. Te(Ⅳ)-H2SO4-H2O 体系中卤素离子催化还原Te(Ⅳ) 反应动力学 [J]. 中国有色金属学报, 2010, 20(12): 2438−2444. SUN Zhao-ming, ZHENG Ya-jie. Reaction kinetics of Te(Ⅳ)using halogen ions as catalyst in Te(Ⅳ)-H2SO4-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(12): 2438−2444.
[9] 马亚赟, 郑雅杰, 丁光月, 王俊文, 董俊婓, 张福元. 卤素离子催化作用下SO2还原沉金后液及其热力学特征[J]. 中国有色金属学报, 2016, 26(4): 901−907. MA Ya-yun, ZHENG Ya-jie, DING Guang-yue, DING Guang-yue, WANG Jun-wen, DONG Jun-fei, ZHANG Fu-yuan. Precipitated gold solution reduced by SO2under halogen ion composite catalyst and its thermodynamic characteristics[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(4): 901−907.
[10] 张福元, 郑雅杰, 孙召明, 马亚赟, 董俊斐. 采用亚硫酸钠还原法从沉金后液中回收稀贵金属[J]. 中国有色金属学报, 2015, 25(8): 2293−2299. ZHANG Fu-yuan, ZHENG Ya-jie, SUN Zhao-ming, MA Ya-yun, DONG Jun-fei. Recovery of rare and precious metals from precipitated gold solution by Na2SO3 reduction[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(8): 2293−2299.
[11] 韩其勇. 冶金过程动力学[M]. 北京: 冶金工程出版社, 1987. HAN Qi-yong. Dynamics in Metallurgical Process[M]. Beijing: Metallurgical Industry Press, 1987.
[12] 郑俐玉, 于少明, 刘 彬, 陈 亮, 黄伶俐. 石煤提钒碱浸过程动力学研究[J]. 稀有金属, 2011, 35(1): 101−105. ZHENG Li-yu, YU Shao-ming, LIU Bin, CHEN Liang, HUANG Ling-li. Kinetics of leaching vanadium with alkaline from stone coal[J]. Chinese Journal of Rare Metals, 2011, 35(1): 101−105.
[13] SZEKELY J.EVANS J W. A structural model for gas-solid reactions with a moving boundary –II: The effect of grain size, porosity and temperature on the reaction of porous pellets[J]. Chem Eng Sci, 1971, 26(11): 1901−1913.
[14] MOKMEL M, DREISINGER D, WASSINK B. Thermodynamics and kinetics study of tellurium removal with cuprous ion[J]. Hydrometallurgy, 2014, 147/148: 20−29.
[15] 吴维昌, 冯洪清,吴开冶.标准电极电位数据手册[M]. 北京: 科学出版社, 1991: 30−224. WU Wei-chang, FENG Hong-qing, WU Kai-ye. Manual of standard electrode potential date[M]. Beijing: Science Press, 1991: 30−224.
[16] 史 焱, 詹先成, 吕太平, 李 霖, 曹呈勇, 舒晓明, 李成容, 李琳丽. 抗氧剂亚硫酸钠、亚硫酸氢钠及焦亚硫酸钠氧化反应速率常数的测定[J]. 化学学报, 2006, 64(6): 496−500. SHI Yan, ZHAN Tian-cheng, LÜ Tai-ping, LI Lin, CAO Chen-yong, SHU Xiao-ming, LI Chen-rong, LI Lin-li. Determination of oxidation rate constants of antioxidants sodium sulfite, sodium bisulfite and sodium pyrosulfite[J]. Acta Chimica Sinica, 2006, 64(6): 496−500.
[17] 侯晓川, 肖连生, 高丛堦, 张启修, 张贵清, 曹佐英, 李青刚. 从镍钼矿冶炼烟尘浸出液中还原硒的热力学及应用[J]. 中国有色金属学报, 2010, 20(12): 2431−2437. HOU Xiao-chuan, XIAO Lian-sheng, GAO Cong-jie, ZHANG Qi-xiu, ZHANG Gui-qing, CAO Zuo-ying, LI Qing-gang. Thermodynamics and application of selenium reduction from leaching solution of smelting dust of Ni-Mo ore[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(12): 2431−2437.
[18] LEVENSPIEL O. Chemical reaction engineering[M]. 3rd ed. New York: John Wiley & Sons, 1999.
(编辑 何学锋)
Thermodynamic and dynamic characteristics analysis of reducing Se, Te, Au, Pd and Pt of precipitated gold solution by Na2S2O5compound
WANG Xin-xin1, 2, ZHENG Ya-jie2, JIN Li-e1, ZHANG Fu-yuan2
(1. College of Chemistry and Chemical Engineering, Taiyuan University of Technology, Taiyuan 030024, China;2. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Selenium and tellurium were recovered from precipitated gold solution by the compound of Na2S2O5. At the same time, gold, platinum and palladium were also captured. In order to determine the optimum process parameters, three main effect factors were investigated by an orthogonal experiment. The thermodynamic and dynamic characteristics of reducing precipitated gold solution by Na2S2O5, SO2and N2H4compound were analyzed. The study shows that: the influence factors on reduction rate of Se and Te decrease in such an order: reaction time, the amount of Na2S2O5, the amount of N2H4. When SO2is bubbled to saturation , the amount of Na2S2O5is 30 g/L, the amount of N2H4is 1.5 mL/L, reaction temperature is 85 ℃, SO2is passed into solution intermittently, the time for SO2passing into solution is 0.5h after one hour per reaction, the flow rate of SO2is 0.4 L/min, reaction time is 9 h, the reduction rates of Au, Pt, Pd are 100%, the reduction rates of Se and Te are 71.50% and 90.30%, respectively. The reaction of Na2S2O5compound reducing Se and Te follows First-order kinetics. The apparent activation energy of reducing Se and Te which is controlled by chemical reaction is determined to beSe=52.533 kJ/mol andTe=70.828 kJ/mol. The analysis of thermodynamic characteristics shows that, Se, Te, Au, Pd and Pt exit in the form of AuCl4−, PtCl42−, PdCl42−, H2SeO3and TeCl62−, respectively. Sodium metabisulfite and SO2exit mainly in the form of H2SO3, hydrazine hydrate exits in the form of N2H5+.
precipitated gold solution; N2H5+; orthogonal experiment; thermodynamics; kinetics
Project(201407300993) supported by the High Technology Research and Development Program of Xinjiang Uygur Autonomous Region, China
2016-07-08; Accepted date: 2016-12-22
ZHENG Ya-jie; Tel: +86-13974810738; E-mail: zyj@csu.edu.cn
10.19476/j.ysxb.1004.0609.2017.09.24
1004-0609(2017)-09-1943-08
TF09
A
新疆维吾尔自治区高技术研究发展计划资助项目(201407300993)
2016-07-08;
2016-12-22
郑雅杰,教授,博士;电话:13974810738;E-mail:13974810738@163.com

