铁铜双金属氧化物对水体中Sb(Ⅴ)的吸附去除研究*
李勇超 吴继鑫 任伯帜 耿 兵
(1.湖南科技大学土木工程学院,湖南 湘潭 411201;2.中国农业科学院农业环境与可持续发展研究所,农业清洁领域团队,北京 100081)
铁铜双金属氧化物对水体中Sb(Ⅴ)的吸附去除研究*
李勇超1吴继鑫1任伯帜1耿 兵2#
(1.湖南科技大学土木工程学院,湖南 湘潭 411201;2.中国农业科学院农业环境与可持续发展研究所,农业清洁领域团队,北京 100081)
通过化学共沉淀法制备铁铜双金属氧化物,并采用扫描电镜、X射线衍射、氮吸附脱附实验对其化学组成及表面积进行分析。通过静态吸附与固定床动态吸附实验考察铁铜双金属氧化物对废水中Sb(Ⅴ)的吸附去除能力,并分析了吸附动力学与反应机制。结果表明,制得的铁铜双金属氧化物并不仅是铜氧化物与铁氧化物的简单混合,其比表面积远大于铁氧化物和铜氧化物;静态吸附实验显示,铁铜双金属氧化物对Sb(Ⅴ)溶液的吸附去除率明显高于铁氧化物和铜氧化物,当Sb(Ⅴ)溶液初始pH为6.0,初始质量浓度为20mg/L,溶液体积100mL,振荡速度100r/min,吸附时间为24h,0.03g铁铜双金属氧化物对Sb(Ⅴ)的吸附去除率高达95.6%,吸附数据符合伪二级动力学方程;固定床动态吸附实验表明,随着进水流量的增加,床层耗竭时间缩短;铁铜双金属氧化物对Sb(Ⅴ)去除以化学吸附为主,铁铜双金属氧化物在吸附过程中生成铁置换的黝铜矿。
铁铜双金属氧化物Sb(Ⅴ) 静态吸附 动态吸附 固定床
Abstract: Fe-Cu binary oxide was fabricated through a co-precipitation process and characterized with XRD,SEM,and N2adsorption-desorption measurements. The removal ability of Sb(Ⅴ) from aqueous solution by Fe-Cu binary oxide was studied through both batch experiment and column experiment,and the adsorption dynamics and reaction mechanism were also analyzed. Results demonstrated that the Fe-Cu binary oxide was not the mixture of ferrihydrite and CuO,and its specific surface area was higher than that of both iron oxide and copper oxide. Batch experiment indicated that the Sb(Ⅴ) removal ability of Fe-Cu binary oxide was significantly higher than that of iron oxide and copper oxide. When the initial Sb(Ⅴ) concentration was 20 mg/L,solution volume was 100 mL,pH was 6.0,and vibrating rate was 100 r/min,95.6% of 20 mg/L Sb(Ⅴ) was removed by Fe-Cu binary oxide after 24 h reaction. Furthermore,the removal of Sb(Ⅴ) by Fe-Cu binary oxide followed the pseudo-second-order kinetic. Column tests results showed that as the flow rates increased,adsorption saturation time became shorter. Sb(Ⅴ) adsorption onto Fe-Cu binary oxide was mainly controlled by the chemisorption process,and the iron-substituted tetrahedrite was formed.
Keywords: Fe-Cu binary oxide; Sb(Ⅴ); static adsorption; dynamic adsorption; fixed bed column
我国是世界上锑(Sb)储量最丰富的国家。近年来,由于大规模锑矿开采、冶炼和加工导致矿区附近水体污染非常严重[1-2]。Sb在人体内可与巯基结合,抑制琥珀酸氧化酶等的活性,破坏细胞内离子平衡,导致多系统、多脏器损害,对人类健康构成严重威胁[3-4]。因此,Sb及其化合物被美国环境保护署及欧盟列为优先控制污染物,我国规定饮用水中的Sb不得超过5 μg/L[5]。
目前,去除水体中Sb的常用技术有吸附法[6]、沉淀/共沉淀法[7]、电化学法[8]等,其中吸附法具有操作简单、经济高效、可再生等特点被广泛应用。双金属氧化物对重金属具有优良的吸附性能,LIU等[9]制备了铁锰复合氧化物,发现该复合氧化物对Sb(Ⅴ)具有很好的吸附效果,在pH=5.0的条件下,铁锰复合氧化物对Sb(Ⅴ)的最大吸附容量达1.05 mmol/g,略高于羟基氧化铁,远高于二氧化锰。LI等[10]采用共沉淀法制备铁锆双金属氧化物并用其去除水体中Sb(Ⅴ),研究发现铁锆双金属氧化物对Sb(Ⅴ)的吸附性能大于锆氧化物及无定形铁氧化物,当pH=7.0、Sb(Ⅴ)初始质量浓度为10 mg/L时,铁锆双金属氧化物对Sb(Ⅴ)的最大吸附能力为51 mg/g。
铜氧化物一般被用于催化、电池等材料行业,其对溶液中重金属As的去除能力十分明显。MARTINSON等[11]研究表明,铜氧化物能够在较宽pH范围内高效去除水体中的As(Ⅲ)和As(Ⅴ)。ZHANG等[12]表明纳米铁铜双金属氧化物制备费用低,易再生,对溶液中As(Ⅲ)和As(Ⅴ)去除效果良好。Sb的化学性质与As相似,但铜氧化物对水体Sb去除性能及相关机制研究鲜有报道。鉴于我国矿区Sb污染日益严重,开发高效吸附材料治理矿区水体Sb污染意义重大[13]。
1 实验部分
1.1 实验准备
实验所需的试剂均为分析纯。将0.104 5 g KSb(OH)6溶于4 mL浓盐酸(12 mol/L)中,然后用稀盐酸(1 mol/L)定容至50 mL,在80 ℃水浴锅中溶解,即得质量浓度为1 000 mg/L的Sb(Ⅴ)储备溶液,将储备溶液于4 ℃下冰箱保存。根据实验需要用去离子水将储备液稀释成不同浓度的Sb(Ⅴ)反应液。所有玻璃器皿、聚乙烯瓶在使用前用15%(质量分数)的硝酸溶液浸泡24 h后,再用大量去离子水冲洗后使用。
1.2 铁铜双金属氧化物的制备
配制0.617 mol/L的FeCl3溶液和0.5 mol/L的CuSO4溶液,将20 mL FeCl3溶液和8 mL CuSO4溶液在磁力搅拌下混合均匀,向所混合溶液中缓慢滴加1.25 mol/L的NaOH溶液,使混合溶液pH维持在9.5,继续反应2 h后离心分离、蒸馏水洗涤,重复上述操作3次,即得红棕色胶体颗粒;在80 ℃下干燥24 h,研磨备用。同时制备单纯铁氧化物、铜氧化物作为对比材料,制备过程除无需投加铜盐或铁盐外,其他步骤均与上述方法相同。
1.3 铁铜双金属氧化物的表征
采用JSM-6380LV型扫描电子显微镜(SEM,日本电子株式会社)对制备材料的粒度、形貌进行分析。用D8 Advance型X射线衍射仪(XRD,德国Bruker公司)分析样品成分。将样品在150 ℃脱气12 h,采用NOVA2200e型比表面和孔径分布分析仪(美国Quantachrome公司)对制备材料的比表面积进行测定。
1.4 Sb(Ⅴ)静态吸附实验
Sb(Ⅴ)静态吸附实验在125 mL具塞聚乙烯瓶中进行。将3种制备的吸附材料0.03 g投加到100 mL初始质量浓度为20 mg/L的Sb(Ⅴ)溶液中,调节初始pH为6.0,100 r/min下振荡反应,按设定时间间隔取样,过0.45 μm滤膜,测定溶液中Sb(Ⅴ)浓度,计算Sb(Ⅴ)去除率。
1.5 Sb(Ⅴ)动态吸附实验
采用内径50 mm、柱高200 mm 的有机玻璃柱为固定床反应装置,柱内填置石英砂(80目),柱底铺设玻璃棉,将4.5 g铁铜双金属氧化物均匀填充于有机玻璃柱中。配置初始质量浓度为5 mg/L、pH为6.0的Sb(Ⅴ)溶液,使Sb(Ⅴ)溶液从上向下通过固定床,用蠕动泵控制流量分别为0.12、0.27、0.48 L/h。每隔一定时间测出水Sb(Ⅴ)浓度,绘制流出曲线。动态实验结束后将铁铜双金属氧化物取出进行SEM、XRD表征,同时测定出水中总铁、总铜含量[15],考察铁铜双金属氧化物在溶液中的稳定性。
2 结果与讨论
2.1 材料表征
2.1.1 SEM分析
图1分别为铁铜双金属氧化物、铁氧化物、铜氧化物的SEM图。由图1可见,铁氧化物呈紧密块状结构,结块体积较大;铜氧化物呈现出絮状体结构,且结构较为松散;铁铜双金属氧化物也呈块状,结块粒径在1~10 μm,表面特征相对更接近铁氧化物但结构比铁氧化物松散,这可能是由于絮状铜氧化物进入导致。
2.1.2 XRD分析
将制得的铁氧化物、铜氧化物、铁铜双金属氧化物样品烘干研磨后进行XRD表征,XRD谱图见图2。由图2可见,铁氧化物为非晶型,XRD谱图整体平滑,仅在2θ为35.0°、55.0°处存在极不明显的微弱峰,这是水铁矿(Fe2O3·2FeOOH·2.6H2O)的特征峰[16];铜氧化物在2θ为36.5°、39.0°、49.5°、62.0°处出现了尖锐的衍射峰,这说明主要成分是晶态氧化铜[17];铁铜双金属氧化物的特征峰相对复杂,既有水铁矿的非晶特征峰,同时在衍射角39.0°处出现氧化铜特征峰,此外还出现了CuFe3O4的特征衍射峰(30.5°、63.0°)[18]。这说明所得无定形铁铜双金属氧化物并不仅是铜氧化物与铁氧化物的简单混合。

图1 3种吸附材料的SEM图Fig.1 SEM images of 3 prepared adsorbents
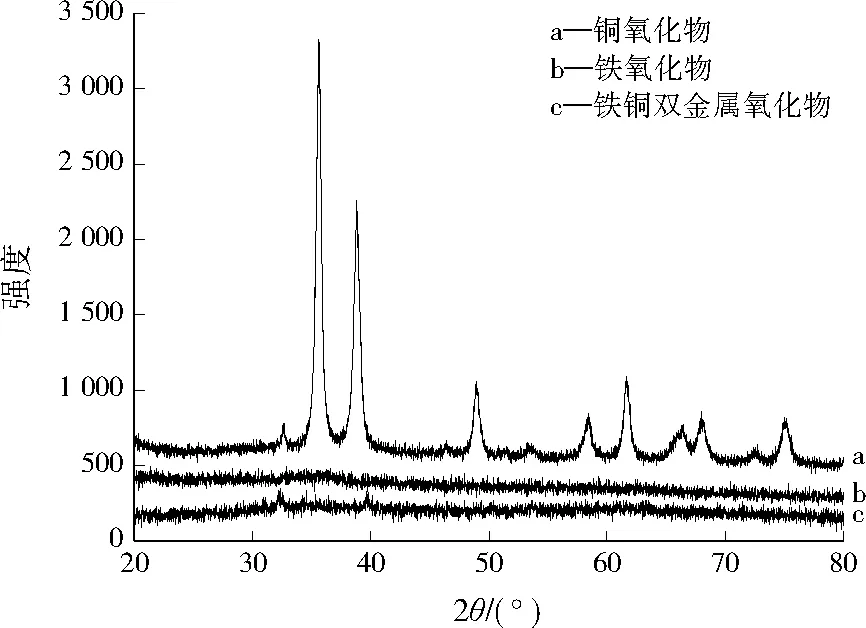
图2 3种吸附材料的XRD图谱Fig.2 XRD patterns of 3 prepared materials
2.1.3 比表面积分析
图3为铁铜双金属氧化物、铁氧化物、铜氧化物的氮吸附脱附曲线。采用Brunauer-Emmett-Teller (BET)模型计算3种吸附材料的比表面积,采用Barrett-Joyner-Halenda (BJH)法评价材料表面孔分布。从氮吸附脱附曲线可以看出,3种吸附材料均具有典型的第Ⅳ类等温线、H3型迟滞回线特征,吸附-脱附等温线之间的滞后回线说明存在扩散瓶颈,表明吸附剂具有介孔结构,且是由粒子堆积形成的狭缝孔[19]。3种吸附材料的平均孔径、孔容和比表面积见表1,可以看出铁铜双金属氧化物比铁氧化物、铜氧化物的平均孔径小,孔容、BET比表面积明显高于铁氧化物和铜氧化物。
2.2 Sb(Ⅴ)静态吸附性能
2.2.1 不同吸附材料对Sb(Ⅴ)去除效果比较
前期研究表明,随着溶液初始pH的增加,铁铜双金属氧化物、铁氧化物对Sb(Ⅴ)吸附效果降低,而铜氧化物对Sb(Ⅴ)的去除效果变化不大。本研究以初始pH=6.0为代表值,考察同等条件下3种吸附材料在静态条件下对Sb(Ⅴ)的去除能力,结果见图4。由图4可见,3种吸附材料对Sb(Ⅴ)去除效果均呈先迅速增加后逐渐平缓的趋势。反应进行到24 h时,0.03 g铁铜双金属氧化物、铁氧化物、铜氧化物对20 mg/L Sb(Ⅴ)的去除率分别为95.6%、69.2%、23.7%,即铁铜双金属氧化物、铁氧化物、铜氧化物对水体中Sb(Ⅴ)吸附量分别为63.73、46.13、15.80 mg/g。可见,铁铜双金属氧化物对Sb(Ⅴ)去除能力高于铁氧化物与铜氧化物,这主要是因为絮状铜氧化物引入铁氧化物中,改变单独铁氧化物紧密的块状结构,使得铁铜双金属氧化物材料比表面积大大增加,且表面分散了大量微小孔隙,提升了Sb(Ⅴ)的吸附能力。
2.2.2 动力学分析
为了进一步研究铁铜双金属氧化物对Sb(Ⅴ)的去除机制,采用伪二级动力学方程(见式(1))对Sb(Ⅴ)去除过程进行动力学分析:
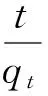
(1)
式中:t为反应时间,h;qt为t时刻下吸附材料对Sb(Ⅴ)的吸附量(mg/g);k2为伪二级动力学速率常数,g/(mg·h);qe为平衡吸附量,mg/g。
以t为横坐标,t/qt为纵坐标对3种吸附材料去除Sb(Ⅴ)的动力学数据进行拟合分析,结果见图5,相关参数见表2。从图5可以看出,3条曲线拟和度均较高,相关系数R2均在0.98以上,表明3种吸附材料对Sb(Ⅴ)的去除过程符合伪二级动力学方程,化学吸附在Sb(Ⅴ)的去除过程中占主要作用[20]。

图3 3种吸附材料的氮吸附-脱附曲线Fig.3 N2 adsorption-desorption isotherm of 3 prepared materials
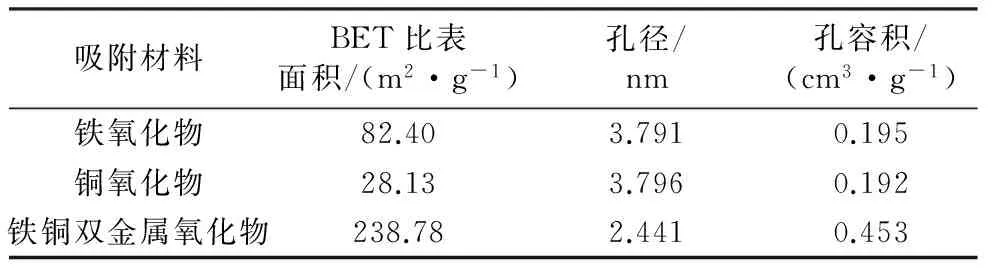
吸附材料BET比表面积/(m2·g-1)孔径/nm孔容积/(cm3·g-1)铁氧化物82.403.7910.195铜氧化物28.133.7960.192铁铜双金属氧化物238.782.4410.453
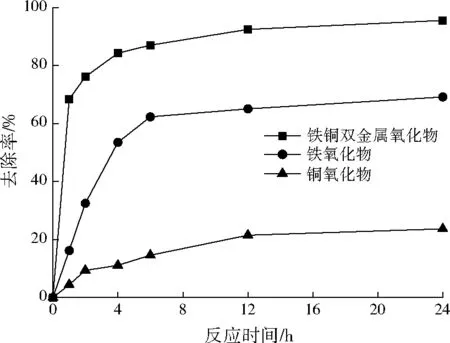
图4 铁铜双金属氧化物、铁氧化物与铜氧化物对Sb(Ⅴ)的去除Fig.4 Removal of Sb(Ⅴ) by Fe-Cu binary oxide,iron oxide and copper oxide
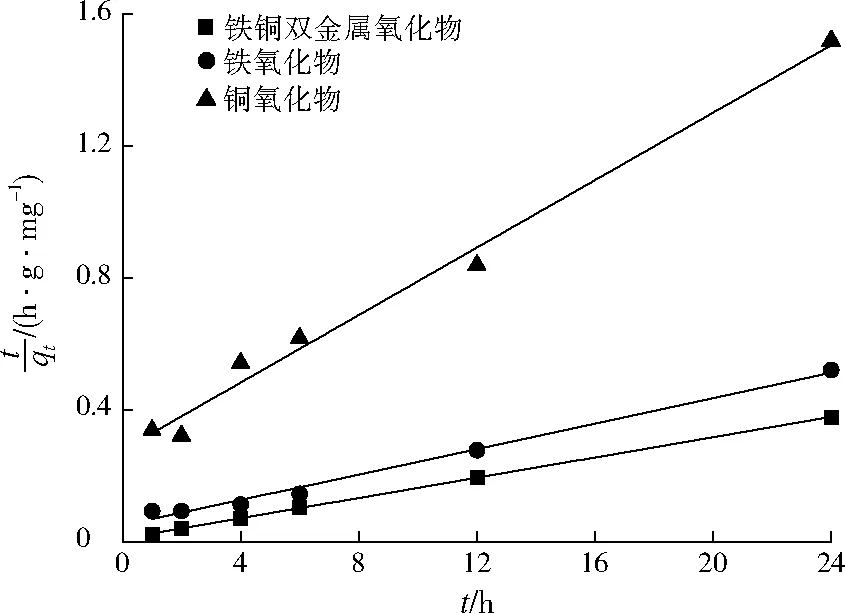
图5 3种吸附材料对Sb(Ⅴ)去除反应动力学Fig.5 Kinetics of Sb(Ⅴ) removal by 3 prepared materials

吸附材料k2/(g·mg-1·h-1)qe/(mg·g-1)R2铁铜双金属氧化物0.02665.100.999铁氧化物0.01551.730.986铜氧化物0.00919.540.988
2.3 Sb(Ⅴ)动态吸附性能
2.3.1 固定床流出曲线
从静态吸附实验可以看出,铁铜双金属氧化物对Sb(Ⅴ)去除效果远好于铁氧化物与铜氧化物,为此本研究只考察了铁铜双金属氧化物对Sb(Ⅴ)的动态吸附性能。图6为不同进水流量下铁铜双金属氧化物填充固定床去除Sb(Ⅴ)的流出曲线。当流出液中Sb(Ⅴ)的质量浓度(ct’,mg/L)达到初始质量浓度(c0,mg/L)的90%时即视为吸附柱床层耗竭[21],记录耗竭时间。
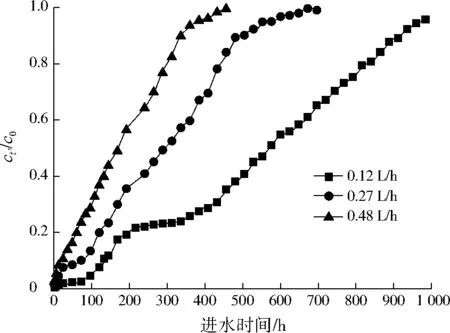
图6 不同进水流量下Sb(Ⅴ)的流出曲线Fig.6 Break through curve of Sb(Ⅴ)at different flow rate
由图6可见,当进水流量为0.12 L/h 时,耗竭时间为936 h;当流量增加到0.27 L/h,则耗竭时间减小到504 h;继续增加流量至0.48 L/h,耗竭时间缩短至360 h。可见流量的增加使固定床床层耗竭时间急剧降低。这是因为当Sb(Ⅴ)进水浓度和吸附材料填充量不变时,进水流量增大直接增加了吸附柱的Sb(Ⅴ)负荷。经计算,当进水流量为0.12、0.27、0.48 L/h时,床层Sb(Ⅴ)负荷分别为0.60、1.35、2.40 mg/h。大流量进水时,Sb(Ⅴ)负荷增加,而铁铜双金属氧化物提供活性吸附位点数不变,该吸附材料将会快速饱和,缩短工作时间;其次,进水流速过快可能会导致吸附材料与Sb(Ⅴ)接触不充分,影响去除效果。
2.3.2 动态吸附模型分析
本研究采用常用的Thomas模型(见式(2))[22]对流出曲线进行模拟预测,估算实验条件下铁铜双金属氧化物对Sb(Ⅴ)的最大柱吸附量。
(2)
式中:kT为Thomas速率常数,L/(h·mg);qmax为Sb(Ⅴ)的最大柱吸附量,mg/g;W为吸附材料填充质量,g;Q为吸附柱进水流量,L/h;t’为吸附柱动态进水时间,h。
根据式(2),以ln(c0/ct’-1)对t’做线性分析,计算最大柱吸附量qmax和Thomas速率常数kT。得到不同进水流量下,铁铜双金属氧化物动态吸附去除Sb(Ⅴ)的相关参数,结果见表3。由表3可见, Thomas模型对数据拟合效果较好,3种进水流量下相关系数R2均不小于0.93,说明Thomas模型能够很好地描述铁铜双金属氧化物在较长时间动态吸附水体中Sb(Ⅴ)的过程。从表3还可以看出,随着进水流量Q的增加,qmax和kT随之增加,说明本实验进水流量设计合理,Sb(Ⅴ)与铁铜双金属氧化物接触比较充分,床层发挥出较好的吸附效能。

表3 不同进水流量Sb(Ⅴ)流出曲线的Thomas模型参数
2.4 反应机制分析
图7、图8分别为吸附后铁铜双金属氧化物的SEM与XRD谱图。从图7可以看出,吸附后铁铜双金属氧化物的形貌相发生很大变化,生成了大量的长方体块状晶态物质。由图8可见,水铁矿和氧化铜的特征峰变得更加微弱,而在2θ为32.5°、46.5°、57.0°处出现了尖锐衍射峰,说明吸附过程中生成了晶态物质,经对比分析,吸附后铁铜双金属氧化物的特征峰与黝铜矿(Cu12Sb4S13)的特征峰极为相似。

图7 吸附后铁铜双金属氧化物的SEM图Fig.7 SEM image of Fe-Cu binary oxide after adsorption
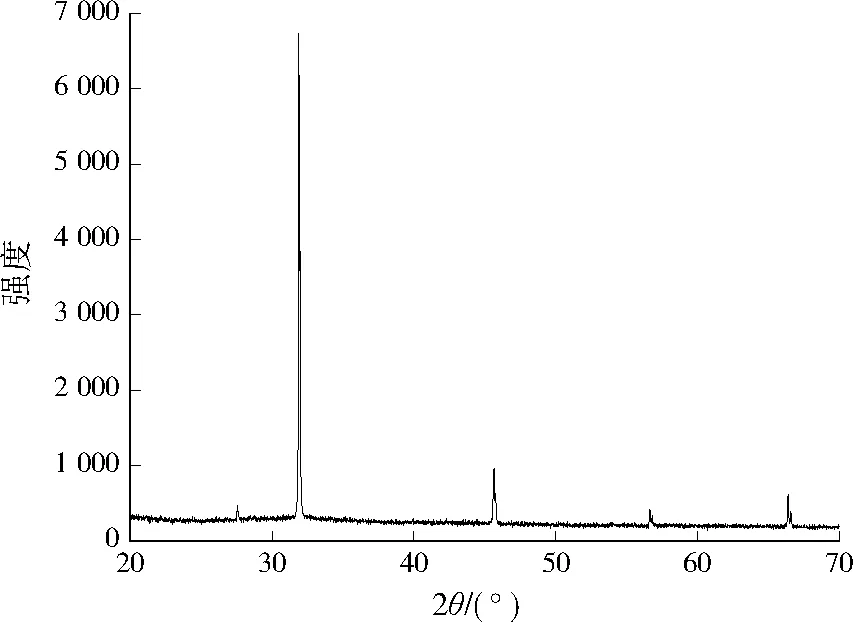
图8 吸附后铁铜双金属氧化物的XRD图Fig.8 XRD pattern of Fe-Cu binary oxide after adsorption
动力学分析表明,铁铜双金属氧化物对水体中Sb(Ⅴ)的吸附去除过程中化学吸附占主要作用,推测铁铜双金属氧化物在吸附过程中发生溶解,一定量的铁离子和铜离子释放到溶液中,对流出液中总铁和总铜的浓度进行测定,发现总铁和总铜的质量浓度分别低于0.3、1.0 mg/L,MAIELLO等[23]的研究表明黝铜矿中的铜元素很容易被铁、镍等元素替换,结合吸附后铁铜双金属氧化物的SEM、XRD谱图推测,溶出的铁、铜离子重新被吸附到铁铜双金属氧化物表面,生成了铁置换的黝铜矿。
3 结 论
将铁盐、铜盐混合溶液在碱性条件下共沉淀后低温干燥,得到了比表面积大且具有介孔结构的铁铜双金属氧化物吸附材料。静态吸附实验表明,再溶液初始pH为6.0,Sb(Ⅴ)初始质量浓度为20 mg/L,溶液体积100 mL,振荡速度100 r/min,吸附时间为24 h,0.03 g铁铜双金属氧化物对Sb(Ⅴ)的吸附去除率高达95.6%,吸附数据符合伪二级动力学方程;固定床动态吸附实验表明,随着进水流量的增加,床层工作时间显著缩短,Thomas模型能够很好地描述铁铜双金属氧化物对Sb(Ⅴ)的动态吸附;铁铜双金属氧化物对Sb(Ⅴ)去除以化学吸附为主,铁铜双金属氧化物在吸附过程中生成铁置换的黝铜矿。
[1] 朱静,吴丰昌,邓秋静,等.湖南锡矿山周边水体的环境特征[J].环境科学学报,2009,29(2):655-661.
[2] SMICHOWSKI P,MADRID Y,CAMARA C.Analytical methods for antimony speciation in waters at trace and ultratrace levels:a review[J].Fresenius Journal of Analytical Chemistry,1998,360(6):623-629.
[3] SHANG GUAN Yuxian,QIN Xiaopeng,ZHAO Long,et al.Effects of iron oxide on antimony(Ⅴ) adsorption in natural soils:transmission electron microscopy and X-ray photoelectron spectroscopy measurements[J].Jouranal of Soil and Sediments,2016,16(2):509-517.
[4] FERGUSON J F,GAVIS J.A review of the arsenic cycle in natural waters[J].Water Research,1972,6(11):1259-1274.
[5] GB 5749—2006,生活饮用水水质标准[S].
[6] UNGUREANU G,SANTOS S,BOAVENTURA R,et al.Arsenic and antimony in water and wastewater:overview of removal techniques with special reference to latest advances in adsorption[J].Journal of Environmental Management,2015,151:326-342.
[7] GUO Xuejun,WU Zhijun,HE Mengchang.Removal of antimony(Ⅴ) and antimony(Ⅲ) from drinking water by coagulation-flocculation-sedimentation(CFS)[J].Water Research,2009,43(17):4327-4335.
[8] ZHU Jing,WU Fengchang,PAN Xiangliang,et al.Removal of antimony from antimony mine flotation wastewater by electrocoagulation with aluminum electrodes[J].Journal of Environmental Sciences,2011,23(7):1066-1071.
[9] LIU Ruiping,XU Wei,HE Zan,et al.Adsorption of antimony(Ⅴ) onto Mn(Ⅱ)-enriched surfaces of manganese-oxide and Fe-Mn binary oxide[J].Chemosphere,2015,138:616-624.
[10] LI Xuehua,DOU Xiaomin,LI Junqin.Antimony(Ⅴ) removal from water by iron-zirconium bimetal oxide: performance and mechanism[J].Journal of Environmental Sciences,2012,24(7):1197-1203.
[11] MARTINSON C A,REDDY K J.Adsorption of arsenic(Ⅲ) and arsenic(Ⅴ) by cupric oxide nanoparticles[J].Journal of Colloid and Interface Science,2009,336(2):406-411.
[12] ZHANG Gaosheng,REN Zongming,ZHANG Xiwang,et al.Nanostructured iron(Ⅲ)-copper(Ⅱ) binary oxide: a novel adsorbent for enhanced arsenic removal from aqueous solutions[J].Water Research,2013,47(12):4022-4031.
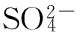
[14] FILELLA M,BELZILE N,CHEN Y W.Antimony in the environment:a review focused on natural waters Ⅰ. occurrence[J].Earth-Science Reviews,2002,57(1/2):125-176.
[15] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[16] JAMBOR J L,DUTRIZAC J E.Occurrence and constitution of natural and synthetic ferrihydrite:a widespread iron oxyhydroxide[J].Chemical Reviews,1998,98(7):2549-2585.
[17] LIU Xiang,CUI Shengsheng,SUN Zijun,et al.Copper oxide nanomaterials synthesized from simple copper salts as active catalysts for electrocatalytic water oxidation[J].Electrochimica Acta,2015,160:202-208.
[18] JOSHI N,BANERJEE S.PVP coated copper-iron oxide nanocomposite as an efficient catalyst for Click reactions[J].Tetrahedron Letters,2015,56(28):4163-4169.
[19] PASSE COUTRIN N,ALTENOR S,COSSEMENT D,et al.Comparison of parameters calculated from the BET and Freundlich isotherms obtained by nitrogen adsorption on activated carbons: a new method for calculating the specific surface area[J].Microporous and Mesoporous Materials,2008,111(1):517-522.
[20] HO Y S,MCKAY G.The kinetics of sorption of divalent metal ions onto sphagnum moss peat[J].Water Research,2000,34(3):735-742.
[21] UDDIN M T,RUKANUZZAMAN M,KHAN M M R,et al.Adsorption of methylene blue from aqueous solution by jackfruit (Artocarpusheteropyllus) leaf powder:a fixed-bed column study[J].Journal of Environmental Management,2009,90(11):3443-3450.
[22] SUKSABYE P,THIRAVETYAN P,NAKBANPOTE W.Column study of chromium(Ⅵ) adsorption from electroplating industry by coconut coir pith[J].Journal of Hazardous Materials,2008,160(1):56-62.
[23] MAIELLO P,ZOPPI G,MILES R W,et al.Chalcogenisation of Cu-Sb metallic precursors into Cu3Sb(SexS1-x)3[J].Solar Energy Materials and Solar Cells,2013,113(2):186-194.
AdsorptionremovalofSb(Ⅴ)fromaqueoussolutionbyFe-Cubinaryoxide
LIYongchao1,WUJixin1,RENBozhi1,GENGBing2.
(1.SchoolofCivilEngineering,HunanUniversityofScienceandTechnology,XiangtanHunan411201;2.AgriculturalClearWatershedGroup,InstituteofEnvironmentandSustainableDevelopmentinAgriculture,ChineseAcademyofAgriculturalSciences,Beijing100081)
2016-12-15)
李勇超,女,1985年生,博士,讲师,研究方向为水体重金属污染控制。#
。
*国家自然科学基金资助项目(No.51504094、No.41471399)。
10.15985/j.cnki.1001-3865.2017.08.001

