胸腔镜与开胸全肺切除治疗非小细胞肺癌的疗效比较*
王少东 李 晓 隋锡朝 李 运 姜冠潮 王 俊
(北京大学人民医院胸外科,北京 100044)
**通讯作者,E-mail:jwangmd@yahoo.com
·临床研究·
胸腔镜与开胸全肺切除治疗非小细胞肺癌的疗效比较*
王少东 李 晓 隋锡朝 李 运 姜冠潮 王 俊**
(北京大学人民医院胸外科,北京 100044)
目的探讨胸腔镜与开胸全肺切除在非小细胞肺癌治疗中的安全性、彻底性及中期疗效。方法回顾性分析2009年1月~2016年12月69例非小细胞肺癌行全肺切除的资料,其中24例行胸腔镜手术,45例行传统开胸手术。胸腔镜组男性较少[66.7%(16/24) vs. 93.3%(42/45),χ2=6.435,P=0.011],新辅助化疗比例较少[16.7%(4/24) vs. 40.0%(18/45),χ2=3.924,P=0.048],2组年龄、吸烟史、肿瘤位置和直径、术前合并症、新辅助放疗、病理类型、TNM分期均无显著性差异(P>0.05)。比较2组手术情况、术后并发症,以及1年、3年无复发生存率和总生存率。结果2组在纵隔淋巴结清扫站数和个数、淋巴结病理阳性个数、术后住院时间、术后并发症方面差异均无统计学意义(P>0.05),胸腔镜组手术时间短[中位数200(120~300)min vs. 240(120~360)min,Z=-2.278,P=0.023],术中出血少[100(20~600)ml vs. 300(50~1500)ml,Z=-3.088,P=0.002],术后引流时间短[1(1~2)d vs. 1(1~7)d,Z=-2.066,P=0.039]。中位随访时间19(3~63)个月,胸腔镜组术后1年、3年无复发生存率分别为80%、43.2%,开胸组为84.1%、36.3%,2组无显著性差异(log-rankχ2=0.765,P=0.382)。胸腔镜组1年、3年生存率分别为84.4%、70.1%,开胸组为79.8%、42.5%,2组无显著性差异(log-rankχ2=2.594,P=0.107)。结论全肺切除治疗非小细胞肺癌,胸腔镜与开胸手术具有同样的安全、彻底性,两者中期生存相当。胸腔镜全肺切除具有手术时间短、术中出血少、术后带管时间短的优势。
肺癌; 全肺切除术; 胸腔镜手术; 开胸手术
肺癌是全世界肿瘤相关死亡第一因素[1],只有30%的早期及局部进展期肺癌有手术根治机会,全肺切除占肺癌肺切除手术的15%左右[2]。2006年以来,与开胸肺叶切除术比较,胸腔镜肺叶切除由于术后疼痛轻、并发症发生率低、肿瘤相关预后好而被NCCN指南推荐为首选[3~6],而针对胸腔镜全肺切除的报道很有限[7~11]。本研究回顾性分析2009年1月~2016年12月69例非小细胞肺癌行全肺切除的资料,其中24例行胸腔镜手术,45例行传统开胸手术,评价两种术式的手术安全性、彻底性及中期疗效。
1 临床资料与方法
1.1 一般资料
2009年1月~2016年12月于我中心行全肺切除的非小细胞肺癌共69例,年龄34~72岁,(57.1±8.4)岁。行全肺切除原因:中心型肺癌无法通过袖式切除保证肿瘤完整切除39例,肿瘤跨叶裂生长15例,肿瘤侵犯肺动脉主干无法通过血管袖式切除或血管成形完整切除肿瘤10例,叶间裂内钙化淋巴结无法游离肺动脉分支3例,肺癌术后新发肿瘤行补充全肺切除2例。
均先行胸腔镜探查,除外胸壁转移,评估认为可以通过全肺切除完整切除病变后,依据不同术者习惯直接开胸手术或继续全胸腔镜下全肺切除,其中胸腔镜全肺切除24例,开胸全肺切除45例,胸腔镜组男性患者较少、新辅助化疗比例较低,第1秒用力呼气量占预计值百分比(FEV1%)<70%比例较高,2组年龄、吸烟史、肿瘤侧别和直径、一氧化碳弥散量占预计值百分比(DLCO%)、术前合并症、新辅助放疗、病理类型、TNM分期无显著性差异(P>0.05),见表1。
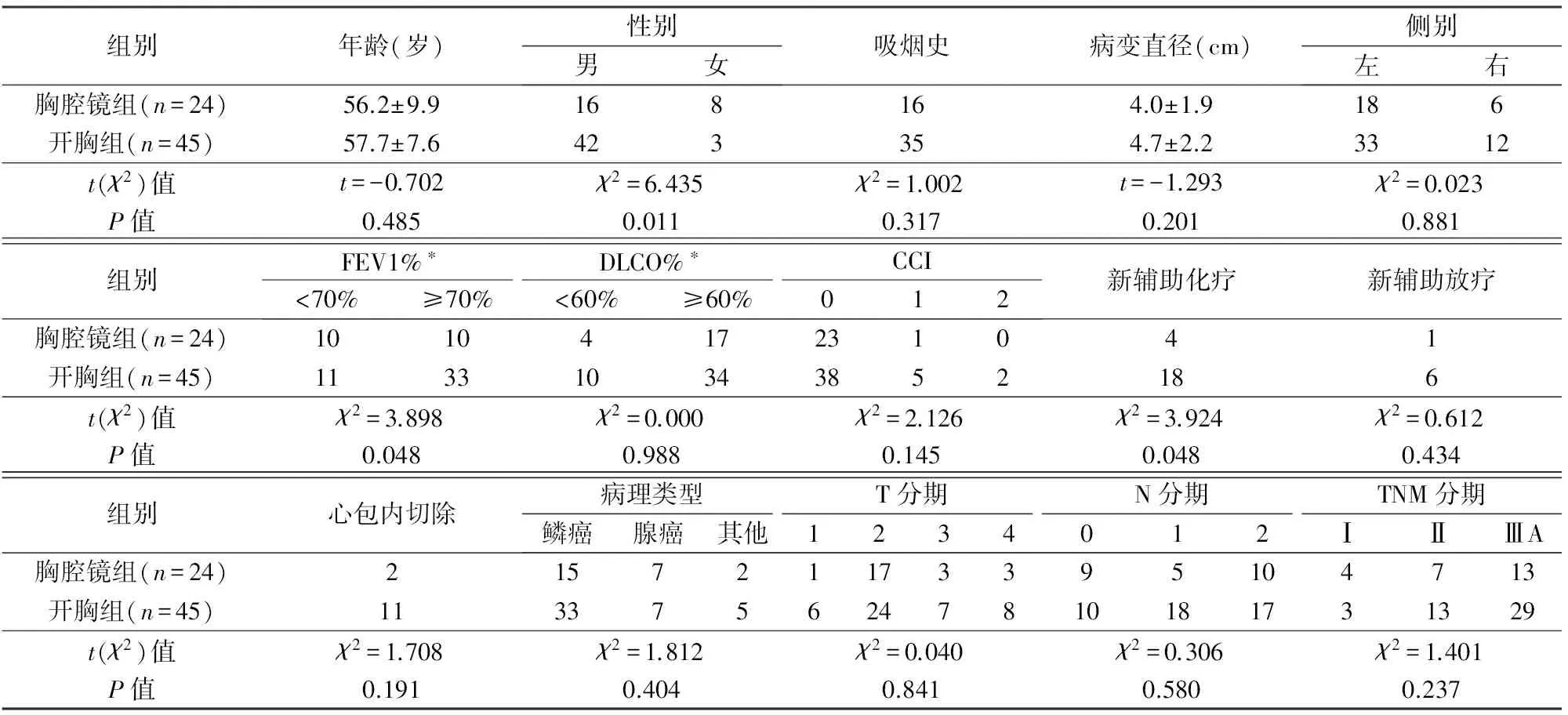
表1 2组一般资料比较
*有资料不全,FEV1%胸腔镜组4例、开胸组1例缺失,DLCO%胸腔镜组3例、开胸组1例缺失FEV1%:第1秒用力呼气量占预计值百分比;DLCO%:一氧化碳弥散量占预计值百分比;CCI:查尔森合并症指数[12]
1.2 手术方式
传统开胸全肺手术:采用后外侧切口,长约15 cm,切断前锯肌及部分背阔肌,经第4或5肋间进胸,肋骨撑开,直视下完成全肺切除。
全胸腔镜手术:采用三切口,主操作口位于第4、5肋间腋前线长约4 cm,辅助操作口位于肩胛下角线第7肋间长约1.5 cm,观察口位于腋中线第7肋间长约1.5 cm,不撑开肋骨。从下肺韧带开始,向上解剖肺门周围纵隔胸膜,先切断静脉,肺门松解后,再根据左、右侧肺动脉和支气管解剖位置的不同,切除顺序随时调整。一般右侧切除顺序为下肺静脉-中叶静脉-上叶静脉-右主支气管-肺动脉,左侧切除顺序为下肺静脉-上叶静脉-左肺动脉主干-切割缝合器闭合左主支气管。胸腔镜全肺切除技巧遵循我科2010年的报道[13]。要点包括:①由术者双手分持直杆电凝钩和带有2个弯角的特制吸引器,经同一切口置入协调操作,完成胸内结构的解剖与分离,即“王氏手法”。②首先处理支气管动脉,在肺门部对其主干及分支进行电凝或结扎后,再进行其他操作。③鞘内分离肺动脉及肺静脉,采用电钩配合钝头吸引器打开并分离血管外鞘,摘除周围淋巴结,使血管达到“骨骼化”之后再进行结扎或离断。④对于支气管、肺动脉、肺静脉及分化不全的叶间裂,均采用相应型号的直线切割缝合器处理。对于直径较细的血管亦可使用Hem-o-lok自动结扎夹、LigaSure双极电刀及缝扎等方法处理。
2组均行标准的淋巴结清扫,右侧常规清扫2、4、7、8、9、10、11、12组,左侧常规清扫5、6、7、8、9、10、11、12组。
1.3 术后辅助治疗和随访
ⅠB期及以上非小细胞肺癌如无禁忌均接受标准辅助化疗4周期,方案为PC或GP。均为专人定期随访。围手术期并发症定义为手术后30天内或住院期间出现的并发症[14]。局部复发定义为原发灶复发或相应引流区域复发,包括术侧肺门、纵隔淋巴结复发及支气管残端复发;其余部位复发定义为远处转移。总生存期定义为手术结束到死亡的时间,或截止到最后一次随访的时间。无进展生存期定义为手术结束直至疾病进展,包括局部复发或远处转移的时间。
1.4 统计学处理
要提高对其的重视程度,首先要从高层着手。只有管理者重视并且注重运用,才能更好地让工作人员应用到实际工作中。首先,管理人员要树立自己正确的意识,起到带领员工主动学习的作用。同时企业也要加强对员工的培训与教导,让他们提高自己的工作意识,时刻意识到管理会计工作的重要性,不断地加强自己的工作能力,紧跟时代步伐抓住机遇为企业创造更大的利益。
2 结果
2.1 围手术期结果比较
胸腔镜组中转开胸5例(20.8%),均为主动中转,原因包括钙化淋巴结粘连3例,肿瘤较大肺门显露困难2例。2组均手术顺利,无术中并发症。
2组围手术期结果比较见表2,胸腔镜组手术时间短,术中出血少,术后引流时间短,术后病理均证实支气管切缘阴性,2组纵隔淋巴结清扫站数和个数、淋巴结病理阳性个数、术后住院时间差异均无显著性。2组均无围术期死亡。胸腔镜组术后并发症8例,其中心房纤颤(房颤)3例,喉返神经损伤1例,肺炎1例,胃瘫1例,肺不张1例,支气管胸膜瘘1例。开胸组术后并发症9例,其中急性肾功能损伤3例,房颤2例,喉返神经损伤2例,肺炎1例,胸腔积液需穿刺引流1例。2组术后并发症发生率差异无显著性,所有并发症均经保守治疗治愈。
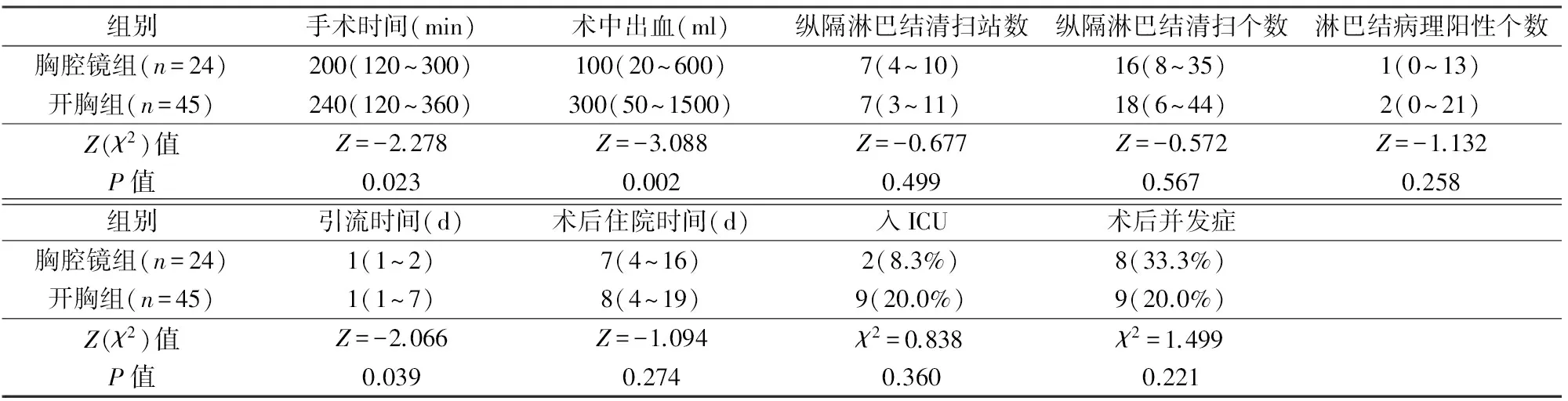
表2 2组围术期指标比较
2.2 随访结果比较
全组中位随访时间19(3~63)个月,胸腔镜组肿瘤复发9例(37.5%),其中局部复发4例,远处转移5例;开胸组肿瘤复发26例(57.8%),局部复发7例,远处转移15例,局部复发合并远处转移4例。胸腔镜组术后1年、3年无复发生存率分别为80%、43.2%,开胸组为84.1%、36.3%,2组无复发生存无显著性差异(log-rankχ2=0.765,P=0.382)(图1)。胸腔镜组1年、3年总生存率分别为84.4%、70.1%,开胸组为79.8%、42.5%,2组间总生存无显著性差异(log-rankχ2=2.594,P=0.107)(图2)。
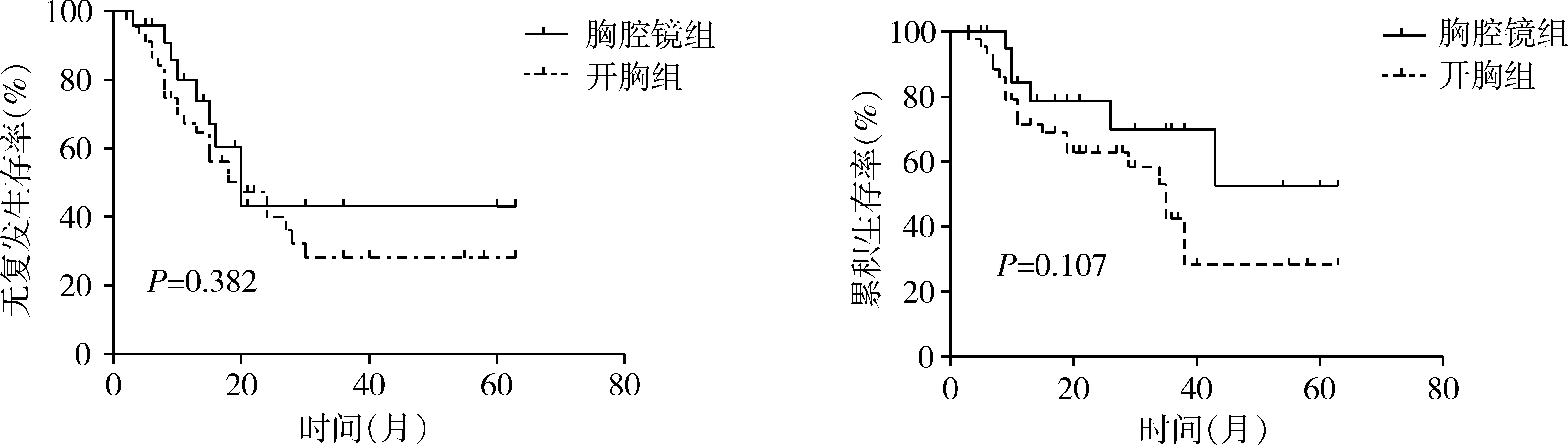
图1 2组无复发生存曲线 图2 2组总生存曲线
3 讨论
自1993年Roviaro等[15]首次报道胸腔镜全肺切除治疗2例局部进展期鳞癌以来,越来越多的研究表明这种术式不仅在技术上安全可行,并且在肿瘤治疗远期效果上与传统开胸术式相同[9],但目前国内外依然缺乏循证依据较强的针对两种术式效果的对比研究。本研究通过总结单中心7年胸腔镜全肺切除经验,对比开胸全肺切除的中期疗效,并将中转开胸病例归入胸腔镜组,符合意向性治疗原则,对两种术式的评价更加客观。
本研究中开胸组男性患者比例较高,与既往研究类似。Nwogu等[9]报道的目前为止最大样本的胸腔镜全肺切除研究中,开胸组男性显著多于胸腔镜组(71% vs. 38%),Pagès等[3]的研究同样显示这种趋势。同时,本研究中开胸组行新辅助化疗患者比例高,而多项研究显示全肺切除术前行新辅助化疗只是增加术后并发症发生率,而对肺癌患者围手术期死亡率和长期生存无影响[16,17]。
本研究中胸腔镜组术中出血量显著少于传统开胸组,手术时间也缩短,与文献报道结果相似[9,10],2组均未出现致命性大出血。胸腔镜组中转开胸率为20.8%(5/24),虽然与胸腔镜肺叶切除中转开胸率(2.5%~14.7%[6,18,19])相比明显增加,但与文献报道胸腔镜全肺切除中转开胸率(2.1%~25%[9,20])相似,考虑到全肺切除适应证多为局部进展期肺癌,肺血管、支气管分离难度大,这个中转开胸率是可以接受的,因此,我们认为,胸腔镜全肺切除与开胸相比同样安全可靠,但如果术中出现腔镜下无法处理的情况,应果断中转开胸。
本研究全肺切除术后总体并发症发生率为24.6%(17/69)(文献报道为33%~49.22%[2,8]),2组均无活动性大出血等严重并发症。胸腔镜组1例迟发型支气管胸膜瘘,术后4个月经气管镜诊断,经支气管支架封堵治愈,术后35个月随访无复发生存。胸腔镜组术后并发症发生率为33.3%(8/24)。本研究中胸腔镜全肺切除术后最常见并发症为房颤12.5%(3/24),开胸组为4.4%(2/45),与Nwogu等[9]研究结果相似,他的研究中胸腔镜组、开胸组房颤发生率分别为34%和14%(P=0.054),其原因为胸腔镜组更倾向于术中打开心包以更好地控制血管近端,从而导致房颤发生率增加,而Nagai等[8]的研究显示术后房颤与心包切开不相关,可能是胸腔镜术后早期下地活动,在全肺术后纵隔不稳定的情况下,加剧了心房的压力导致房颤[17]。
2017年美国胸科医师学会(American College of Chest Physicians,ACCP)肺癌诊疗指南建议,肺癌根治至少需要完成3组淋巴结清扫[21],本组中位清扫淋巴结7组,达到诊疗规范的要求。多项研究显示,胸腔镜下系统性纵隔淋巴结清扫与开胸手术相比,淋巴结清扫个数及站数无差异[22,23],本研究中胸腔镜与开胸全肺切除同样无差异,均能达到肺癌诊疗规范的淋巴结清扫要求,而且胸腔镜下淋巴结清扫在某些部位较开胸更有优势[24],尤其是在清扫一些位置较深的隆突下淋巴结时,腔镜近距离观察,使得操作更加精准,因此,胸腔镜全肺切除在清扫淋巴结过程中同样可靠。
Whitson[25]及Ng[19]等研究认为胸腔镜与开胸肺叶切除相比预后更好,可能的原因包括:胸腔镜手术减少对机体的免疫抑制,从而可以在切除肿瘤的同时清除残留的肿瘤细胞;与开胸术后相比,胸腔镜术后血中自然杀伤T细胞、T细胞氧化活性以及免疫趋化因子水平升高。但是胸腔镜全肺切除没有显示出微创的预后优势,Nwogu等[9]对24例胸腔镜全肺切除和35例开胸全肺切除患者随访47个月,2组总生存率无显著差异,进一步的亚组分析依然没有差异,但此研究中的变量不匹配,开胸组患者肿瘤直径较大,分期也较晚。而本研究中2组肿瘤大小及分期均无差别,2组总生存率和无复发生存率均无统计学差异,表明胸腔镜全肺切除中期效果至少不逊于开胸全肺切除。
本研究存在一些不足,主要包括:单中心回顾性研究并且样本量有限;中位随访时间短,尤其是胸腔镜全肺切除多于近几年开展,需进一步随访以获得长期生存数据。
综上,在全肺切除治疗非小细胞肺癌中,胸腔镜与开胸手术具有同样的安全彻底性,两者总生存率相当,胸腔镜手术具有手术时间短、术中出血少、术后引流时间短的优势。
1 Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012.CA Cancer J Clin,2015,65(2):87-108.
2 Petrella F,Spaggiari L.Therapeutic options following pneumonectomy in non-small cell lung cancer.Expert Rev Respir Med,2016,10(8):919-925.
3 Pagès P,Delpy J,Orsini B,et al.Propensity score analysis comparing video thoracoscopic lobectomy with thoracotomy:a French nationwide study.Ann Thorac Surg,2016,101(4):1370-1378.
4 Paul S,Altorki NK,Sheng S,et al.Thoracoscopic lobectomy is associated with lower morbidity than open lobectomy:a propensity-matched analysis from the STS database.J Thorac Cardiovasc Surg,2010,139(2):366-378.
5 Swanson SJ,Herndon JN,D’Amico TA,et al.Video-assisted thoracic surgery lobectomy:report of CALGB 39802:a prospective,multi-institution feasibility study.J Clin Oncol,2007,25(31):4993-4997.
6 Flores RM,Park BJ,Dycoco J,et al.Lobectomy by video-assisted thoracic surgery (VATS) versus thoracotomy for lung cancer.J Thorac Cardiovasc Surg,2009,138(1):11-18.
7 Conlan AA,Sandor A.Total thoracoscopic pneumonectomy:indications and technical considerations.J Thorac Cardiovasc Surg,2003,126(6):2083-2085.
8 Nagai S,Imanishi N,Matsuoka T,et al.Video-assisted thoracoscopic pneumonectomy:retrospective outcome analysis of 47 consecutive patients.Ann Thorac Surg,2014,97(6):1908-1913.
9 Nwogu CE,Yendamuri S,Demmy TL.Does thoracoscopic pneumonectomy for lung cancer affect survival?Ann Thorac Surg,2010,89(6):S2102-S2106.
10 Sahai RK,Nwogu CE,Yendamuri S,et al.Is thoracoscopic pneumonectomy safe?Ann Thorac Surg,2009,88(4):1086-1092.
11 Bernard A,Deschamps C,Allen MS,et al.Pneumonectomy for malignant disease:factors affecting early morbidity and mortality.J Thorac Cardiovasc Surg,2001,121(6):1076-1082.
12 Charlson ME,Pompei P,Ales KL,et al.A new method of classifying prognostic comorbidity in longitudinal studies:development and validation.J Chronic Dis,1987,40(5):373-383.
13 李 运,王 俊,隋锡朝,等.全胸腔镜肺叶切除手术操作流程及技巧的优化:北京大学人民医院经验.中华胸心血管外科杂志,2010,26(5):300-306.
14 Fernandez FG,Kosinski AS,Burfeind W,et al.The Society of Thoracic Surgeons Lung Cancer Resection Risk Model:Higher Quality Data and Superior Outcomes.Ann Thorac Surg,2016,102(2):370-377.
15 Roviaro G,Varoli F,Rebuffat C,et al.Major pulmonary resections:pneumonectomies and lobectomies.Ann Thorac Surg,1993,56(3):779-783.
16 Gudbjartsson T,Gyllstedt E,Pikwer A,et al.Early surgical results after pneumonectomy for non-small cell lung cancer are not affected by preoperative radiotherapy and chemotherapy.Ann Thorac Surg,2008,86(2):376-382.
17 Broderick SR,Patel AP,Crabtree TD,et al.Pneumonectomy for clinical stage IIIA non-small cell lung cancer:the effect of neoadjuvant therapy.Ann Thorac Surg,2016,101(2):451-457.
18 Swanson SJ,Meyers BF,Gunnarsson CL,et al.Video-assisted thoracoscopic lobectomy is less costly and morbid than open lobectomy:a retrospective multiinstitutional database analysis.Ann Thorac Surg,2012,93(4):1027-1032.
19 Ng CS,Wan IY,Yim AP.Impact of video-assisted thoracoscopic major lung resection on immune function.Asian Cardiovasc Thorac Ann,2009,17(4):426-432.
20 Thomas PA,Berbis J,Baste J,et al.Pneumonectomy for lung cancer:Contemporary national early morbidity and mortality outcomes.J Thorac Cardiovasc Surg,2015,149(1):73-82.
21 Kozower BD,Larner JM,Detterbeck FC,et al.Special treatment issues in non-small cell lung cancer:diagnosis and management of lung cancer,3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines.Chest,2013,143(5 Suppl):e369S-e399S.
22 Hoksch B,Ablassmaler B,Walter M,et al.Radical thoracoscopic lobectomy with lymphadenectomy in a cadaver model.Can J Surg,2002,45(5):376-380.
23 Kim HK,Choi YS,Kim J,et al.Outcomes of unexpected pathologic N1 and N2 disease after video-assisted thoracic surgery lobectomy for clinical stage I non-small cell lung cancer.J Thorac Cardiovasc Surg,2010,140(6):1288-1293.
24 李剑锋,李 运,王 俊,等.全胸腔镜下肺叶切除技术要点分析.中国微创外科杂志,2009,9(1):30-32.
25 Whitson BA,Groth SS,Duval SJ,et al.Surgery for early-stage non-small cell lung cancer:a systematic review of the video-assisted thoracoscopic surgery versus thoracotomy approaches to lobectomy.Ann Thorac Surg,2008,86(6):2008-2016.
ComparisonofThoracoscopicandThoracotomicPneumonectomyforNon-smallCellLungCancer
WangShaodong,LiXiao,SuiXizhao,etal.
DepartmentofThoracicSurgery,PekingUniversityPeople’sHospital,Beijing100044,China
WangJun,E-mail:jwangmd@yahoo.com
ObjectiveTo evaluate the safety, feasibility and mid-term efficacy of video-assisted thoracoscopic surgery (VATS) pneumonectomy for non-small cell lung cancer (NSCLC).MethodsFrom January 2009 to December 2016, 69 patients who underwent pnumonectomy for NSCLC were reviewed, among which 24 patients underwent thoracoscopical pneumonectomy and 45 patients underwent open thoracotomy. The VATS group had less male patients [66.7% (16/24) vs. 93.3% (42/45),χ2=6.435,P=0.011] and lower neoadjuvant chemotherapy rate [16.7% (4/24) vs. 40.0% (18/45),χ2=3.924,P=0.048].There were no significant differences in age, smoking history, tumor location and diameter, neoadjuvant radiation, pathology type, and TNM staging between the two groups (P>0.05). Surgery condition, postperative complications, overall survival and recurrence free survival were compared between the two groups.ResultsThere were no significant differences in mediastinal lymph nodes dissected, positive lymph nodes, hospital stay, and postoperative complications between the two groups (P>0.05). The surgery time and operative blood loss were less in the VATS group than those in the thoracotomy group [median: 200 (120-300) min vs. 240 (120-360) min,Z=-2.278,P=0.023; 100 (20-600) ml vs. 300 (50-1500) ml,Z=-3.088,P=0.002]. The postoperative drainage time in the VATS group was also shorter than that in the thoracotomy group [1 (1-2) days vs. 1 (1-7) days,Z=-2.066,P=0.039]. The median follow-up time was 19 (3-63) months. The one-year recurrence-free survival rate was 80% in the VATS group and 84.1% in the thoracotomy group, and three-year recurrence-free survival rate was 43.2% and 36.3%, respectively (log-rankχ2=0.765,P=0.382). The one-year overall survival rate was 84.4% in the VATS group and 79.8% in the thoracotomy group, and the three-year overall survival rate was 70.1% and 42.5%, respectively (log-rankχ2=2.594,P=0.107).ConclusionFor NSCLC, VATS pneumonectomy is a feasible procedure with less operative blood loss, shorter surgery time and postoperative drainage time, with its surgical and oncologic outcomes comparable to that of thoracotomy pneumonectomy.
Lung cancer; Pneumonectomy; Video-assisted thoracoscopic surgery; Thoracotomy
北京市科技计划(D1411000000214004)
A
1009-6604(2017)10-0882-05
10.3969/j.issn.1009-6604.2017.10.005
2017-01-22)
(修回日期:2017-05-18)
(责任编辑:王惠群)

