细叶石仙桃黄酮类成分的分离及其抗肿瘤活性
陈小兵,黄丽芸,许 军,邓鼎森*,凌志杰
(1.赣南卫生健康职业学院,江西 赣州 341000;2.江西中医药大学药学院,江西 南昌 330004)
细叶石仙桃黄酮类成分的分离及其抗肿瘤活性
陈小兵1,黄丽芸1,许 军2,邓鼎森1*,凌志杰1
(1.赣南卫生健康职业学院,江西 赣州 341000;2.江西中医药大学药学院,江西 南昌 330004)
采用硅胶柱层析等方法对细叶石仙桃全草进行化学成分的分离和结构鉴定,分离得到3个化合物。根据化合物的理化性质及其光谱数据分析可鉴定为黄酮类化合物,分别为化合物1.7-羟基-3-(4′-羟苯基)异黄酮;2.槲皮素3.7-羟基-3-(4′-甲氧基苯基)色原酮。本试验采用了MTT方法筛选所得化合物的抗肿瘤生物活性,同时再检测化合物对H22细胞周期的影响情况。试验结果表明化合物1和3具有较好的抗肿瘤活性,能够诱导H22细胞周期阻滞于GO/G1期。
细叶石仙桃;黄酮类成分;结构鉴定;抗肿瘤活性
细叶石仙桃(Pholidota Cantonensis)为兰科石仙桃属植物。细叶石仙桃为兰科植物石仙桃的全草或假鳞茎,性甘味凉,归肺、肾经,有养阴、清热、利湿、散瘀之效,主治肺热咳嗽、吐血、咽喉肿痛、风湿疼痛、湿热浮肿、疳积、跌打损伤[1]。本研究对江西赣州产的细叶石仙桃中黄酮类成分进行研究,分得黄酮类化学成分。本试验采用了MTT方法来筛选所得单体化合物的抗肿瘤活性,同时再检测化合物对H22细胞周期影响情况。试验结果表明化合物1和3具有较好的抗肿瘤活性,能够诱导H22细胞周期阻滞于GO/G1期。
1 材料
1.1 仪器及药材
Nicolet 5700 型傅里叶变换红外光谱仪;Inova 400型核磁共振仪(TMS为内标);制备液相色谱仪为Shimadzu LC-6AD (制备柱,YMC-Pack ODS-A);大孔吸附树脂HP-20(日本三菱公司);ACSCalibur流式细胞仪:TecanInfinite M200型多功能酶标仪(瑞士Tecan公司);CO2恒温细胞培养箱(美国Thenllo公司)。葡聚糖凝胶Sephadex LH-20(美国 Amersham Pharmacia Biotech 公司)。细叶石仙桃样品于2015年9月采自江西赣州,性状特征参照文献[2]描述,经江中药业股份有限公司国家二级技师颜干明鉴定为细叶石仙桃。凭证样品保存于赣南卫生健康职业学院中药标本室。
人结肠癌细胞HT-29、肝癌细胞H22、小鼠移植性肿瘤S180和人乳腺癌细胞MCF-7(美国ATCC)。
2 方法与结果
2.1 提取与分离
取细叶石仙桃全草粉末15 kg,用8倍量水提取3回,2小时每回,合并提取液,用旋转蒸发仪减压浓缩,得到浓缩提取物1.4 kg。取出水提物1 kg,再用8倍量的95%乙醇溶液回流提取3回,3小时每回,所得提取液再用旋转蒸发仪减压回流浓缩,所得棕色流浸膏用水搅拌分散,然后依次用三氯甲烷、甲醇分别萃取,合并萃取液再用旋转蒸发仪减压回流浓缩,回收溶剂后得浸膏。得到甲醇溶剂萃取浸膏330g棕色物,水溶解后再用Diaion HP-20型大孔吸附树脂吸附,然后用水、10%、40%和80%乙醇溶液洗脱进行层析分离,薄层色谱法鉴定、合并相似流份得到7个不同梯度共100个洗脱流份。经反复硅胶柱色谱、结晶分离、反复重结晶得到3个化合物。
2.2 化合物结构鉴定
分离提取得到的化合物依据化合物的理化性质及其波谱数据用于化合物结构鉴定。鉴定结果如下。
化合物I淡黄色针状结晶,分子式为C15H10O4,mp328~330℃。盐酸-镁粉反应呈阳性,显示为黄酮类化合物。IR(KBr)显示:在3265 cm-1有羟基的最大吸收,在1710 cm-1有C=O的吸收峰。苯环吸收:1629,1599,1511,1456cm-1。EI-MS:m/z 254.7[M]+。1H-NMR(CD3OD,400MHz)δ:6.75 (d,2H,J=8.2 Hz,H-6,8),6.89(d,2H,J=2.0 Hz,H-3′,-5′),7.41(d,2H,H-2′,-6′),7.9(d,1H,H-5),8.21(s,1H,H-1),10.81(s,1H,OH)。13C-NMR(CD3OD,100 MHz)δ:102.1(C-3′,5′),116.1(C-6,8),122.4(C-4),123.5(C-2),125.7(C-1′),128.2(C-2′,6′),131.1(C-5),153.2(C-1),156.9(C-7,4′),175.3(C-3,C=O)。上述化合物的理化性质及其光谱数据与文献报道的基本一致[3],可鉴定化合物 I 为:7-羟基-3-(4′-羟苯基)异黄酮。
化合物Ⅱ 淡黄色针状,分子式为C15H10O7,mp311~313℃。用盐酸-镁粉试验,反应呈阳性,此化合物为黄酮类。苯环吸收:1625,1581,1511,1428cm-1。1H-NMR(CD3OD,400MHz)δ:6.01(d,1H,J=2.3Hz,H-6),6.21(d,1H,J=2.4=0Hz,H-8),6.61(d,1H,J=8Hz,H-5′),6.75(d,1H,J=8.5Hz,H-6′),6.61(d,1H,J=8Hz,H-5′),7.13(d,1H,J=8,2.5Hz,H-2′),9.23(s,1H,3′-OH),9.33(s,1H,4′-OH),9.23(d,1H,4′-OH),10.21(s,1H,7-OH),12.23(s,1H,5-OH),13.02(s,1H,3-OH).13C-NMR(CD3OD,100MHz)δ:95.5(C-8),98.3(C-6),104.9(C-4),112.8(C-6′),118.1(C-3′),120.8(C-2′),125.8(C-1′),138.2(C-2),146.9(C-4′),147.9(C-5′),160.5(C-1),164.2(C-5),166.2 (C-7),179.1 (C-3,C=O).上述化合物的理化性质及其光谱数据与文献报道的基本一致[4],可鉴定为槲皮素。
化合物III黄色颗粒状,分子式为C16H12O4,mp264~265℃。用盐酸-镁粉试验,反应呈阳性,此化合物为黄酮类。薄层色谱以5%FeCl3溶液显色,呈现蓝黑色,显示有酚羟基存在。IR (KBr)光谱显示有羟基的吸收(3400cm-1),1712 cm-1处明显C=O吸收。苯环吸收峰:1654,1593,1531,1443 cm-1。EI-MS:m/z 269.1[M+H]+。1H-NMR(CD3OD,400MHz)δ:3.95(s,3H,-CH3),6.81(d,2H,H-6,8),6.91(d,2H,J=2.0Hz,H-3′,-5′),7.39(d,2H,H-2′,-6′),7.92(d,1H,J=8.0Hz,H-5),8.21(s,1H,H-1),10.1(s,1H,OH)。13C-NMR(CD3OD,100 MHz)δ:55.6(-OCH3),102.3(C-8),113.7(C-3′,5′),115.4(C-6,),116.4(C-4),123.7(C-2),124.6(C-1′),127.3(C-5),130.1(C-2′),130.4(C-6′),152.4(C-1),158.1(C-9),165.2(C-7),174.9(C-3,C=O)。上述化合物的理化性质及其光谱数据与文献报道的基本一致[5],故鉴定为7-羟基-3-(4′-甲氧基苯基)色原酮。
2.3 MTT试验
按照MTT法,将HT-29、H22、S180和MCF-7细胞(1*108L-1)铺于96孔的细胞培养板上,每个板上各设置5个复孔。再分别将化合物1、2、3、环磷酰胺试药,分别制成l mg/mL的母液,将最终浓度为80、40、20、10、5 μg/mL稀释后加至各给药组,在37℃、5%CO2饱和湿度条件下培育3天,培育前4 h,每孔加入10 μL的 5mg/mL浓度的MTT溶液,再培养4 h,每孔加入二甲基亚砜(DMSO)100 μL,振荡10 min,在酶标仪490 nm处测定各孔D,计算IC50值。见表1。

表1 化合物和标准对照物的抗肿瘤活性
表1试验结果表明:化合物1能够明显地抑制人结肠癌细胞、肝癌细胞、小鼠移植性肿瘤和人乳腺癌细胞的生长,并且H22的IC50值较低。化合物3亦能抑制H22细胞生长。
2.4 化合物对于H22细胞周期的影响
将H22细胞用DMEM培养基中(含10%胎牛血清,30 μg/mL青霉素,50 μg/mL链霉素)。在37℃、5%CO2及饱和湿度下于培养箱内培养,2~3天传代1次。按每1 mL2×104个细胞铺板于96孔培养板中,每组2个复孔。培养24 h后,试验组加入化合物2(30 μg/mL),同上条件继续培养48 h后终止培养。以不加药组作空白对照,同操作。细胞染色后以流式细胞仪观察细胞周期的分布特征情况,采用ModiFit软件进行凋亡和细胞周期分布情况分析。见表2。
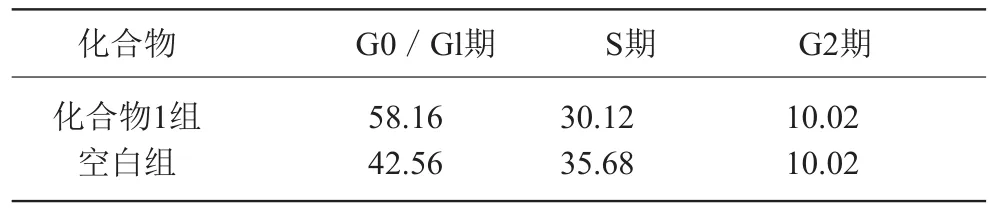
表2 化合物1作用于H22肿瘤细胞的周期分布情况(%)
表2结果表明:化合物1能明显诱导H22细胞周期的阻滞,与空白组相比,化合物2能够使H22细胞G0/Gl期的比例有较大增加,同时,S期的比例有所下降,G2期的比例保持不变。
3 讨 论
细叶石仙桃全草具有清热凉血、滋阴润肺和消肿止痛的功效,常用于治疗咳嗽痰喘、肺炎、咽喉肿痛、咳血、跌打损伤和关节炎等。本研究专门对细叶石仙桃的黄酮类成分进行了分离提取及鉴定以及抗肿瘤活性实验,经硅胶柱层析等方法分离纯化,根据化合物的理化性质及其光谱数据分析可鉴定为黄酮类化合物。同时采用的MTT法,试验结果表明从细叶石仙桃中分离提取的化合物1和3均具有一定抗肿瘤生物活性,也能够显著增加G0/G1期的细胞比例,使得G1期细胞不能通过细胞周期检测点进入S期,从而使得G0/G1期阻滞,阻断了肿瘤细胞的DNA合成。
[1] 南京中医药大学.中药大辞典(上册)[M].上海:上海科技出版社,2006:837.
[2] 中国科学院中国植物志编辑委员会.中国植物志:18卷[M].北京:科学出版社,2009.390-400.
[3] Azadeh Matin,Navnath Gavande,Moon S.et al.7-Hydroxybenzopyran-4-one Derivatives: A Novel Pharmacophore of Peroxisome Proliferator-Activated Receptor r and -γ (PPARr and γ)Dual AgonistsKim[J].J.Med.Chem,2009,52,6835-6850.
[4] XU Fang-hui,DING Yu-xiang et al.Chemical Constituents of Ethyl Acetate Fraction from Hypericum ascyron[J].Journal of Chinese Medicinal Materials,2016,39(2):322-325.
[5] Mohammed Hosny ,John P.N.Rosazza,Novel Iso flavone,Cinnamic Acid,and Triterpenoid Glycosides in Soybean Molasses[J],J.Nat.Prod,2009,62,853-858.
R932
B
ISSN.2095-8242.2017.055.10822.02
江西省卫生计生委中医药科研基金资助项目(项目编号:2013A095)
邓鼎森,男,高级讲师,硕士研究生
本文编辑:吴玲丽

