加速溶剂萃取-凝胶渗透色谱联合固相萃取净化-气相色谱质谱法测定土壤中的6种多环麝香
罗 庆,王诗雨,孙丽娜,王 辉
(沈阳大学 区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044)
加速溶剂萃取-凝胶渗透色谱联合固相萃取净化-气相色谱质谱法测定土壤中的6种多环麝香
罗 庆,王诗雨,孙丽娜,王 辉
(沈阳大学 区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044)
通过对萃取、净化和检测等条件的优化,建立了土壤中萨利麝香、粉檀麝香、特拉斯麝香、开许梅龙、佳乐麝香和吐纳麝香等6种多环麝香的加速溶剂萃取-凝胶渗透色谱与固相萃取协同净化-气相色谱质谱检测方法.采用V(正己烷)∶V(丙酮)=1∶1的混合溶剂作为萃取溶剂,在100 ℃下静态萃取5 min,并循环2次;萃取液浓缩后进入凝胶渗透色谱系统,采用V(环己烷)∶V(乙酸乙酯)=1∶1的混合溶剂作为流动相进行洗脱,收集7.5~15.0 min的洗脱液;洗脱液浓缩后进入已用10 mL正己烷活化的硅胶填料的固相萃取小柱,采用10 mL二氯甲烷洗脱,收集洗脱液并浓缩定容;采用气相色谱质谱联用技术在选择离子扫描模式下进行检测.该方法6种多环麝香的加标回收率为81.3%~106.6%,相对标准偏差为6.4%~11.5%,方法检出限为0.56~0.72 μg·kg-1,方法定量限为1.88~2.39 μg·kg-1.
多环麝香;加速溶剂萃取;固相萃取;凝胶渗透色谱;气相色谱质谱联用
多环麝香作为一种“假持久性有机污染物”,具有与多环芳烃、多氯联苯等持久性有机污染物相似的性质,如较强的亲脂憎水特性、难降解、易生物富集以及雌激素活性等[1]受到国内外环境领域相关研究工作者的广泛关注[2].目前,在污水、活性污泥、大气等环境样品中均检测出了多环麝香[3-6],而这些多环麝香污染物最终会通过大气沉降、灌溉、污泥农用等各种途径进入到土壤环境中,进而对土壤造成环境污染.因此,急需建立土壤样品中多环麝香的精准分析方法.
目前,固体样品中有机污染物的萃取方法主要有索式提取[7]、超声波辅助提取[8]、微波辅助提取[9-10]、加速溶剂萃取[11-12]和超临界流体二氧化碳萃取[13-14]等,净化方法也主要是采用硅胶[15]、中性氧化铝[16]和弗罗里硅土[17]等作为填料的固相萃取法净化.然而土壤样品基质较为复杂,存在较强的基质效应,此外土壤中多环麝香的含量也极低,属于痕量检测范围.因此,为了更有效地去除土壤中的杂质干扰、提高样品的萃取和净化效果、并进一步提升样品前处理的自动化程度,本研究将加速溶剂萃取(ASE)、凝胶渗透色谱(GPC)与固相萃取(SPE)协同净化、气相色谱质谱(GC-MS)检测相结合,建立了土壤中萨利麝香、粉檀麝香、特拉斯麝香、开许梅龙、佳乐麝香和吐纳麝香等6种多环麝香的精准分析方法.与现有的土壤中多环麝香的分析方法相比,本方法采用的全自动样品前处理平台(Preplinc Platform)将GPC、SPE和定量浓缩有机结合,可明显降低样品基质的干扰、提高方法的自动化程度、减少人为操作的影响,实现大量样品的快速、准确分析.
1 实验部分
1.1仪器与试剂
TRACE GC Ultra-PolarisQ气相色谱质谱仪(AI/AS 3000自动进样器,Xcalibur 1.4 工作站),美国Thermo Fisher公司;旋转蒸发器,RE52-99,上海亚荣生化仪器厂;加速溶剂萃取仪,ASE 300,美国DIONEX公司;全自动样品前处理平台(包含凝胶渗透色谱系统、固相萃取系统、浓缩系统),Preplinc Platform,美国J2公司;真空冷冻干燥系统,FDU-1100,TOKYO RIKAKIKAI CO.LTD;超纯水机,Milli-Q,美国Millipore公司;硅胶填料的固相萃取小柱(500 mg/6 mL),美国SUPELCO公司.
萨利麝香(Celestolide,ADBI)、粉檀麝香(Phantolide,AHMI)、特拉斯麝香(Traseolide,ATII)、开许梅龙(Cashmeran,DPMI)、佳乐麝香(Galaxolide,HHCB)和吐纳麝香(Tonalide,AHTN)均购自德国Dr.Ehrenstorfer公司.
色谱纯正己烷和二氯甲烷购自Thermo Fisher公司,色谱纯环己烷和乙酸乙酯购自上海国药集团,色谱纯丙酮购自山东禹王集团,分析纯硅藻土购自天津博纳艾杰尔科技有限公司,实验用水为Millipore超纯水.
1.2 GC-MS分析条件
GC条件:色谱柱,TR5-MS型石英毛细管柱(30 m×0.25 mm×0.25 μm);色谱柱升温程序初始温度为120 ℃,以15 ℃·min-1升至170 ℃,然后以2 ℃·min-1升至200 ℃,最后以30 ℃·min-1升至280 ℃并保持10 min;进样口温度250 ℃;载气、辅助气高纯氦气,载气流速为1 mL·min-1;进样方式不分流进样,不分流时间0.75 min;进样量,1 μL.
MS条件:EI离子源,电离电压70 eV;离子源温度为230 ℃;传输线温度为280 ℃;质谱扫描方式为选择离子扫描(SIM),扫描离子(m/z)见表1;溶剂延迟时间为5 min.

表1 6种多环麝香的气相色谱保留时间和质谱定性、定量扫描离子Table 1 Retention time,mass spectrometry, quantitative scanning of ions of gas chro- matography of 6 polycyclic musks
1.3样品前处理
提取方法:将冷冻干燥后的土壤样品研磨并使用0.9 mm筛进行筛分,称取精确到0.01 g 的5.00 g的过筛土壤样品,装入34 mL的不锈钢加速溶剂萃取池中,萃取池的剩余空间用硅藻土填充.采用V(正己烷)∶V(丙酮)=1∶1的混合溶剂作为提取剂,在萃取压力为10.342 5 Pa、萃取温度为100 ℃的条件下静态萃取5 min,萃取结束后采用60%萃取池体积的萃取溶剂冲洗萃取池.整个ASE提取过程循环2次.
净化方法:包括凝胶渗透色谱净化和固相萃取净化两种方法.首先,将经ASE提取的土壤样品萃取液浓缩至近干,然后用V(环己烷)∶V(乙酸乙酯)=1∶1的10 mL混合溶剂溶解并转移到凝胶渗透色谱系统中.采用V(环己烷)∶V(乙酸乙酯)=1∶1的混合溶剂作为凝胶渗透色谱的流动相,土壤样品萃取液引入GPC柱后,用流动相进行洗脱,收集7.5~15.0 min时间段的洗脱液.然后,将收集的GPC洗脱液浓缩至近干并用正己烷定容至1 mL,接着将样品引入已用10 mL正己烷活化的硅胶填料的固相萃取小柱中,采用10 mL二氯甲烷作为洗脱溶剂进行洗脱,收集全部洗脱液.最后,将收集的SPE洗脱液浓缩至近干并用正己烷定容至1 mL,4 ℃冰箱保存,待GC-MS检测.整个凝胶渗透色谱净化、固相萃取净化以及样品浓缩过程全部由全自动样品前处理平台Preplinc Platform自动完成.
2 结果与讨论
2.1质谱条件
利用GC-MS的全扫描检测方式对标准品进行定性,确定DPMI、ADBI、AHMI、ATII、HHCB和AHTN的出峰时间、定性离子和定量离子,检测结果见表1.在优化后的气相色谱质谱检测条件下,6种多环麝香能够在14 min内完成分析,并且各化合物之间分离度良好.图1是100 μg·L-1的萨利麝香、粉檀麝香、特拉斯麝香、开许梅龙、佳乐麝香和吐纳麝香等6种多环麝香在选择离子扫描(SIM)模式下的总离子流色谱图(TIC).

图1 100 μg/L的6种多环麝香在选择离子扫描模式下的总离子流色谱图Fig.1 SIM total ion chromatogram of 6 polycyclic musks in 100 μg/L
2.2样品提取条件的优化
分别选择V(正己烷)∶V(二氯甲烷)=1∶1的混合溶剂和V(正己烷)∶V(丙酮)=1∶1的混合溶剂作为ASE的萃取溶剂.萃取效果表明(见图2),当采用V(正己烷)∶V(丙酮)=1∶1的混合溶剂作为ASE的萃取溶剂时土壤中多环麝香的提取效果最好,加标回收率大于80%.因此,选择V(正己烷)∶V(丙酮)=1∶1的混合溶剂作为本方法的ASE萃取溶剂.
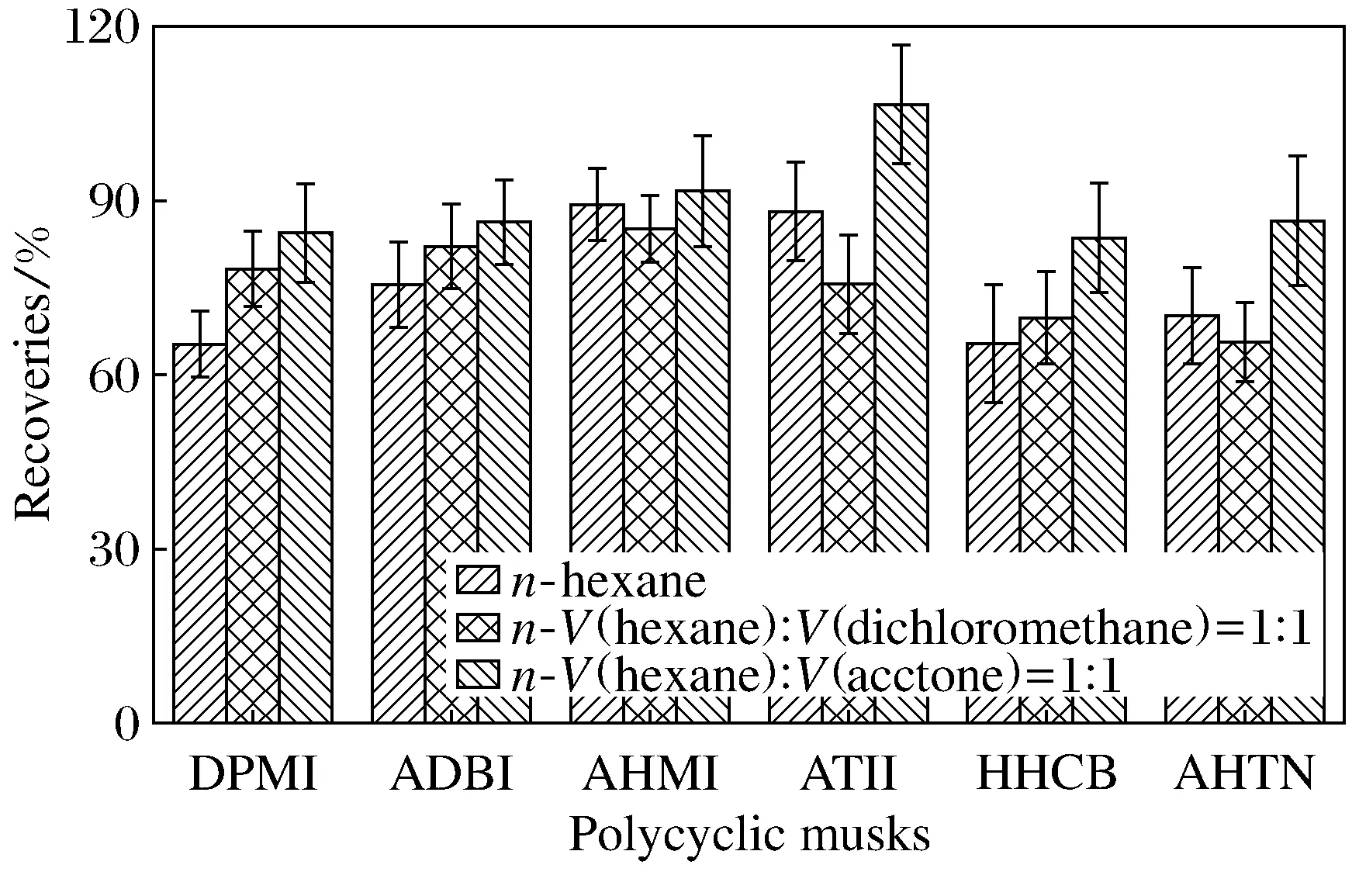
图2 采用不同萃取溶剂的土壤中6种多环麝香的平均加标回收率(n=3)Fig.2 The recoveries of 6 kinds of polycyclic musk at different extraction organic solvent (n=3)
改变ASE的萃取温度(60、80、100、120 ℃),发现当萃取温度从60 ℃升至100 ℃时,6种多环麝香的加标回收率均随着萃取温度的增加而提高;但当温度继续升高至120 ℃时,6种多环麝香的加标回收率没有继续随着萃取温度的增加而提高,而是表现出了不同程度的降低(如图3所示).因此,选择100 ℃作为本研究的ASE萃取温度.
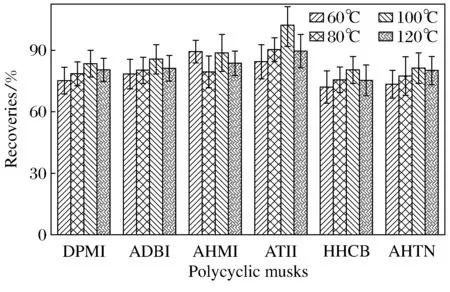
图3 采用不同萃取温度的土壤中6种多环麝香的平均加标回收率(n=3)Fig.3 The recoveries of 6 kinds of polycyclic musk at different extraction temperature(n=3)
改变ASE静态萃取时间(5 、10、15 min),发现当ASE静态萃取时间从5 min增加至15 min时,6种多环麝香的平均加标回收率基本没有变化,这表明ASE静态萃取时间对土壤中6种多环麝香的萃取效果没有显著影响(见图4).因此,为了缩短分析时间,提高分析效率,本方法选择静态萃取时间为5 min.当静态萃取循环次数设定为2次和3次时,土壤中6种多环麝香的平均加标回收率相差不大,但略高于静态萃取循环次数为1次的萃取效率,因此本方法选择静态萃取循环次数为2次.

图4 采用不同静态萃取时间的土壤中6种多环麝香的平均加标回收率(n=3)Fig.4 The recoveries of 6 kinds of polycyclic musk at different static extraction times(n=3)
2.3样品净化条件的优化
本实验使用的GPC柱规格为400 mm×25 mm ID,填料为Bio-Beads(S-X3),200~400目,整个柱子约含填料50 g.由于GPC要求其流动相与柱子规格、填料等一致,因此根据本实验使用的GPC柱选用体积比为1∶1的环己烷/乙酸乙酯混合溶剂作为GPC的淋洗液,流速为4.7 mL·min-1.将配置好的萨利麝香、粉檀麝香、特拉斯麝香、开许梅龙、佳乐麝香和吐纳麝香等6种多环麝香混合标准溶液引入GPC净化系统,从6 min开始收集洗脱液,每0.5 min收集一次,总共收集20瓶洗脱液.通过分析每瓶洗脱液中萨利麝香、粉檀麝香、特拉斯麝香、开许梅龙、佳乐麝香和吐纳麝香的浓度,绘制出6种多环麝香的流出曲线,如图5所示.

图5 6种多环麝香的GPC流出曲线
Fig.5 The GPC elution curve of 6 kinds of polycyclic musk
从图5可以看出,6种多环麝香标准品在7.5~15.0 min之间全部从凝胶色谱柱中流出,因此为了确保凝胶色谱柱的净化效果,最大限度地去除土壤中杂质的干扰,并且保证样品中多环麝香能有较高的回收率,收集时间确定为7.5~15.0 min.
通过文献调研,二氯甲烷是最常用的、也是最有效的多环麝香等有机污染物的固相萃取洗脱溶剂,因此,本研究直接选用二氯甲烷作为土壤中6种多环麝香的固相萃取洗脱溶剂.但不同方法使用了不同的洗脱体积,因此有必要对二氯甲烷的使用量进行优化.本研究选用了6、8、10、12 mL等4个用量的二氯甲烷进行洗脱效果对比实验,结果发现二氯甲烷的用量从6 mL增加至10 mL时,6种多环麝香已经全部洗脱出来,而且共同洗脱出的杂质较少;当二氯甲烷洗脱量继续增加至12 mL时,已有较多杂质共同流出,影响检测效果.因此,本方法选用10 mL二氯甲烷作为土壤中6种多环麝香的固相萃取洗脱溶剂.
2.4方法的线性范围和检出限
配制5种不同质量浓度的DPMI、ADBI、AHMI、ATII、HHCB和AHTN的混合标准溶液进行测定,每个质量浓度重复测定3次,发现6种多环麝香在10~1 000 μg·L-1的质量浓度范围内线性关系良好,相关系数均大于0.999.通过逐级稀释6种多环麝香的标准溶液,分别以3倍的信噪比(S/N)和10倍的S/N计算6种多环麝香的仪器检出限和定量限,6种多环麝香的仪器检出限和定量限分别为3和10 μg·L-1.进一步通过回收率校正计算出了土壤中6种多环麝香的加速溶剂萃取-凝胶渗透色谱联合固相萃取净化-气相色谱质谱检测的方法检出限和定量限,分别为0.56~0.72 μg·kg-1和1.88~2.39 μg·kg-1,见表2.
表2方法的质量浓度线性范围、相关系数及仪器检出限和定量限


化 合 物线性范围μg·L-1回归方程相关系数(R2)检出限μg·L-1定量限μg·L-1开许梅龙(DPMI)10~1000Y=18.16X-13.210.9992310萨利麝香(ADBI)10~1000Y=18.77X-133.680.9998310粉檀麝香(AHMI)10~1000Y=15.51X-20.280.9996310特拉斯麝香(ATII)10~1000Y=10.51X-75.210.9998310佳乐麝香(HHCB)10~1000Y=33.08X-173.730.9995310吐纳麝香(AHTN)10~1000Y=-19.47X-11.730.9993310
2.5方法的回收率和精密度
将25、125和500 ng的6种多环麝香标准品加入到5.00 g已准确测得6种多环麝香含量的土壤样品中,使得6种多环麝香的加标剂量分别为5、25、100 μg·kg-1.将加入6种多环麝香标准品的土壤样品充分混和均匀后按照1.3章节中样品前处理的步骤处理,重复7次.实验结果表明,即使在极低质量浓度的条件下,本方法土壤样品中6种多环麝香的加标回收率也高于80%,相对标准偏差也较低,仅为11.5%.低、中、高3个加标质量浓度条件下土壤样品中6种多环麝香的平均加标回收率位于81.3%~106.6%之间,7次重复的相对标准偏差(RSD)介于6.4%~11.5%,见表3.
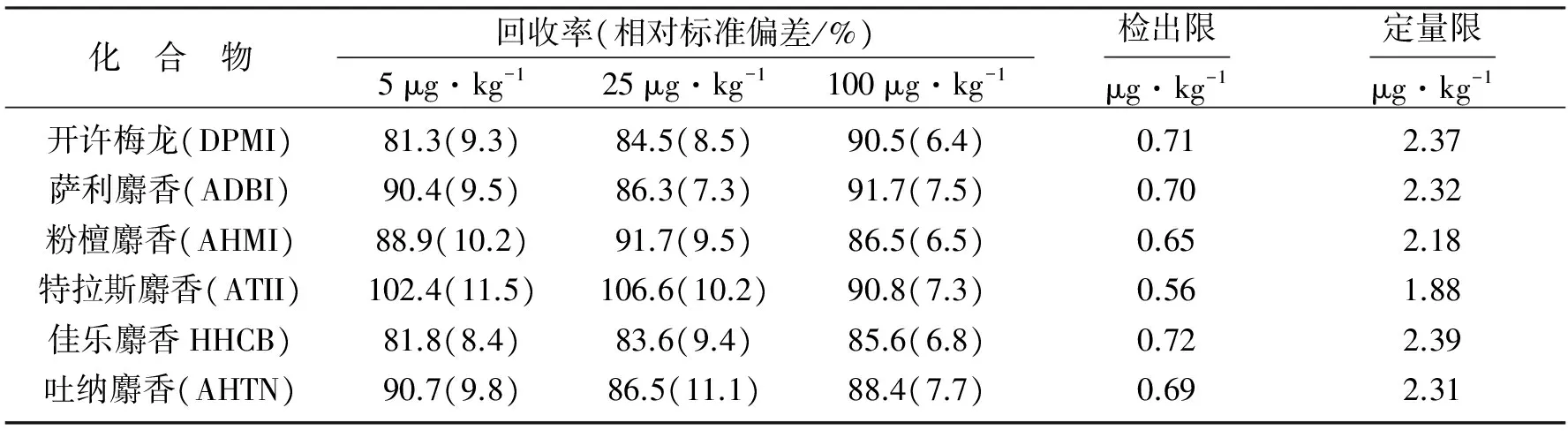
表3 方法不同含量的回收率、精密度、检出限及定量限Table 3 Recoveries,RSD,LOD and LOQ of different content of the method
2.6样品分析
为了检验本方法的实际检测效果,分别采集了沈阳周边的以浑河、辽河等地表水为灌溉用水的八一灌区、沈抚灌区、石佛寺灌区和张士灌区等4个典型灌区的16个农田土壤样品,采用本方法进行测定.发现4个灌区的16个农田土壤样品均存在不同程度的多环麝香污染,佳乐麝香和吐纳麝香的检出率为100%,其中佳乐麝香的污染物含量为3.42~19.53 μg·kg-1,吐纳麝香的污染物含量为0.95~7.42 μg·kg-1(低于定量限).其余4种多环麝香未检出,这与我国地表水中多环麝香的污染特征相似.
[1] MATAMOROS V,BAYONA J M.Elimination of pharmaceuticals and personal care products in subsurface flow constructed wetlands[J].Environmental Science &Technology,2006,40(18):5811-5816.
[2] 陈多宏,曾祥英,盛彦清,等.典型污染源中多环麝香的污染特征[J].中国环境监测,2008,24(1):67-70.
CHEN D H,ZENG X Y,SHENG Y Q,et al.The pollution character of the polycyclic musks in a typical cosmetic plant[J].Environmental Monitoring in China,2008,24(1):67-70.
[3] ESCHKE H.Synthetic musks in different water matrices[M]∥The Handbook of Environmental Chemistry:Part X.Vol 3.Berlin:Springer,2004:17-28.
[4] PECK A M,HORNBUCKLE K C.Synthetic musk fragrances in Lake Michigan[J].Environmental Science &Technology,2004,38(2):367-372.
[5] REGUEIRO J,GARCIA-JARES C,LLOMPART M,et al.Development of a method based on sorbent trapping followed by solid-phase microextraction for the determination of synthetic musks in indoor air[J].Journal of Chromatography A,2009,1216(14):2805-2815.
[6] ZENG X,SHENG G,XIONG Y,et al.Determination of polycyclic musks in sewage sludge from Guangdong,China using GC-EI-MS[J].Chemosphere,2005,60(6):817.
[7] 田艺心,王美娥,陈卫平,等.污水和污泥中的人工合成麝香分析方法[J].生态学杂志,2011,30(2):395- 400.
TIAN Y X,WANG M E,CHEN W P,et al.Analytical methods for synthetic musk in wastewater and sewage sludge[J].Chinese Journal of Ecology,2011,30(2):395- 400.
[8] TERNES T A,HERRMANN N,BONERZ M,et al.A rapid method to measure the solid-water distribution coefficient (Kd) for pharmaceuticals and musk fragrances in sewage sludge[J].Water Research,2004,38(19):4075-4084.
[9] 罗庆,孙丽娜.微波辅助萃取气相色谱质谱法测定土壤、底泥及植物样品中的多环麝香[J].分析试验室,2011,30(4):50-53.
LUO Q,SUN L N.Determination of polycyclic musks in soil,sediment and plants using microwave-assisted solvent extraction with gas chromatography-mass spectrometry[J].Chinese Journal of Analysis Laboratory,2011,30(4):50-53.
[10] 罗庆,孙丽娜,张耀华.土壤中多环麝香微波辅助提取与其它提取方法的对比研究[J].分析测试学报,2011,30(7):745-749.
LUO Q,SUN L N,ZHANG Y H.Comparative study of microwave-assisted solvent extraction and other extraction methods of polycyclic musks in soil[J].Journal of Instrumental Analysis,2011,30(7):745-749.
[11] TERNES T A,BONERZ M,HERRMANN N,et al.Determination of pharmaceuticals,iodinated contrast media and musk fragrances in sludge by LC/tandem MS and GC/MS[J].Journal of Chromatography A,2005,1067(1/2):213-223.
[12] 付海滨,闫超杰,李修平,等.加速溶剂萃取技术在食品安全检测领域中的应用[J].沈阳大学学报(自然科学版),2013,25(4):279-283.
FU H B,YAN C P,LI X P,et al.Application of accelerated solvent extraction in food safety detection[J].Journal of Shenyang University (Natural Science),2013,25(4):279-283.
[13] LEE H B,PEART T E,SARAFIN K.Occurrence of Polycyclic and Nitro Musk Compounds in Canadian sludge and wastewater samples[J].Water Quality Research Journal of Canada (Canadian Association,2003,38(4):683-702.
[14] SMYTH S A,LISHMAN L,ALAEE M,et al.Sample storage and extraction efficiencies in determination of polycyclic and nitro musks in sewage sludge[J].Chemosphere,2007,67(2):267-275.
[15] 叶洪,林永辉,杨方,等.气相色谱串联质谱法测定个人护理品中九种合成麝香[J].分析试验室,2012,31(11):45-49.
YE H,LIN Y H,YANG F,et al.Determination of 9 synthetic musks in personal care and sanitation products by GC-MS/MS[J].Chinese Journal of Analysis Laboratory,2012,31(11):45-49.
[16] 胡正君,史亚利,蔡亚岐.加速溶剂萃取/气相色谱质谱法测定鱼类样品中的多环麝香[J].环境化学,2011,30(1):362-265.
HU Z J,SHI Y L,CAI Y Q.Determination of polycyclic musks in fishes samples by accelerated solvent extraction (ASE) and gas chromatography-mass spectrometry[J].Environmental Chemistry,2011,30(1):362-265.
[17] 车金水,虞锐鹏,王利平,等.太湖流域人工合成麝香的分布调查研究[J].香料香精化妆品,2010(6):12-16.
CHE J S,YU R P,WANG L P,et al.Investigation on content distribution of the synthetic musks in Taihu Lake[J].Flavour Fragrance Cosmetics,2010(6):12-16.
Determinationof6PolycyclicMusksinSoilbyASE-GPC-SPEPurificationandGC-MSDetection
LuoQing,WangShiyu,SunLina,WangHui
(Key Laboratory of Regional Environment and Eco-Remediation of Ministry of Educatione,Shenyang University,Shenyang 110044,China)
A new method using ASE combined with GPC and SPE cleanup followed by GC-MS detection has been established for the quantitative determination of six polycyclic musks in soil.In the method,the samples were extracted by ASE withV(hexane)∶V(acetone)=1∶1 at 100 ℃ for 5 min,and cycle 2 times.After evaporated to dryness,the extract was dissolved in 10 mLV(cyclohexane)∶V(ethyl acetate)=1∶1 and injected into GPC column withV(cyclohexane)∶V(ethyl acetate)=1∶1 as the mobile phase at a flow rate of 4.7 mL·min-1.The 7.5~15.0 min fraction was collected for subsequent analysis.The portions collected from GPC were dissolved in 1 mL hexane after evaporated to dryness.Then the 1 mL extractions were purified by SPE using silica gel column,eluted with 10 mL dichloromethane.Finally,the eluate was dissolved in 1 mL hexane after evaporated to dryness,and then analyzed by GC-MS in the Selective Ion Monitor (SIM) mode.The correlation coefficient of each polycyclic musk wasr2>0.99,the average recoveries were in the range of 81.3%~106.6%.The RSD ranged from 6.4% to 11.5%.The method detection limit (MDL) is 0.56~0.72 μg·kg-1,and the method quantitative limit (MQL) is 1.88~2.39 μg·kg-1.
polycyclic musk;accelerated solvent extraction;solid phase extraction;gel permeation chromatography;gas chromatography-mass spectrometry
2017-04-01
国家重点基础研究发展规划资助项目(2014CB441100);国家科技重大专项基金资助项目(2012ZX07202004).
罗 庆(1984-),男,湖北随州人,沈阳大学讲师.
2095-5456(2017)05-0362-06
X 833
A
【责任编辑:胡天慧】

