龙须菜养殖对深澳湾表层水体pCO2的影响
王首吉, 杜虹, 张清芳, 陈洋, 梅志平, 陈伟洲
1.汕头大学海洋生物研究所, 汕头 515063 2.汕头大学生物系, 汕头 515063
龙须菜养殖对深澳湾表层水体pCO2的影响
王首吉1, 杜虹2*, 张清芳2, 陈洋2, 梅志平1, 陈伟洲1
1.汕头大学海洋生物研究所, 汕头 515063 2.汕头大学生物系, 汕头 515063
根据2014年2—5、7 月在深澳湾获得的表层海水总碱度和pH值, 结合水文、天气、海湾养殖情况等因素, 以探讨海区 CO2收支计算方法为主要目的, 研究了汕头市南澳县龙须菜(Gracilaria lemaneiformis)养殖对深澳湾表层水CO2体系空间分布特征的影响。结果显示: 2014年2、4、7月深澳湾为CO2的汇区, 3、5月为CO2的源区。相比浮游植物, 2014年2、3、5 月龙须菜对CO2吸收贡献率分别为62.90%、71.19%和52.20%。4月赤潮爆发, 叶绿素a含量高达16.65 μg·L–1, 此时龙须菜光呼吸作用变强, 吸收O2同时释放CO2, 浮游植物成为深澳湾主导生物, 对CO2的吸收占主导地位。通过区域对比, 发现龙须菜养殖区水体的pCO2和DIC都比非养殖区的低, 相比鱼、贝养殖区, 藻类养殖区更有可能成为CO2的汇区。
龙须菜; 浮游植物; 海水pH值; 海水总碱度; 表层二氧化碳分压
1 前言
全球近岸每年从大气中吸收的 CO2总量达到0.33—0.36 Pg·Cyr–1, 占开放海域每年吸收 CO2的27%—30%[1]。但由于边缘海的复杂性, 碳循环过程难以准确估算, 这一直是困扰大多学者的问题。研究表明边缘海是大气 CO2的汇, 有些沿海区域至少是碳的弱汇[2–4]。目前人工海洋增汇主要途径是增加海洋生物固碳, 经联合国粮食及农业组织(Food and Agriculture Organization, FAO)统计, 全球藻类产业中中国占到了72%, 中国近岸每年约有33万吨碳通过海藻养殖从海区移去[5]。但目前关于海藻碳汇的基础研究并不多, 尤其海湾特殊的地理位置是否真的是大气 CO2的汇区尚未得知, 大型海藻如何影响近岸表层海水pCO2也未见报道, 海洋碳汇的估算方式也不尽相同, 这都需要大量的基础数据作为理论支持。而龙须菜作为中国重要的经济海藻之一[6]。在广东省汕头市南澳岛养殖已有十余年[7]。深澳湾作为我国龙须菜养殖的主要海湾之一, 以2011年为例, 龙须菜养殖面积为 731 hm2, 产量为 27217 t[8],该区域龙须菜养殖对表层水 pCO2的影响尚未见报道。本研究通过2014年2—5、7月对深澳湾表层海水理化因子的跟踪调查, 利用的新的估算方法, 探讨龙须菜养殖对表层海水 pCO2变化的影响, 旨在从新的角度去理解经济海藻在海湾养殖中的固碳作用。
2 调查海域与方法
2.1 采样布点及采样方法
深澳湾水域面积13.3 km2, 水深1.1—6.3 m, 平均水深1.9 m, 泥质水底[9]。调查海区范围及站点参照图1, 共设置18个采样站点, 分别于2014年2、3、4、5、7 月进行五次取样调查, 采样时间为 7:00—12:00, 其中 S8站点为非养殖区, S1—S7和 S9—S16站点为龙须菜养殖区, S17站点为牡蛎挂养区, S18站点为鱼类养殖区, 采样同时用GPS定位各养殖区域的外围点, 计算养殖面积, 试验期间深澳湾降雨量如图2。
样品采集和分析调查方法均参照《海洋调查规范》[10]与《海洋监测规范》[11]规定方法进行, 分别监测了总碱度(Total alkalinity, TA)、硝酸盐氮(NO3–)、磷酸盐(PO43–)、叶绿素a(Chl-a)。pH的测定使用瑞士 METTLER TOLEDO便携式 pH计(相对精度±0.001)。利用美国In-Situ Inc SMARTROLL 便携式水质分析仪测定表层海水水温(Sea Surface Temperature, SST)、盐度(salinity, Sal)、溶解氧(Dissolved Oxygen, DO)。
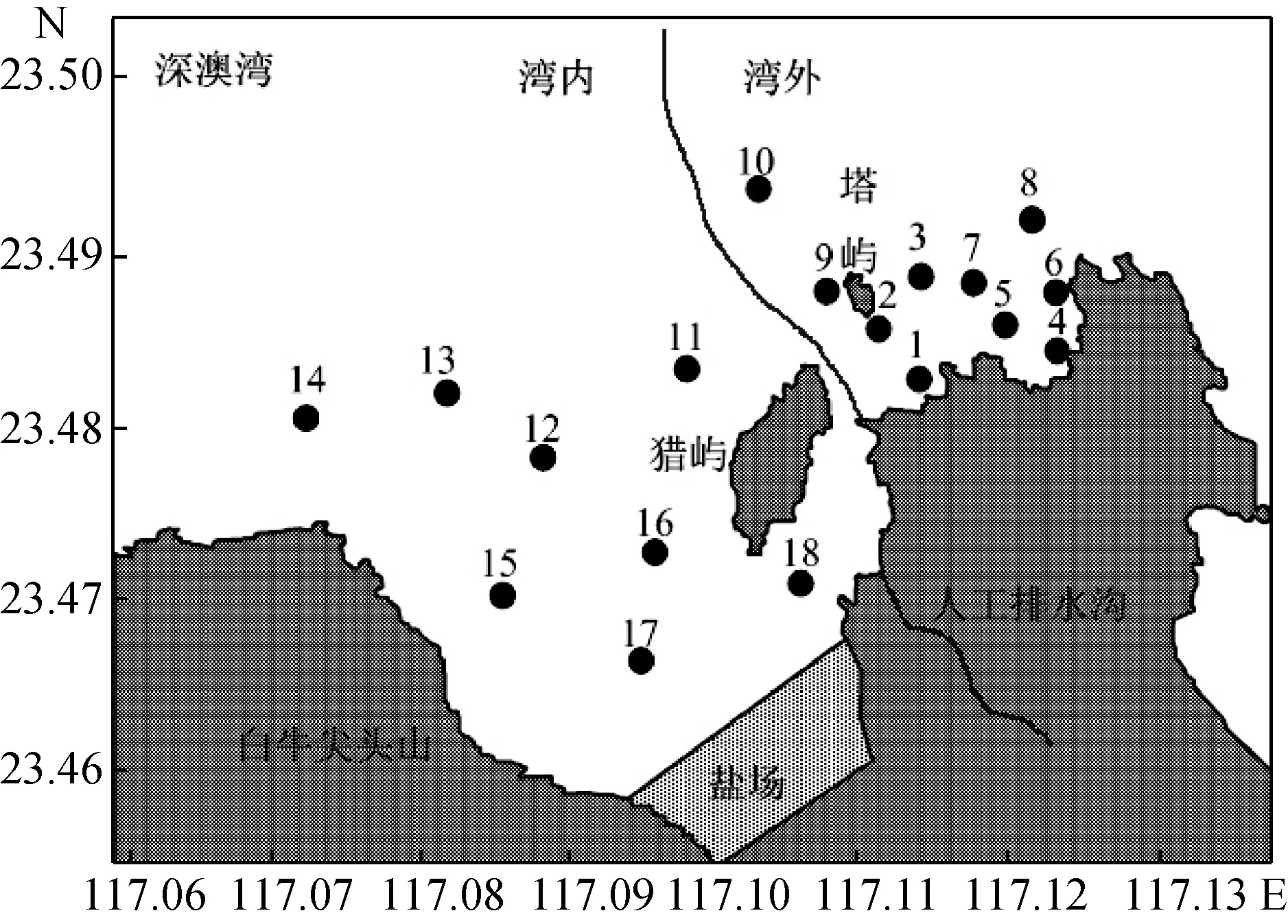
图1 深澳湾调查站点分布图Fig.1 Survey stations in Shenao Bay
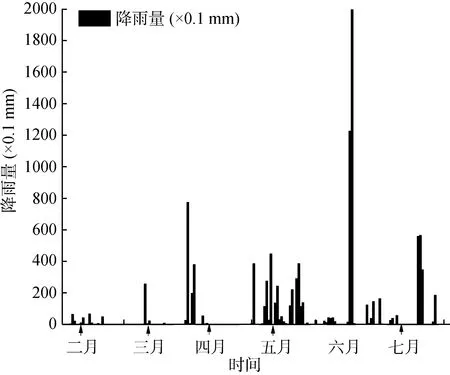
图2 深澳湾 1 月至 7 月降雨量Fig.2 Precipitation in Shenao Bay from Jun to July
2.2 无机碳体系计算
当海水的 CO2体系处于平衡时, 如果海水的水温、盐度和压力已经测定, 那么pH、TA、溶解无机碳(Dissolved inorganic carbon, DIC)和表层二氧化碳分压(pCO2)就可以任意测定两个, 然后计算出其余的参数[12], 本研究通过测定 pH和 TA数据, 利用CO2SYS软件, 计算DIC及其他CO2体系参数。
2.3 固碳比例计算
海水中溶解氧浓度会随风速的增加而增大, 一般情况下, 其主要影响因素是水温和盐度[13]。根据熊孝先、鲍永恩的经验公式(1)、公式(2), 可将不同月份DO值换算成同水温18 ℃、同盐度30‰ 的DO值[13–14]。之后再利用统一标准下的数据进行计算。
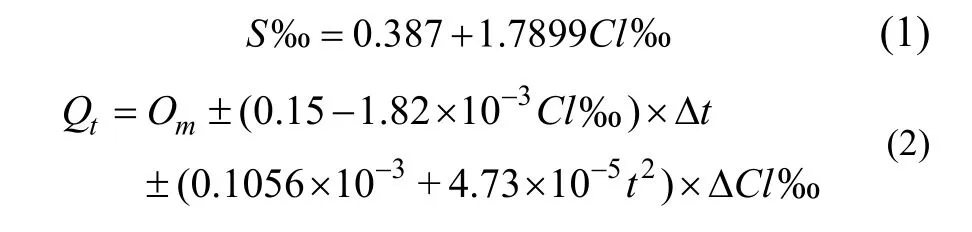
注:S‰: 实际测得的盐度值,Cl‰: 换算的氯度值,Qt: 欲换算的溶解氧浓度,Om: 实际测得的溶解氧浓度, Δt: 水温实际值与欲换算值差值,t: 欲换算水温值, ΔCl‰: 实测与欲换算的氯度差值。
在不考虑外部因素的前提下, 每年12月到次年5月深澳湾水体中的溶解氧变化主要由浮游植物和龙须菜产生, 而每年的6月到11月无龙须菜, 此时DO浓度仅由浮游植物生物量决定。通过计算无龙须菜养殖月份(每年6—11月)的DOx/Chl-ax值, 利用历年实际测得的DO值和Chl-a值, 求出浮游植物贡献的DO浓度。然后根据海水实际DO值与微藻贡献的DO的差值, 求出由龙须菜贡献的DO百分比(公式4)。

注:DOx: 每年6—11月(无龙须菜养殖)的DO浓度。Chl-ax: 每年 6—11月(无龙须菜养殖)的 Chl-a浓度(其中有赤潮的月份:DOx/Chl-ax=1.343, 无赤潮月份:DOx/Chl-ax=3.082)。n: 代表2、3、4、5月(其中 4月代入DOx/Chl-ax=1.343, 其他月份代入DOx/Chl-ax=3.082), 数据来源于谢玲(2014)和郑兵(2010)[15]。DO龙须菜: 由龙须菜引起的水体溶解氧变化。DO微藻: 由浮游植物引起的水体溶解氧变化。DO总: 实际测得的海水溶解氧。
植物光合作用对CO2的吸收和O2的释放比例是1:1的关系, 所以DO浓度的大小可以表征CO2的吸收情况, 即可以用产氧比例代表固碳比例, 公式(5)。
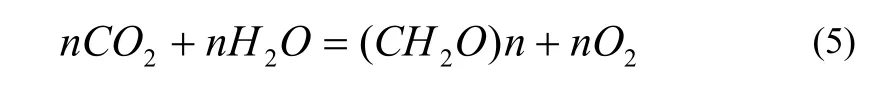
2.4 数据处理与分析
利用SPSS 21.0软件进行线性相关分析,α=0.05水平下,p<0.05视为差异显著,p<0.01视为差异极其显著, 利用Surfer 9.0和Adobe Photoshop CS3进行地图和等值线图绘制, 利用Origin 8.0进行图表绘制。
3 结果与讨论
3.1 表层海水环境参数的空间分布特征
经调查2014年2—5月龙须菜挂养面积为分别为7.79、8.85、9.74、12.0 km2。2—5、7月平均水温依次为13.63 ℃、13.81 ℃、21.22 ℃、21.57 ℃、30.15 ℃,盐度保持在33‰左右, 总体变化不大。由图3可见2月份 DO的高值中心和 pCO2的低值中心均出现在龙须菜挂养的区域, pCO2的高值中心出现在牡蛎挂养区。3月份整个海区的pCO2变化浮动不大, 并由内向外递减。4月DO平均饱和度为(194±17)%(表2), S18最低为 161%, S11最高为 232%, Chl-a平均浓度为16.65 μg·L–1, 由岸边向外递增。5月份的DO饱和度只有92%, 高值中心在近岸, Chl-a、pCO2由內向外递增, 最低值在龙须菜挂养区。7月份 Chl-a平均浓度为 14.33 μg·L–1, 高值中心出现在牡蛎挂养区域, 此处也是DO的高值中心和pCO2的低值中心。
由上可见, 龙须菜、牡蛎、鱼类的养殖, 会使海区的DO和pCO2产生明显的区域划分。此外赤潮对海区pCO2的影响也非常明显, 赤潮的爆发, 会使这种区域划分格局更为显著。
3.2 不同养殖区pCO2的变动情况
由表1可见, 龙须菜养殖区的pCO2和DIC比非养殖区低, 牡蛎与鱼类养殖区的pCO2比非养殖区高,相比鱼、贝养殖区, 海藻养殖区更有可能成为 CO2汇区。此外, 牡蛎养殖区的ΔpCO2: 2月>3月>4月>5月, ΔDIC: 2月>4月>3月>5月, 鱼类养殖区ΔpCO2: 2月>3月>5月>4月, ΔDIC: 2月>4月>5月>3月, 可见牡蛎和鱼类养殖区的ΔpCO2和ΔDIC基本逐月减小,推断这可能是因为龙须菜养殖面积逐月扩大, 龙须菜养殖区域水体流动影响了牡蛎、鱼类养殖区域, 龙须菜以汇的角色影响着牡蛎、鱼类养殖区域(源角色)。
戴民汉[16]研究表明夏季台湾海峡南侧海区为CO2显著的源区, 张远辉[17]研究表明台湾海峡表层水 CO2略呈饱和。本研究通过大气 pCO2与海水pCO2(图4)的比较: 3、5月深澳湾表现为CO2的源区,2、4、7月表现为CO2的汇区。本实验结果显示: 除了4月(赤潮爆发)深澳湾作为强汇区外, 3、5月份仍作为CO2的源区, 2月仅作为CO2的弱汇区。据报道深澳湾 2014 年春季龙须菜总固碳总量约为 631.9 t[18],可见龙须菜的养殖能在一定的程度上改变海区源的角色, 但由于龙须菜养殖面积相对于整片海区较小,使深澳湾作为汇的角色不显著。
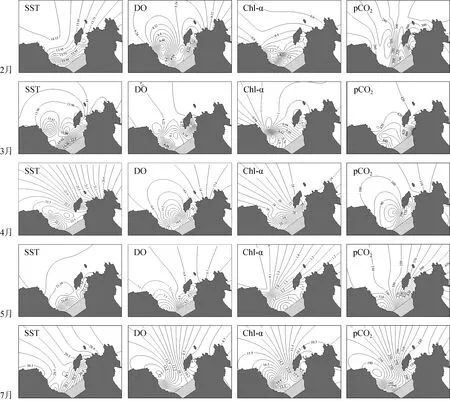
图3 2014年2—5、7月深澳湾表层海水与溶解无机碳系统相关的环境参数的空间分布Fig.3 Spatial distribution of parameters related to DIC system of surface water in Shenao Bay from Feb to May and July 2014
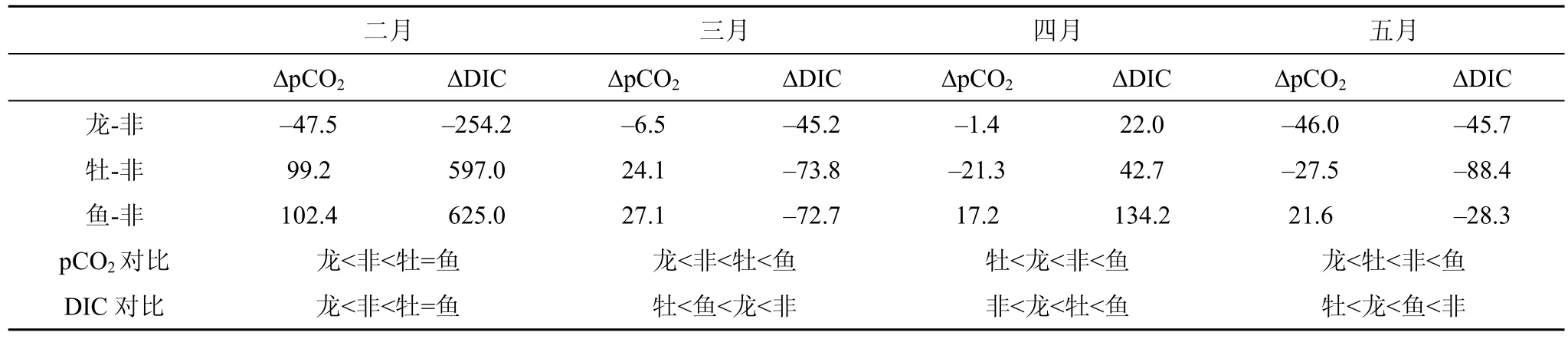
表1 不同养殖区域pCO2和DIC与空白养殖区pCO2和DIC差值Tab.1 D-value of pCO2 and DIC between cultivation area and blank area
3.3 CO2体系参数与环境因子关系
研究表明海藻的光合作用速率主要决定于水温[19], 但同时受营养限制。4月赤潮爆发(表2), 硝酸盐氮最低值只有 0.611 μmol·L–1, 磷酸盐仅为0.124 μmol·L–1, 此时龙须菜出现大面积的黄化现象。据报道, 龙须菜的这种“黄化”现象是由环境缺氮造成的[20–21], 由此可见, 龙须菜光合作用受到营养盐的限制, 固碳能力不高。

图4 深澳湾不同养殖区表层水pCO2分压的变化Fig.4 Seasonal variation of pCO2 of different maricultural areas in Shenao Bay
表层海水的pCO2受到物理、化学、生物等外部条件的影响, 如水温、盐度等的影响[22]。其中水温是主要因素, 据报道夏季东海西部表层海水水温与pCO2呈负相关关系[23], 本实验逐步回归分析显示(表3): pCO2与水温并无相关关系(除 5月), 而与chl-a和DO有相关性, 可见初级生产者光合作用更可能是造成 DO过饱和的主要原因, 说明海区的浮游植物对 pCO2的影响较大。此外 CO2体系参数与Sal没有相关性, 说明深澳湾海水的物理混合过程对CO2影响不明显, 排除了物理过程对pCO2的影响作用。7月份CO2体系参数仅与DO相关, 7月没有龙须菜, 此时 chl-a浓度达到(12.32±3.88) μg·L–1, 说明浮游植物对CO2的吸收贡献所占比例很大。综上说明海区pCO2变化受外部环境因子影响不明显, 虽然深澳湾作为汇的角色不显著, 但这个变化是由生物过程的引起的。
3.4 龙须菜和浮游植物产氧量计算及固碳分析
藻类光合作用过程会吸收 CO2, 同时释放 O2,海水中 CO2减少会使 HCO3–和 CO32–的比例增加,DIC和pCO2下降[24], 本实验中DO与CO2参数表现出强的负相关性(y=–40.13x+ 680.32,r=0.8359)。通过对溶解氧的定量分析, 估算藻类单位时间内的产氧量, 进而表征光合作用速率[25]。
开阔的海域, 溶解氧浓度的影响因素较多, 物理过程和生物过程都会影响海区溶解氧浓度。本文将影响溶解氧浓度的主要因素(温度、盐度)归一化,同时忽略不同季节藻种类不一样而引起的误差, 用叶绿素a浓度表征微藻数量, 大致估算深澳湾浮游植物和龙须菜的产氧比例, 进而用产氧比例表示固碳比例。
根据公式(1)、(2)将不同月份的DO浓度值换算成统一条件下的DO浓度值, 如表4。
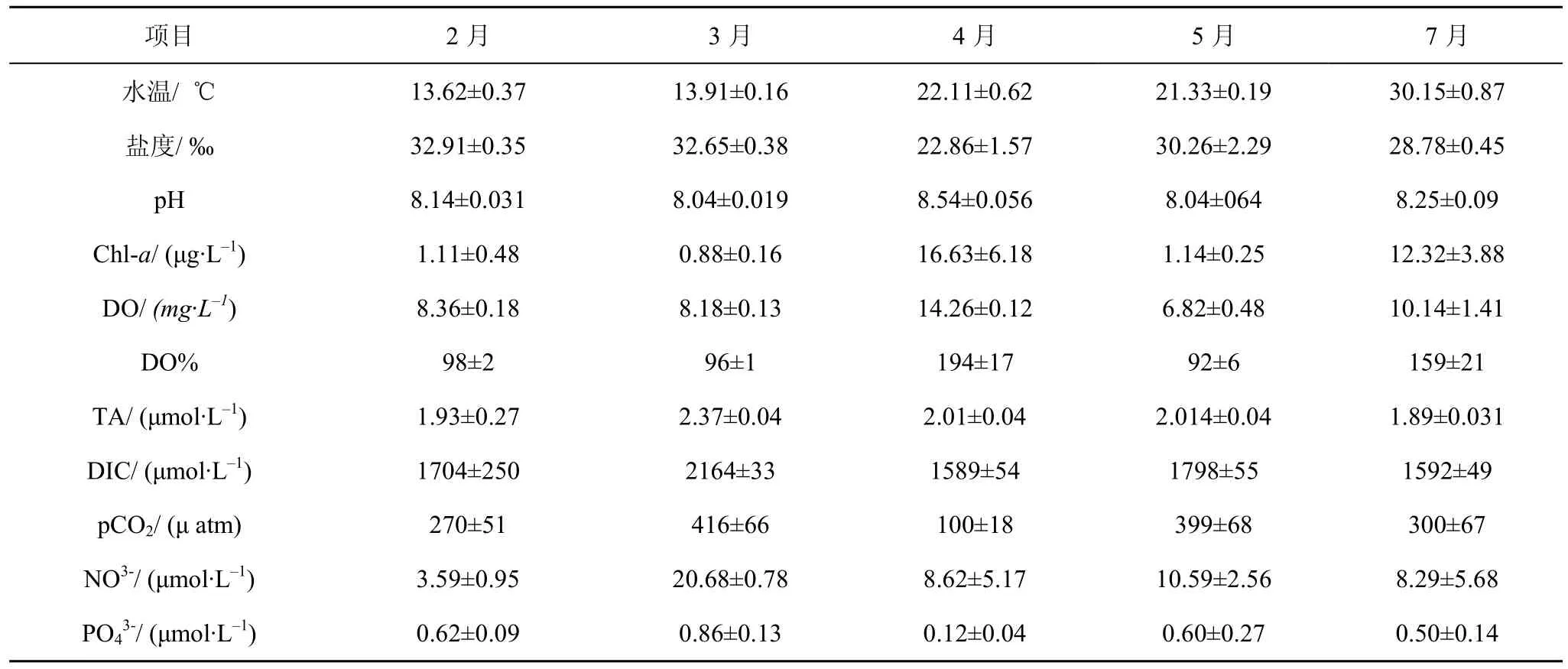
表2 深澳湾表层海水中环境因子平均浓度的季节变化Tab.2 Seasonal variation of average value of different environmental parameters in Shenao Bay
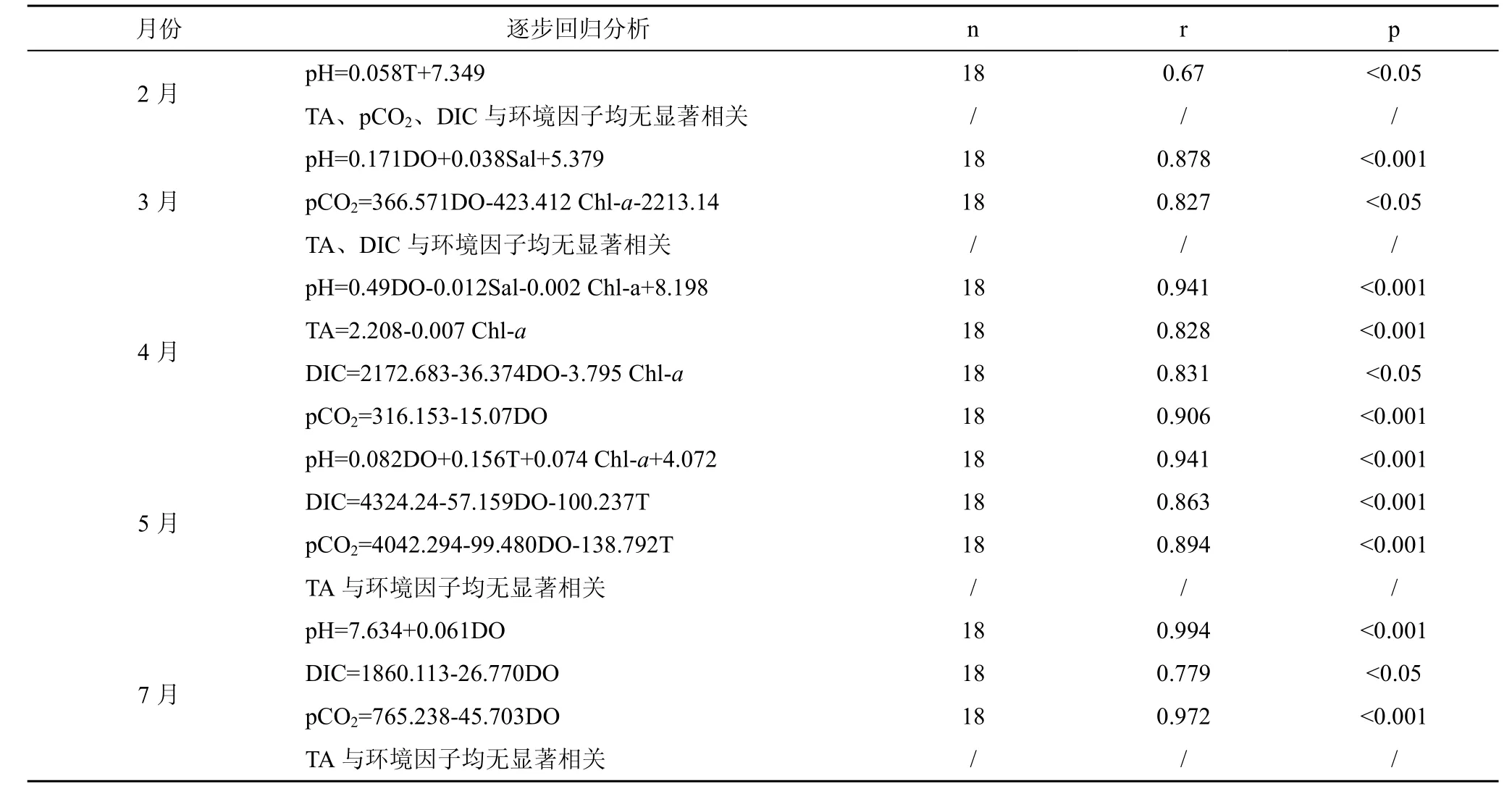
表3 深澳湾CO2体系各参数与环境因子空间分布数据的逐步回归分析结果Tab.3 Stepwise regression analyses results of CO2 system parameters with environmental factors of spatial distribution data

表4 换算成水温为18 ℃, 盐度为30‰时的DO浓度Tab.4 The value of DO when temperature converts to 18℃and salinity converts to 30‰
根据公式(3)、公式(4)和表4的计算结果, 计算出不同月份由浮游植物和龙须菜产生的DO比例如表5。结果显示: 2—5月龙须菜的产氧比例占海区总产氧量的百分比分别为: 62.90%、71.19%、-27.56%和52.20%。其中4月爆发赤潮, 此时龙须菜的产氧量表现为负值, 分析是由于龙须菜生物量增加, 养殖深度加深(实际的养殖深度从2月的0.3—0.5 m到5月的1—1.8 m), 光合作用减弱造成的。与此同时4月DO%达到194%, 显著高于其他月份, DIC浓度为(1589±540 μmol·L–1, pCO2为(100±18) μatm显著低于其他月份。研究表明, 在高O2、低CO2的条件下, 植物会进行光呼吸作用, 吸收 O2同时释放 CO2[26–27],所以在这样高O2、低CO2的条件下, 海区龙须菜更可能是通过光呼吸维持生长。本课题组前期研究表明, 龙须菜在缺氮48 h之后光呼吸作用增强, 补氮过程龙须菜的光呼吸作用更加显著[28]。通过 Chl-a和营养盐的对比, 说明此时是赤潮爆发后期, 即前期赤潮爆发期间, 大量营养被吸收, 赤潮后期营养快速释放, 造成此时的龙须菜光呼吸作用强烈。
计算结果显示 4月龙须菜的产氧比例为负值,说明此时龙须菜的光呼吸作用比光合作用强。但此时的溶解氧含量高, 说明海区浮游植物光合作用产生的O2既承担了龙须菜吸收的那一部分, 又补充了海水中的溶解氧, 可见浮游植物在此时的光合作用是非常强烈的。
根据表5浮游植物与龙须菜的产氧比例和植物光合作用原理式(5)。说明在 2、3、5月份中, 深澳湾龙须菜对CO2的固定分别占总固定量的: 62.90%、71.19%和52.20%, 4月浮游植物成了优势种, 龙须菜在低CO2, 高O2的条件下, 进行光呼吸作用, CO2的固定由浮游植物起主导作用。
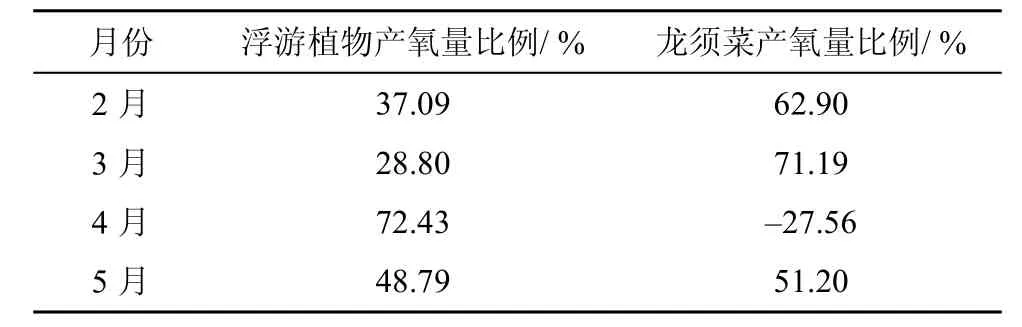
表5 2015年2—5月深澳湾浮游植物和龙须菜产氧量Tab.5 Oxygen produced by phytoplankton and G.lemaneiformis from Feb to May 2014 in Shenao Bay
虽然龙须菜的生物量是逐月增长的, 但 5月产氧贡献率比3、4月都少。龙须菜挂养深度会随生物量的增加而自动加深, 接收的光照变弱, 且团簇的龙须菜仅表面接收到光照, 团簇内部藻体同样进行光呼吸作用, 这影响后期龙须菜的固碳贡献率。从图4可见2月深澳湾作为CO2的汇区, 但是强度很低, 3、5月作为CO2的源, 强度也较弱, 4月发生赤潮, 浮游植物数量多, 面积广, 使深澳湾变为CO2的强汇区。
4 总结
本文着重于对海藻碳汇估算方法的摸索讨论,尝试用新的途径解释海区 CO2的变动情况, 这将为我们在大面积评价海区是CO2的源区或汇区提供一个可借鉴的方法。根据2014年2—5、7月深澳湾的调查结果, 表明深澳湾的龙须菜以汇的角色存在,使海区pCO2分区明显, 同时龙须菜养殖对pCO2的作用效果会影响到其他养殖区域, 但由于外部环境的干扰, 龙须菜作用下的深澳湾作为汇的角色并不十分显著。据报道在实际的海藻生态系统中, 附生生物的贡献在海藻场生态系统中仅次于支持生物,可以为海藻场生态系统提供高达 30% 的生物生产力和30%的生物多样性[29]。本实验中赤潮爆发时浮游植物对 CO2的吸收上远超过龙须菜, 但是龙须菜的后期会被从海区移走而浮游植物则会死亡分解,所浮游植物固定的 CO2又会重新回到海区, 因此还需从龙须菜自身角度去评估碳汇作用。
虽然龙须菜的养殖能够固定 CO2, 并在收获的时候从海区移走, 但由于深澳湾面积小, 空气、海水的流动性较强, 难以直接从海区的检测数据估算龙须菜养殖对大气 CO2的影响, 该碳汇估算方法还需从物理、化学、生物等多方面做进一步研究和优化。
[1]CHEN T A C, BORGES A V.Reconciling opposing views on carbon cycling in the coastal ocean: Continental shelves as sinks and near-shore ecosystems as sources of atmospheric CO2[J].Deep Sea Research Part II Topical Studies in Oceanography, 2009, 56(8-10): 578–590.
[2]FRANKIGNOULLE M, BORGES A V.European continental shelf as a significant sink for atmospheric carbon dioxide[J].Global Biogeochemical Cycles, 2001, 15(3):569–576.
[3]THOMAS H, BOZEC Y, ELKALAY K, et al.Enhanced open ocean storage of CO2from shelf sea pumping[J].Science, 2004, 304(5701): 1005–1008.
[4]LIU K K, ATKINSON L, CHEN C T A, et al.Exploring continental margin carbon fluxes on a global scale[J].Eos Transactions American Geophysical Union, 2000,81(52):641–644.
[5]张继红, 方建光, 唐启升.中国浅海贝藻养殖对海洋碳循环的贡献[J].地球科学进展, 2005, 20(3):359–365.
[6]张学成, 费修绠.全国水产原良种审定委员会审定品种——981龙须菜及其栽培技术介绍[J].科学养鱼, 2008, (6):21–22.
[7]彭长连, 温学, 林植芳, 等.2007.龙须菜对海水氮磷富营养化的响应[J].植物生态学报, 31(3): 505–512.
[8]王兆礼, 张汉华, 朱长波, 等.深澳湾养殖生态系统服务功能价值评估[J].海洋环境科学, 2014, 33(3): 378–382.
[9]王亮根, 杜虹, 陈伟洲, 等.深澳湾浮游植物群落特征及其多样性研究[J].生态科学, 2010, 29(3): 200–206.
[10]GB/T 12763.4—2007, 海洋调查规范, 第 4部分: 海水化学要素调查[S].
[11]GB/T 17378.4—2007, 海洋监测规范, 第4部分: 海水分析[S].
[12]MILLERO F J.Thermodynamics of the carbon dioxide system in the oceans[J].Geochimicaet Et Cosmochimica Acta, 1995, 59(4): 661–677(17).
[13]鲍永恩.辽宁省沿海温、盐度对海水溶解氧浓度的影响和换算[J].海洋环境科学, 1983, 2(3): 82–86.
[14]熊孝先, 刘明星, 王玉英, 等.膠州湾盐度与氯度关系式[J].科学通报, 1959, 4(4): 128–128.
[15]谢玲, 李海燕, 徐华兵, 等.深澳湾海水养殖生态系统健康评价[J].生态学杂志, 2014, 33(5):1233–1242.
[16]戴民汉, 魏俊峰, 翟惟东.南海碳的生物地球化学研究进展[J].厦门大学学报(自然科学版), 2011, 40(2): 545–551.
[17]张远辉, 黄自强, 王伟强, 等.台湾海峡二氧化碳研究[J].应用海洋学学报, 2000.19(2): 163-169.
[18]王首吉, 杜虹, 梅志平, 等.春季深澳湾龙须菜固碳量及其影响因素[J].海洋环境科学, 2016(3).
[19]DAVISON I R.Environmental effects on algal photosynthesis: temperature[J].Journal of Phycology, 1991, 27(1):2–8.
[20]BJORNSARER B R, WHEELER P A.Effect of nitrogen and phosphorous supply on growth and tissue composition of Ul-va fenestrate and Enteromorpha in testinalis (Ulvales,Chorophyta) [J].Journal of Phycology, 1990, 26(4): 603–611.
[21]LAPOINTE B E.The effects of light and nitrogen no growth, pigment content and biochemical composition ofGracilaria foliferav.angustissima(Gigartinales, Rhodophyta).J Phycol[J].Journal of Phycology, 2008, 17(1):90–95.
[22]WEISS R F.Carbon dioxide in water and seawater: the solubility of a non-ideal gas[J].Marine Chemistry, 1974, 2:203–215.
[23]谭燕, 张龙军, 王凡, 等.夏季东海西部表层海水中的pCO2及海-气界面通量[J].海洋与湖沼, 2004, 35(3):239-245.
[24]BOTO K G, BUNT J S.Dissolved oxygen and pH relationship in northern Australian mangrove waterways[J].Limnology & Oceanography, 1981, 26(6): 1176–1178.
[25]高坤山.藻类光合固碳的研究技术与解析方法[J].海洋科学, 1999, (6): 37–41.
[26]KAMEL H, CATHERINE COLAS F S, MIZUKI T, et al.The pentatricopeptide repeat protein OTP87 is essential for RNA editing of nad7 and atp1 transcripts in Arabidopsis mitochondria.[J].Journal of Biological Chemistry, 2011,286(24): 21361–71.
[27]BOŻENA SZAL, ANNA PODGÓRSKA.The role of mitochondria in leaf nitrogen metabolism[J].Plant Cell &Environment, 2012, 35(10): 1756–1768.
[28]温金艳.缺氮及氮恢复对龙须菜内源氨氮代谢影响的研究[D].汕头: 汕头大学, 2016.
[29]KOMATSU T, MIKAMI A, SULTANA S, et al.Hydroacoustic methods as a practical tool for cartography of seagrass beds[J].Otsuchi Marine Science, 2003, 28: 72–79.
The influence of the cultivation of Gracilaria lemaneiformis on the pCO2in surface waters of Shenao Bay
WANG Shouji1, DU Hong2,*ZHANG Qingfang2, CHEN Yang2, MEI Zhiping1, CHEN Weizhou1
1.Marine Biology Institute,Shantou University,Shantou515063,China2.Biology Department,Shantou University,Shantou515063,China
Based on the investigation of total alkalinity (TA) and pH in the surface waters from in Shenao Bay Feb to May 2014 and July 2014, combined with hydrological characteristics, weather conditions, cultivation environment and other parameters, the influence of the cultivation ofGracilaria lemaneiformison spatial distribution characteristics of the parameters of CO2in Shenao Bay was discussed.The main purpose of this paper is to discuss the calculation method of CO2balance in sea area.The results showed that Shenao Bay was a CO2sink area in Feb, April and July 2014, and a CO2source region in March and May.In comparison to phytoplankton, the rates of contribution to absorb CO2byG.lemaneiformiswere respectively 62.90%, 71.19% and 52.20% in Feb, March and May.When red tide occurred in April, the content of chl-awas as high as 16.65 μg·L–1.Meanwhile, the photorespiration ofG.lemaneiformisbecame stronger.G.lemaneiformisabsorbed O2and released CO2.Phytoplankton became the dominant creatures.The contribution of phytoplankton to absorb CO2was significantly bigger than that ofG.lemaneiformis.Through regional comparison, it is found that the pCO2and DIC inGlemaneiformisculture zones were lower than those in non-culture zones.Compared with fish, shellfish culture zones, algae culture zones are more likely to be CO2sink area.
Glemaneiformis; phytoplankton; pH of sea water; total alkalinity of sea water; surface CO2partial pressure
10.14108/j.cnki.1008-8873.2017.05.020
P76, Q178.1
A
1008-8873(2017)05-152-08
王首吉, 杜虹, 张清芳, 等.龙须菜养殖对深澳湾表层水体pCO2的影响[J].生态科学, 2017, 36(5): 152-159.
WANG Shouji, DU Hong, ZHANG Qingfang, et al.The influence of the cultivation ofGracilaria lemaneiformison the pCO2in surface waters of Shenao Bay[J].Ecological Science, 2017, 36(5): 152-159.
2016-09-01;
2017-03-03
广东省海洋与渔业局科技推广专项项目(A201405B06); 海洋公益性行业科研专项(201105008-9)
王首吉(1990—), 男, 硕士, 主要从事海洋生态研究, E-mail: 13sjwang2@stu.edu.cn
*通信作者:杜虹, 女, 博士, 教授, 主要从事海洋学研究, E-mail: hdu@stu.edu.cn

