脱酰胺对葵花籽蛋白酶解肽的钙结合量及体外消化性的影响
袁兴宇 冯文君 包小兰
(内蒙古农业大学食品科学与工程学院,呼和浩特 010018)
脱酰胺对葵花籽蛋白酶解肽的钙结合量及体外消化性的影响
袁兴宇 冯文君 包小兰
(内蒙古农业大学食品科学与工程学院,呼和浩特 010018)
通过谷氨酰胺酶对葵花籽蛋白酶解肽进行脱酰胺,得到脱酰胺的葵花籽蛋白酶解肽,以此为试样,研究脱酰胺对葵花籽蛋白酶解肽的钙结合能力的影响。结果发现,脱酰胺的葵花籽蛋白酶解肽的钙结合量由72.97 mg/g显著增加到98.20 mg/g,说明脱酰胺可以显著提高葵花籽蛋白酶解肽的钙结合量;通过傅立叶红外光谱对脱酰胺前后葵花籽蛋白酶解肽的钙结合位点进行分析,发现葵花籽蛋白酶解肽与钙结合后,氨基的特征吸收峰均发生移动,N-H的伸缩振动带由3 323 cm-1移动至3 340 cm-1,酰胺Ⅱ带由1 160 cm-1移动至1 656 cm-1,酰胺Ⅲ带由1 241 cm-1移动至1 246 cm-1,同时脱酰胺使其酰胺Ⅰ带由1 660 cm-1移动至1 656 cm-1,说明葵花籽蛋白酶解物肽链上的氨基及羧基是钙的主要结合位点,且脱酰胺后C=O伸缩振动引起的酰胺Ⅰ带进一步向低频移动,表明脱酰胺后羧基上的氧原子与钙的配位作用得到增强,促进了葵花籽蛋白酶解肽钙结合量的提高;另一方面研究还发现体外消化后脱酰胺的葵花籽蛋白酶解肽钙复合物的钙结合量能保持86%以上,与未脱酰胺的花籽肽钙复合物相比消化后的钙结合量提高24%以上。表明脱酰胺能够显著提高葵花籽蛋白酶解肽钙复合物的消化稳定性,即提高葵花籽蛋白酶解肽的钙结合稳定性。
葵花籽蛋白酶解肽 钙结合能力 脱酰胺 消化稳定性
前期研究发现,葵花籽蛋白酶解肽肽链上的羧基及氨基与钙离子结合形成水溶性复合物[1],如何进一步提高葵花籽蛋白酶解肽的钙结合量及其稳定性对其促进人体钙吸收的研究具有重要意义。有研究表明,通过谷氨酰胺酶对大豆蛋白酶解肽进行脱酰胺处理,可以显著提高大豆蛋白酶解肽的钙结合量及钙结合稳定性,提高其对胃蛋白酶及胰蛋白酶的消化的抑制能力[2]。葵花籽蛋白酶解肽与大豆酶解肽均是重要的植物性蛋白来源的多肽,谷氨酰胺酶是否也会对葵花籽蛋白酶解肽的钙结合能力及消化稳定性产生影响还尚不清楚。
本研究探讨了脱酰胺对葵花籽蛋白酶解肽钙结合量及结合稳定性的影响,以期为进一步探究葵花籽蛋白酶解肽对促进人体钙吸收作用提供参考。
1 材料与方法
1.1 原料与试剂
葵花籽分离蛋白:自制;Protease M(51.5 AU/g,粉体)、谷氨酰胺酶:日本天野酶制剂株式会社;氢氧化钠、盐酸、无水氯化钙、醋酸、醋酸钠、磷酸氢二钠等:国药集团化学试剂有限公司。
1.2 主要仪器与设备
AL204电子天平:梅特勒-托利多仪器有限公司;HJ-6电热恒温水浴锅:金坛市城西春兰仪器厂;PB-10酸度计:赛多利斯科学仪器北京有限公司;MS-H280-PRO恒温加热磁力搅拌器:大龙兴创实验仪器有限公司;SC-3612低速离心机:安徽中科中佳科学仪器有限公司;LGJ-25C冷冻干燥机:北京四环科技有限公司;BCD-223MTX新飞冰箱:河南新飞电器有限公司;HJ-1磁力搅拌器:金坛市荣华仪器制造公司。
1.3 试验方法
1.3.1 葵花籽蛋白酶解肽的制备
称取1g葵花籽分离蛋白于烧杯中,加入50 mL蒸馏水,用1 mol/L HCl调节pH至3,放入50 ℃恒温水浴锅中加入0.01 g protease M。酶解温度保持50 ℃,酶解时间60 min。酶解后90 ℃水浴灭酶10 min。冷却至室温,3 000 r/min离心20 min后取上清液,用1 mol/L NaoH调节pH至7.4后冷冻干燥备用。
1.3.2 水解度的测定[3]
将水解液定容至50mL,吸取20 mL样品2份,分别置于烧杯中,加水50 mL,用0.05 mol/L NaOH标准溶液滴定至pH 8.2。加入10 mL中性甲醛溶液,混匀,再用0.05 mol/L NaOH标准溶液滴定至pH 9.2,记录消耗NaOH标准溶液体积,同时做空白对照试验[3]。水解度测定结果计算公式:
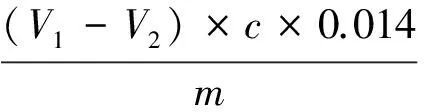
式中:V1为空白试剂加入甲醛后滴定消耗的氢氧化钠标准溶液的体积/mL;V2为测定样品加入甲醛后消耗的氢氧化钠标准溶液的体积/mL;c为氢氧化钠标准溶液的浓度/mol/L;V3为水解液总体积/mL;V4为滴定用水解液的体积/mL;
1.3.3 葵花籽蛋白酶解肽的脱酰胺的方法
将葵花籽蛋白酶解肽配置成2 %溶液,在pH 7.0、温度为50 ℃的条件下添加谷氨酰胺酶(E/S=1/50)进行酶解,在反应时间为0、1、2、3、4h时分别取样,真空冷冻干燥备用[4-5]。
1.3.4 葵花籽蛋白酶解肽脱酰胺率的测定方法[6]
称取样品0.05 g于螺口培养管中,加入5 mL、3 mol/L盐酸,放入110 ℃烘箱中,3 h后取出。然后取康威氏皿,在中央内室加入2 %硼酸3 mL和指示剂1滴,在外室一侧加入处理好的样品2 mL,另一侧加饱和K2CO3溶液3 mL,将康威氏皿放入30 ℃恒温箱中,36 h后取出。最后用0.01 mol/L HCL滴定内室吸收液,以蓝紫色为终点。脱酰胺率的计算公式如下:
脱酰胺率=

1.3.5 脱酰胺葵花籽蛋白酶解肽钙复合物的制备及钙结合量的测定
称取脱酰胺后的葵花籽蛋白酶解肽溶解于蒸馏水中,在37 ℃水浴中放置10 min,使其充分溶解。然后加入0.06 mol/L的CaCl2溶液,反应30 min后,离心(4 500 r/min,20 min)去除沉淀。取上清液加入到透析袋(MWCO:500 u,10 cm×31 mm)中,将透析袋用专用夹夹紧,转移到装有蒸馏水的烧杯中,在冰箱内(4 ℃)用磁力搅拌器进行透析,以除去酶解物中没有结合的游离钙。透析过程中每4 h更换一次透析液,持续透析48 h,取部分样品冷冻干燥,即为葵花籽蛋白酶解肽钙复合物。其余样品移到25 mL容量瓶中,透析袋用蒸馏水冲洗3次,定容到30 mL,采用原子吸收光谱法测定透析液中钙的含量。
1.3.6 傅里叶变换红外光谱分析[7]
称取微量冻干粉样品放于金刚石窗片上,压平后用Nic-Plan 红外显微镜(美国Nicolet公司)在Magna-IR 750傅里叶变换红外光谱仪检测,扫描64次,分辨率为4 cm-1。
1.3.7 脱酰胺葵花籽蛋白酶解肽的肽钙复合物的消化试验
胃蛋白酶消化试验:将脱酰胺的葵花籽蛋白酶解肽肽钙复合物配制成0.5%(m/V)的溶液,用1 mol/L的HCl将溶液的pH调到2.0,加入1%(E/S)的胃蛋白酶在37 ℃条件下进行消化,消化到120 min时分别取出样品,在沸水中加热5 min灭酶,转移至透析袋(MWCO:500 u)中,然后透析。透析48 h,分别收集透析液,测定其钙含量。
胰蛋白酶消化试验:将上述经胃蛋白酶消化后的析液样品溶液用1 mol/L的NaOH将溶液的pH调到7.4,加入1%(E/S)胰蛋白酶在37 ℃条件下继续消化,消化到240 min取出样品,80 ℃加热15min灭酶,将样品转移至透析袋(MWCO:500 u)中透析48 h,分别收集透析液,测定其钙含量。
1.3.8 统计与分析
每个试验重复3次,对脱酰胺葵花籽蛋白酶解肽的钙结合能力、脱酰胺率及消化后脱酰胺蛋白酶解肽的钙结合能力的数据进行分析,利用SPSS19.0软件进行统计分析,差异显著性水平为0.05。
2 结果与分析
2.1脱酰胺对葵花籽蛋白酶解肽的钙结合量的影响
前期研究发现酶解60 min水解度为10.2 %的葵花籽蛋白酶解肽的钙结合量为72.97 mg/g,其钙结合量显著高于酶解30、90、120、150 min的酶解产物的钙结合量,因此选取酶解时间为60 min的产物进行进一步研究。以葵花籽分离蛋白为原料,采用蛋白酶protease M将其酶解60 min获得葵花籽蛋白酶解产物,进一步采用谷氨酰胺酶对其进行脱酰胺处理,在1、2、3、4 h分别取样,获得脱酰胺的葵花籽蛋白酶解产物,测定其脱酰胺率及钙结合量,结果如表1所示。

表1 葵花籽蛋白酶解肽的脱酰胺率及钙结合量
结果发现,葵花籽蛋白酶解肽的钙结合能力随着脱酰胺时间及脱酰胺率的增加得到了显著的提高,在脱酰胺时间为180 min、脱酰胺率为20.42%时其钙结合量达到97.37 mg/g。继续延长脱酰胺时间,葵花籽蛋白酶解肽的脱酰胺率及钙结合量无显著变化(P<0.05)。说明脱酰胺可以提高葵花籽蛋白酶解肽的钙结合量。脱酰胺反应是一种肽分子修饰及改性的重要手段,通过谷氨酰胺酶将蛋白质或肽侧链上的酰胺基团脱去转变为羧基的反应[8],能增加金属离子与肽的结合位点[9]。前期研究发现,大豆肽与钙的结合位点主要是其肽链上天冬酰胺及谷氨酰胺上的羧基,经过脱酰胺处理后可提高大豆肽的钙结合量[10],大豆肽脱酰胺后钙结合量增加的主要原因是通过脱酰胺反应使肽链上的羧基更多暴露出来,从而增加了钙的结合位点。本试验采用谷氨酰胺酶对葵花籽蛋白酶解肽进行脱酰胺,也提高了葵花籽蛋白酶肽的钙结合能力,说明脱酰胺可以提高大豆肽、葵花籽肽等植物蛋白来源多肽的钙结合量。
由先前试验可知,脱酰胺可以显著提高葵花籽蛋白酶解肽的钙结合能力,但葵花籽蛋白酶解肽与钙的具体结合位点及脱酰胺对其产生的影响依然尚未明确。肽链上不同基团由于分子伸缩振动、变形振动在红外光谱中会形成特征吸收峰,可以反映有机配体与金属离子螯合的结合信息[11]。通过傅里叶变换光谱红外对脱酰胺的葵花籽蛋白酶解肽进行分析,明确其结合机制。结果如表2、图1所示。

表2 脱酰胺后葵花籽蛋白酶解肽及其肽钙复合物的中红外光谱
注:酶解物字母含义与图1一致。

注:A表示未加钙的葵花籽蛋白酶解物;B表示加钙反应的葵花籽蛋白酶解物;C表示加钙反应的脱酰胺率为15.18%葵花籽蛋白酶解肽;D表示加钙反应的脱酰胺率21.17%的葵花籽蛋白酶解肽。图1 葵花籽蛋白酶解肽及其肽钙复合物的中红外光谱

2.2脱酰胺对葵花籽蛋白酶解肽钙复合物消化稳定性的影响
研究食物源蛋白质派生出来的肽的生理活性,需要证明食物蛋白质在消化道中是否被消化道中的蛋白酶消化,形成游离状态的小分子肽[12],如果是消化道中的蛋白酶以外的蛋白酶酶解得到的肽及还需要明确对消化道中的蛋白酶的耐受性[13],研究发现肽钙复合物通过消化系统在小肠中直接被小肠刷状缘细胞吸收到细胞或血液中,提高钙在机体内的生物利用率[14],因此研究肽钙复合物对胃蛋白酶及胰蛋白酶的消化稳定性具有重要的意义。本次主要研究脱酰胺对葵花籽蛋白酶解肽钙复合物消化稳定性及其钙结合量的影响。蛋白质在胃里消化是胃蛋白的最佳pH为1~2,在十二指肠消化时里胰蛋白酶的最佳pH为7~8。食物在胃里半排空的时间是0.5~3 h,在十二指肠、空肠的驻留时间是2~2.7 h[15],因此,为了更好的模拟体内消化道环境,采用体外胃蛋白酶和胰蛋白酶水解模式来模拟消化道环境[16],确定消化时间为胃蛋白酶消化2 h,胰蛋白酶消化2 h[17],对脱酰胺化的可溶性葵花籽蛋白酶解肽钙复合物作消化处理,测定处理前后的钙结合量,结果如表3、表4所示。
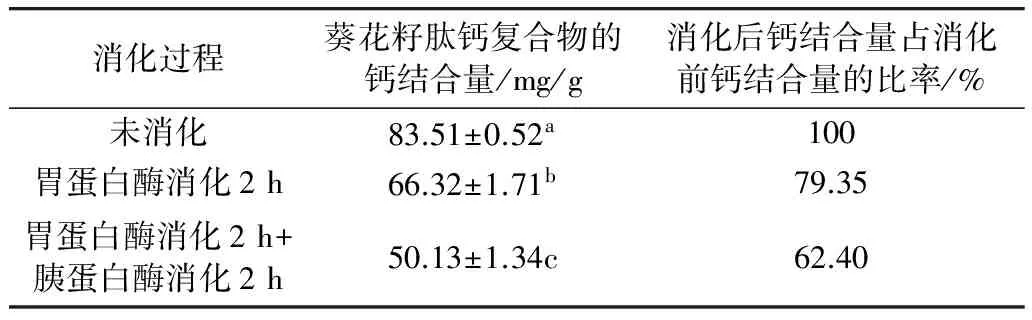
表3 胃蛋白酶、胰蛋白酶消化不同时间的葵花籽蛋白酶解肽钙复合物的钙结合量

表4 胃蛋白酶、胰蛋白酶消化不同时间的脱酰胺葵花籽蛋白酶解肽钙复合物的钙结合量
从表3、表4中可以看出,经胃蛋白酶及胰蛋白酶消化后,脱酰胺的葵花籽蛋白酶解肽钙复合物的钙结合量能保持86 %以上,与未脱酰胺的葵花籽蛋白酶解肽钙复合物相比消化后的钙结合量提高了24%,且显著高于未脱酰胺的葵花籽蛋白酶解肽钙复合物的钙结合量的保持率(P<0.05)。前期研究发现,钙离子易与氨基酸羧基配位,与氮配位原子作用较弱,谷氨酰胺和天冬酰胺同时含氧、氮配位原子[18],脱酰胺后肽链上的氮配位原子减少而含氧配位原子增加,使肽链上的羧基与钙的结合位点增加,钙结合能力更强,从而提高其消化稳定性。结果表明脱酰胺能够提高葵花籽蛋白酶解肽钙复合物的抵抗胃蛋白酶及胰蛋白酶消化的能力;脱酰胺可以提高葵花籽蛋白酶解肽的钙结合稳定性。
3 结论
3.1 葵花籽蛋白酶解肽的钙结合能力随着脱酰胺时间及脱酰胺率的增加得到了显著的提高,表明脱酰胺可以提高葵花籽蛋白酶解肽的钙结合量。通过傅立叶红外光谱对葵花籽蛋白酶解肽的钙结合位点进行分析,表明葵花籽蛋白酶解物肽链上的氨基及羧基是钙的主要结合位点,且脱酰胺后C=O伸缩振动引起的酰胺Ⅰ带进一步向低频移动,表明脱酰胺后羧基上的氧原子与钙的配位作用得到增强,促进了葵花籽蛋白酶解肽钙结合量的提高。
3.2 通过胃蛋白酶及胰蛋白酶消化试验,表明脱酰胺可以提高葵花籽肽钙复合物对胃蛋白酶和胰蛋白酶消化的抑制作用,即提高了葵花籽蛋白酶解肽的钙结合稳定性。
[1]冯文君. 葵花籽和花生蛋白酶解肽的钙结合特性及结构表征[D]. 内蒙古农业大学, 2015
Feng W J. Sunflower seeds and peanuts peptide calcium binding characteristics and structural characterization of protease solution [D]. Inner Mongolia Agricultural University, 2015
[2]包小兰.大豆肽与钙结合形成可溶性复合物的机制及其稳定性的研究[D].北京:中国农业大学,2007:38-52
Bao X L. Soy peptide combined with calcium formation mechanism and stability of soluble compounds research [D]. Beijing: China Agricultural University, 2007:38-52
[3]赵新准.蛋白质水解物水解度的测定[J].食品科学.2008(11):65-68
Zhao X Z. The determination of protein hydrolysate hydrolyzed degree [J]. Journal of Food Science. 2008(11):65-68
[4]Kato A, Tanaka A, Matsudomi N, et al. Deamidation of food proteins by protease in alkaline pH[J]. Journal of Agricultural and Food Chemistry, 1987, 35(2):224-227
[5]Jin D H, Zhang Y, Suzuki Y, et al. Inhibitory effect of protein hydrolysates on calcium carbonate crystallization.[J]. Journal of Agricultural and Food Chemistry, 2000, 48(11):5450-4
[6]Li L, Qiang Z, Selomulya C, et al. The effect of deamidation on the structural, functional, and rheological properties of glutelin prepared from Akebia trifoliata, var. australis, seed[J]. Food Chemistry, 2015, 178:96-105
[7]Chylińska M, Szymańskachargot M, Kruk B, et al. Study on dietary fibre by Fourier transform-infrared spectroscopy and chemometric methods.[J]. Food Chemistry, 2016, 196:114-122
[8]Matsudomi N, Kato A, Kobayashi K. Conformation and Surface Properties of Deamidated Gluten[J]. Agricultural and Biological Chemistry, 1982, 46(6):1583-1586
[9]李丹, 赵新淮. 酪蛋白的谷氨酰胺酶水解及其产物的金属离子螯合能力[J]. 食品与发酵工业, 2010(11):21-25
Li D, Zhao H X. Glutamine enzyme hydrolysis of casein and its product of metal ion chelating ability [J]. Journal of food and fermentation industry, 2010 (11) : 21-25
[10]Bao X L, Lv Y, Yang B C, et al. A Study of the Soluble Complexes Formed during Calcium Binding by Soybean Protein Hydrolysates[J]. Journal of Food Science, 2008, 73(3):117-21
[11]Voort F R V D. Fourier transform infrared spectroscopy applied to food analysis[J]. Food Research International, 1992, 25(5):397-403
[12]Madalena D A,scar L. Ramos, Pereira R N, et al.Invitrodigestion and stability assessment of β-lactoglobulin/riboflavin nanostructures[J]. Food Hydrocolloids, 2016, 58:89-97
[13]Syal K, Tadala R. Modifications in trypsin digestion protocol for increasing the efficiency and coverage.[J]. Protein and Peptide Letters, 2015, 22(4):372-8
[14]Nie R Y, Liu Y J, Liu M, et al. Study on the stability of peptide-calcium complex from tilapia scale protein hydrolysates[J]. Science and Technology of Food Industry, 2014
[15]Huo Y J, Wang B, Guo S S, et al. Antioxidant activity and bioavailability of the Pacific cod meat peptides during simulated gastrointestinal digestion and absorption[J]. Science and Technology of Food Industry, 2016
[16]Vermeirssen V, Van C J, Decroos K, et al. The impact of fermentation andinvitrodigestion on the formation of angiotensin-I-converting enzyme inhibitory activity from pea and whey protein.[J]. Journal of Dairy Science, 2003, 86(2):429-38
[17]Wang W, Zhao G, Han Q. Study on the optimum condition of soybean digested by pepsin-trypsininvitro[J]. China Feed, 2009
[18]Zachariou M, Hearn M T W. Protein selectivity in immobilized metal affinity chromatography based on the surface accessibility of aspartic and glutamic acid residues.[J]. Journal of Protein Chemistry, 1995, 14(6):419-30.
Effect of Deamidation of Sunflower Seed Protein Peptide on Amount of Calcium andinvitroDigestibility
Yuan Xingyu Feng Wenjun Bao Xiaolan
(College of Food Science and Technology, Inner Mongolia Agricultural University, Huhehaote 010018)
Sunflower seed protein peptide of deamidation, which is prepared by deamidation of sunflower seed protein peptide using glutaminase, was the objects of research on effect of deamidation of sunflower seed protein peptide on Amount of Calcium. The results showed that the amount of calcium of deamidation of sunflower seed protein peptide increased from 72.97 mg/g to 98.20 mg/g significantly. The deamidation of the sunflower tryptic peptide samples was analyzed by Fourier infrared spectrum. Amino characteristic absorption peaks were moved. The N—H stretching vibration band were moved from 332 3 cm-1to 334 0 cm-1.The amide Ⅱ band were moved from 116 0 cm-1to 165 6 cm-1.The amide III band were moved from 124 1 cm-1to 124 6 cm-1.The deamidation cause the amide I band were moved from 166 0 cm-1to 165 6 cm-1. The results showed that the Amino and carboxyl groups on the peptide chain of Sunflower seed protein peptide were mainly calcium binding sites. The C=O stretching vibration caused by the amide I band further to the low frequency shift after deamidation. It showed that the coordination of oxygen atoms and calcium in the carboxyl group was enhanced, which promoted the increase of the calcium binding capacity of the sunflower seed protein. On the other hands, the study also found that deamidation of sunflower seed protein peptide calcium complexes had high maintain ability to calcium binding amount more than 86% which was increased more than 24% obviously compared with sunflower seed protein peptide calcium complexes. The results showed that the digestion stability of sunflower seed peptide calcium complex substance was enhanced by deamidation and the calcium binding stability of sunflower seed peptide was increased.
sunflower seed protein peptide, amount of calcium, glutaminase, digestion stability
TS201.2
A
1003-0174(2017)10-0073-05
国家自然科学基金地区科学基金(31460404)
2016-08-30
袁兴宇,男,1992年出生,硕士,粮食油脂及植物蛋白工程
包小兰,女,1969年出生,副教授,植物蛋白加工利用

