α-生育酚壳聚糖纳米粒的制备、表征及体外缓释抗氧化性能
陈文彬,严文静,徐幸莲,章建浩*
(国家肉品质量与安全控制工程技术研究中心,农业部畜产品加工与质量控制重点开放实验室,江苏省肉类生产与加工质量安全控制协同创新中心,南京农业大学食品科技学院,南京 210095)
α-生育酚壳聚糖纳米粒的制备、表征及体外缓释抗氧化性能
陈文彬,严文静,徐幸莲,章建浩*
(国家肉品质量与安全控制工程技术研究中心,农业部畜产品加工与质量控制重点开放实验室,江苏省肉类生产与加工质量安全控制协同创新中心,南京农业大学食品科技学院,南京 210095)
α-生育酚作为天然抗氧化剂和营养强化剂被广泛应用于食品领域,但由于其对氧气、光照、金属离子等环境敏感,易快速失活,且不溶于水,极大地限制了其应用范围。本研究采用乳化-离子凝胶两步法制备α-生育酚壳聚糖纳米粒,将α-生育酚进行包埋。以颗粒平均粒径、多分散系数、表面电位为参考指标,通过单因素及正交试验考察壳聚糖(chitosan,CS)质量浓度、α-生育酚质量浓度、CS与三聚磷酸钠(sodium tripolyphosphate,TPP)质量比、pH值、搅拌速率等因素对纳米颗粒平均粒径和包封率的影响,确定最优制备工艺。采用动态光散射仪、扫描电镜、傅里叶红外光谱对纳米颗粒进一步表征,并考察其体外释放性能和抗氧化效果,以期为α-生育酚在腌腊肉制品后期贮藏过中的脂质抗氧化应用提供理论基础。结果表明,α-生育酚壳聚糖纳米粒最优制备工艺条件为CS质量浓度1 mg/m L、α-生育酚质量浓度1 mg/m L、CS与TPP质量比7∶1、CS初始pH值为4.5、搅拌速率900 r/m in。所得纳米颗粒平均粒径214 nm,包封率51.65%。红外光谱表明CS与三聚磷酸钠静电吸附,生育酚被包封。扫描电镜下形态学结构大小均匀,呈规则球形。体外释放实验和抗氧化实验表明α-生育酚壳聚糖纳米粒具有缓释抗氧化作用。
α-生育酚;壳聚糖纳米粒;表征;缓释;抗氧化
纳米技术是近年来极具发展潜力的新兴技术,目前已被广泛应用于化工、电子、医药、食品等领域[1]。纳米粒是纳米技术中较为常用的载体之一,在微粒给药系统以及活性包装领域的应用研究日趋普遍。基于不同方法制备的纳米颗粒具有较好的生物相容性、靶向性和缓释性,能有效提高诸多生物活性物质的稳定性及生物利用率[2-3]。在食品领域,纳米粒已作为氨基酸、蛋白质、维生素等功能性营养助剂的新型输送载体,具有提高活性成分物理靶向性,增加其稳定性,控制其缓慢释放等优势[4]。尤其对难溶性活性成分具有良好的增溶作用,可提高其生物利用度,增强作用效果[1,5]。此外,在食品活性包装领域,纳米粒也常作为防腐剂、抗氧化剂、抑菌剂的载体制备具有抗氧化抑菌活性的缓释包装膜[6]。通过包装材料向食品中缓慢释放活性物质,具有消耗活性成分少,却能起到长效作用的优势[7]。
壳聚糖(chitosan,CS)是甲壳素脱乙酰得到的天然多糖中唯一的阳离子碱性氨基多糖,安全无毒,具有良好的生物相容性和生物降解性,可包封带负电荷高聚物药物,是一种优良的药物载体[8]。相比于蛋白、多肽、磷脂等较难大量获取的壁材,CS来源广泛,成本低廉,将其作为壁材包埋药物,其制备工艺简单,且阳离子碱性氨基可受环境pH值的影响实现所包埋药物的控制释放[9]。此外,CS本身具有较好的成膜性和广谱抗菌性,适用于可食性涂膜缓释材料的大批量制备[10]。近年来CS逐渐成为生物医学工程以及药物、基因载体等领域研究较多的材料之一,尤其是在药物的控释、缓释、靶向以及智能释药系统中的应用受到了广泛的关注[11-12]。王舒舒[13]利用离子凝胶法制备了苦丁茶多酚-壳聚糖纳米粒,增加了苦丁茶多酚的稳定性,提高了生物利用度,同时还具有缓释作用。武陶[10]通过离子凝胶法制备的山梨酸纳米防腐颗粒具有较好的稳定性和缓释性,扩大了山梨酸在肉品保鲜上的应用。Seyed等[14]用两步法制备壳聚糖纳米粒,将牛至精油包埋成纳米颗粒,起到了缓释精油活性成分的效果。壳聚糖纳米粒的主要制备方法包括乳化交联法、乳化液滴法、沉淀析出法、反相胶束法、化学修饰壳聚糖法和离子凝胶法等[15]。与其他方法相比,离子凝胶法能在温和条件下生成平均粒径几十至数百纳米的壳聚糖纳米粒,不使用有机溶剂和醛类交联固化剂,反应过程简便迅速,极具实用价值[8,16]。
α-生育酚是自然界广泛存在的脂溶性维生素,具有明显的抗氧化能力,能起到清除自由基的作用,同时还具有促进人体新陈代谢、增强机体耐力、提高免疫力、美容护肤以及抗衰老等生理功能,因此常常被作为天然抗氧化剂和营养助剂应用于食品中,美国联邦法规将其分类为公认安全的食品添加剂[17]。但是由于α-生育酚对光、氧、金属离子敏感,且不溶于水,极大地限制了其生物利用度。为此,越来越多的研究者采用纳米技术将α-生育酚之类的活性物质进行包埋,制备成纳米颗粒,达到长效缓释的作用,以提高其生物利用度[18-19]。
本研究选择α-生育酚作为被包埋的活性物质,通过乳化-离子凝胶两步法制备α-生育酚壳聚糖纳米粒(α-tocopherol chitosan nanoparticles,α-TOCCSNPs),考察影响其形成的主要因素。通过正交试验优化制备工艺,测定其包封率及缓释抗氧化性能,以期将α-TOCCSNPs应用于食品贮藏中长效抗氧化防腐保鲜。
1 材料与方法
1.1 材料与试剂
CS(脱乙酰度≥90%) 上海瑞永生物科技有限公司;三聚磷酸钠(sodium tripolyphosphate,TPP)Sigma A ldrich试剂(中国)有限公司;α-生育酚 上海阿拉丁试剂有限公司;氢氧化钠、冰乙酸等均为分析纯;所用水为超纯水。
1.2 仪器与设备
MS-01加热型磁力搅拌器 美国精骐有限公司;A lleg ra64R高速冷冻离心机 美国Beckm an公司;UV-2600紫外分光光度计 日本岛津公司;Zetasizer Nano-Zeta电位仪 英国马尔文公司;tensor27傅里叶红外光谱仪 德国布鲁克公司;evo18扫描电子显微镜德国蔡司公司。
1.3 方法
1.3.1 α-TOCCSNPs的制备
根据Hosseini等[14]和Keaw chaoon等[20]的方法稍作改动,采用乳化-离子凝胶两步法制备。
称取一定量的CS粉末,溶于体积分数1%的冰乙酸溶液室温下搅拌过夜至澄清溶液,0.45 μm微孔滤膜过滤,用1 mol/L的NaOH溶液调pH值为4.8,配制成5 mg/m L的CS溶液。根据实验设计,用超纯水将CS溶液稀释成不同质量浓度梯度后备用。
称取一定量的TPP粉末,用超纯水溶解得到与CS溶液质量浓度一一对应的浓度梯度的交联剂溶液,用0.45 μm微孔滤膜过滤,2~4 ℃冰箱保存备用。
量取一定量的CS溶液于锥形瓶中,100 W超声处理10 m in。置于恒温磁力搅拌器上,加入质量分数2%的Tween 80,60 ℃加热搅拌30 m in,得到均一溶液。
称取一定量的α-生育酚,溶于无水乙醇。配制不同质量浓度的α-生育酚溶液,缓慢加入CS溶液中,持续温和搅拌。
将制得的CS与生育酚的混合溶液置于磁力搅拌器上冰水浴搅拌,用注射器往其中逐滴加入2~4 ℃的TPP溶液,滴加速度1滴/s,温和搅拌30 m in,得到淡蓝色乳光溶液即为α-TOCCSNPs悬液。
按以上相同的步骤,往CS溶液中滴加TPP溶液,但不加入α-生育酚,即得到壳聚糖空白纳米粒(CSNPs)溶液。
1.3.2 α-TOCCSNPs理化性能表征
1.3.2.1 平均粒径、多分散系数及表面电位的测定
将在不同条件下制备得到的纳米粒溶液用马尔文纳米粒度基于动态光散射(dynam ic light scattering,DLS)原理测定仪测定其水合平均粒径、表面电位以及多分散系数。
1.3.2.2 形态学观察
通过扫描电子显微镜观察纳米粒的外观形态:取一滴悬浮液,滴于光面铝架上,自然干燥后喷金处理,置于扫描电镜样品台上,加速电压为5 kV,观察其形态。
1.3.2.3 红外光谱分析
通过傅里叶红外光谱检测分析CS、CSNPs、α-TOCCSNPs的结构变化。取CS、CSNPs和α-TOCCSNPs样品置于液体样品池中,放入样品室,使用红外目标自动识别附件扫描64 次,测定红外光谱。
1.3.3 α-生育酚包封率的测定
1.3.3.1 α-生育酚溶液标准曲线的绘制
精确称取α-生育酚50 mg,用无水乙醇溶解,定容至100 m L,配制成0.5 mg/m L的储备液。精确量取0.2、0.4、0.6、0.8、1.0 m L储备液至10 m L棕色容量瓶中,用无水乙醇定容,作为待测液。以无水乙醇为空白在292 nm波长处分别测定吸光度,得到α-生育酚吸光度与质量浓度标准曲线方程为:Y=7.594 3X-0.045 8(R2=0.999 4)。
1.3.3.2 α-TOCCSNPs包封率测定
根据Keaw chaoon等[20]所述方法,采用紫外分光光度法测定α-生育酚的含量。取100 μL α-TOCCSNPs悬液于10 m L离心管中,加入5 m L 2 mol/L HCl溶液,95 ℃煮沸30m in,冷却,加入1 m L无水乙醇混合均匀,用高速离心机在25 ℃、9 000 r/m in条件下离心5 m in。取上清液用紫外分光光度计在200~400 nm波长范围内进行光谱扫描测定,可通过α-生育酚溶液标准曲线和292 nm波长处的吸光度计算得到α-生育酚的含量。用等体积空白纳米粒悬液作为空白样以同样的方法测定。通过公式(1)计算其包封率(encapsulation efficiency,EE):

式中:m总为体系中α-生育酚的总质量/mg;m游为体系中游离的α-生育酚质量/mg。
1.3.4 纳米粒体外缓释性能分析
参照文献[20-22]所述方法,略微改动。在不同pH值的缓冲液:醋酸盐缓冲液(pH 3.5)、磷酸盐缓冲液(pH 7.4)、硼酸盐缓冲液(pH 9.18)中分别进行α-TOCCSNPs的体外缓释性能测定。取500 μL α-TOCCSNPs分散溶液于1.5 m L离心管中25 ℃、9 000 r/m in离心5 m in,取上清液,加入800 μL缓冲液重悬,室温下孵化。每隔一定时间将样品在25 ℃、9 000 r/m in离心5 m in,取800 μL上清液于10 m L离心管中,加入5 m L缓冲液,用紫外分光光度计在200~400 nm波长处扫描测定,根据α-生育酚标准曲线计算其释放量,根据公式(2)计算其累计释放率。每次取样分析后往原离心管中补充等量新鲜的缓冲液,重悬后继续孵化。

式中:Mt为每个时间点测得的α-生育酚累计释放量;t为体外释放时间;M0为初始载α-生育酚含量。
1.3.5 α-TOCCSNPs体外抗氧化性能分析
参照Esmaeili等[23]的方法进行DPPH自由基清除率测定,略微改动。将9 m L质量浓度为1 mg/m L的α-生育酚溶液与含等量α-生育酚的壳聚糖纳米粒溶液各自加入3 m L浓度为10-4m o l/L的1,1-二苯基-2-三硝基苯肼(1,1-d ipheny l-2-p ic ry lhyd razy l,DPPH)甲醇溶液得到混合液。将混合液放入暗室反应30、60、90、120、150 m in,用紫外分光光度计分别测定517 nm波长处混合液的吸光度。每个样品做6 次平行实验,取平均值。DPPH自由基清除率根据公式(3)计算:

式中:A0为空白DPPH在517 nm处的吸光度;A517nm为样品溶液在517 nm处的吸光度。
1.3.6 单因素试验和正交试验设计
1.3.6.1 单因素试验
选取因素:搅拌速率500 r/min、CS质量浓度1.5 mg/mL、TPP质量浓度1.5 mg/m L、CS与TPP质量比5∶1、α-生育酚质量浓度1.0 mg/m L、CS溶液pH 4.8,固定以上条件,考察单一因素对壳聚糖纳米粒平均粒径、表面电位及包封率的影响。各因素取值分别为CS质量浓度(0.5、1.0、1.5、2.0、2.5 mg/m L)、搅拌速率(300、500、700、900、1 100 r/m in)、pH值(3.5、4.0、4.5、5.0、5.5)、CS与TPP质量比(1∶1、3∶1、5∶1、7∶1、9∶1)、α-生育酚质量浓度(0.50、0.75、1.00、1.25、1.50 mg/m L)。
1.3.6.2 正交试验
根据单因素试验结果,选取CS质量浓度、CS与TPP质量比、pH值、α-生育酚质量浓度为主要因素,以平均粒径和包封率为评价指标进行正交试验[24-25]。
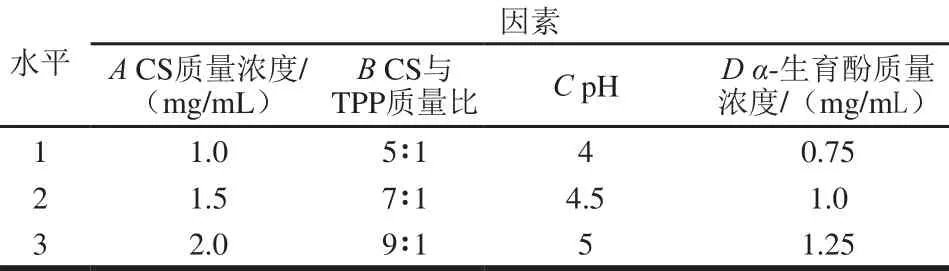
表1 L9(34)正交试验设计因素与水平Table 1 Factors and levels used in orthogonal array design
1.4 数据分析
使用统计分析软件SPSS 22.0对数据进行单因素方差分析,使用Excel 2013、Origin 2016对实验数据进行作图分析,每组实验样品测定3 次。
2 结果与分析
2.1 α-TOCCSNPs制备单因素试验结果
2.1.1 CS对纳米粒平均粒径及表面电位的影响

图1 CS质量浓度对纳米粒平均粒径及表面电位的影响Fig. 1 Effect of CS concentration on average particle size and surface potential
由图1可知,α-TOCCSNPs平均粒径及表面电位都随CS质量浓度的增加而增大。主要原因是随着CS溶液质量浓度增大,CS分子间距减小,分子间氢键作用力增强,较多的分子链间的交联增多,随后与单个TPP分子结合形成颗粒较大的粒子[26]。此外,由于CS分子的氨基质子化作用,使得溶液整体带正电荷。CS浓度越大,体系中带正电荷的分子越多,溶液表面电位呈现增大的趋势[27]。
2.1.2 CS与TPP质量比对纳米粒平均粒径及表面电位的影响

图2 CS与TPP质量比对纳米粒平均粒径及表面电位的影响Fig. 2 Effect of mass ratio betwen CS and TPP on average particle size and surface potential
由图2可知,随着CS与TPP质量比的减小,即随着TPP质量的增加,纳米粒平均粒径呈现先下降后显著上升的趋势,表面电位呈现显著减小的趋势。当CS与TPP质量比为9∶1时,少量带负电的TPP磷酸基团与过量CS分子链上带正电的质子化氨基基团结合,但是由于交联密度小,氨基结合位点未被充分结合,形成纳米颗粒较为松散。随着TPP质量的增加,体系中负电基团增多,与CS链上的氨基结合位点充分交联。当CS与TPP质量比为7∶1时,交联密度增大,同一分子链上未被结合的氨基位点被结合,链间距进一步缩小靠拢,使得纳米粒平均粒径进一步减小,形成平均粒径为152 nm单分散性较好的纳米粒子,表面电位32.2 mV,体系稳定。当TPP的质量继续增加时,CS分子链上的交联位点被充分结合,额外的磷酸基团引起更多的CS分子参与到纳米粒的交联当中,使得粒子平均粒径显著增加。当TPP多到一定程度时,粒子平均粒径已经从纳米级增加到微米级,粒子表面电荷密度无法维持体系的稳定,粒子间静电排斥力无法抵抗重力作用从而产生絮状沉淀[28]。离子表面电荷是维持体系稳定的重要因素,TPP质量的增加使得CS上的氨基被中和,表面电位显著下降。
2.1.3 pH值对纳米粒平均粒径及表面电位的影响

图3 CS溶液pH值对纳米粒平均粒径及表面电位的影响Fig. 3 Effects of initial CS solution pH on average particle size and surface potential
由图3可知,CS溶液初始pH值从3.5升到5.5,纳米粒平均粒径先下降后急剧上升,表面电位呈现显著下降趋势。CS溶液的初始pH值对于壳聚糖纳米粒的形成至关重要[28-29]。在酸性环境下,H+与CS分子链上的—NH2结合,氨基质子化形成聚电解质溶液,使得—NH3+与TPP中带负电的磷酸基团得以交联形成pH值可控的纳米颗粒。当pH值小于4.5时,强质子化作用使得CS分子链上氨基被充分质子化,溶液正电荷密度较大,表面电位较高,分子内静电排斥作用较强,CS分子链得以伸展,导致形成平均粒径稍大的α-TOCCSNPs。当pH值在4.5~5之间时,相对减弱质子化作用使得分子间排斥力减弱,正负离子交联作用大于排斥作用,纳米粒平均粒径进一步减小。在pH值为5时,平均粒径达到最小203 nm。而当pH值继续增大,CS分子中—NH3+减少,CS与TPP间的交联作用变小,易形成大颗粒絮状沉淀,溶液表面电位的持续下降导致体系稳定性显著下降。
2.1.4 搅拌速率对纳米粒平均粒径及表面电位的影响
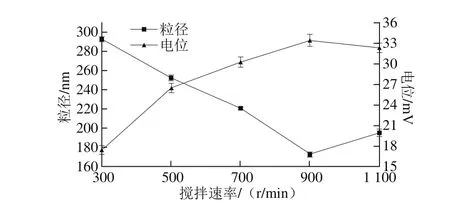
图4 搅拌速率对纳米粒平均粒径及表面电位的影响Fig. 4 Effect of stirring speed on average particle size and surface potential
由图4可知,当搅拌速率不断增大时,α-TOCCSNPs平均粒径呈现整体减小后略微增大的趋势,表面电位呈现增大的趋势。较低的搅拌速率使得通过逐滴滴加法制备的α-TOCCSNPs在交联剂TPP刚滴入CS溶液中时,无法完全分散,导致局部TPP浓度过高,易产生凝聚,形成平均粒径较大的颗粒[25]。随着搅拌速率的增大,加入的TPP液滴被分散均匀,同时部分长链CS分子也会在高搅拌速率下断裂成短链分子。从而使得CS与TPP的带电基团充分交联形成平均粒径更小的纳米颗粒。在900 r/m in转速时,颗粒平均粒径达到最小172 nm,此时表面电位为33.4 m V。当转速进一步增大时,其平均粒径有略微上升,可能是因为高转速下的高剪切力破坏了粒子间的静电排斥力及水化层阻隔,造成了粒子间的聚集,使得粒子单分散性下降[26]。此外,随着转速的增大,使得CS分子在醋酸溶液中充分溶解,质子化作用使得正电荷密度变大,最终纳米颗粒表面电位增大。
2.1.5 α-生育酚对纳米粒平均粒径及表面电位的影响
由图5可知,随着α-生育酚质量浓度的增大,纳米粒平均粒径呈整体下降后略有上升的趋势,表面电位呈下降趋势。当α-生育酚质量浓度为1.25 mg/m L时,所得纳米粒平均粒径最小,为208 nm。由于α-生育酚分子含酚羟基,其与CS分子间会形成氢键,两者的结合加上TPP的交联作用,促进了α-TOCCSNPs的形成[30]。α-生育酚质量浓度的增加,使得CS分子中更多的氨基被结合,从而在一定程度上降低了表面电位。但在一定量CS的体系中,所能形成的纳米粒数量有限。随着被包埋的α-生育酚达到饱和,剩余的α-生育酚分子吸附于纳米粒表面,一定程度上增大了颗粒水合平均粒径[31]。

图5 α-生育酚质量浓度对纳米粒平均粒径及表面电位的影响Fig. 5 Effect of α-tocopherol concentration on average particle size and surface potential
2.2 正交试验结果
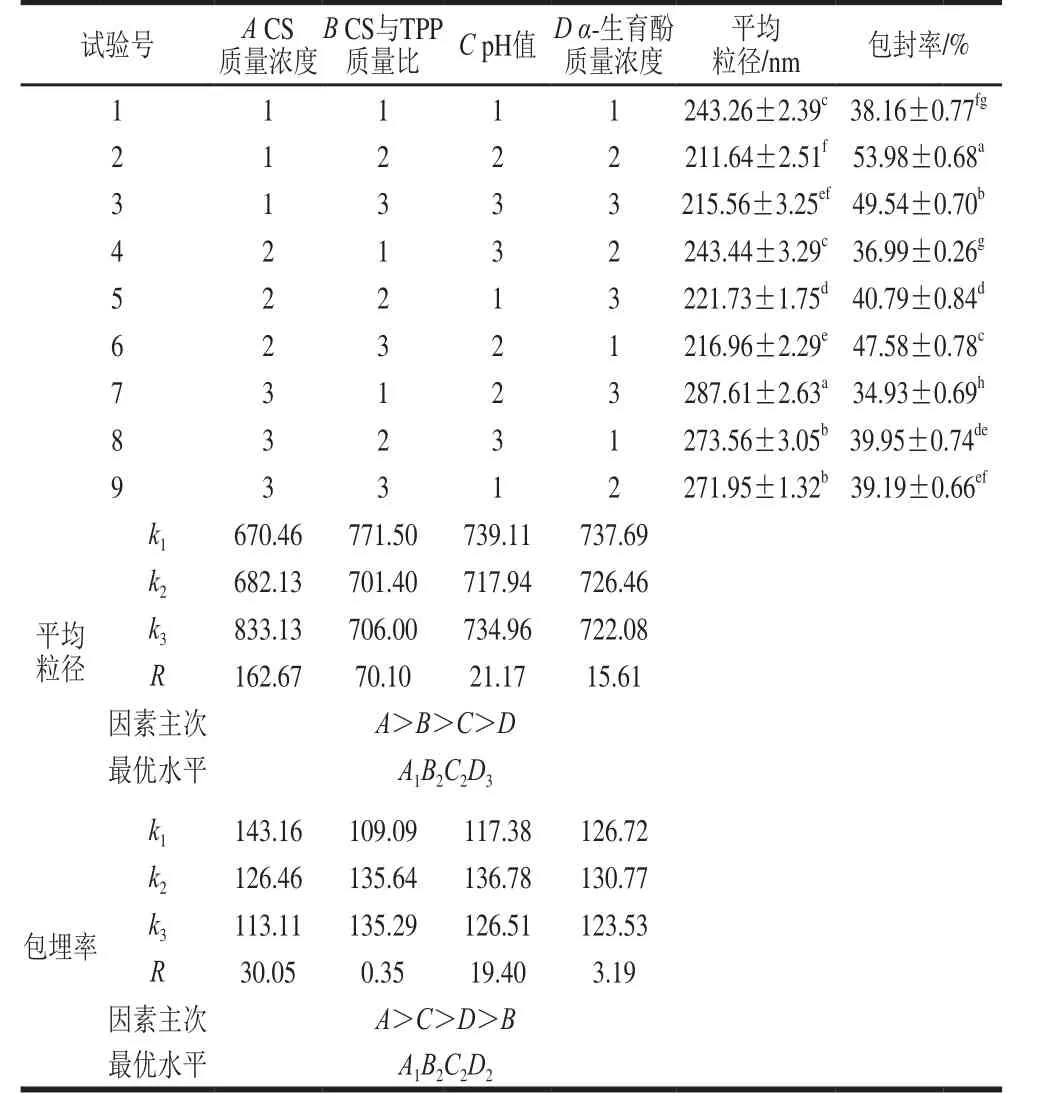
表2 正交试验设计及结果Table 2 Orthogonal array design w ith experimental results
根据表2结果,采用极差分析法分析正交试验数据。各因素对颗粒平均粒径的影响主次因素为:CS质量浓度>CS与TPP质量比>pH值>α-生育酚质量浓度。各因素对包封率影响主次因素为:CS质量浓度>pH值>α-生育酚质量浓度>CS与TPP质量比。按照平均粒径越小为优的原则,最优工艺组合为A1B2C2D3,制得的α-TOCCSNPs平均粒径约为153 nm,包封率为44.51%。按包封率越高为优的原则,最优工艺组合为A1B2C2D2,制得的α-生育酚纳米粒平均粒径约为214 nm,包封率为51.65%。为制备较高包封效果的纳米粒,最终确定选用最优工艺为A1B2C2D2,即CS质量浓度1.0 mg/m L,CS与TPP质量比为7∶1,CS初始pH值为4.5,α-生育酚质量浓度为1.0 mg/m L。
2.3 α-TOCCSNPs的表征
2.3.1 最优工艺条件下制得的纳米粒平均粒径分布及表面电位

图6 最优工艺条件下α-TOCCSNPs粒径分布图Fig. 6 Average particle size distribution of α-tocopherol-loaded chitosan nanoparticles p repared under the op timal conditions

图7 最优工艺条件下α-TOCCSNPs表面电位图Fig. 7 Zeta potential distribution of α-tocopherol-loaded chitosan nanoparticles prepared under the optimal conditions
如图6、7所示,α-TOCCSNPs平均粒径为215 nm,多分散系数为0.275,小于0.3,表面电位为31.1 m V,大于30 mV,表明在最优工艺制备条件下纳米颗粒分散性良好,粒径分布均匀,体系稳定,适用于后期研究[32-33]。
2.3.2 纳米粒扫描电镜图

图8 α-TOCCSNPs扫描电镜图Fig. 8 SEM image of α-tocopherol-loaded chitosan nanoparticles
从图8可以看到,制备的纳米颗粒接近球形,分散性良好,粒径分布均匀,与DLS测得结果一致。
2.3.3 红外光谱分析

图9 CS、CSNPs、α-TOCCSNPs红外光谱图Fig. 9 FTIR spectra of CS, CSNPs and α-TOCCSNPs
由图9可见,CS溶液、CSNPs、α-TOCCSNPs在特征峰吸收区3 000~3 500、1 500~1 700、1 000~1 500 cm-1有着不同的吸收峰。吸收峰在3 300~3 450 cm-1段与CS分子中羟基、氨基、酰胺基的伸缩振动有关[34]。CS在此处的吸收峰为3 402.15 cm-1,而在CSNPs和α-TOCCSNPs中,该峰转移到了3 346.31 cm-1和3 313.45 cm-1处,分子内、分子间氢键的作用使得伸缩振动频率向低波数方向移动,峰形变宽,表明了CS与TPP之间的氢键作用加强。α-TOCCSNPs比CSNPs多转移了32.86 cm-1,可能是α-生育酚与CS分子中未被交联的氨基基团相互作用的结果[34]。在1 500~1 700 cm-1段,CS吸收峰为1 695.52 cm-1,而CSNPs和α-TOCCSNPs的吸收峰转移到了1 637.49、1 608.75 cm-1处,表示在CSNPs和α-TOCCSNPs中,TPP的磷酸基团与CS的—NH2、—CONH2都发生了交联。在1 379.67 cm-1处,α-TOCCSNPs出现了一个小峰,是由于在α-生育酚分子的酚羟基发生面内弯曲振动所致,说明α-生育酚的—OH与CS分子间存在相互作用[35]。CS形成CSNPs和α-TOCCSNPs后还出现了1 261.47 cm-1和1 242.67 cm-1的峰,表示了C—N发生伸缩振动,说明了氨基在CSNPs和α-TOCCSNPs形成的过程中发生了交联作用。另外,在1 053.2、1 012.54 cm-1处,α-TOCCSNPs出现了C—O—C的对称拉伸,再次说明了CS与α-生育酚之间也存在相互作用,也证明了α-生育酚被成功包埋形成α-TOCCSNPs中[36]。
2.3.4 体外缓释性能

图10 不同pH值缓冲液条件下α-TOCCSNPs累计释放曲线Fig. 10 Cumulative release curve of α-tocopherol chitosan nanoparticles at different buffer pH values
缓释性能是载药纳米颗粒的重要性能指标,其可以保持活性物质在体系中缓慢释放,达到长效作用。图10中,α-TOCCSNPs在不同pH值的缓冲液环境中有着不同的缓释效果[37]。在0~12 h内,纳米粒表现出明显的突释效应,由于纳米粒表面有部分α-生育酚附着,较易从体系中释放出来,前期α-生育酚的累计释放量很高[23]。在
24 h后,纳米粒进入缓释阶段且不同pH值环境下的纳米粒呈现出不同的缓释速度。载药颗粒的药物释放分为体系瓦解、表面侵蚀、去吸附作用、扩散等阶段。因此,体系中药物释放的关键在于药物从颗粒中向外界介质扩散的过程以及聚合物基质的降解。在pH值为7.4的缓冲液中,α-生育酚缓释量明显小于在pH值为3.5和9.18缓冲液中的释放量。这是因为在酸性介质中,高浓度的H+渗透进入纳米粒,发生强质子化作用,使得质子化—NH3+之间的排斥力不断加大,最终导致纳米粒膨胀破裂,促进了α-生育酚的较大释放。而在碱性介质中,由于OH-的作用,壳聚糖链上的氨基发生较强的去质子化作用,导致CS与TPP之间的交联作用被弱化甚至消失,纳米颗粒逐步被破坏,α-生育酚得到大量的释放[23,38]。综上可得,α-TOCCSNPs是具有较好的缓释作用,且其释放量可通过pH值进行调控,达到控制释放的目的[21]。
2.3.5 体外抗氧化性能

图11 α-TOCCSNPs DPPH自由基清除率Fig. 11 DPPH free radical scavenging effect of α-tocopherol chitosan nanoparticles
由图11可得,α-生育酚和α-TOCCSNPs进行的体外DPPH自由基清除实验中,α-TOCCSNPs的自由基清除率比未包埋的α-生育酚低是因为纳米粒中的抗氧化剂释放需要一定的时间,这也印证了其具有缓释作用[39]。α-生育酚是一类与自由基能够发生快速结合的非酶类自由基清除剂。在60 m in后,α-生育酚的DPPH自由基清除率基本保持不变,说明α-生育酚已被反应完毕,失去了继续抗氧化的作用。而α-TOCCSNPs在30~150 m in内具有持续的抗氧化作用,且DPPH自由基清除率不断上升[23]。它在延长抗氧化作用时间的同时还有效地保护了抗氧化剂不被破坏,实现了α-生育酚的长效抗氧化作用[21]。
3 结 论
本研究通过乳化-离子凝胶两步法成功制备了α-TOCCSNPs,并通过正交试验优化了其制备工艺:CS质量浓度1 m g/m L,α-生育酚质量浓度1 mg/m L,CS与TPP质量比7∶1,CS初始pH值为4.5,搅拌速率900 r/m in。所得纳米颗粒平均粒径为214 nm,包封率为51.65%。此外,通过体外缓释抗氧化实验证明,α-TOCCSNPs是可受pH值调控具有缓释效果的纳米材料,可有效延长生育酚的抗氧化效果,提高其利用率,解决其在诸多应用中的环境限制,为将其应用于腌腊肉制品、果蔬等食品长效抗氧化活性包装提供较好的指导意义[40-42]。
[1] RASH ID I L, KHOSRAV I-DARAN I K. The app lications o f nanotechnology in food industry[J]. Critical Reviews in Food Science &Nutrition, 2011, 51(8): 723-730. DOI:10.1080/10408391003785417.
[2] STARK W J, STOESSEL P R, WOHLLEBEN W, et al. Industrial applications of nanoparticles[J]. Chem ical Society Reviews, 2015,44(16): 5793-5805. DOI:10.1039/C4CS00362D.
[3] M ALAM Y, LIM E J, SEIFALIAN A M. Cu rren t trends in the app lication o f nanopartic les in d rug delivery[J].Cu rren t M ed icina l Chem istry, 2011, 18(7): 1067-1078.DOI:10.2174/092986711794940860.
[4] FATHI M, MART N Á, MCCLEMENTS D J. Nanoencapsulation of food ingredients using carbohydrate based delivery systems[J]. Trends in Food Science & Technology, 2014, 39(1): 18-39. DOI:10.1016/j.tifs.2014.06.007.
[5] 李苗苗. 天然活性成分的包埋及稳定性研究[D]. 北京: 北京化工大学, 2015: 7-9.
[6] ALMEIDA A C S, PEIXOTO F M, MELO N R, et al. Application of nanothecnology in food packaging[J]. Polímeros, 2015, 25.DOI:10.1590/0104-1428.2069.
[7] 韩甜甜. 新型缓释型食品抗氧化包装膜的研发[D]. 无锡: 江南大学,2014: 7-14.
[8] 刘慧. 壳聚糖微球/纳米粒的制备及其性能研究[D]. 杭州: 浙江大学, 2007: 12-36.
[9] 王铮. pH-响应性聚氨基酸类高分子的合成及其药物控制释放研究[D].天津: 南开大学, 2011: 15-18.
[10] 武陶. 山梨酸纳米粒的制备及其在肉品保鲜上的应用[D]. 咸阳:西北农林科技大学, 2014: 6-25.
[11] MOGHANJOUGHI A A, KHOSHNEVIS D, ZARRABI A. A concise review on smart polymers for controlled drug release[J]. Drug Delivery &Translational Research, 2016, 6(3): 1-8. DOI:10.1007/s13346-015-0274-7.
[12] 高艳, 王瑄, 万明, 等. 壳聚糖微球的制备及其在药物载体中的应用[J]. 功能材料, 2015, 46(2): 2007-2012. DOI:10.3969/j.issn.1001-9731.2015.02.002.
[13] 王舒舒. 苦丁茶多酚-壳聚糖纳米微球的制备及其性能评价[D].南京: 南京农业大学, 2010: 9-28.
[14] HOSSEINI S F, ZANDI M, REZAEI M, et al. Tw o-step method for encapsulation of oregano essential oil in chitosan nanoparticles:preparation, characterization and in vitro release study[J]. Carbohydrate Polymers, 2013, 95(1): 50-56. DOI:10.1016/j.carbpol.2013.02.031.
[15] TAJM IR-RIAHI H A, NAFISI S, SANYAKAMDHORN S, et al.Applications of chitosan nanoparticles in drug delivery[J]. Methods in Molecular Biology, 2014, 1141(1141): 165-184. DOI:10.1007/978-1-4939-0363-4_11.
[16] 曾海燕. 壳聚糖纳米粒子的制备及其稳定皮克林乳液的研究[D].无锡: 江南大学, 2015: 4-18.
[17] 张婧菲, 胡志萍, 王恬. 天然维生素E及其衍生物的研究进展[J].饲料工业, 2015(8): 31-35.
[18] ARESTA A, CALVANO C D, TRAPANI A, et al. Development and analytical characterization of vitam in(s)-loaded chitosan nanoparticles for potential food packaging applications[J]. Journal of Nanoparticle Research, 2013, 15(4): DOI:10.1007/s11051-013-1592-7.
[19] QUINONES J P, GOTHELF K V, KJEMS J, et al. Self-assembled nanoparticles of modified-chitosan conjugates for the sustained release of DL-alpha-tocopherol[J]. Carbohydr Polym, 2013, 92(1): 856-864.DOI:10.1016/j.carbpol.2012.10.005.
[20] KEAWCHAOON L, YOKSAN R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles[J].Co lloids Surfaces B: Bioin terfaces, 2011, 84(1): 163-171.DOI:10.1016/j.colsurfb.2010.12.031.
[21] ALISHAHI A, M IRVAGHEFI A, TEHRANI M R, et al. Shelf life and delivery enhancement of vitam in C using chitosan nanoparticles[J].Food Chem istry, 2011, 126(3): 935-940. DO I:10.1016/j.foodchem.2010.11.086.
[22] CHO Y, K IM J T, PARK H J. Size-controlled self-aggregated N-acy l chitosan nanopartic les as a v itam in C carrier[J].Carbohydrate Polymers, 2012, 88(3): 1087-1092. DOI:10.1016/j.carbpol.2012.01.074.
[23] ESMAEILI A, ASGARI A. In vitro release and biological activities of Carum copticum essential oil (CEO) loaded chitosan nanoparticles[J].International Journal of Biological Macromolecules, 2015, 81: 283-290. DOI:10.1016/j.ijbiomac.2015.08.010.
[24] NORONHA C M, GRANADA A F, DE CARVALHO S M, et al.Op tim ization o f α-tocophero l loaded nanocapsu les by the nanoprecipitation method[J]. Industrial Crops and Products, 2013, 50:896-903. DOI:10.1016/j.indcrop.2013.08.015.
[25] 武陶, 丁武. 山梨酸纳米防腐颗粒的制备、表征及其缓释性能[J].食品科学, 2014, 35(10): 57-61. DOI:10.7506/spkx1002-6630-201410011.
[26] 范闻. 单分散壳聚糖纳米粒子的制备及其载体应用的研究[D].武汉: 湖北大学, 2011: 10-23.
[27] GAO Q, WAN A. Effects of molecular weight, degree of acetylation and ionic strength on surface tension of chitosan in dilute solution[J].Carbohydrate Polymers, 2006, 64(1): 29-36.
[28] FAN W, YAN W, XU Z, et al. Fo rm ation m echanism o f monodisperse, low molecular weight chitosan nanoparticles by ionic gelation technique[J]. Colloids Surfaces B: Biointerfaces, 2012, 90:21-27. DOI:10.1016/j.colsurfb.2011.09.042.
[29] CA I Y, LAPITSKY Y. Formation and dissolution of chitosan/pyrophosphate nanoparticles: is the ionic crosslinking of chitosan reversible? [J]. Colloids Surfaces B: Biointerfaces, 2014, 115:100-108.DOI:10.1016/j.colsurfb.2013.11.032.
[30] NAGHIBZADEH M, AMANI A, AM INI M, et al. An insight into the interactions between tocopherol and chitosan in ultrasoundprepared nanoparticles[J]. Journal of Nanomaterials, 2010, 2010: 1-7.DOI:10.1155/2010/818717.
[31] 全国芬. 肉桂精油壳聚糖纳米粒的制备及在冷却肉保藏中的应用研究[D]. 咸阳: 西北农林科技大学, 2014: 5-17.
[32] JONASSEN H, KJONIKSEN A L, HIORTH M. Stability of chitosan nanoparticles cross-linked w ith tripo lyphosphate[J].Biomacromo lecu les, 2012, 13(11): 3747-3756. DOI:10.1021/bm301207a.
[33] RAMPINO A, BORGOGNA M, BLASI P, et al. Chitosan nanoparticles: preparation, size evolution and stability[J]. International Journal of Pharmaceutics, 2013, 455(1/2): 219-228. DOI:10.1016/j.ijpharm.2013.07.034.
[34] HU B, PAN C, SUN Y, et al. Optim ization of fabrication parameters to produce chitosan-tripolyphosphate nanoparticles for delivery of tea catechins[J]. Journal of Agriculture and Food Chem istry, 2008, 56:7451-7458.
[35] LOPEZ-LEON T, CARVALHO E L, SEIJO B, et al. Physicochemical characterization of chitosan nanoparticles: electrokinetic and stability behavior[J]. Journal of Colloid & Interface Science, 2005, 283(2):344-351. DOI:10.1016/j.jcis.2004.08.186.
[36] JOSEPH J J, SANGEETHA D, GOMATHI T. Sunitinib loaded chitosan nanoparticles formulation and its evaluation[J]. International Journal o f Bio logical M acrom o lecu les, 2016, 82: 952-958.DOI:10.1016/j.ijbiomac.2015.10.079.
[37] TSAI M L, CHEN R H, BAI S W, et al. The storage stability of chitosan/tripolyphosphate nanoparticles in a phosphate buffer[J].Carbohydrate Po lymers, 2011, 84(2): 756-761. DOI:10.1016/j.carbpol.2010.04.040.
[38] GOMATHI T, GOVINDARAJAN C, ROSE H R M, et al. Studies on drug-polymer interaction, in vitro release and cytotoxicity from chitosan particles excipient[J]. International Journal of Pharmaceutics ,2014, 468(1/2): 214-222. DOI:10.1016/j.ijpharm.2014.04.026.
[39] LUO Y, ZHANG B, WHENT M, et al. Preparation and characterization of zein/chitosan complex for encapsulation of alphatocopherol, and its in vitro controlled release study[J]. Colloids Surfaces B: Biointerfaces, 2011, 85(2): 145-152. DOI:10.1016/j.colsurfb.2011.02.020.
[40] SIRIPATRAWAN U, NOIPHA S. A ctive film from chitosan incorporating green tea extract for shelf life extension of pork sausages[J].Food Hyd roco lloids, 2012, 27(1): 102-108. DOI:10.1016/j.foodhyd.2011.08.011.
[41] ZAMBRANO-ZARAGOZA M L, MERCADO-SILVA E, DEL REAL L A, et al. The effect of nano-coatings w ith α-tocopherol and xanthan gum on shelf-life and browning index of fresh-cut “red delicious”apples[J]. Innovative Food Science & Emerging Technologies, 2014,22: 188-196. DOI:10.1016/j.ifset.2013.09.008.
[42] MOHAMMAD I A, HASHEM I M, HOSSEINI S M. Chitosan nanoparticles loaded w ith Cinnamomum zeylanicum essential oil enhance the shelf life of cucumber during cold storage[J]. Postharvest Bio logy and Techno logy, 2015, 110: 203-213. DOI:10.1016/j.postharvbio.2015.08.019.
Preparation, Characterization and in Vitro Sustained Antioxidant Activity of α-Tocopherol-Loaded Chitosan Nanoparticles
CHEN Wenbin, YAN Wenjing, XU Xinglian, ZHANG Jianhao*
(Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control,Key Lab of Meat Processing and Quality Control, M inistry of Agriculture, National Center of Meat Quality and Safety Control,College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
α-tocopherol is a natural antioxidant and nutritional supplement and has been w idely used in the food field.However, its scope of application is greatly limited due to its high susceptibility to environmental factors including oxygen,light and metal ions, ease of inactivation and water insolubility. In this study, α-tocopherol was encapsulated in chitosan nanoparticles (α-TOCCSNPs) by emulsification-ionic gelation method. To optim ize the process, the average particle size(APS) and encapsulation efficiency (EE) were investigated as a function of chitosan (CS) concentration, α-tocopherol concentration, mass ratio of CS to sodium tripolyphosphate (TPP), pH and stirring speed by one-factor-at-a-time and orthogonal array designs. The CS nanoparticles were characterized by dynam ic light scattering (DLS), Fourier transform infrared (FTIR) spectroscopy and scanning electron m icroscope (SEM) and evaluated for release profi les and antioxidant properties in vitro in order to provide a theoretical basis for the application of α-tocopherol to inhibit lipid oxidation in cured meat products during storage. The results demonstrated that the optimal conditions for preparing α-tocopherol loaded CS/TPP nanoparticles were as follow s: CS concentration, 1 mg/m L; mass ratio of CS to TPP, 7:1; pH, 4.5, and stirring speed, 900 r/m in. The APS and EE of α-tocopherol loaded nanoparticles were 214 nm and 51.65%, respectively under the optim ized conditions. The FTIR spectrum confi rmed that the encapsulation of α-tocopherol was achieved by electrostatic adsorption, and the SEM observation showed uniform average particle size distribution and regular spherical morphology.The α-tocopherol chitosan nanoparticles had sustained antioxidant activity in vitro.
α-tocopherol; chitosan nanoparticles; characterization; sustained release; antioxidant activity
2016-09-26
国家公益性行业(农业)科研专项(201303082-2);江苏高校优势学科建设工程资助项目
陈文彬(1992—),男,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:2014108074@njau.edu.cn
*通信作者:章建浩(1961—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:nau_zjh@njau.edu.cn
10.7506/spkx1002-6630-201722033
TS201.1
A
1002-6630(2017)22-0216-08
陈文彬, 严文静, 徐幸莲, 等. α-生育酚壳聚糖纳米粒的制备、表征及体外缓释抗氧化性能[J]. 食品科学, 2017, 38(22):216-223. DOI:10.7506/spkx1002-6630-201722033. http://www.spkx.net.cn
CHEN Wenbin, YAN Wenjing, XU Xinglian, et al. Preparation, characterization and in vitro sustained antioxidant activity of α-tocopherol-loaded chitosan nanoparticles[J]. Food Science, 2017, 38(22): 216-223. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722033. http://www.spkx.net.cn

